修回日期: 2020-06-10
接受日期: 2020-06-18
在线出版日期: 2020-07-28
由严重急性呼吸综合征冠状病毒-2 (severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)引起的新型冠状病毒肺炎(coronavirus disease-2019, COVID-19)已经发展为全球大流行性疾病, 给人类带来了巨大的危机与灾难. 该病主要经呼吸道飞沫和密切接触传播, 但是否能够经消化道感染与传播一直是医学界和广大公众非常关注的问题. 本述评从COVID-19的临床表现与消化系统症状、病毒的检测与分离培养、宿主细胞受体血管紧张素转化酶2的表达与分布等方面, 对该问题进行了论述与分析. SARS-CoV-2存在经消化道感染与传播的潜在风险, 应加强进一步的确证研究与有效防控.
核心提要: 新型冠状病毒肺炎已经发展为全球大流行性疾病, 有超过200个国家和地区的207万以上人感染. 该病主要经呼吸道飞沫和密切接触传播, 但是部分患者具有消化道症状, 人消化道存在血管紧张素转化酶2病毒受体, 粪便中能够检测到病毒核酸与分离培养到活的病毒, 胃肠道上皮细胞中能够检测到病毒复制. 因此, 新型冠状病毒存在经消化道感染与传播的潜在风险, 应加强确证研究与有效防控.
引文著录: 刘纯杰. 新型冠状病毒通过消化道感染与传播的可能性浅析. 世界华人消化杂志 2020; 28(14): 563-569
Revised: June 10, 2020
Accepted: June 18, 2020
Published online: July 28, 2020
Coronavirus disease-2019 (COVID-19) caused by severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) has evolved into a global pandemic and brought great crises and disasters to mankind. The disease is transmitted mainly through respiratory droplets and close contact, but whether it can be transmitted through the digestive tract and by faeces has been a problem of great concern to the medical community and the general public. This review discusses and analyzes the problem in terms of clinical manifestations and digestive system symptoms of COVID-19, detection and isolation of virus, expression and distribution of angiotensin-converting enzyme 2 receptor, etc. There is a potential risk of infection and transmission of SARS-CoV-2 through the digestive tract. It is suggested to carry out further confirmatory research and strengthen effective means of prevention and control.
- Citation: Liu CJ. Possibility of SARS-CoV-2 infection and transmission through the digestive tract. Shijie Huaren Xiaohua Zazhi 2020; 28(14): 563-569
- URL: https://www.wjgnet.com/1009-3079/full/v28/i14/563.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i14.563
由严重急性呼吸综合征冠状病毒-2 (severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)引起的新型冠状病毒肺炎(coronavirus disease-2019, COVID-19)从去年底首次发现并报道以来, 至今已经在全世界200多个国家和地区检出, 成为我国建国以来, 全世界二战以来最大的重大突发公共卫生事件, 并已发展为全球大流行性疾病, 给人类带来了巨大的危机与灾难.
从大量的流行病学调查资料来看, 经呼吸道飞沫和密切接触传播是该病主要的传播途径. 近来, 有人先后从粪便和唾液中检测到SARS-CoV-2核酸, 并且从粪便样本中分离到了活的病毒颗粒. 那么, COVID-19是否会经消化道感染与传播? 该问题自然成为了医学界和广大公众非常关心的问题. 本文基于现有文献报道, 拟就此做一简要述评, 以期给相关研究者和疫情防控人员一些有益的启迪与警示.
冠状病毒是一类较大的有包膜的病毒, 具有线性单股正链RNA基因组. 它包括4个属: α冠状病毒、β冠状病毒、γ冠状病毒和δ冠状病毒. 冠状病毒是仅能够感染脊椎动物的重要病原体, 不同的冠状病毒表现出不同的宿主范围和组织嗜性. 冠状病毒感染可引起人和动物发生呼吸道、消化道和神经系统疾病.
有四种冠状病毒HCoV⁃HKU1、HCoV⁃NL63、HCoV⁃229E和HCoV⁃OC43估计与人类已经共存了很长时间, 它们在世界范围内, 在人体中经常出现循环感染的现象, 但这些病毒的感染通常只能引起普通感冒, 是人发生普通感冒第二位的原因, 约占15%[1]. 在免疫力比较强的儿童和成人, 它们感染通常无症状或者仅引起轻度到中度的上呼吸道疾病; 在免疫功能低下的个体, 婴儿和老年人, 它们能够引起下呼吸道感染性病变, 包括细支气管炎和肺炎[2].
在过去近二十年的时间里, 由动物β冠状病毒传染给人, 导致发生了两次严重的疾病, 其中一次是2002-2003年由蝙蝠来源的β冠状病毒, 通过果子狸中间宿主, 跨种传播给人, 导致严重的急性呼吸系统综合征(severe acute respiratory syndromes, SARS)[3]. SARS最终全球有8422人感染, 916人死亡(死亡率11%). 2012年, 中东发生了中东呼吸系统综合征(Middle East respiratory syndrome, MERS)冠状病毒感染事件, 病毒也是来源于蝙蝠, 通过中间宿主单峰驼传染给人, 至今为止已有27个国家发现了MERS冠状病毒感染病例, 共感染2494人, 死亡858人[4](死亡率34%).
此次引起疾病暴发流行的SARS-CoV-2是目前已知的第7种可感染人类的冠状病毒. 通过病毒基因组测序与序列分析, 初步确定该病毒的自然宿主仍然是蝙蝠. 该病毒与SARS和MERS病毒同属于β类冠状病毒属, 但是亲源关系较远, 是一种全新的病毒. 2020-02-11世界卫生组织(world health organization, WHO)将新型冠状病毒肺炎疾病命名为COVID-19. 同日, 国际病毒分类委员会将新型冠状病毒命名为SARS⁃CoV⁃2. 不同于果子狸是SARS病毒的中间宿主(尽管仍有争议), 单峰骆驼是MERS病毒中间宿主, 穿山甲是否为新型冠状病毒的中间宿主还很难确定, 需要更多的动物溯源证据.
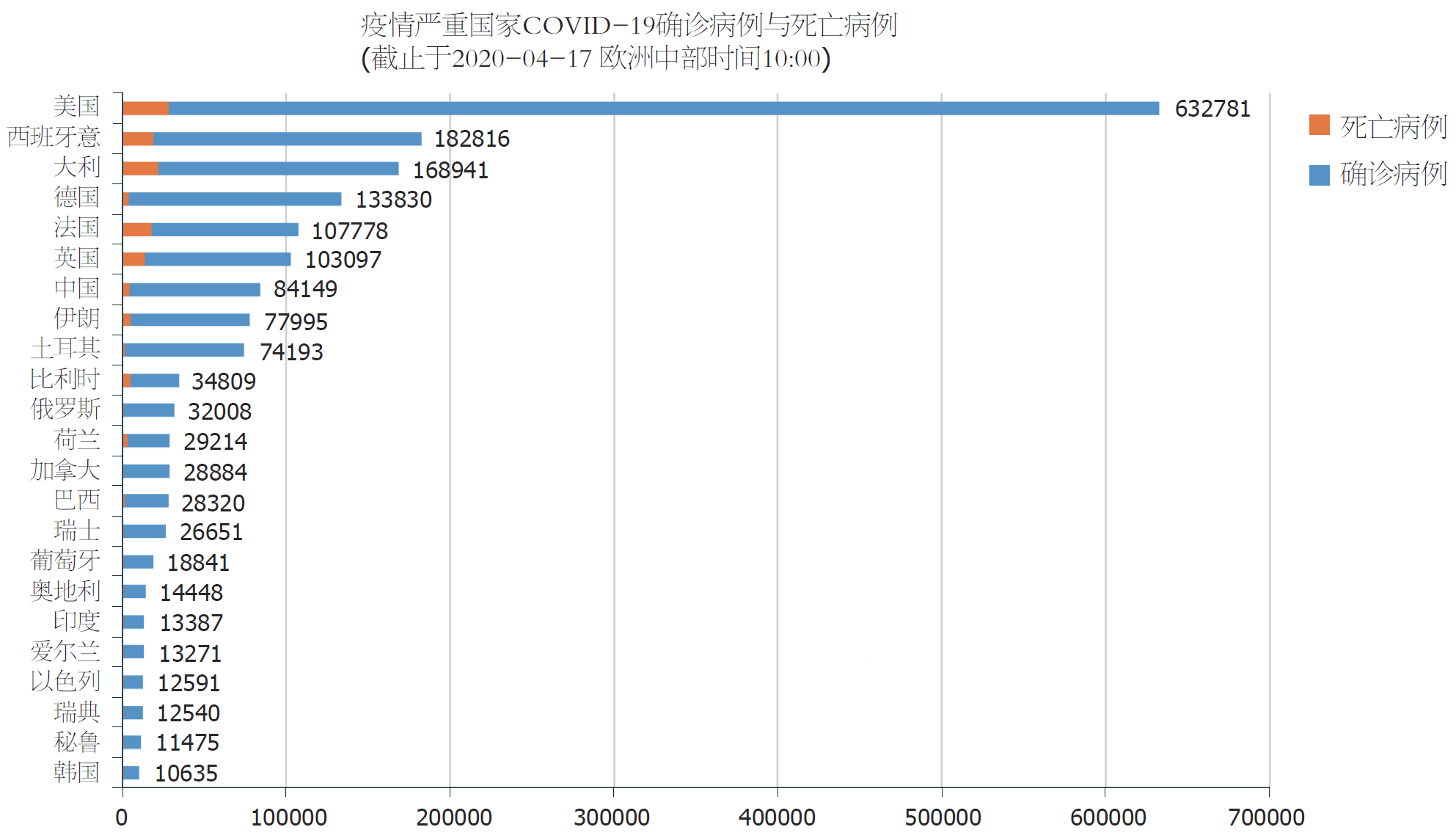
SARS⁃CoV⁃2与SARS-CoV相比, 体内复制速度更快, 表现更为隐匿, 传染性更强, 通常在症状出现之前即具有传染性. COVID-19被认为是我国新中国成立以来传播速度最快、感染范围最广、防控难度最大的一次重大突发公共卫生事件. 据国家CDC统计数据, 截止2020-04-17, 24时, 全国(含港澳台)确诊病例84180人, 死亡4642人(死亡率5.51%). 该疫情也已在全球多点暴发和快速蔓延, 成为二战以来最严重的全球危机, 是一场人类与病毒之间的世界大战, 几乎波及到了全球每一个角落, 对全球经济和金融市场造成极大威胁, 给人民生活产生重大影响. 2020-01-30, WHO宣布新冠疫情为国际关注的突发公共卫生事件; 2020-03-11, WHO评估新冠疫情具有了全球性大流行特征. 据WHO报告, 截止欧洲中部时间2020-04-17, 10时, 全球200多个国家和地区有COVID-19确诊病例, 总确诊人数超过了207万, 累计死亡139378人(死亡率6.72%). 我国COVID-19疫情发生重要时间节点见图1, 国外COVID-19疫情严重国家确诊与死亡病例数统计结果见图2.
基于大量的流行病学调查资料, 该病的潜伏期为1-14 d, 多数为3-7 d. 患者以发热、干咳、乏力为主要表现, 少数患者伴有鼻塞、流涕、咽痛、肌痛和腹泻症状. 根据患者的不同表现可以分为轻型、普通型、重型和危重型四型. 轻型患者仅表现为低热、轻微乏力等, 无影像学肺炎表现; 普通型患者具有发热和呼吸道症状, 影像学可见肺炎表现; 重症患者多在发病一周后出现呼吸困难和/或低氧血症, 严重者可快速进展为急性呼吸窘迫综合征、尿毒症休克、难以纠正的代谢性酸中毒和出凝血功能障碍及多器官功能衰竭等[5].
SARS-CoV和MERS-CoV感染患者, 不仅能够引起以呼吸系统为主的临床表现, 也有一定比例的患者出现消化道症状. 如, 在2002-2003年的SARS疫情中, 16%-73%的SARS患者通常在发病的第一周内出现腹泻; 在2012年的MERS-CoV暴发疫情中, 有四分之一的MERS-CoV患者出现腹泻或腹痛等胃肠道症状.
在此次武汉发生的SARS-CoV-2感染的早期报告中, 有2%-10%的COVID-19患者出现了胃肠道腹泻、腹痛和呕吐等症状; 与不需要重症监护的患者相比, 重症监护患者的腹痛发生率更高, 有10%的患者在出现发热和呼吸道症状前1-2 d出现腹泻和恶心. 据Guan等[6]报道的在中国30个省份、552家医院, 共1099例确诊病例的临床特征分析数据, 5.0% (55例)有恶心或呕吐症状, 3.8% (42例)有腹泻症状; 在Guan等[7]另一篇报道中, 他们统计分析了来自全国31个省份、575家医院的1590例COVID-19确诊病例, 其中5.8% (80/1371)具有恶心或呕吐症状, 4.2% (57/1359)具有腹泻症状. Jin等[8]报道分析了浙江省截止2020-02-08, COVID-19有胃肠道症状的患者特征, 在651例确诊COVID-19患者中, 74例(11.4%)存在至少1种胃肠道症状(恶心、呕吐、腹泻), 高于武汉患者. 威海市立医院Song等[9]报道腹泻可能是新冠病毒感染的首发症状, 文章报道了一例SARS-CoV-2感染者初期持续性腹泻和低烧, 但无咳嗽, 呼吸困难和胸痛等症状.提示病毒感染相关的腹泻, 可能是有些患者的首发症状.
COVID-19患者不仅能够在呼吸道采集样本(咽拭子、鼻拭子、肺泡灌洗液等)中检测到病毒核酸, 而且已经在多个呼吸道之外采集的样本, 包括粪便标本、肛拭子、唾液、泪液和结膜分泌物、尿液、血液和脑脊液中, 检测到了有SARS-CoV-2核酸的存在.
《新英格兰医学杂志》2020-03-05刊登了美国首例COVID-19确诊患者的诊治过程研究论文[10]. 在这位 35 岁男性的检查结果中, 鼻咽拭子和口咽拭子SARS-CoV-2检测阳性, 患者入院后, 除了干咳等症状外, 还陆续出现了恶心、呕吐、排稀便和腹部不适等症状. 在发病第7天采集的粪便样品经 rRT-PCR 核酸检测呈现阳性.
中山大学附属第五医院Xiao等[11]在《胃肠病学》杂志报道了对73例SARS-CoV-2感染住院患者各类标本检测结果, 其中粪便标本SARS-CoV-2核酸阳性39例(53.42%), 男25例、女14例, 年龄范围10个月-78岁, 粪便标本阳性持续时间1-12 d. 此外, 有17例(23.29%)患者在呼吸道样本呈现阴性后, 粪便标本仍然呈阳性.
广州医科大学Xu等[12]近期报道了10例新冠病毒感染患儿的临床特征, 以及持续的肛拭子病毒核酸检测阳性现象, 提示粪口传播是SARS-CoV-2的潜在传播途径. 研究纳入10例因暴露史而进行筛查并经核酸检测确诊者, 患儿临床表现9例为轻症, 1例完全无症状. X光片检测均无明确肺炎迹象, 血象也基本正常. 有8例患儿在咽拭子检测阴性后, 肛拭子持续呈现阳性, 其中1例出院后2 wk肛拭子复阳, 1例出院1 wk后复阳, 6例症状消失后肛拭子仍阳性. 这些检测结果提示, 患儿消化道病毒载量较呼吸道高且持续时间长, 病毒有粪口传播的可能.
中山大学Wu等[13]最新研究也发现, COVID-19患者粪便核酸检测阳性的持续时间比较长. 研究者从74名患者中收集了呼吸道和粪便样本进行病毒核酸检测, 有33例(45%)的粪便样本自发病到康复均为病毒核酸阴性, 有41例患者从首次症状出现后, 呼吸道样本核酸检测阳性的平均时间为11.2 d, 而粪便样本平均维持阳性的时间为27.9 d. 有一例患者在呼吸道样本核酸检测转阴后, 连续33 d粪便样本核酸检测呈阳性; 另一例患者在首次出现症状后47 d检测其粪便样本均核酸阳性.
香港大学To等[14]对香港两所医院的SARS-CoV-2感染者后口咽(深喉)唾液中的病毒载量及血清抗体反应进行了连续动态监测. 从筛选获得的23例患者所采集标本检测结果表明, 口咽后部唾液或其他呼吸道标本的病毒载量中位数为5.2 log10拷贝/mL, 只有3名(13%)患者的唾液样本中未检测出新冠病毒RNA. 唾液病毒载量在症状出现后的第一周最高, 随后随时间逐渐下降. 一名患者在症状出现后25 d检测到病毒RNA. 年龄越大, 病毒载量越高. 与SARS不同, COVID-19患者的病毒载量最高, 这可能也是该病传播迅速的原因之一. 尽管尚未见同类研究报道, 本研究选择的患者人数较少, 但仍然可以表明, 从患者唾液中可以检测到SARS-CoV-2. 2020-04-13, 美国格罗斯大学宣布, 该校下属的RUCDR infinite Biological 公司及其合作者, 获得了美国FDA授予的紧急使用权, 可通过唾液检测方法来检测SARS-CoV-2感染.
目前, 世界各地批准使用的SARS-CoV-2检测方法主要是病毒核酸检测, SARS-CoV-2核酸检测阳性, 表明样本中存在病毒核酸片段. 但是, 能够带来粪口传播的前提是粪便中有活病毒, 是否存在活的病毒, 还需要有核酸检测之外的进一步的证据. 据新华网2020-02-13消息, 钟南山、李兰娟院士团队近日分别从新冠肺炎患者的粪便样本中分离出SARS-CoV-2. 钟南山院士团队与广州医科大学呼吸疾病国家重点实验室等单位合作, 从一例COVID-19患者的粪便拭子标本中分离到一株SARS-CoV-2, 实验室通过多种细胞系接种样本并传代, 最终从Vero E6细胞中成功分离出SARS-CoV-2毒株. 与此同时, 浙江大学传染病诊治国家重点实验室李兰娟院士团队也从患者粪便样本中分离出病毒. 该实验室研究人员从5份粪便样本中, 有3份分离到了SARS-CoV-2. 在分离出的细胞里也观察到明显病变, 经过检测并常规盲传及再次标本分离都确认了病毒的存在. 这也充分说明, 粪便中不仅能检测到SARS-CoV-2核酸, 而且证明粪便中存在着活病毒粒子, 这为COVID-19的发生新增了一种新的传染源.
病毒通过与宿主细胞表面特定的受体相结合而发生感染, 这种结合既是病毒具有细胞和组织嗜性的重要决定因素, 也是病毒获得结合其他物种相应受体能力, 实现物种间传播的先决条件. SARS-CoV-2之前的人冠状病毒, 除了HCoV-OC43和HCoV-HKU1是与糖分子(9-O-乙酰唾液酸)结合实现细胞附着外, 其余四个人冠状病毒均以蛋白肽酶为识别受体. HCoV-229E与人氨基肽酶N结合, MERS-CoV与人二肽基肽酶4相互作用. 尽管SARS-CoV和hCoV-NL63属于不同的冠状病毒属, 但是它们均与人血管紧张素转化酶2 (angiotensin-converting enzyme 2, ACE2)相互识别进入宿主细胞. COVID-19疫情暴发后, 我国科学家迅速确定SARS-CoV-2的结合受体也是ACE2[15]. ACE2是一类跨膜糖蛋白, 表达ACE2的细胞可作为SARS-CoV-2感染的靶细胞, 分析不同器官、组织和细胞类型的ACE2表达模式可以揭示SARS-CoV-2感染的潜在风险.
冠状病毒进入感染细胞的过程是由嵌入包膜的位于病毒表面的刺突糖蛋白(S蛋白)介导的. 在大多数情况下, S蛋白会被宿主蛋白酶切割为分别负责受体识别和膜融合的S1和S2亚基. S1可以进一步分为N末端结构域(N-terminal domain, NTD)和C末端结构域(C-terminal domain, CTD), SARS-CoV和MERS-CoV利用S1 CTD识别受体, 称为受体结合结构域(receptor-binding domain, RBD), 小鼠肝炎冠状病毒则是利用S1 NTD与受体结合. SARS-CoV-2 S蛋白是在蝙蝠冠状病毒序列中融入了穿山甲的冠状病毒的S蛋白序列, 其S蛋白中负责与ACE2相互作用的区域有待鉴定. 中国科学院联合多家单位从结构和功能角度, 揭示了SARS-CoV-2利用人ACE2进入感染细胞. 他们鉴定出S1 CTD是SARS-CoV-2与ACE2受体相互作用的关键区域, 并随后解析出SARS-CoV-2-CTD与ACE2结合的晶体结构. 与SARS-RBD相比, SARS-CoV-2-CTD中关键残基的置换, 使得SARS-CoV-2-CTD与ACE2在结合界面有更多的原子相互作用, 并导致比SARS-RBD更高的受体结合亲和力[16]. 与此同时, 美国明尼苏达大学Shang等[17]测定了SARS-CoV-2 RBD与ACE2结合复合物的晶体结构. 与SARS-CoV相比, SARS-CoV-2 RBD中的ACE2结合脊具有更紧密的构象, 且SARSCoV-2 RBD中的几个残基变化稳定了RBD/ACE2界面上的两个病毒结合热点. SARS-CoV-2 RBD的这些结构特征增强了与人ACE2结合亲和力.
Zou等[18]利用已发表的单细胞RNA-seq数据资料, 通过分析不同器官、不同类型细胞的ACE2受体表达谱, 揭示了人体不同组织器官容易发生SARS-CoV-2感染与损伤的潜在风险. 分析表明, 肺脏被认为是风险最高的. 肺脏、心脏、食道、肾脏、膀胱和回肠, 及其特定的Ⅱ型肺泡上皮细胞、心肌细胞、肾近端小管细胞、回肠和食道上皮细胞以及膀胱、尿路上皮细胞易受SARS-CoV-2感染. 因此, 这些器官发生SARS-CoV-2感染的风险性高.
近期, 德国科学家Lukassen等[19]也通过单核和单细胞RNA测序的方式, 研究了受体ACE2蛋白以及S刺突蛋白切割酶: 跨膜丝氨酸蛋白酶(transmembrane protease serine 2, TMPRSS2)在肺组织(12个供体, 39778个细胞)和各段支气管(4个供体, 17521个细胞)中的表达水平及其在各种细胞类型中的分布. 结果表明, TMPRSS2在两种组织中都有表达, 但ACE2在各段支气管分支中主要表达于一种瞬时分泌细胞.
Xu等[20]利用来自"TCGA"和"FANTOM5 CAGE"两个公共数据库中大量的RNA-seq数据资料, 分析了13种TCGA癌旁正常组织和14种FANTOM5 CAGE正常组织的RNA序列信息, 探讨了ACE2在口腔粘膜上皮中的表达. 此外, 他们还根据一个独立的内部单细胞转录本数据资料, 鉴定与确认了口腔中表达ACE2的细胞组成和比例. 结果表明, ACE2在口腔黏膜中有表达. 有趣的是, 这种受体在舌上皮细胞中高度富集.
ACE2的表达与分布不仅可以从单细胞RNA序列信息和相关公共数据库中获得, 而且也通过RT-PCR和免疫染色等实验方法得到了验证. 2002年, Harmer 等[21]用定量 RT-PCR 的方法, 在6例尸检72种人体组织中系统检测了ACE2的分布和表达水平. 结果发现, ACE2集中分布在呼吸道和肺脏、肾脏、消化道(尤其是小肠)、心血管和皮肤组织中, 而在脑、脾脏和淋巴组织中表达量很低. Xiao等[11]通过免疫荧光染色试验表明, SARS-CoV-2受体ACE2蛋白在胃、十二指肠和直肠粘膜的腺上皮细胞有大量表达; 而在食管粘膜上皮细胞(主要为鳞状上皮细胞)中则是少有表达.
SARS-CoV-2能否经消化道感染与传播, 一直是医学界和广大公众非常关心的问题. 国家卫健委发布的《新型冠状病毒肺炎诊疗方案(试行第七版)》[5]指出: "经呼吸道飞沫和密切接触传播是主要的传播途径. 在相对封闭的环境中长时间暴露于高浓度气溶胶情况下, 存在经气溶胶传播的可能. 由于在粪便和尿液中可分离到新型冠状病毒, 应注意粪便及尿对环境污染造成气溶胶或接触传播". 该方案提到了粪便中可以分离到SARS-CoV-2, 但没有明确消化道是否一个可能的传播途径.
其实, 某些动物冠状病毒是能够经肠道感染的, 如猪传染性胃肠炎病毒、犬冠状病毒、猫肠道冠状病毒、兔冠状病毒和牛冠状病毒等. 人的冠状病毒HCoV-OC43, 与牛冠状病毒有着显著的抗原和基因相似性, 尽管它是通过呼吸道在人与人之间发生传播, 但在高达57%的感染者中能够引起胃肠道症状. 因此, 在冠状病毒引起的感冒中, 胃肠道症状与呼吸系统症状一样明显, 常被称为"胃流感"[22].
根据前面的论述, 我们得知: 第一, 有一定比例的COVID-19患者表现有消化道的腹部不适、腹泻、腹痛和呕吐等症状, 重症监护患者的腹痛发生率更高, 有部分患者出现的消化道症状是该病的首发症状; 第二, 在COVID-19患者的粪便和深部唾液中能够检测到SARS-CoV-2核酸, 且核酸阳性结果持续时间长、病毒载量高, 部分感染者呼吸道标本检测阴性后粪便标本仍呈阳性; 在粪便中分离到了活的病毒粒子, 它们能够引起明显的细胞病变; 第三, 在消化道和口腔粘膜上皮细胞有SARS-CoV-2受体ACE2的表达. 因此, 理论上存在着SARS-CoV-2经消化道感染的可能性.
SARS-CoV-2感染细胞后, 要利用宿主细胞进行自身核酸复制与蛋白合成. Xiao等[11]通过对病毒核衣壳蛋白染色结果表明, 在胃、十二指肠和直肠腺上皮染色结果阳性, 而食管上皮细胞阴性. 对来自粪便SARS-CoV-2 RNA检测阳性病人的胃肠组织进行染色试验, 观察到了胃肠上皮细胞ACE2和SARS-CoV-2染色阳性. 这进一步实验证明了, SARS-CoV-2确实可以感染胃肠腺上皮细胞, 并在细胞内合成病毒RNA和蛋白质, 组装成新的病毒粒子释放到胃肠道.
但到目前为止, 还没有确凿的证据表明, SARS-CoV-2能够通过摄入被污染的食物或水导致发病, 即尚缺乏临床上SARS-CoV-2经消化道感染的病例报道.
粪便中存在的病毒是否能够引起COVID-19疫情传播呢? 在SARS期间, 香港淘大花园曾发生同一楼道的小区居民集中感染的现象. 受感染者大部分没有直接接触过SARS患者, 并明显集中在E座的两个垂直单元里. 起先推测感染者可能是在电梯和楼道里, 通过呼吸飞沫发生的疫病传播, 但是经提醒居民戴口罩和避免触摸眼耳口鼻后, 传播没有减少, 反而又有很多人发生了感染. 最后经综合分析, 依据从粪便、卫生间, 以及下水管道中检测出SARS病毒, 并结合房屋结构, 香港卫生署认为, 病毒可能是经粪便排出后, 通过排泄物和废水经下水道扩散传播, 在一定条件下也可能以气溶胶或接触形式传播. 这一现象警示我们, SARS-CoV-2也可能会经过粪便扩散传播, 需要加强对感染者排泄物进行消毒处理, 避免通过废水管道或形成气溶胶扩散传播. 近日, 哈尔滨也发生了一起住在同一单元楼房, 为上、下楼邻居, 互不认识, 也没有直接接触, 但发生了感染的现象, 值得追踪探讨是否存在这种情况的可能性.
毋容置疑, 经呼吸道飞沫和密切接触传播是COVID-19主要的传播途径. 但综上所述, 尽管至今没有COVID-19经消化道感染的明确病例报道, 也没有SARS-CoV-2通过粪便扩散传播的直接证据, COVID-19经消化道感染的可能性仍然是存在的, SARS-CoV-2仍然具有经粪便扩散传播的潜在风险.
这方面的问题不仅应该引起我们充分的关注, 而且值得我们进行深入的研究. 关于SARS-CoV-2在细胞内进行感染后复制的证据, 除了可以检测细胞具有ACE2受体, 细胞内存在病毒核酸与蛋白之外, 还可以通过检测病毒亚基因组信使RNA (subgenomic messenger RNA, sgRNA)的方式证明[23]. 病毒sgRNA只在感染细胞中转录, 且不被包装成病毒粒子, 检测sgRNA可以表明样本中存在感染细胞. 将同一样本中的病毒sgRNA与病毒基因组RNA进行比较, 可以判断病毒的复制程度.
应用动物模型或许能够验证COVID-19经消化道感染和传播的可能性. SARS-CoV-2感染的动物模型目前已经有人ACE2转基因小鼠模型、仓鼠模型、雪貂模型和非人灵长类动物(恒河猴、食蟹猴)模型等. Chan等[24]应用金黄叙利亚仓鼠模型, 模拟建立了COVID-19的临床与病理特征. 仓鼠可以感染SARS-CoV-2, 并表现为呼吸急促、体重减轻, 早期有渗出性弥漫性肺损伤, 后期肺组织增生修复. 感染仓鼠在呼吸道和肠道, 可以检测到病毒核衣壳蛋白的表达. 有意思的是, 感染仓鼠始终能够感染同笼接触的仓鼠, 并导致类似的病理变化. 由于仓鼠有食用笼中粪便的习性, 感染是由于呼吸飞沫传播, 还是接触传播, 或者粪口传播值得利用该动物模型进行SARS-CoV-2感染传播途径的深入研究.
学科分类: 胃肠病学和肝病学
手稿来源地: 北京市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
科学编辑: 张晗 制作编辑:刘继红
| 1. | Mäkelä MJ, Puhakka T, Ruuskanen O, Leinonen M, Saikku P, Kimpimäki M, Blomqvist S, Hyypiä T, Arstila P. Viruses and bacteria in the etiology of the common cold. J Clin Microbiol. 1998;36:539-542. [PubMed] |
| 2. | Su S, Wong G, Shi W, Liu J, Lai ACK, Zhou J, Liu W, Bi Y, Gao GF. Epidemiology, Genetic Recombination, and Pathogenesis of Coronaviruses. Trends Microbiol. 2016;24:490-502. [PubMed] [DOI] |
| 3. | Chan-Yeung M, Xu RH. SARS: epidemiology. Respirology. 2003;8 Suppl:S9-14. [PubMed] [DOI] |
| 4. | Middle East Respiratory Syndrome Coronavirus. Accessed 18 Apr 2020. Available from: https://www.who.int/emergencies/mers-cov/en/. |
| 5. | 国家卫生健康委员会. 新型冠状病毒肺炎诊疗方案(试行第七版). Available from: http://www.nhc.gov.cn/yzygj/s7653p/202003/46c9294a7dfe4cef80dc7f5912eb1989.shtml. |
| 6. | Guan WJ, Ni ZY, Hu Y, Liang WH, Ou CQ, He JX, Liu L, Shan H, Lei CL, Hui DSC, Du B, Li LJ, Zeng G, Yuen KY, Chen RC, Tang CL, Wang T, Chen PY, Xiang J, Li SY, Wang JL, Liang ZJ, Peng YX, Wei L, Liu Y, Hu YH, Peng P, Wang JM, Liu JY, Chen Z, Li G, Zheng ZJ, Qiu SQ, Luo J, Ye CJ, Zhu SY, Zhong NS; China Medical Treatment Expert Group for Covid-19. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med. 2020;382:1708-1720. [PubMed] [DOI] |
| 7. | Guan WJ, Liang WH, Zhao Y, Liang HR, Chen ZS, Li YM, Liu XQ, Chen RC, Tang CL, Wang T, Ou CQ, Li L, Chen PY, Sang L, Wang W, Li JF, Li CC, Ou LM, Cheng B, Xiong S, Ni ZY, Xiang J, Hu Y, Liu L, Shan H, Lei CL, Peng YX, Wei L, Liu Y, Hu YH, Peng P, Wang JM, Liu JY, Chen Z, Li G, Zheng ZJ, Qiu SQ, Luo J, Ye CJ, Zhu SY, Cheng LL, Ye F, Li SY, Zheng JP, Zhang NF, Zhong NS, He JX, China Medical Treatment Expert Group for COVID-19. Comorbidity and its impact on 1590 patients with COVID-19 in China: a nationwide analysis. Eur Respir J. 2020;55:2000547. [PubMed] [DOI] |
| 8. | Jin X, Lian JS, Hu JH, Gao J, Zheng L, Zhang YM, Hao SR, Jia HY, Cai H, Zhang XL, Yu GD, Xu KJ, Wang XY, Gu JQ, Zhang SY, Ye CY, Jin CL, Lu YF, Yu X, Yu XP, Huang JR, Xu KL, Ni Q, Yu CB, Zhu B, Li YT, Liu J, Zhao H, Zhang X, Yu L, Guo YZ, Su JW, Tao JJ, Lang GJ, Wu XX, Wu WR, Qv TT, Xiang DR, Yi P, Shi D, Chen Y, Ren Y, Qiu YQ, Li LJ, Sheng J, Yang Y. Epidemiological, clinical and virological characteristics of 74 cases of coronavirus-infected disease 2019 (COVID-19) with gastrointestinal symptoms. Gut. 2020;69:1002-1009. [PubMed] [DOI] |
| 9. | Song Y, Liu P, Shi XL, Chu YL, Zhang J, Xia J, Gao XZ, Qu T, Wang MY. SARS-CoV-2 induced diarrhoea as onset symptom in patient with COVID-19. Gut. 2020;69:1143-1144. [PubMed] [DOI] |
| 10. | Holshue ML, DeBolt C, Lindquist S, Lofy KH, Wiesman J, Bruce H, Spitters C, Ericson K, Wilkerson S, Tural A, Diaz G, Cohn A, Fox L, Patel A, Gerber SI, Kim L, Tong S, Lu X, Lindstrom S, Pallansch MA, Weldon WC, Biggs HM, Uyeki TM, Pillai SK; Washington State 2019-nCoV Case Investigation Team. First Case of 2019 Novel Coronavirus in the United States. N Engl J Med. 2020;382:929-936. [PubMed] [DOI] |
| 11. | Xiao F, Tang M, Zheng X, Liu Y, Li X, Shan H. Evidence for Gastrointestinal Infection of SARS-CoV-2. Gastroenterology. 2020;158:1831-1833.e3. [PubMed] [DOI] |
| 12. | Xu Y, Li X, Zhu B, Liang H, Fang C, Gong Y, Guo Q, Sun X, Zhao D, Shen J, Zhang H, Liu H, Xia H, Tang J, Zhang K, Gong S. Characteristics of pediatric SARS-CoV-2 infection and potential evidence for persistent fecal viral shedding. Nat Med. 2020;26:502-505. [PubMed] [DOI] |
| 13. | Wu Y, Guo C, Tang L, Hong Z, Zhou J, Dong X, Yin H, Xiao Q, Tang Y, Qu X, Kuang L, Fang X, Mishra N, Lu J, Shan H, Jiang G, Huang X. Prolonged presence of SARS-CoV-2 viral RNA in faecal samples. Lancet Gastroenterol Hepatol. 2020;5:434-435. [PubMed] [DOI] |
| 14. | To KK, Tsang OT, Leung WS, Tam AR, Wu TC, Lung DC, Yip CC, Cai JP, Chan JM, Chik TS, Lau DP, Choi CY, Chen LL, Chan WM, Chan KH, Ip JD, Ng AC, Poon RW, Luo CT, Cheng VC, Chan JF, Hung IF, Chen Z, Chen H, Yuen KY. Temporal profiles of viral load in posterior oropharyngeal saliva samples and serum antibody responses during infection by SARS-CoV-2: an observational cohort study. Lancet Infect Dis. 2020;20:565-574. [PubMed] [DOI] |
| 15. | Zhou P, Yang XL, Wang XG, Hu B, Zhang L, Zhang W, Si HR, Zhu Y, Li B, Huang CL, Chen HD, Chen J, Luo Y, Guo H, Jiang RD, Liu MQ, Chen Y, Shen XR, Wang X, Zheng XS, Zhao K, Chen QJ, Deng F, Liu LL, Yan B, Zhan FX, Wang YY, Xiao GF, Shi ZL. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature. 2020;579:270-273. [PubMed] [DOI] |
| 16. | Wang Q, Zhang Y, Wu L, Niu S, Song C, Zhang Z, Lu G, Qiao C, Hu Y, Yuen KY, Wang Q, Zhou H, Yan J, Qi J. Structural and Functional Basis of SARS-CoV-2 Entry by Using Human ACE2. Cell. 2020;181:894-904.e9. [PubMed] [DOI] |
| 17. | Shang J, Ye G, Shi K, Wan Y, Luo C, Aihara H, Geng Q, Auerbach A, Li F. Structural basis of receptor recognition by SARS-CoV-2. Nature. 2020;581:221-224. [PubMed] [DOI] |
| 18. | Zou X, Chen K, Zou J, Han P, Hao J, Han Z. Single-cell RNA-seq data analysis on the receptor ACE2 expression reveals the potential risk of different human organs vulnerable to 2019-nCoV infection. Front Med. 2020;14:185-192. [PubMed] [DOI] |
| 19. | Lukassen S, Chua RL, Trefzer T, Kahn NC, Schneider MA, Muley T, Winter H, Meister M, Veith C, Boots AW, Hennig BP, Kreuter M, Conrad C, Eils R. SARS-CoV-2 receptor ACE2 and TMPRSS2 are primarily expressed in bronchial transient secretory cells. EMBO J. 2020;39:e105114. [PubMed] [DOI] |
| 20. | Xu H, Zhong L, Deng J, Peng J, Dan H, Zeng X, Li T, Chen Q. High expression of ACE2 receptor of 2019-nCoV on the epithelial cells of oral mucosa. Int J Oral Sci. 2020;12:8. [PubMed] [DOI] |
| 21. | Harmer D, Gilbert M, Borman R, Clark KL. Quantitative mRNA expression profiling of ACE 2, a novel homologue of angiotensin converting enzyme. FEBS Lett. 2002;532:107-110. [PubMed] [DOI] |
| 22. | Openshaw PJ. Crossing barriers: infections of the lung and the gut. Mucosal Immunol. 2009;2:100-102. [PubMed] [DOI] |
| 23. | Wölfel R, Corman VM, Guggemos W, Seilmaier M, Zange S, Müller MA, Niemeyer D, Jones TC, Vollmar P, Rothe C, Hoelscher M, Bleicker T, Brünink S, Schneider J, Ehmann R, Zwirglmaier K, Drosten C, Wendtner C. Virological assessment of hospitalized patients with COVID-2019. Nature. 2020;581:465-469. [PubMed] [DOI] |
| 24. | Chan JF, Zhang AJ, Yuan S, Poon VK, Chan CC, Lee AC, Chan WM, Fan Z, Tsoi HW, Wen L, Liang R, Cao J, Chen Y, Tang K, Luo C, Cai JP, Kok KH, Chu H, Chan KH, Sridhar S, Chen Z, Chen H, To KK, Yuen KY. Simulation of the clinical and pathological manifestations of Coronavirus Disease 2019 (COVID-19) in golden Syrian hamster model: implications for disease pathogenesis and transmissibility. Clin Infect Dis. 2020; Epub ahead of print. [PubMed] [DOI] |