修回日期: 2020-04-21
接受日期: 2020-04-27
在线出版日期: 2020-05-28
早期肝癌的根治性治疗手段包括手术切除、肝移植、局部消融等. 其中, 微波消融(microwave ablation, MWA)具有微创、根治、治疗时间短、并发症少, 且不受热沉效应影响等优势而被广泛应用于临床, 尤其适用于肿瘤邻近主要血管、肝转移瘤等. 然而, 其本身亦存在对消融靶区大小及形状不可预测的局限性. 本文系统阐述MWA治疗肝癌的有效性和安全性, 同时介绍新一代MWA系统的相对优越性, 为临床肝癌MWA治疗提供一些参考.
核心提要: 该文系统阐述微波消融(microwave ablation, MWA)治疗肝癌的有效性和安全性, 同时介绍新一代MWA系统的相对优越性.
引文著录: 何泽华, 吴秋林, 叶行, 王开元, 黎乐群, 彭宁福. 肝癌微波消融的研究进展. 世界华人消化杂志 2020; 28(10): 371-377
Revised: April 21, 2020
Accepted: April 27, 2020
Published online: May 28, 2020
The treatment methods for early liver cancer include surgical resection, liver transplantation, and local ablation. Among them, microwave ablation (MWA) is widely used in clinical practice because of its outstanding advantages, such as minimal invasiveness, radical curative effect, short treatment time, few complications, and no heat-sink effect, especially for the treatment of tumors adjacent to major vessels and hepatic metastases. However, MWA also has limitations such as unpredictable size and shape of the ablation area. This review systematically illustrates the effectiveness and safety of MWA in the treatment of liver cancer. Meanwhile, the relative superiority of the new generation of MWA is discussed, with an aim to provide reference for MWA of liver cancer.
- Citation: He ZH, Wu QL, Ye H, Wang KY, Li LQ, Peng NF. Microwave ablation of liver cancer: An updated review. Shijie Huaren Xiaohua Zazhi 2020; 28(10): 371-377
- URL: https://www.wjgnet.com/1009-3079/full/v28/i10/371.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i10.371
原发性肝癌在我国恶性肿瘤发病率中排第四位, 肿瘤相关死亡率中位居第三. 其中, 肝细胞癌(hepatocellular carcinoma, HCC)约占85%-90%, 年龄标化后的5年生存率仅为10.1%. 目前, 早期肝癌的根治性手段主要包括手术切除、肝移植、消融治疗等. 然而, 由于常伴肝功能不全及其它合并症、肝内肿瘤分布、供体缺乏等原因, 仅部分患者可行手术切除或肝移植治疗. 由此, 经皮局部消融(percutaneous local ablation, PLA), 尤其微波消融(microwave ablation, MWA), 被推荐为当前最佳替代治疗方法之一, 适用于BCLC临床分期中的部分早期(A期)患者, 要求肿瘤直径≤5 cm, 以≤3 cm为优. 依据2019年我国卫健委颁布的原发性肝癌诊疗规范, 对Ia期及部分Ib期肝癌(即单个肿瘤、直径≤5 cm; 2-3个肿瘤、最大直径≤3 cm; 无血管、胆管和邻近器官侵犯及远处转移; 肝功分级Child-Pugh A或B级); ECOG-PS 0-2, 推荐行PLA或联合介入. 对于适合肝移植的早期肝癌, PLA可作为桥接手段之一. 其中, MWA即利用电磁波产生电磁场、加热诱导组织凝固坏死, 临床上已广泛应用于肝癌(包括肝转移瘤)的治疗. 本文将重点介绍MWA在肝癌患者中的疗效及并发症, 同时介绍新一代MWA系统的相对优越性, 为肝癌的消融治疗提供一些参考.
MWA规划着重于如何将探针准确置入靶肿瘤, 并选择合适的消融功率和时间(通常5-20 min), 以确保肿瘤适形消融, 尽可能保全周围正常组织. 近来, 鉴于缺乏可靠的MWA治疗规划, Liu等[1]提出三维可视规划系统, 可显示肿瘤与周边重要脉管结构及临近组织的空间关系, 测算其距离, 并提供最少进针次数、最佳针径等参数, 不仅有利于指导操作, 且助于术后评估消融区. 操作过程, 常采用B超、计算机断层扫描(computed tomography, CT)等引导. B超具备实时、多平面成像、无辐射等优点, 应用最广; CT可用于B超难以发现的部分病灶(如隔顶、肺附近), 但有辐射. 此外, 两者联合可显著提高进针准度. 然而, 有时仍难以将探针精确靶向病灶. 2019年最新研究[2]提示, 计算机辅助导航、立体定向成像系统可显著提升靶向精度, 进而提高安全性和疗效. 另外, 新近动物实验显示, CT引导下机器人能准确将各型消融针置入任一靶区[3]; 随后, 在比较机械针系统与CT引导徒手置针的RCT研究中发现, 前者定位次数与置入精度均优于后者[4]. 因此, 智能三维置针可能是MWA未来研究的重要方向之一.
与手术切除相比, MWA不彻底消融率较高, 相应局部复发率增加. 为降低局部复发率, 消融边界应至少扩大至肿瘤周围正常肝组织3-5 mm. 目前, 评估消融边界的常用手段包括B超、超声造影(contrast-enhanced ultrasound, CEUS)、CT、增强CT(contrast enhancement CT, CECT)和磁共振成像(magnetic resonance imaging, MRI). 其中, CECT不仅准确性较高[5], 尚可早期发现MWA相关的并发症. B超准确度受组织产生的气体影响, 而CEUS准确率类似于CECT, 且成本低、无辐射. CT因MWA前后图像水平和方向不全匹配, 很难确认是否达足够的消融范围. MRI可准确区分消融边缘及靶区内肿瘤组织, 尤其弥散加权成像. 鉴于消融后肿瘤存活与坏死部分的表观扩散系数存在差异, MRI可能是评估消融边缘的最有效方法[6]. 此外, PET/CT也具有一定的临床应用前景, 但限于成本过高. 然而, 呼吸运动可引起消融前后切面位置不同, 故CECT、CEUS和MRI在评估消融边界方面尚存在一定的局限. Tang等[7]发现, 采用CT图像对肿瘤和消融部位进行三维重建拟合, 可改善评估效果.
首次治疗采用MWA的221例HCC中, 术后随访1 mo. 其中, 201例(90.95%)获得一次性完全消融, 8例(3.62%)实现二次完全消融, 余12例(5.43%)二次消融后仍未完全消融, 尤其>5 cm的肿瘤难以取得一次性完全消融. 相关并发症22例(10.4%), 包括胸腔积液、高胆红素血症各5例, 腹水、腹腔内出血各2例, 肝性脑病、肾上腺危象各1例, 肾衰竭6例, 无死亡. 肿瘤大小、数目、位置与并发症发生率无显著相关性. 中位随访41 mo, 中位无复发生存(relapse free survival, RFS)、总生存(overall survival, OS)分别为14 mo、41 mo. 多因素分析显示, 甲胎蛋白(alpha-fetoprotein, AFP)、γ-谷氨酰转肽酶(γ-glutamyl transpeptidase, GGT)是RFS独立影响因素, 而肿瘤数目及大小、AFP、GGT、复发类别为OS独立预后因素. 这些结果表明, MWA在HCC一线治疗中疗效显著, 且具有良好耐受性[8].
肝切除术(hepatic resection, HR)是治疗早期HCC的金标准, 而PLA, 包括MWA, 广泛用于肿瘤<5 cm、高龄、肝功受损患者. 长期随访表明, 对于<5 cm的单发HCC, MWA与HR预后无明显差异, 且前者创伤较小[9]. 然而, 对于肿瘤>3 cm的患者, HR的RFS优于MWA, 因此肝功正常患者, 建议行HR[9,10]. 同时, 有研究表明MWA和HR的OS和并发症发生率无显著差异, 但前者局部复发率高于后者[10-13]. 在一项Meta分析中, 包括1个随机对照试验(randomized controlled trial, RCT)和15个观察研究, 涉及22-424名患者, 随访时间为15-60 mo, 大部分研究比较MWA与HR疗效, 部分比较MWA+HR与单用HR/MWA治疗. 结果显示, MWA局部复发的风险显著高于HR (RR = 2.49, P = 0.016). 此外, MWA+HR与HR/MWA单一治疗的局部复发率无明显差异. 虽然MWA、HR的1年生存率相同, 但前者3、5年生存率分别较后者低6%、12%. 然而, 对于肿瘤较小和/或较深、肝功不全、合并症较多、肝外转移等不适合肝切除患者更倾向于选择MWA[14].
射频消融(radiofrequency ablation, RFA)即利用电极电流在肿瘤内产热, 使其坏死. 与RFA比较, MWA有以下优势: 产生更大消融区、治疗时间更短、不受周围组织及热沉效应影响. 对95项研究(包括5224例经RFA治疗的肝肿瘤)行Meta分析结果显示, RFA局部复发率为12.4%, 其中肿瘤>3-5 cm、>5 cm(局部复发率依次为24.1%、58.1%)治疗后局部复发率明显增高[15]. 对40项临床试验进行Meta分析, HCC患者经MWA治疗后(与RFA相比), 肿瘤>3 cm的OS为22 mo (21 mo), 肿瘤≤3 cm的OS为50 mo (27 mo); 局部复发率、并发症发生率、无病生存期分别为3.9%-22.0% (0%-20.9%)、2.1%-61.5% (0%-45.4%)、14-22 mo (10.5 mo-NA). 这些结果表明MWA和RFA的OS无统计学差异, 当肿瘤直径≥3 cm或位于血管周围时, MWA优于RFA[16]. 另一研究, 22例HCC 27个病灶行腹腔镜下(laparoscopic, Lap) MWA, 13例HCC 15个病灶行Lap-RFA, 发现两者安全性相当, 但前者手术时间较短、肿瘤完全坏死率较高[17]. 此外, 对于<2 cm的HCC, RFA消融次数、局部复发率明显低于MWA, 且消融面积较大、OS较长, 而异位复发率无显著差异[18]. 以上结果显示各研究间尚存争议, 仍需深入探索两者间的疗效差异.
患者在等待供体时, 为延缓疾病进展, 以免错失肝移植(liver transplantation, LT)机会, 常行桥接治疗. 比较RFA和MWA作为LT桥接手段的疗效, 发现两组肿瘤完全坏死率分别为45%和53%, 且RFA/MWA联合TACE, 均可有效诱导HCC肿瘤坏死[19]. 在比较不同桥接方式的疗效中发现, MWA生存率与TACE、RFA无明显差异[20]. 此外, 由于应用免疫抑制等因素, LT后常有肝内多发复发和肝外转移, 已不适合行手术治疗. LT后复发患者行MWA治疗, 其3、6、9、12、18、24 mo生存率分别为90.9%、81.8%、71.6%、51.5%、30.7%、15.3%, 平均生存时间为17.3 mo, 且近期并发症少、副作用轻、耐受性好, 而远期疗效仍有待继续观察[21].
对于晚期肝癌, 经动脉化疗栓塞(transcatheter arterial chemoembolization, TACE)联合PLA是其有效治疗方式之一. 其中, TACE+RFA的疗效和OS均优于单用RFA, 而TACE+MWA亦可显著提高疗效和OS, 尤其在<3 cm肿瘤中可减少治疗次数, 且随访期间未见复发及相关并发症[22]. 对35例HCC的41个<3 cm肿瘤行TACE+MWA序贯治疗, 后经CT及活检证实, 肿瘤完全坏死34个、不完全坏死7个, 随访期间2例复发[23]. 在≤7 cm HCC治疗中, 随机分为联合(TACE-RFA/TACE-MWA)和单一(RFA/MWA)治疗组, 联合组疗效、RFS、OS均优于单一组[24]. 另外, TACE+MWA可延长>5 cm的HCC患者的OS, 且无严重并发症[25]. 在不可切除的HCC中, TACE+MWA有明显缩瘤效应, 生存率优于单用TACE[26], 且MWA应至少在TACE的2 wk后进行. 此外, 对于大小不等HCC, TACE+MWA与TACE+RFA疗效相似[27]. Li等[28]将3000例HCC分为TACE+MWA组和TACE组, 发现联合治疗组的肿瘤完全坏死率和生存率均较高. 研究证实, TACE中使用的碘油及明胶海绵可通过动脉-门脉瘘道、增强RFA或MWA诱导的凝固坏死, 使消融面积扩大, 并加强卫星结节完全性坏死, 从而降低复发风险、延长生存[16].
MWA死亡率≤0.36%, 并发症发生率为2.4%-4.6%[29], 可分为消融术中、术后及延迟发生类型, 以下将讨论其发生机制及相应防治策略.
主要为疼痛、迷走兴奋、肿瘤破裂等. MWA常用局部麻醉, 对于肿瘤较大、临近肝包膜、消融时间较长者疼痛较为明显, 可引起身体不经意活动、伤及临近组织, 偶有消融被迫停止、影响疗效, 甚至可诱发胆心反射. 术前镇静镇痛处理、术中心电监护, 可有效降低其发生率. 发生迷走兴奋者可予以阿托品类药物, 缓解症状. 外生型肝肿瘤易破裂, 可能为消融灶内压力过高所致, 故消融过程应逐渐增加输出功率, 且需谨慎监测针尖位置[30].
主要包括消融后综合征、胸部合并症、肝脓肿、毗邻组织损伤、门脉或肝静脉栓塞、大出血和皮肤烧伤. 消融后综合征发生率约30%-60%, 常见于术后3 d内, 呈低热、畏寒、乏力、疼痛、恶心、呕吐等, 可能与肿瘤坏死、吸收有关[31]. 胸部合并症发生率约1.8%, 包括胸腔积液、积血, 气胸、脓胸, 肺栓塞等, 多见肿瘤位居隔顶者, 常伴膈肌损伤, 采用人工胸水策略可有效降低其发生率[32]. 肝脓肿发生率约1.7%, 为较严重并发症, 常为消融灶或软组织感染所致, 严重者可诱发脓毒症、脓毒症休克、多器官功能障碍综合征, 甚至死亡. 术中严格遵守无菌操作, 高危患者预防性使用抗菌药, 一旦发生加强抗感染、早期穿刺充分引流, 甚至持续冲洗, 多可治愈[33]. 肝毗邻组织损伤常见于胆囊、胃肠道、膈肌等, 消融边界距肝表面<1 cm时易发生. 胆囊损伤可引起胆囊壁增厚、反应性胆囊炎等, 胆囊穿孔因胆汁散热效应而较为少见. 肠穿孔发生率约0.1%-0.3%, 其症状往往数天后才出现, 可能与肠壁热损伤、周围炎症抑制穿孔相关表现有关, 采取人工腹水及胃肠道排空可减少其发生[34]. 膈肌热损伤多见肿瘤位居膈顶者, 常伴胸部合并症. 同理, 人工胸水或腹水可降低其发生率. 消融伤及肾上腺可致儿茶酚胺分泌过多、引发Takotsubo综合征, 故消融边缘距肾上腺≥1 cm为宜. 门脉或肝静脉栓塞发生率约1.1%, 门脉易形成血栓, 肝静脉次之, 与血管直径、腔内流速、消融方式、管壁机械性损有关. 此外, 血栓脱落可致肺栓塞[35]. 大出血发生率约0.1%-0.4%, 常见于肿瘤临近血管、凝血功能障碍、包膜下肿瘤破裂者. 对于顽固性或动脉出血者, 常需行动脉栓塞, 甚至手术处理[36]. PLA相关皮肤灼伤发生率约0.1%-3.2%, 基于MWA采用内部冷却探针, 安全性较高, 皮肤灼伤较为少见[37]. 此外, PLA相关坏死物可致肾功不全患者发生急性肾衰. 上述多数并发症呈自限性, 积极非手术处理后可恢复. 操作过程选择安全进针路径、合适温度, 实时监测穿刺过程, 术中术后严密监测生命体征, 可有效减少甚至避免其发生.
主要为胆道损伤、瘘管形成、肿瘤播散及快速增殖等. 其中, 胆道损伤发生率约1%-12%, 常引起胆瘘、胆汁瘤、胆管狭窄, 并继发胆道感染. 部分患者无需特殊治疗, 而胆管炎反复发作者则需行胆道引流[38]. 此外, 还有肠管-胸腔瘘、胆道-心包瘘等. 病理表现为胆道积脓、积气, 一旦发生加强抗感染、充分引流, 部分严重者需手术处理. 操作过程选择安全路径、规范操作, 可有效减少其发生. 肿瘤播散发生率约0.6%, 以针道种植转移为主, 应减少穿刺次数、消融针道10-20 s、避免直接穿刺外生肿瘤[39]. PLA相关性肿瘤快速增殖发生率为0.1%-2.9%, 可能与缺氧诱导因子-1α、血管内皮生长因子、血小板源性生长因子、成纤维细胞生长因子等促进残余瘤细胞快速增殖有关, 也可能为PLA后瘤内高压促使瘤细胞扩散至门脉所致. 此外, 与针道播散亦存一定相关性[40]. 因此, 消融应保证瘤组织完全坏死, 并预留足够安全边缘.
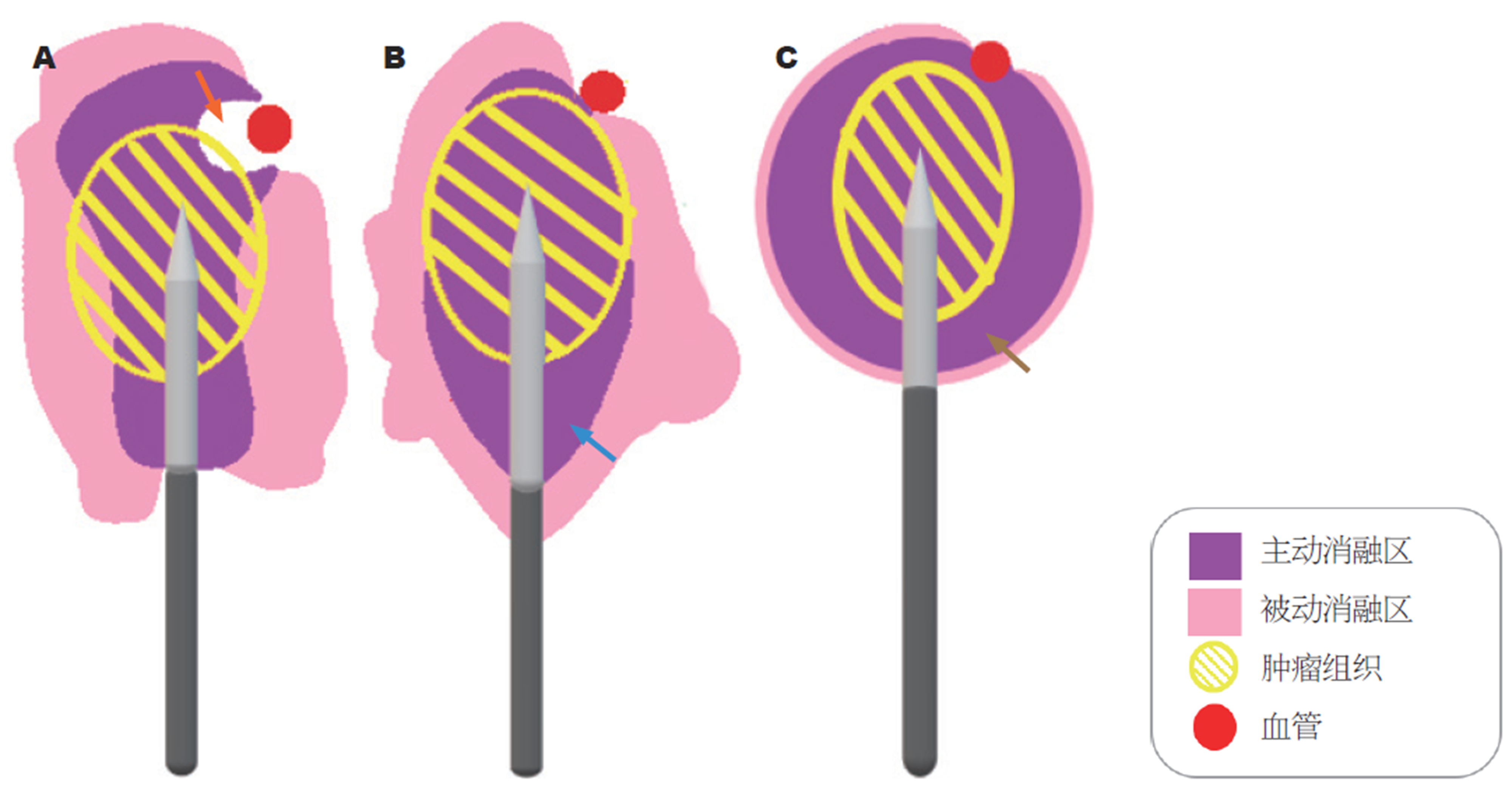
起初, MWA用于肝切除术中的辅助止血, 后在肝肿瘤治疗中获得快速发展. 它利用电磁波产生快速振荡电磁场, 使水分子运动、摩擦产热, 可在探针周围产生2 cm加热区, 引起肿瘤组织凝固坏死. 其频率有915 MHz和2450 MHz, 后者为目前最常用类型[13]. 目前, 临床上所使用的MWA系统对消融区大小和形状缺乏可预测性, 导致无法取得预期疗效. 新一代MWA系统(Emprint™ Ablation System with Thermosphere™ Technology, Microwave thermosphere ablation, MTA)是同一制造商研发的MWA改进版, 常用频率为2450 MHz, 由100 W发电机、高效可重复使用的电缆线和消融泵组成. 其中, 消融过程消融泵对探针进行冷却. MTA克服了MWA磁场为椭圆形的局限性(图1), 通过场控制、热控制、波长控制, 可获得较大、精确及可预测的球形消融区[41]. 场控可调节电子在探针中的运动, 产生预期的场形状, 且不受组织环境改变的影响. 通常, 探针和同轴电缆过度加热可导致非靶区热损伤, 而热控采用无菌盐水滴注、产生内部冷却, 以确保消融区不受干燥组织影响. 此外, 肿瘤组织消融加热过程, 其介电常数相继变化, 使电磁波波长发生改变, 最后导致场形状改变. 波长控制是通过无菌生理盐水循环于探针轴, 产生以下效应: 使该介电常数变化最小、维持较短恒定波长、保持探针所需电子运动模式, 利于场控, 从而维持较恒定的环境. 与MWA相比, 相同功率及时间下, MTA在离体牛肝中, 可产生大小相当、形态规则、更接近球形的消融灶, 且受热沉效应的影响更小[42].
Zaidi等[43]对53例肝肿瘤行Lap-MTA, 结果显示并发症发生率约11.3%, 无死亡; 肿瘤完全消融率99.3%, 不全消融灶1个(0.7%); 中位随访4.5 mo, 观察到局部复发灶1个(0.7%). 另外, 在腔镜或开腹MTA治疗的100例肝肿瘤(共301个肝肿物; HCC 10例, 共21个肝肿物)患者中, 排除19例联合肝切和8例联合肠癌切除, 其90 d并发症发生率7% (5/73), 包括急性肾损伤、慢性阻塞性肺疾病加重、颈内静脉血栓形成伴肺栓塞、肠系膜上静脉及门脉血栓形成、术后肺炎各1例, 其中1例与消融无关; 中位随访16 mo, 病灶、患者局部复发率分别为6.6% (20/301)、15% (15/100), 均属肝转移瘤, 而HCC未观察到局部复发[44]. 此外, 在HCC的有关研究中, 44例52个病灶行MTA, 55例70个病灶行RFA, 发现两组肿瘤完全坏死率无显著差异, 治疗后随访1年, 局部复发率无统计学差异(MTA/RFA: 6.91%/5.17%; HR = 0.82; log rank = 0.8036), 均无针道种植转移. 其并发症发生率亦无显著差异(MTA/RFA: 13.6%/14.5%), 其中MTA组包括肝梗死1例、出血3例和胆汁瘤2例, RFA组包括肝梗死2例、出血3例、皮肤灼伤1例、迷走神经反射1例和胆汁瘤1例[45]. 还有, 比较MTA和RFA在肠癌肝转移治疗中情况, 发现两者局部复发率依次为10%、20% (P = 0.020); 90 d并发症发生率相似(MTA/RFA: 10%/8%; P = 0.848), 均无死亡[46]. 上述研究多因素分析提示, 肿瘤>3 cm、消融方式、消融边缘、肿瘤类型均为局部复发的独立预测因子, 皆证实MTA安全、可行, 且其近期局部复发率较低.
MTA具有较高的瘤内温度及热效率, 且可在远离针头处形成消融区, 对于肿瘤位于大血管之间及存在肝周粘连者, 针头不需100%插入肿瘤中央[43]. 同时, MTA亦存在某些缺陷, 如消融区迅速扩大易导致邻近组织意外消融、玻璃纤维针头无法承受明显扭曲等[43]. 与其它PLA技术(包括MWA)比较, MTA似乎为较大HCC及肝转移瘤(包括复发类型)的潜在有效治疗手段, 如联合TACE, 效果更佳. 然而, MTA替代手术、RFA、TACE等其它方式的可行性, 尚需大规模RCT研究提供证据.
总之, 在MWA治疗部分肝癌的研究中, 已证实其有效性及安全性; 可与肝切、RFA相媲美, 甚至略显更优; 与TACE序贯联合, 有助于提高疗效; 还可作为肝移植的桥接手段之一. 近年, 新一代MWA(即MTA)开始逐步应用于肝癌的治疗, 尤其肝转移瘤领域. 初步结果显示, MTA一定程度上能克服既往MWA在消融靶区大小及形状等不可预测的局限性. 然而, MTA尚未广泛应用于临床, 其使用经验较少, 处理策略亦不成熟. 此外, MTA也存在消融靶区迅速扩大而致邻近组织意外消融等共性问题. 因此, MTA与MWA、RFA等的优劣比较, 尚有待广泛开展、深入探索.
学科分类: 胃肠病学和肝病学
手稿来源地: 广西壮族自治区
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): D
E级 (差): 0
科学编辑: 王禹乔 制作编辑:刘继红
| 1. | Liu F, Liang P, Yu X, Lu T, Cheng Z, Lei C, Han Z. A three-dimensional visualisation preoperative treatment planning system in microwave ablation for liver cancer: a preliminary clinical application. Int J Hyperthermia. 2013;29:671-677. [PubMed] [DOI] |
| 2. | Lachenmayer A, Tinguely P, Maurer MH, Frehner L, Knöpfli M, Peterhans M, Weber S, Dufour JF, Candinas D, Banz V. Stereotactic image-guided microwave ablation of hepatocellular carcinoma using a computer-assisted navigation system. Liver Int. 2019;39:1975-1985. [PubMed] [DOI] |
| 3. | Hiraki T, Matsuno T, Kamegawa T, Komaki T, Sakurai J, Matsuura R, Yamaguchi T, Sasaki T, Iguchi T, Matsui Y, Gobara H, Kanazawa S. Robotic Insertion of Various Ablation Needles Under Computed Tomography Guidance: Accuracy in Animal Experiments. Eur J Radiol. 2018;105:162-167. [PubMed] [DOI] |
| 4. | Heerink WJ, Ruiter SJS, Pennings JP, Lansdorp B, Vliegenthart R, Oudkerk M, de Jong KP. Robotic versus Freehand Needle Positioning in CT-guided Ablation of Liver Tumors: A Randomized Controlled Trial. Radiology. 2019;290:826-832. [PubMed] [DOI] |
| 5. | Bouda D, Lagadec M, Alba CG, Barrau V, Dioguardi Burgio M, Moussa N, Vilgrain V, Ronot M. Imaging review of hepatocellular carcinoma after thermal ablation: The good, the bad, and the ugly. J Magn Reson Imaging. 2016;44:1070-1090. [PubMed] [DOI] |
| 6. | Winters SD, Jackson S, Armstrong GA, Birchall IW, Lee KH, Low G. Value of subtraction MRI in assessing treatment response following image-guided loco-regional therapies for hepatocellular carcinoma. Clin Radiol. 2012;67:649-655. [PubMed] [DOI] |
| 7. | Tang H, Tang Y, Hong J, Chen T, Mai C, Jiang P. A measure to assess the ablative margin using 3D-CT image fusion after radiofrequency ablation of hepatocellular carcinoma. HPB (Oxford). 2015;17:318-325. [PubMed] [DOI] |
| 8. | Wang T, Lu XJ, Chi JC, Ding M, Zhang Y, Tang XY, Li P, Zhang L, Zhang XY, Zhai B. Microwave ablation of hepatocellular carcinoma as first-line treatment: long term outcomes and prognostic factors in 221 patients. Sci Rep. 2016;6:32728. [PubMed] [DOI] |
| 9. | Ryu T, Takami Y, Wada Y, Hara T, Sasaki S, Saitsu H. Hepatic resection versus operative microwave ablation for single hepatocellular carcinoma ≤5 cm: A propensity score-matched analysis. Surgery. 2019;166:254-262. [PubMed] [DOI] |
| 10. | Xu J, Zhao Y. Comparison of percutaneous microwave ablation and laparoscopic resection in the prognosis of liver cancer. Int J Clin Exp Pathol. 2015;8:11665-11669. [PubMed] |
| 11. | Li W, Zhou X, Huang Z, Zhang K, Luo X, Zhong J, Chen Y. Short-term and long-term outcomes of laparoscopic hepatectomy, microwave ablation, and open hepatectomy for small hepatocellular carcinoma: a 5-year experience in a single center. Hepatol Res. 2017;47:650-657. [PubMed] [DOI] |
| 12. | Zhang QB, Zhang XG, Jiang RD, Hu CX, Sun D, Ran L, Zhang ZL. Microwave ablation versus hepatic resection for the treatment of hepatocellular carcinoma and oesophageal variceal bleeding in cirrhotic patients. Int J Hyperthermia. 2017;33:255-262. [PubMed] [DOI] |
| 13. | Chong CCN, Lee KF, Chu CM, Chan AWH, Wong J, Chan SL, Lok HT, Fung AKY, Fong AKW, Cheung YS, Yu SCH, Johnson P, Lai PBS. Microwave ablation provides better survival than liver resection for hepatocellular carcinoma in patients with borderline liver function: application of ALBI score to patient selection. HPB (Oxford). 2018;20:546-554. [PubMed] [DOI] |
| 14. | Glassberg MB, Ghosh S, Clymer JW, Wright GWJ, Ferko N, Amaral JF. Microwave ablation compared with hepatic resection for the treatment of hepatocellular carcinoma and liver metastases: a systematic review and meta-analysis. World J Surg Oncol. 2019;17:98. [PubMed] [DOI] |
| 15. | Mulier S, Ni Y, Jamart J, Ruers T, Marchal G, Michel L. Local recurrence after hepatic radiofrequency coagulation: multivariate meta-analysis and review of contributing factors. Ann Surg. 2005;242:158-171. [PubMed] [DOI] |
| 16. | Izzo F, Granata V, Grassi R, Fusco R, Palaia R, Delrio P, Carrafiello G, Azoulay D, Petrillo A, Curley SA. Radiofrequency Ablation and Microwave Ablation in Liver Tumors: An Update. Oncologist. 2019;24:e990-e1005. [PubMed] [DOI] |
| 17. | Simo KA, Sereika SE, Newton KN, Gerber DA. Laparoscopic-assisted microwave ablation for hepatocellular carcinoma: safety and efficacy in comparison with radiofrequency ablation. J Surg Oncol. 2011;104:822-829. [PubMed] [DOI] |
| 18. | Ohmoto K, Yoshioka N, Tomiyama Y, Shibata N, Kawase T, Yoshida K, Kuboki M, Yamamoto S. Comparison of therapeutic effects between radiofrequency ablation and percutaneous microwave coagulation therapy for small hepatocellular carcinomas. J Gastroenterol Hepatol. 2009;24:223-227. [PubMed] [DOI] |
| 19. | Vasnani R, Ginsburg M, Ahmed O, Doshi T, Hart J, Te H, Van Ha TG. Radiofrequency and microwave ablation in combination with transarterial chemoembolization induce equivalent histopathologic coagulation necrosis in hepatocellular carcinoma patients bridged to liver transplantation. Hepatobiliary Surg Nutr. 2016;5:225-233. [PubMed] [DOI] |
| 20. | Rubinstein MM, Kaubisch A, Kinkhabwala M, Reinus J, Liu Q, Chuy JW. Bridging therapy effectiveness in the treatment of hepatocellular carcinoma prior to orthotopic liver transplantation. J Gastrointest Oncol. 2017;8:1051-1055. [PubMed] [DOI] |
| 21. | Zhai H, Liang P, Yu XL, Cheng Z, Han ZY, Liu F, Yu J. Microwave ablation in treating intrahepatic recurrence of hepatocellular carcinoma after liver transplantation: An analysis of 11 cases. Int J Hyperthermia. 2015;31:863-868. [PubMed] [DOI] |
| 22. | Seki T, Tamai T, Nakagawa T, Imamura M, Nishimura A, Yamashiki N, Ikeda K, Inoue K. Combination therapy with transcatheter arterial chemoembolization and percutaneous microwave coagulation therapy for hepatocellular carcinoma. Cancer. 2000;89:1245-1251. [PubMed] [DOI] |
| 23. | Yang WZ, Jiang N, Huang N, Huang JY, Zheng QB, Shen Q. Combined therapy with transcatheter arterial chemoembolization and percutaneous microwave coagulation for small hepatocellular carcinoma. World J Gastroenterol. 2009;15:748-752. [PubMed] [DOI] |
| 24. | Yi Y, Zhang Y, Wei Q, Zhao L, Han J, Song Y, Ding Y, Lu G, Liu J, Ding H, Dai F, Tang X. Radiofrequency ablation or microwave ablation combined with transcatheter arterial chemoembolization in treatment of hepatocellular carcinoma by comparing with radiofrequency ablation alone. Chin J Cancer Res. 2014;26:112-118. [PubMed] [DOI] |
| 25. | Xu LF, Sun HL, Chen YT, Ni JY, Chen D, Luo JH, Zhou JX, Hu RM, Tan QY. Large primary hepatocellular carcinoma: transarterial chemoembolization monotherapy versus combined transarterial chemoembolization-percutaneous microwave coagulation therapy. J Gastroenterol Hepatol. 2013;28:456-463. [PubMed] [DOI] |
| 26. | Liu C, Liang P, Liu F, Wang Y, Li X, Han Z, Liu C. MWA combined with TACE as a combined therapy for unresectable large-sized hepotocellular carcinoma. Int J Hyperthermia. 2011;27:654-662. [PubMed] [DOI] |
| 27. | Ginsburg M, Zivin SP, Wroblewski K, Doshi T, Vasnani RJ, Van Ha TG. Comparison of combination therapies in the management of hepatocellular carcinoma: transarterial chemoembolization with radiofrequency ablation versus microwave ablation. J Vasc Interv Radiol. 2015;26:330-341. [PubMed] [DOI] |
| 28. | Li W, Man W, Guo H, Yang P. Clinical study of transcatheter arterial chemoembolization combined with microwave ablation in the treatment of advanced hepatocellular carcinoma. J Cancer Res Ther. 2016;12:C217-C220. [PubMed] [DOI] |
| 29. | Poggi G, Tosoratti N, Montagna B, Picchi C. Microwave ablation of hepatocellular carcinoma. World J Hepatol. 2015;7:2578-2589. [PubMed] [DOI] |
| 30. | Chiang J, Birla S, Bedoya M, Jones D, Subbiah J, Brace CL. Modeling and validation of microwave ablations with internal vaporization. IEEE Trans Biomed Eng. 2015;62:657-663. [PubMed] [DOI] |
| 31. | Andreano A, Galimberti S, Franza E, Knavel EM, Sironi S, Lee FT, Meloni MF. Percutaneous microwave ablation of hepatic tumors: prospective evaluation of postablation syndrome and postprocedural pain. J Vasc Interv Radiol. 2014;25:97-105.e1-2. [PubMed] [DOI] |
| 33. | Yu MA, Liang P, Yu XL, Cheng ZG, Han ZY, Liu FY, Yu J. Liver abscess as a complication of microwave ablation for liver metastatic cholangiocarcinoma after bilioenteric anastomosis. Int J Hyperthermia. 2011;27:503-509. [PubMed] [DOI] |
| 34. | Bertot LC, Sato M, Tateishi R, Yoshida H, Koike K. Mortality and complication rates of percutaneous ablative techniques for the treatment of liver tumors: a systematic review. Eur Radiol. 2011;21:2584-2596. [PubMed] [DOI] |
| 35. | Kim AY, Rhim H, Park M, Lee MW, Kim YS, Choi D, Lim HK. Venous thrombosis after radiofrequency ablation for hepatocellular carcinoma. AJR Am J Roentgenol. 2011;197:1474-1480. [PubMed] [DOI] |
| 36. | Liang P, Wang Y, Yu X, Dong B. Malignant liver tumors: treatment with percutaneous microwave ablation--complications among cohort of 1136 patients. Radiology. 2009;251:933-940. [PubMed] [DOI] |
| 37. | Park JG, Park SY, Tak WY, Kweon YO, Jang SY, Lee YR, Hur K, Lee HJ, Lee HW. Early complications after percutaneous radiofrequency ablation for hepatocellular carcinoma: an analysis of 1,843 ablations in 1,211 patients in a single centre: experience over 10 years. Clin Radiol. 2017;72:692.e9-692.e15. [PubMed] [DOI] |
| 38. | Koda M, Murawaki Y, Hirooka Y, Kitamoto M, Ono M, Sakaeda H, Joko K, Sato S, Tamaki K, Yamasaki T, Shibata H, Shimoe T, Matsuda T, Toshikuni N, Fujioka S, Ohmoto K, Nakamura S, Kariyama K, Aikata H, Kobayashi Y, Tsutsui A. Complications of radiofrequency ablation for hepatocellular carcinoma in a multicenter study: An analysis of 16 346 treated nodules in 13 283 patients. Hepatol Res. 2012;42:1058-1064. [PubMed] [DOI] |
| 39. | Livraghi T, Meloni F, Solbiati L, Zanus G; Collaborative Italian Group using AMICA system. Complications of microwave ablation for liver tumors: results of a multicenter study. Cardiovasc Intervent Radiol. 2012;35:868-874. [PubMed] [DOI] |
| 40. | Kang TW, Lim HK, Lee MW, Kim YS, Rhim H, Lee WJ, Gwak GY, Paik YH, Lim HY, Kim MJ. Aggressive Intrasegmental Recurrence of Hepatocellular Carcinoma after Radiofrequency Ablation: Risk Factors and Clinical Significance. Radiology. 2015;276:274-285. [PubMed] [DOI] |
| 41. | Hübner F, Schreiner R, Reimann C, Bazrafshan B, Kaltenbach B, Schüßler M, Jakoby R, Vogl TJ. Ex vivo validation of microwave thermal ablation simulation using different flow coefficients in the porcine liver. Med Eng Phys. 2019;66:56-64. [PubMed] [DOI] |
| 42. | 楚 文颖. 真圆微波技术与传统微波消融效果比较的离体实验研究. 天津: 天津医科大学. 2019. [DOI] |
| 43. | Zaidi N, Okoh A, Yigitbas H, Yazici P, Ali N, Berber E. Laparoscopic microwave thermosphere ablation of malignant liver tumors: An analysis of 53 cases. J Surg Oncol. 2016;113:130-134. [PubMed] [DOI] |
| 44. | Takahashi H, Kahramangil B, Berber E. Local recurrence after microwave thermosphere ablation of malignant liver tumors: results of a surgical series. Surgery. 2018;163:709-713. [PubMed] [DOI] |
| 45. | Suwa K, Seki T, Tsuda R, Yamashina M, Murata M, Yamaguchi T, Nishio A, Okazaki K. Short term treatment results of local ablation with water-cooled microwave antenna for liver cancer: Comparison with radiofrequency ablation. Mol Clin Oncol. 2020;12:230-236. [PubMed] [DOI] |
| 46. | Takahashi H, Kahramangil B, Kose E, Berber E. A comparison of microwave thermosphere versus radiofrequency thermal ablation in the treatment of colorectal liver metastases. HPB (Oxford). 2018;20:1157-1162. [PubMed] [DOI] |