修回日期: 2019-01-01
接受日期: 2019-01-29
在线出版日期: 2019-02-28
探讨超声造影(contrast-enhanced ultrasound, CEUS)定量评估经导管肝动脉化疗栓塞术(transcatheter artery chemo-embolization, TACE)后原发性肝细胞癌(Hepatocellular Carcinoma, HCC)残留肿瘤的血流灌注状态及其应用价值.
选取浙江省德清县人民医院收治并接受TACE治疗的45例HCC患者作为研究对象, 共57个肿瘤, 分别于治疗前1 d、治疗后1 mo行CEUS, 比较TACE前后残留肿瘤的血流灌注参数.
CEUS判定HCC肿瘤残留的灵敏度 = 95.45%, 准确度 = 94.74%, 特异度 = 92.31%; 术后HCC残留肿瘤的增强强度(56.87%±4.15%)较治疗前(75.09%±6.42%)明显下降, 差异有统计学意义(P<0.05); 术后HCC残留肿瘤的达峰时间(25.26 s±3.83 s)较治疗前(21.02 s±3.70 s)明显延长, 差异有统计学意义(P<0.05); 术后HCC残留肿瘤的曲线下面积(581.29±86.43)较治疗前(1017.83±111.76)明显减少, 差异有统计学意义(P<0.05).
CEUS能直观反映HCC经TACE治疗后肿瘤残留状态, 并能定量评估残留肿瘤的血流灌注变化, 可为临床进一步治疗提供血流动力学信息.
核心提要: 运用超声造影实时显示经导管肝动脉化疗栓塞术(transcatheter artery chemo-embolization, TACE)后原发性肝细胞癌(hepatocellular carcinoma, HCC)的血流灌注状态, 并通过时间-强度曲线定量分析TACE后HCC的血流灌注参数变化, 为临床治疗提供血流动力学信息.
引文著录: 张心荣, 欧阳骏, 黄敬垣. 超声造影定量评估TACE术后原发性肝细胞癌的血流灌注变化. 世界华人消化杂志 2019; 27(4): 276-281
Revised: January 1, 2019
Accepted: January 29, 2019
Published online: February 28, 2019
To evaluate the blood perfusion status of residual hepatocellular carcinoma (HCC) tumors after transcatheter arterial chemoembolization (TACE) by contrast-enhanced ultrasound (CEUS) as well as the application value of CEUS.
A total of 45 HCC patients with a total of 57 tumors who underwent TACE at our hospital were selected. CEUS was performed one day before treatment and one month after treatment. The blood perfusion parameters of residual tumors before and after TACE were compared.
The sensitivity, accuracy, and specificity of CEUS in the diagnosis of residual HCC lesions were 95.45%, 94.74%, and 92.31%, respectively. The enhanced intensity (56.87% ± 4.15%) of residual HCC tumors after TACE decreased significantly compared with that (75.09% ± 6.42%) before TACE (P < 0.05). The peak time (25.26 s ± 3.83 s) of HCC residual tumors after TACE was significantly longer than that (21.02 s ± 3.70 s) before TACE (P < 0.05). The area under the curve (581.29 ± 86.43) for residual HCC tumors decreased significantly compared with that (1017.83 ± 111.76) before TACE (P < 0.05).
CEUS can directly reflect the residual state of HCC after TACE and quantitatively evaluate the blood perfusion change of residual tumors, which can provide hemodynamic information for further clinical treatment.
- Citation: Zhang XR, Ouyang J, Huang JY. Quantitative evaluation of blood perfusion in hepatocellular carcinoma after transcatheter arterial chemoembolization by contrast-enhanced ultrasound. Shijie Huaren Xiaohua Zazhi 2019; 27(4): 276-281
- URL: https://www.wjgnet.com/1009-3079/full/v27/i4/276.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i4.276
原发性肝细胞癌(hepatocellular carcinoma, HCC)是一种在我国有着较高发病率和死亡率的恶性肿瘤, 临床上常采用手术和非手术两种方法进行治疗[1-3]. 经导管肝动脉化疗栓塞术(transcatheter artery chemo-embolization, TACE)作为一种HCC非手术治疗的主要方法已广泛用于临床, 故准确评估其治疗效果有着重要意义[4-6]. 超声造影(Contrast-Enhanced Ultrasound, CEUS)不仅能实时动态显示肿瘤组织微循环灌注过程, 而且能精确定量分析感兴趣区微循环血流灌注特征[7-9]. 本研究运用CEUS观察HCC经TACE治疗后的肿瘤残留情况并定量分析其血流灌注状态, 探讨其在TACE疗效评估中的临床应用价值.
选取2016-07/2018-09期间, 浙江省德清县人民医院收治并接受TACE治疗的45例HCC患者作为研究对象, 男32例, 女13例, 年龄37-68岁. 平均年龄50.59岁±7.67岁, 纳入标准: (1)符合HCC诊断标准(2009年)[10]; (2)均经穿刺活检病理确诊; (3)Child-Pugh 分级A级-B级. 排除标准: (1)凝血功能障碍、肝肾功能衰竭; (2)并发严重感染; (3)并发其它恶性肿瘤. 共计57个肿瘤, 最大直径范围2.1-7.3 cm, 平均2.75 cm±0.94 cm, 分别于TACE治疗前1 d、治疗后1 mo接受CEUS.
1.2.1 TACE术: 对股动脉拟穿刺部位进行常规消毒铺巾, 局部浸润麻醉后, 采用Seldinger技术穿刺, 将肝导管送至肝动脉, 超选插管至肿瘤供血动脉, 然后注入碘化油以及化疗药物. 术后拔出导管、动脉鞘, 加压包扎穿刺部位.
1.2.2 CEUS检查: 采用Acuson S2000超声诊断仪(Siemens公司), 配有频率为4.0 MHz的4C1探头以及对比脉冲系列成像技术, 机械指数设置为0.08. 采用Sono Vue(Bracco 公司)作为超声造影剂, 使用前按照说明书注入5 mL生理盐水, 用力震荡摇匀备用.
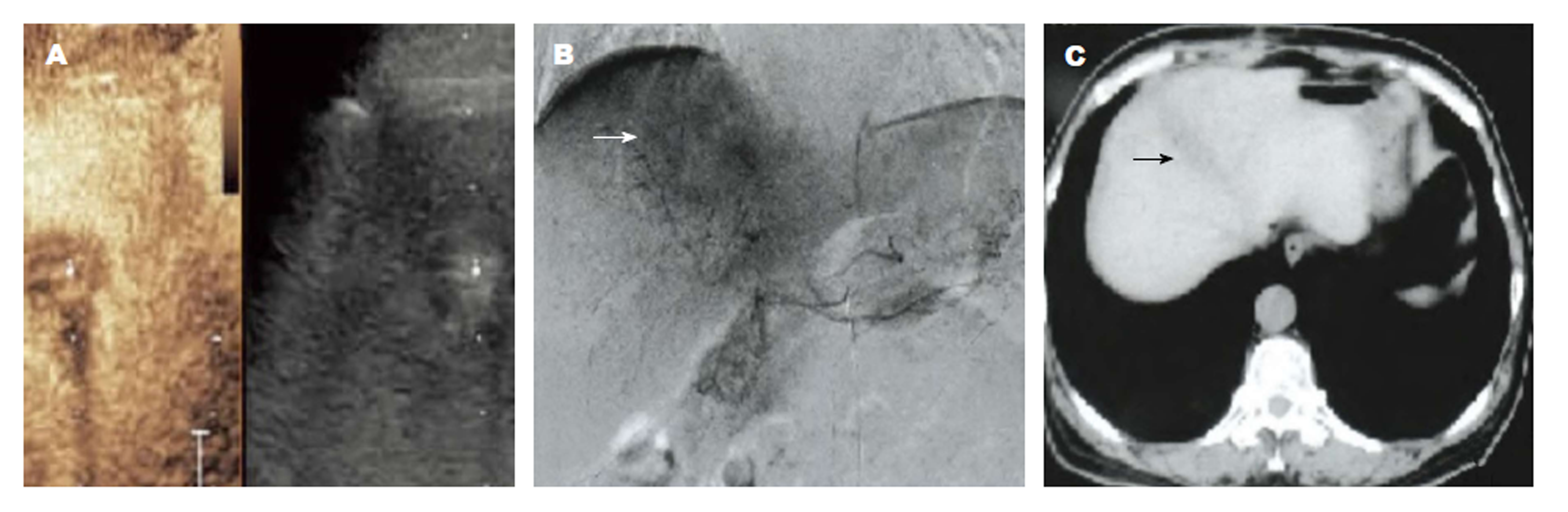
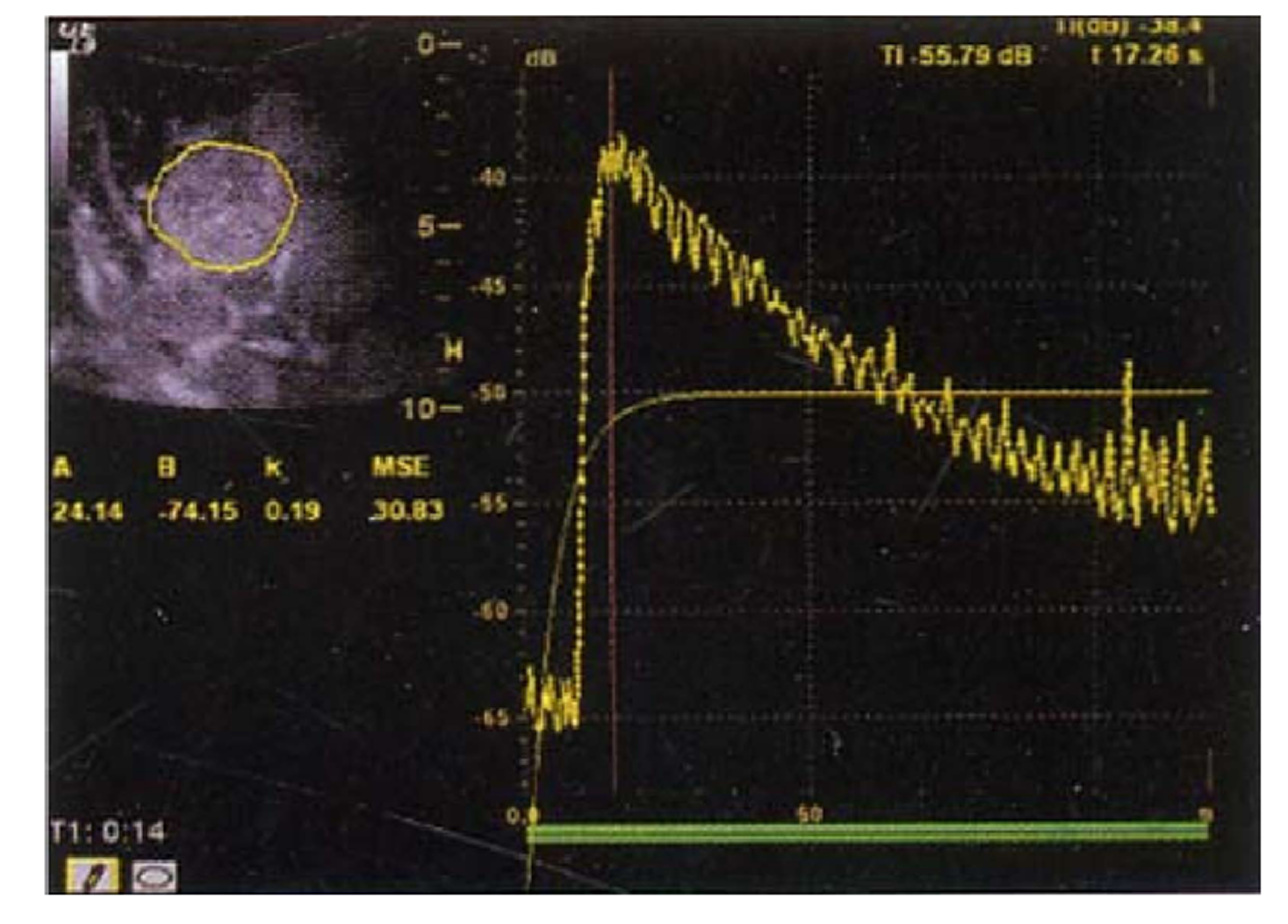
首先行常规超声检查, 记录肿瘤位置、大小、边界、内部回声、血流等情况, 然后选择肿瘤显示最佳切面, 固定探头, 切换至CEUS模式, 抽取2.4 mL Sono Vue经前臂浅静脉团注, 同步计时, 观察并储存造影全程动态图像, 作后期分析. 记录肿瘤的增强特征, 并通过时间-强度曲线(time-intensity curve, TIC)分析并记录肿瘤TACE治疗前后增强强度、达峰时间、曲线下面积等参数. 肿瘤的动脉相设定为0-30 s、门脉相设定为31-120 s, 延迟相设定为121-360 s(图1和图2).
1.2.3 CEUS判定标准: 肿瘤残留:肿瘤在动脉相、门脉相存在造影剂填充, 在延迟相消退; 肿瘤完全灭活:肿瘤在各期相均无造影剂填充, 边缘清晰, 表现为"黑洞征". 以DSA结果作为肿瘤残留与否的"金标准".
统计学处理 采用SPSS 20.0统计软件处理数据. 计量资料以mean±SD表示, 治疗前后比较采用配对样本t检验. 以P<0.05为差异有统计学意义.
TACE治疗后, DSA证实13个肿瘤完全灭活, 44个肿瘤存在不同程度残留.
经TACE治疗后, CEUS显示14个肿瘤无残留, 彻底灭活, 表现为肿瘤内部三期均无增强, 呈"黑洞征"; 43个肿瘤存在不同程度残留, 灭活不彻底, 其中动脉期23个肿瘤表现为结节状高增强, 11个肿瘤表现为不规则形高增强, 5个肿瘤表现为团块状高增强, 4个肿瘤表现为周边环形高增强; 门静脉38个肿瘤表现为低增强, 5个肿瘤表现为等增强; 延迟期43个肿瘤均表现为低增强. CEUS判定HCC肿瘤残留时, 灵敏度 = 95.45%(42/44), 准确度 = 94.74%(54/57), 特异度= 92.31%(12/13)(表1).
| CEUS | DSA | 总计 | |
| 残留 | 灭活 | ||
| 残留 | 42 | 1 | 43 |
| 灭活 | 2 | 12 | 14 |
| 总计 | 44 | 13 | 57 |
术后HCC残留肿瘤的增强强度较治疗前明显下降, 差异有统计学意义(P<0.05); 术后HCC残留肿瘤的达峰时间较治疗前明显延长, 差异有统计学意义(P<0.05); 术后HCC残留肿瘤的曲线下面积较治疗前明显减少, 差异有统计学意义(P<0.05)(表2).
| 参数 | 增强强度(%) | 达峰时间(s) | 曲线下面积 |
| 治疗前 | 75.09 ± 6.42 | 21.02 ± 3.70 | 1017.83 ± 111.76 |
| 治疗后 | 56.87 ± 4.15 | 25.26 ± 3.83 | 581.29 ± 86.43 |
| t值 | 14.870 | -4.845 | 23.240 |
| P值 | 0.000 | 0.000 | 0.000 |
HCC是一种常见恶性肿瘤, 早期症状不明显, 隐匿性较强, 被发现时常处于晚期而致使患者错失手术切除最佳时机[11-13]. 对于晚期HCC患者, 临床常采用非手术方法进行治疗, 而TACE作为一种HCC非手术治疗的主要方法之一, 其主要以阻断肿瘤供血动脉的方式来消除肿瘤, 因其具有创伤小, 效果确切等优点已被广泛用于HCC治疗中[6,14-16]. 但是TACE后肿瘤仍可通过接受门静脉供血或形成侧支循环, 使部分肿瘤存活下来继续生长, 导致肿瘤灭活不彻底. 因此准确评估肿瘤有无残留及残留肿瘤的血流灌注情况, 对临床进一步制定治疗方案具有重要意义.
超声微泡造影剂是一种理想的血管示踪剂, 经外周浅静脉注入微泡造影剂后, 微泡能随血流灌注进入各动静脉及其分支血管, 甚至毛细血管内, 通过显著增加含造影剂组织和无造影剂组织的声阻抗差别, 致使含造影剂组织在CEUS模式下清晰显示[7,17,18]. 因此CEUS可通过实时动态观察造影剂在肿瘤及其周围组织中进入和消退全程, 全面直观反映肿瘤内部及周围的微循环血流灌注状态, 而在临床应用中可根据肿瘤内是否存在造影剂充填进而判断其是否被彻底灭活, 如若肿瘤病灶内探及血流灌注信号, 即表示肿瘤仍然存在活性[19]. 本研究结果中, CEUS判定HCC肿瘤残留时, 灵敏度 = 95.45%, 准确度 = 94.74%, 特异度 = 92.31%. 提示CEUS能有效监测TACE对HCC的治疗效果, 并具有较高的准确度及应用价值. 值得指出的是本研究结果中, 假阳性1例, 原因可能是肿瘤周围炎性充血带所致, 而假阴性2例, 原因可能是肿瘤位置紧靠膈顶部, 受肺气干扰所致.
实体肿瘤的血管生成是其发生、发展的必要条件. 肿瘤能否彻底灭活与其内部供血动脉网成熟度, 血管结构密切相关[20]. CEUS不仅能实时显示造影剂在肿瘤中的灌注过程, 而且能通过时间-强度曲线定量评估肿瘤组织内部新生毛细血管生成情况, 间接反映肿瘤的恶性程度、血流动力学状态以及转移复发能力[21]. 本研究结果中, 经TACE治疗后, HCC残留肿瘤的增强强度较治疗前下降, 而达峰时间较治疗前延长(P<0.05), 证实了TACE对HCC治疗的有效性, 经TACE治疗后HCC肿瘤内的血流灌注状态反生改变. 肿瘤的血管密度、结构以及血流量与其发生、发展密切相关. CUES可通过分析时间-强度曲线的曲线下面积定量评估肿瘤内的血流量. 大量研究显示, 在维持仪器设置条件、造影剂使用量不变时, 曲线下面积与肿瘤组织内的血流量成正比[22]. 本研究结果中, 经TACE治疗后, HCC残留肿瘤的曲线下面积较治疗前明显减少(P<0.05), 提示经TACE治疗后HCC病灶内的血流量明显下降. TACE可通过直接栓塞HCC的主要供血血管以及注入药物引起肿瘤血管的内皮细胞发生变性坏死, 肿瘤血管发生闭塞, 导致肿瘤内微小血管的分布、密度以及结构发生改变, 最终导致肿瘤血供减少, 血流量下降[23].
总之, CEUS能实时动态反映HCC经TACE术治疗后肿瘤残留状态, 并能定量评估残留肿瘤的血流灌注信息, 可作为一种评估HCC患者TACE疗效的可靠影像学方法, 为临床进一步治疗提供依据.
经导管肝动脉化疗栓塞术(transcatheter artery chemo-embolization, TACE)是原发性肝细胞癌(hepatocellular carcinoma, HCC)非手术治疗的重要手段之一, 运用超声造影(contrast-enhanced ultrasound, CEUS)定量分析TACE后HCC的血流动力学状态有利于指导临床治疗.
运用CEUS判定TACE疗效, 通过时间-强度曲线(time-intensity curve, TIC)定量分析TACE后HCC的血流灌注参数变化, 以期为临床治疗提供血流动力学信息.
本篇论文研究的主要目标是运用CEUS定量分析TACE后HCC的血流灌注变化, 结果表明CEUS能有效反映TACE后HCC残留状态, 并能定量评估残留肿瘤的血流灌注情况, 具有一定临床价值.
本篇论文采用CEUS的TIC定量分析TACE后HCC的血流灌注特征. CEUS是一种敏感度极高的血流检测技术, 而TIC既能定量分析肿瘤的微循环血流灌注状态.
本篇论文研究达到了实验目标, 研究结果显示CEUS判定HCC残留的灵敏度 = 95.45%, 准确度 = 94.74%, 特异度 = 92.31%; 与治疗前比较, 治疗后HCC残留肿瘤的增强强度下降, 达峰时间延长, 曲线下面积减少(P<0.05). 本研究结果说明CEUS能有效监测TACE疗效, 并能定量评估残留肿瘤的血流灌注.
本研究发现TACE后HCC的血流灌注状态反生改变. CEUS能定量分析TACE后HCC的血流灌注变化, 有效监测TACE疗效, 指导临床治疗. CEUS能有效评估TACE疗效, 为临床治疗提供血流动力学信息. CEUS可用于评估TACE疗效, 分析TACE后肿瘤的血流灌注特征.
肿瘤周围炎性充血带可导致假阳性; 肿瘤位置紧靠膈顶部, 受肺气干扰可导致假阴性. 本研究未来研究的方向是三维CEUS分析TACE对HCC的疗效. 本研究未来研究的最佳方法是三维CEUS评估TACE后HCC的血流灌注状态变化.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): D, D
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | 张 修平, 李 楠, 卫 旭彪, 李 姗姗, 程 树群. 肝细胞癌合并门静脉癌栓诊断与鉴别诊断研究进展. 中国普外基础与临床杂志. 2017;21:507-511. |
| 2. | Mazzanti R, Arena U, Tassi R. Hepatocellular carcinoma: Where are we? World J Exp Med. 2016;6:21-36. [PubMed] [DOI] |
| 3. | Chan SL, Wong AM, Lee K, Wong N, Chan AK. Personalized therapy for hepatocellular carcinoma: Where are we now? Cancer Treat Rev. 2016;45:77-86. [PubMed] [DOI] |
| 4. | 廖 玉波, 赵 妍, 胡 鸿涛, 郭 晨阳, 马 俊丽, 蒋 丽, 黎 海亮. 肝动脉化疗栓塞术治疗原发性肝细胞癌预后影响因素分析. 中国介入影像与治疗学. 2017;14:729-733. [DOI] |
| 5. | Hucke F, Sieghart W, Pinter M, Graziadei I, Vogel W, Müller C, Heinzl H, Waneck F, Trauner M, Peck-Radosavljevic M. The ART-strategy: sequential assessment of the ART score predicts outcome of patients with hepatocellular carcinoma re-treated with TACE. J Hepatol. 2014;60:118-126. [PubMed] [DOI] |
| 6. | Geschwind JF, Kudo M, Marrero JA, Venook AP, Chen XP, Bronowicki JP, Dagher L, Furuse J, Ladrón de Guevara L, Papandreou C, Sanyal AJ, Takayama T, Ye SL, Yoon SK, Nakajima K, Lehr R, Heldner S, Lencioni R. TACE Treatment in Patients with Sorafenib-treated Unresectable Hepatocellular Carcinoma in Clinical Practice: Final Analysis of GIDEON. Radiology. 2016;279:630-640. [PubMed] [DOI] |
| 7. | Lekht I, Gulati M, Nayyar M, Katz MD, Ter-Oganesyan R, Marx M, Cen SY, Grant E. Role of contrast-enhanced ultrasound (CEUS) in evaluation of thermal ablation zone. Abdom Radiol (NY). 2016;41:1511-1521. [PubMed] [DOI] |
| 8. | Roccarina D, Garcovich M, Ainora ME, Riccardi L, Pompili M, Gasbarrini A, Zocco MA. Usefulness of contrast enhanced ultrasound in monitoring therapeutic response after hepatocellular carcinoma treatment. World J Hepatol. 2015;7:1866-1874. [PubMed] [DOI] |
| 9. | Tada T, Kumada T, Toyoda H, Ito T, Sone Y, Kaneoka Y, Maeda A, Okuda S, Otobe K, Takahashi K. Utility of Contrast-enhanced Ultrasonography with Perflubutane for Determining Histologic Grade in Hepatocellular Carcinoma. Ultrasound Med Biol. 2015;41:3070-3078. [PubMed] [DOI] |
| 11. | Burak KW, Kneteman NM. An evidence-based multidisciplinary approach to the management of hepatocellular carcinoma (HCC): the Alberta HCC algorithm. Can J Gastroenterol. 2010;24:643-650. [PubMed] [DOI] |
| 12. | Uhlmann D, Witzigmann H, Geissler F, Tannapfel A, Hauss J. Hepatocellular carcinoma: resection versus transplantation. Zentralbl Chir. 2000;125:624-628. [PubMed] [DOI] |
| 13. | Hosaka T, Suzuki F, Kobayashi M, Seko Y, Kawamura Y, Sezaki H, Akuta N, Suzuki Y, Saitoh S, Arase Y, Ikeda K, Kobayashi M, Kumada H. Long-term entecavir treatment reduces hepatocellular carcinoma incidence in patients with hepatitis B virus infection. Hepatology. 2013;58:98-107. [PubMed] [DOI] |
| 14. | Bettinger D, Gkika E, Schultheiss M, Glaser N, Lange S, Maruschke L, Buettner N, Kirste S, Nestle U, Grosu AL, Thimme R, Brunner TB. Comparison of local tumor control in patients with HCC treated with SBRT or TACE: a propensity score analysis. BMC Cancer. 2018;18:807. [PubMed] [DOI] |
| 15. | Erhardt A, Kolligs F, Dollinger M, Schott E, Wege H, Bitzer M, Gog C, Lammert F, Schuchmann M, Walter C, Blondin D, Ohmann C, Häussinger D. TACE plus sorafenib for the treatment of hepatocellular carcinoma: results of the multicenter, phase II SOCRATES trial. Cancer Chemother Pharmacol. 2014;74:947-954. [PubMed] [DOI] |
| 16. | Sato Y, Watanabe H, Sone M, Onaya H, Sakamoto N, Osuga K, Takahashi M, Arai Y; Japan Interventional Radiology in Oncology Study Group-JIVROSG. Tumor response evaluation criteria for HCC (hepatocellular carcinoma) treated using TACE (transcatheter arterial chemoembolization): RECIST (response evaluation criteria in solid tumors) version 1.1 and mRECIST (modified RECIST): JIVROSG-0602. Ups J Med Sci. 2013;118:16-22. [PubMed] [DOI] |
| 17. | Schellhaas B, Görtz RS, Pfeifer L, Kielisch C, Neurath MF, Strobel D. Diagnostic accuracy of contrast-enhanced ultrasound for the differential diagnosis of hepatocellular carcinoma: ESCULAP versus CEUS-LI-RADS. Eur J Gastroenterol Hepatol. 2017;29:1036-1044. [PubMed] [DOI] |
| 18. | Paul SB, Dhamija E, Gamanagatti SR, Sreenivas V, Yadav DP, Jain S, Shalimar, Acharya SK. Evaluation of tumor response to intra-arterial chemoembolization of hepatocellular carcinoma: Comparison of contrast-enhanced ultrasound with multiphase computed tomography. Diagn Interv Imaging. 2017;98:253-260. [PubMed] [DOI] |
| 19. | Menozzi G, Maccabruni V, Marini G, Froio E, Garlassi E. Contrast-enhanced ultrasound (CEUS) appearance of hepatic myelolipoma. J Ultrasound. 2014;19:61-65. [PubMed] [DOI] |
| 21. | Haimerl M, Brünn K, Poelsterl S, Beyer LP, Wiesinger I, Stroszczynski C, Jung EM, Wiggermann P. Quantitative evaluation of real-time maximum liver capacity (LiMAx) and time intensity curve (TIC) analysis in CEUS-based microperfusion. Clin Hemorheol Microcirc. 2017;67:373-382. [PubMed] [DOI] |
| 22. | 魏 芳, 何 晶玲, 龙 春艳, 段 琬璐, 王 莎莎, 李 叶阔. 超声造影定量分析失血性休克复苏期肝血流灌注变化的实验研究. 中国医学影像学杂志. 2017;25:409-413. [DOI] |
| 23. | Wu X, Qin L, Fako V, Zhang JT. Molecular mechanisms of fatty acid synthase (FASN)-mediated resistance to anti-cancer treatments. Adv Biol Regul. 2014;54:214-221. [PubMed] [DOI] |