修回日期: 2018-11-08
接受日期: 2019-01-22
在线出版日期: 2019-02-28
研究七氟烷对胃癌(gastric cancer, GC)细胞迁移、侵袭的影响, 并探讨其作用机制.
运用Transwell法检测细胞迁移、侵袭量; 将siCAR MA3组(转染siCARMA3)、NC组(转染siControl)、CARMA3组(转染pcDNA 3.1-CARMA3)、Vector组(转染pcDNA 3.1)均用脂质体法转染至SGC7901细胞; 用qRT-PCR检测细胞中CARMA3 mRNA表达; Western blot检测细胞中CARMA3、p-p65、p65蛋白表达.
与对照组相比, 七氟烷抑制GC细胞迁移、侵袭, 且抑制CARMA3表达; 沉默CARMA3抑制GC细胞迁移、侵袭, 过表达CARMA3促进GC细胞迁移、侵袭, 且CARMA3靶向NF-κB通路; 七氟烷可抑制CARMA3失活NF-κB通路抑制GC细胞迁移、侵袭.
七氟烷可抑制GC细胞迁移、侵袭, 其机制可能与失活CARMA3/NF-κB信号通路有关, 将可为七氟烷用于临床治疗GC提供依据.
核心提要: 七氟烷可以抑制胃癌(gastric cancer, GC)细胞的迁移和侵袭, 其中的作用机制与下调CARMA3失活NF-κB通路有关. 七氟烷有望成为治疗GC的新药物.
引文著录: 贾秀萍, 陈晓贞, 楼群兵, 周振锋, 高亮, 周鹏飞. 七氟烷调节CARMA3靶向NF-κB通路抑制胃癌细胞迁移、侵袭. 世界华人消化杂志 2019; 27(4): 220-227
Revised: November 8, 2018
Accepted: January 22, 2019
Published online: February 28, 2019
To investigate the effect of sevoflurane on cell migration and invasion in gastric cancer (GC) cells, and to explore the underlying mechanism.
After SGC7901 cells were transfected with siCARMA3 (siCARMA3 group), siControl (NC group), pcDNA 3.1-CARMA3 (CARMA3 group), or pcDNA 3.1 (vector group) by liposome method, the expression of CARMA3 mRNA in cells was detected by qRT-PCR, and the protein expression of CARMA3, p-p65, and p65 was detected by Western blot.
Compared with the control group, sevoflurane inhibited the migration and invasion of GC cells and down-regulated the expression of CARMA3. Silencing of CARMA3 inhibited the migration and invasion of GC cells, while overexpression of CARMA3 promoted the migration and invasion of GC cells. CARMA3 targeted the NF-κB pathway. Thus, sevoflurane regulated CARMA3 to inhibit migration and invasion of GC cells by targeting the NF-κB pathway.
Sevoflurane could inhibit the migration and invasion of GC cells via mechanisms that may be related to the regulation of CARMA3 to target the NF-κB pathway. This finding will provide a basis for clinical treatment of GC with sevoflurane.
- Citation: Jia XP, Chen XZ, Lou QB, Zhou ZF, Gao L, Zhou PF. Sevoflurane regulates CARMA3 to inhibit migration and invasion of gastric cancer cells by targeting NF-κB signaling pathway. Shijie Huaren Xiaohua Zazhi 2019; 27(4): 220-227
- URL: https://www.wjgnet.com/1009-3079/full/v27/i4/220.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i4.220
胃癌(gastric cancer, GC)是消化道常见癌症之一, 其发病率在全球范围内位居第四, 仅2012年诊断出95.2万新病例, 且新增病例数呈逐年增加趋势[1]. 近年来GC的早期筛查和治疗技术有较大提高, 但其预后仍不佳. 目前临床上仍迫切需要寻找能够诊断和治疗GC的新型药物. 七氟烷(Sevoflurane)作为一种吸入麻醉药, 凭借其麻醉诱导简单、平稳的优点在临床上广泛应用. 报道显示, 七氟烷吸入法用于老年GC根治手术患者麻醉, 对患者的血流动力学影响小, 术后患者苏醒质量高[2,3]. 七氟烷可调节乳腺癌[4]、前列腺癌[5]、胶质瘤[6]、肺癌、肾癌[7]的癌细胞发展. 黎真真等[8]报道, 七氟烷可抑制卵巢癌细胞增殖、迁移、侵袭. 但七氟烷对GC细胞迁移、侵袭的作用机制尚未完全阐明. 含半胱天冬酶募集结构域的膜相关鸟苷酸激酶蛋白(coactivator-associated arginine methyltransferase, CARMA)蛋白家族有三个成员, 分别为CARMA1、CARMA2、CARMA3. 该家族三成员均广泛参与调节各种疾病的发生发展[9]. CARMA3在乳腺癌[10]、卵巢癌[11]、结直肠癌[12]、肾癌[13]、膀胱癌[13]、胰腺癌等[14]癌组织均高表达, 且与癌细胞的恶性生物学行为关系密切. CARMA3调节乳腺癌、大肠癌细胞的增殖、侵袭、迁移, 其机制与激活NF-κB有关[15-17]. 而NF-κB与细胞增殖分化、肿瘤侵袭转移、上皮-间充质化和肿瘤血管生成密切相关[18]. CARMA3可促进GC细胞增殖、抑制凋亡[19]. 但CARMA3对GC细胞迁移、侵袭的作用机制尚未完全清楚. 本研究拟以人GC细胞 SGC7901为研究对象, 观察七氟烷、沉默CARMA3、过表达CARMA3对GC细胞迁移、侵袭的影响, 其机制可能与失活NF-κB通路有关, 可为七氟烷用于GC的临床治疗提供依据.
人GC细胞SGC7901购自中国科学院上海细胞库; 信号通路特异性激活剂PMA、信号通路特异性抑制剂PTDC、pcDNA 3.1、siCARMA3、Matrigel基质胶购自美国Invitrogen公司; Transwell小室购自美国Coming公司; PVDF膜、LipofectamineTM 2000脂质体、SDS-PAGE 试剂盒、ECL发光液和RIPA蛋白裂解液均购于碧云天公司; DMEM培养基、胎牛血清、BCA蛋白定量试剂盒、逆转录试剂盒均购于大连Takara公司; 半干转膜仪购自美国BIO-RAD公司; 实时荧光定量PCR系统购自美国ABI公司; 紫外分光光度计购自美国Thermo公司; 细胞培养箱购自美国Forma Scientific公司; PCR仪购自美国BIO-RAD公司.
1.2.1 细胞培养: 用含10%胎牛血清的DMEM培养液培养GC细胞SGC7901, 于37 ℃, 5% CO2的培养箱中进行常规培养. 每2-3 d更换培养液或消化传代一次.
1.2.2 转染: 将siCARMA3、siControl、pcDNA 3.1-CAR MA3和pcDNA 3.1用LipofectamineTM2000脂质体转染GC细胞SGC7901, 分别标记为siCARMA3组、NC组、CARMA3组、Vector组. 将转染后的细胞培养至对数生长期进行qRT-PCR实验、Western blot实验和Transwell实验.
1.2.3 Transwell: 取适量对数生长期的转染细胞, 调整细胞密度为106个/孔接种于6孔板, 常规培养至细胞融合度达到70%, 更换为无血清培养基培养过夜. 调整各组细胞密度为105个/mL, 取100 μL加入上室内, 600 μL含血清的培养基加入下室内, 继续培养过夜. 取出小室, 用棉签擦去上室内的细胞, PBS洗涤2次, 甲醇固定30 min, 0.1%结晶紫染色20 min, PBS洗涤2次. 显微镜下观察小室下表面附着的迁移细胞, 随机取5个视野拍照计数, 取平均数.
将小室的上室涂适量基质胶后再加入100 μL适当密度的转染胰腺癌细胞, 其他操作与检测细胞迁移数一样, 最后显微镜下观察小室下表面附着的细胞数量, 随机取5个视野拍照计算, 取平均值.
1.2.4 qRT-PCR: 取适量对数生长期的转染细胞, Trizol裂解液裂解细胞, RNA抽提试剂盒提取RNA,并进行分光光度计定量. 立即用逆转录试剂盒合成cDNA, qRT-PCR试剂盒进行CARMA3 mRNA的检测, 以2-△△Ct法计算定量结果. 实验重复3次.
1.2.5 Western blot: 取适量对数生长期的转染细胞, RIPA裂解后, 提取总蛋白, BCA法蛋白定量后变性, 然后进行SDS蛋白电泳, 之后进行PVDF转膜, 脱脂奶粉封闭2 h, 然后用Ⅰ抗, 4 ℃孵育过夜. 次日, 洗膜后用辣根过氧化物酶标记的Ⅱ抗37 ℃孵育2 h. 结束后加入显影混合液, 显影曝光. 以GADPH为内参, 以目的条带灰度值与GADPH灰度值的比值表示目的蛋白的表达情况.
统计学处理 实验数据采用SPSS 13.0软件进行分析. 计量资料用mean±SD表示, 多组间数据比较采用单因素方差分析, 两两数据比较采用SNK-q检验, 以P<0.05表示差异有统计学意义.
运用Transwell法检测不同浓度七氟烷处理的GC细胞的细胞迁移、侵袭量. 高剂量组、中剂量组、低剂量组于对照组, 细胞迁移量均显著降低, 高剂量组于中剂量组, 细胞迁移量显著降低(图1A和B); 高剂量组、中剂量组、低剂量组于对照组, 细胞侵袭量均显著降低, 高剂量组于中剂量组, 细胞侵袭量显著降低(图1A和C). 可见, 七氟烷抑制为癌细胞迁移、侵袭且呈浓度依赖性.
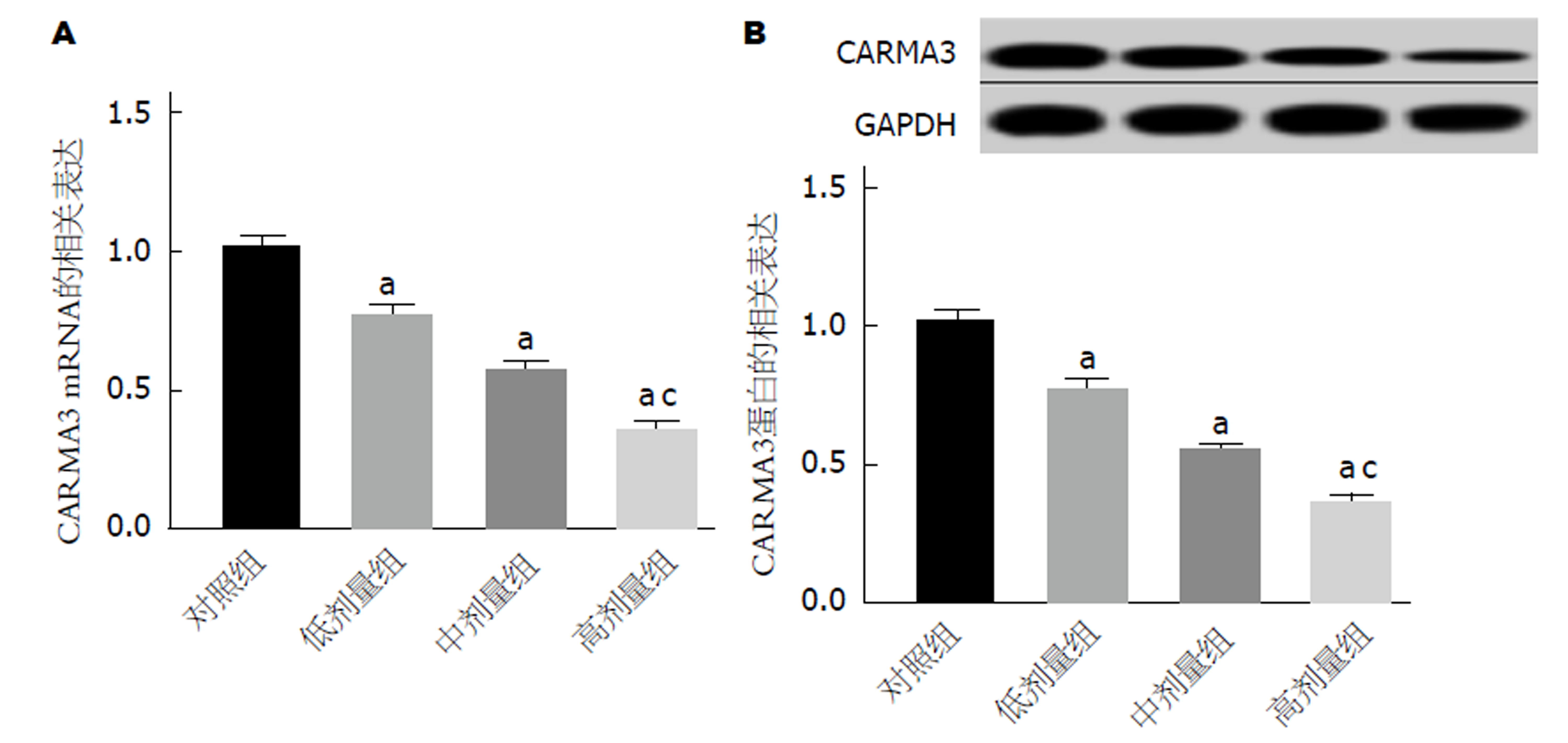
运用qRT-PCR法检测不同浓度组GC细胞中CARMA3 mRNA表达, 高剂量组、中剂量组、低剂量组于对照组, CARMA3 mRNA表达均为显著降低, 高剂量组于中剂量组, CARMA3 mRNA表达显著降低(图2A); CARMA3蛋白表达均显著降低, 高剂量组于中剂量组, CARMA3蛋白表达显著降低(图2B). 可见, 七氟烷抑制GC细胞中CARMA3表达.
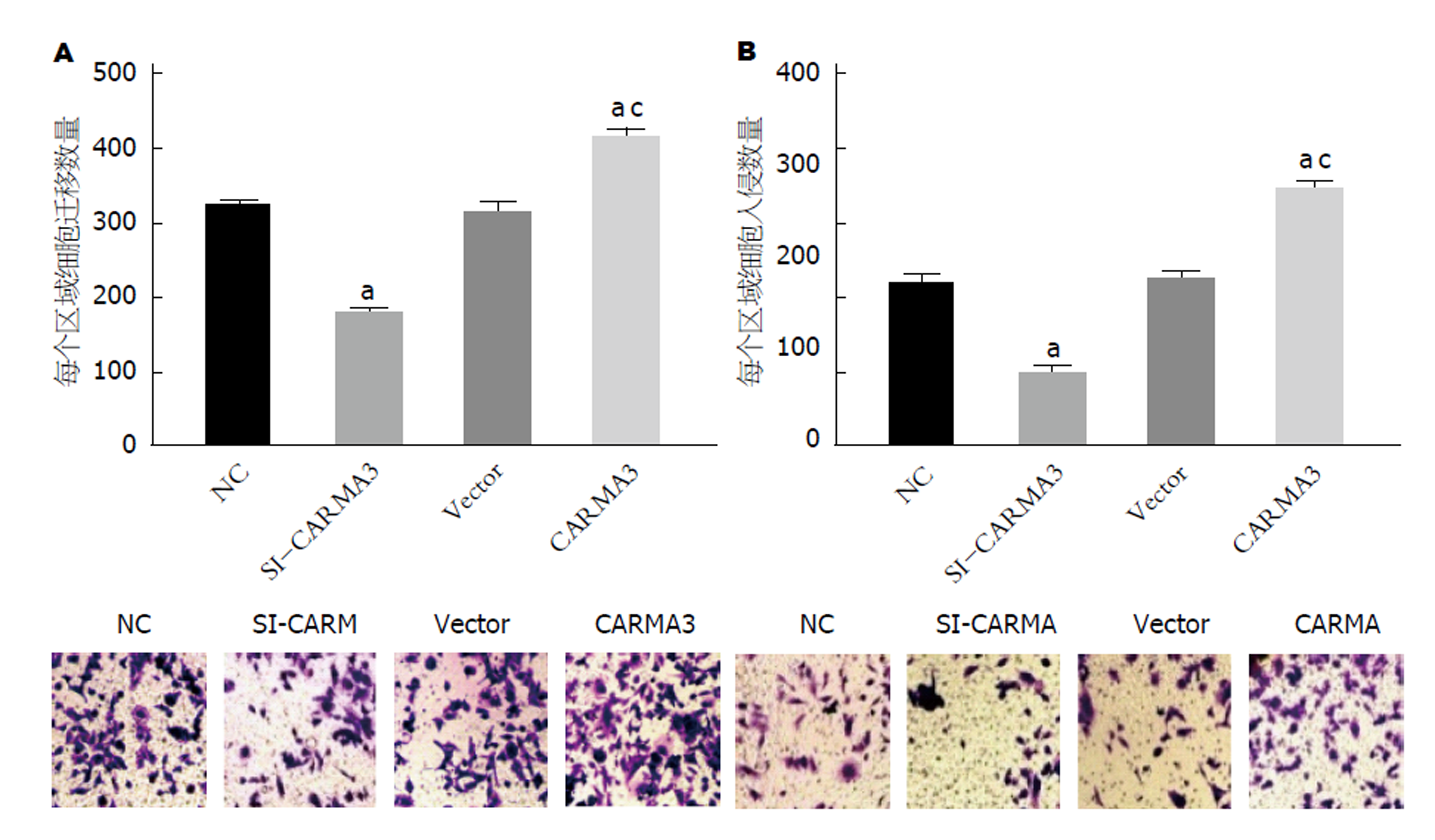
si-CARMA3组于NC组, SGC7901细胞迁移数、侵袭数均显著降低, CARMA3组于NC组, 细胞迁移数、侵袭数均显著升高(图3A和B). CARMA3于Vector组细胞迁移数、侵袭数均显著升高(图3A和B), 均具有统计学意义(P<0.05). 可见, 沉默CARMA3抑制GC细胞迁移、侵袭, 过表达CARMA3促进GC细胞迁移、侵袭.
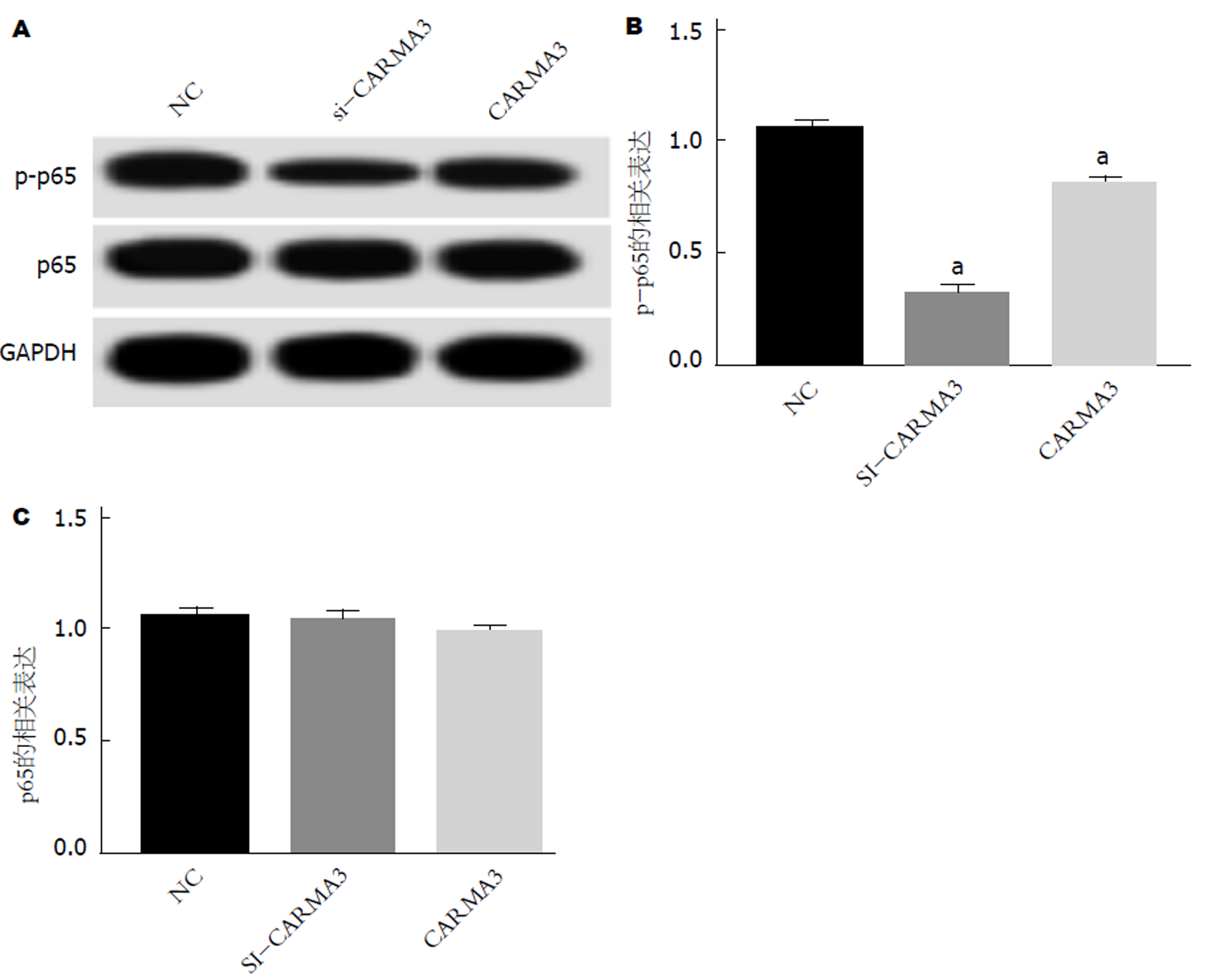
运用Western blot检测si-CARMA3组、CARMA3组GC细胞中p-p65、p65蛋白表达. si-CARMA3组于NC组, p-p65蛋白表达显著降低(图4A和B), p65蛋白表达差异不显著(图4A和C); CARMA3组于NC组, p-p65蛋白表达显著降低(图4A、B), p65蛋白表达差异不显著(图4A和C), 均具有统计学意义(P<0.05). 可见, CARMA3靶向NF-κB信号通路.
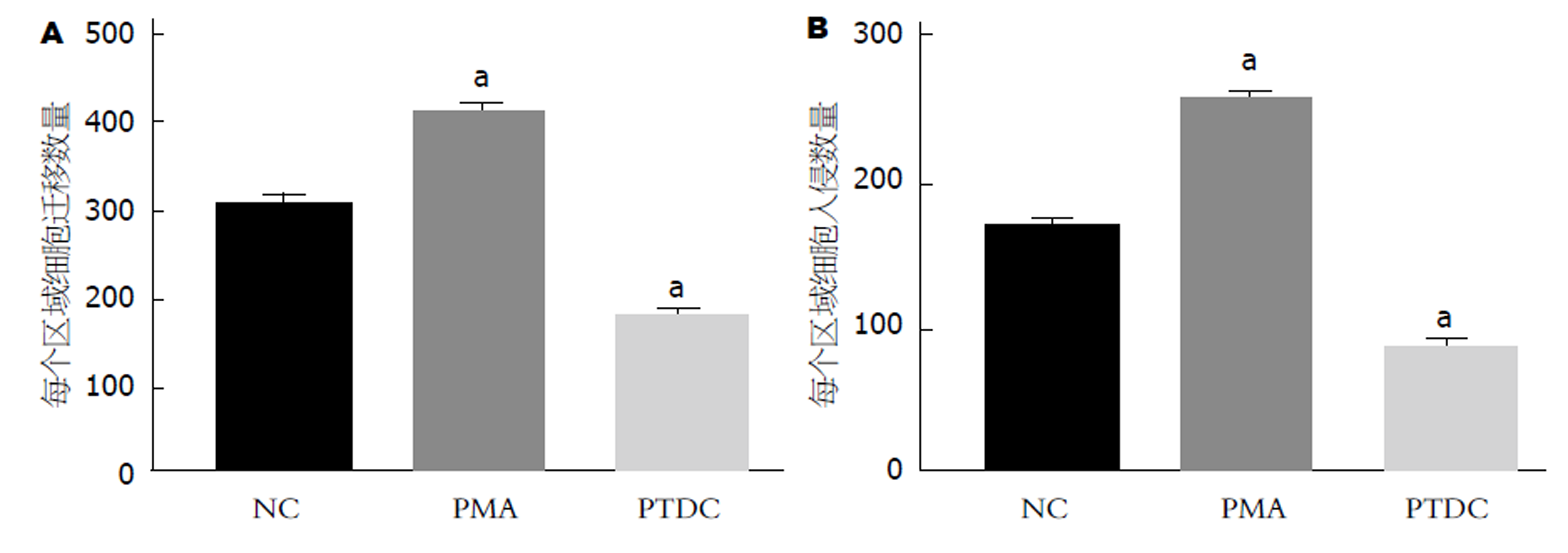
将用1 μmol/L的NF-κB通路激活剂处理48 h的GC细胞标记为PMA组, 用20 μmol/L的NF-κB通路抑制剂处理48 h的GC细胞标记为PTDC组. PMA组于NC组, 细胞迁移数、细胞侵袭数均显著升高(图5A和B), PTDC组于NC组, 细胞迁移数、细胞侵袭数均显著降低(图5A和B), 均具有统计学意义(P<0.05). 可见, NF-κB的活性与GC细胞迁移、侵袭量成正相关.
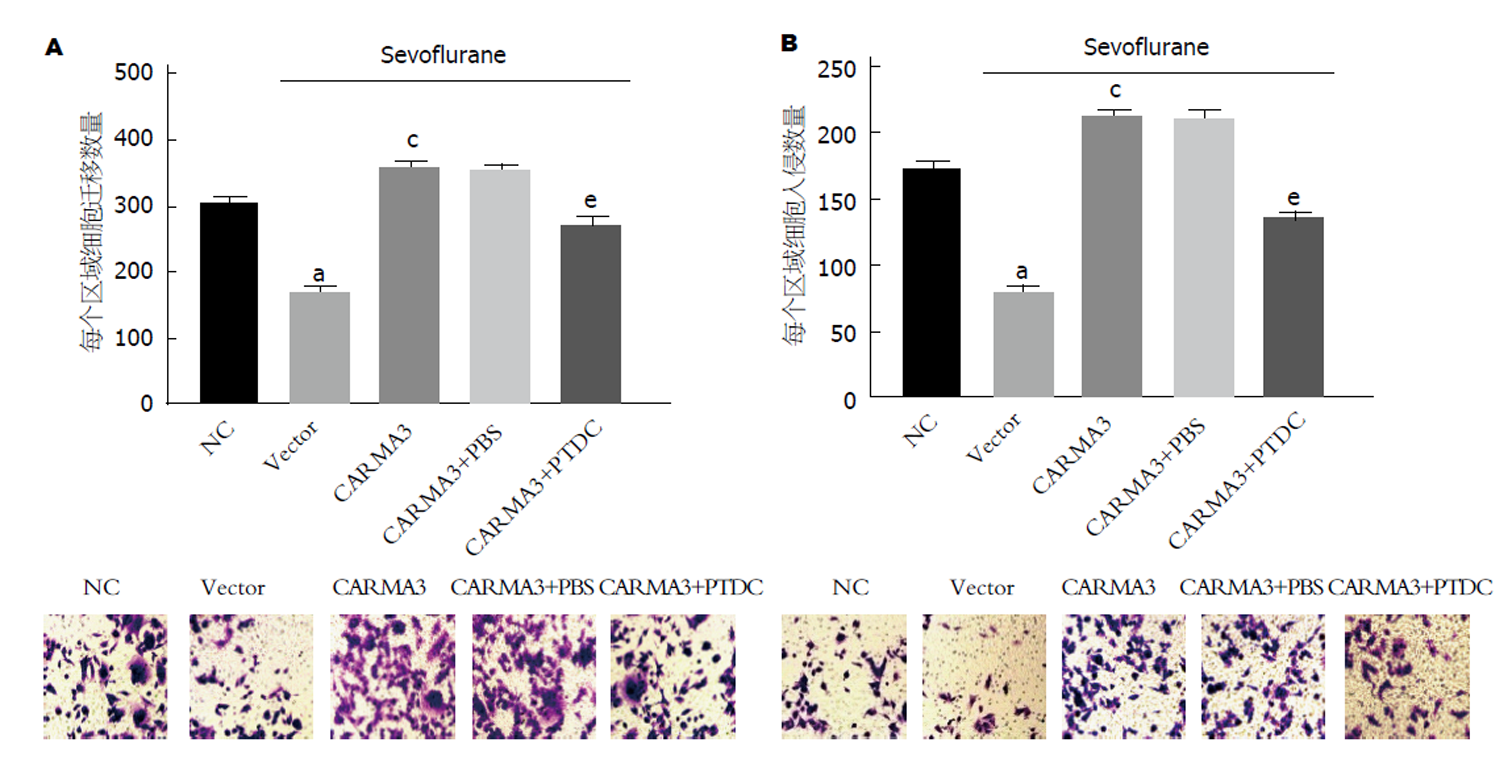
将用七氟烷处理过的Vector组、CARMA3组、CARMA3+PBS组和CARMA3+PTDC组与未做任何处理的NC组相比, Vector组细胞迁移量、侵袭量均显著降低; CARMA3组与Vector组相比, 细胞迁移量、侵袭量均显著升高; CARMA3+PTDC组与CARMA3+PBS组相比, 细胞迁移量、侵袭量均显著降低(图6A和B), 均具有统计学意义(P<0.05). 可见, 七氟烷可调节靶向NF-κB信号通路的CARMA3抑制GC细胞迁移、侵袭.
七氟烷曾为吸入麻醉的里程碑药物, 其为维持儿童全麻的首选药物[20]. 近几年七氟烷在多种癌症中的治疗作用均得到证实. 最近Yang等[21]在研究头颈部鳞状细胞癌(head and neck squamous cell carcinoma, HNSCC)中发现, 七氟烷可抑制头颈部鳞状细胞癌细胞增殖、促进凋亡, 激活HIF-1α途径, 揭示了七氟烷可降低HNSCC细胞的恶性行为, 其机制与激活HIF-1α途径有关. 本研究运用Transwell检测不同浓度七氟烷处理的GC细胞的细胞迁移、侵袭发现, 七氟烷可抑制GC细胞迁移、侵袭, 且呈浓度依赖性; 又运用qRT-PCR、Western blot检测七氟烷处理的GC细胞中CARMA3的mRNA、蛋白表达发现, 七氟烷可抑制CARMA3表达.
半胱天冬酶募集结构域的膜相关鸟苷酸激酶蛋白(CARMA)归属于膜相关鸟苷酸激酶(MAGUK)家族. MAGUK家族蛋白在特定的细胞膜区域具有组装蛋白复合物的支架作用. CARMA的肽链末端有一个半胱氨酸蛋白酶结构域和一个卷曲螺旋结构域, CARMA羧基末端有一个MAGUK区域(PDZ结构域、SH3结构域、GUK结构域)[22]. GARMA蛋白家族的分布非常广泛, 但其家族成员间的分布具有一定特异性, CARMA3主要分布于心、肝、肾、膀胱、卵巢等器官组织中[23]. McAuley等[24]在研究CARMA3在实体肿瘤发病机制的作用中揭示, CARMA-Bcl 10-MALT1(CBM)信号通路在实体肿瘤细胞中具调节作用, 而含有CARMA3的CBM复合物在G蛋白偶联受体(GPCRs)和生长因子受体酪氨酸激酶(PTKs)的下游起作用, GPCRs和PTKs的异常激活是大部分实体肿瘤发病机理的基础, 阐明了CARMA3介导的信号通路在恶性肿瘤中具有重要意义. 刘枋等[25]在研究结肠癌时, 构建敲减CARMA3基因的HCT116细胞, 并对其进行细胞增殖、凋亡、EMT、迁移、侵袭的检测分析发现, 敲减CARMA3可抑制细胞EMT、增殖、迁移、侵袭, 揭示了CARMA3可调节细胞周期、EMT影响结肠癌细胞的增殖、迁移、侵袭, 其机制与NF-κB通路有关. 本研究运用Transwell检测了沉默CARMA3和过表达CARMA3的GC细胞迁移数、侵袭数发现, 沉默CARMA3抑制GC细胞迁移、侵袭, 过表达CARMA3促进GC细胞迁移侵袭.
CARMA3在淋巴和非淋巴细胞中与Ikappa激酶γ/NFκB必需调节(IkappaKgamma-NEMO)物理结合, 且CARMA3的NEMO结合区的表达失活Bcl10介导的NF-κB[26]. Jiang等[16]研究EGFR激活NF-κB的作用机制中发现, CARMA3具有EGF诱导的NF-κB活化所必需的caspase募集域(CARD), 敲减CARMA3抑制EGF刺激后IKK复合物的活化, 导致EGF诱导的IκBα磷酸化和NF-κB的失活, 揭示CARMA3有助于体内肿瘤的生长、转移. Ekambaram等[27]在乳腺癌的研究中发现, 血管紧张素II受体(AGTR1)介导CARMA3-Bcl10-MALT1(CBM通路)信号通路的激活, 促进癌细胞增殖、迁移、侵袭, NF-κB的CBM依赖性激活促进肿瘤血管生成, 揭示AGTR1可激活CBM/ NF-κB信号通路促进乳腺癌的恶化. 本研究检测了沉默CARMA3、过表达CARMA3对NF-κB信号通路的表达发现, 沉默CARMA3可失活NF-κB信号通路, 过表达CARMA3可激活NF-κB信号通路; 进一步运用通路激活剂PMA、通路抑制剂PTDC处理GC细胞发现, NF-κB的活性与GC细胞迁移、侵袭量成正相关, 且过表达CARMA3的GC细胞与七氟烷、通路抑制剂PTDC共处理后可抑制GC细胞迁移、侵袭.
总之, 七氟烷可抑制GC细胞迁移、侵袭, 其机制可能与下调CARMA3失活NF-κB信号通路有关, 为七氟烷治疗GC的临床应用提供理论依据.
七氟烷在多种癌症中均可调节癌细胞的增殖、迁移和侵袭. 但七氟烷在胃癌(gastric cancer, GC)细胞中的作用机制国内外尚未有人研究.
本研究旨在研究七氟烷对GC细胞迁移侵袭的影响, 并探讨其分子作用机制, 以期望为解决GC治疗的问题提供线索.
探讨七氟烷抑制GC细胞迁移侵袭的作用, 及其机制, 以期为GC的治疗提供新方向.
将GC细胞SGC7901分成siCARMA3组(转染siCARM A3)、NC组(转染siControl)、CARMA3组(转染pcDNA 3.1-CARMA3)、Vector组(转染pcDNA 3.1), 用Transwell法检测细胞迁移、侵袭量; 用qRT-PCR检测细胞中CARMA3 mRNA表达; Western blot检测细胞中CARMA3、p-p65、p65的蛋白表达.
本研究成功构建过表达CARMA3和沉默CARMA3的GC细胞发现, GC细胞的迁移侵袭能力与CARMA3的表达量呈正相关; 七氟烷能够抑制GC细胞的迁移侵袭及CARMA3表达, 且CARMA3靶向NF-κB信号通路.
七氟烷可抑制GC细胞迁移、侵袭, 其可能与七氟烷下调CARMA3进而失活NF-κB信号通路有关, 提示七氟烷可用于治疗GC.
本研究仅在体外研究七氟烷对GC细胞迁移侵袭的抑制作用, 后期还需增加七氟烷在动物体内对GC转移的研究实验, 以更清晰的展示七氟烷对GC的治疗价值, 也为七氟烷的临床应用提供更充分的理论依据.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): D
E级 (差): E
编辑: 崔丽君 电编:张砚梁
| 4. | Lim JA, Oh CS, Yoon TG, Lee JY, Lee SH, Yoo YB, Yang JH, Kim SH. The effect of propofol and sevoflurane on cancer cell, natural killer cell, and cytotoxic T lymphocyte function in patients undergoing breast cancer surgery: an in vitro analysis. BMC Cancer. 2018;18:159. [PubMed] [DOI] |
| 6. | Yi W, Li D, Guo Y, Zhang Y, Huang B, Li X. Sevoflurane inhibits the migration and invasion of glioma cells by upregulating microRNA-637. Int J Mol Med. 2016;38:1857-1863. [PubMed] [DOI] |
| 7. | Ciechanowicz S, Zhao H, Chen Q, Cui J, Mi E, Mi E, Lian Q, Ma D. Differential effects of sevoflurane on the metastatic potential and chemosensitivity of non-small-cell lung adenocarcinoma and renal cell carcinoma in vitro. Br J Anaesth. 2018;120:368-375. [PubMed] [DOI] |
| 10. | Xia ZX, Li ZX, Zhang M, Sun LM, Zhang QF, Qiu XS. CARMA3 regulates the invasion, migration, and apoptosis of non-small cell lung cancer cells by activating NF-кB and suppressing the P38 MAPK signaling pathway. Exp Mol Pathol. 2016;100:353-360. [PubMed] [DOI] |
| 11. | Xie C, Han Y, Fu L, Li Q, Qiu X, Wang E. Overexpression of CARMA3 is associated with advanced tumor stage, cell cycle progression, and cisplatin resistance in human epithelial ovarian cancer. Tumour Biol. 2014;35:7957-7964. [PubMed] [DOI] |
| 12. | Wang L, Qian L, Li X, Yan J. MicroRNA-195 inhibits colorectal cancer cell proliferation, colony-formation and invasion through targeting CARMA3. Mol Med Rep. 2014;10:473-478. [PubMed] [DOI] |
| 13. | Wu GL, Yuan JL, Huang XD, Rong JF, Zhang LX, Liu YP, Wang FL. Evaluating the expression of CARMA3 as a prognostic tumor marker in renal cell carcinoma. Tumour Biol. 2013;34:3431-3435. [PubMed] [DOI] |
| 14. | Du S, Jia L, Zhang Y, Fang L, Zhang X, Fan Y. CARMA3 is upregulated in human pancreatic carcinoma, and its depletion inhibits tumor proliferation, migration, and invasion. Tumour Biol. 2014;35:5965-5970. [PubMed] [DOI] |
| 16. | Jiang T, Grabiner B, Zhu Y, Jiang C, Li H, You Y, Lang J, Hung MC, Lin X. CARMA3 is crucial for EGFR-Induced activation of NF-κB and tumor progression. Cancer Res. 2011;71:2183-2192. [PubMed] [DOI] |
| 17. | Miao Z, Zhao T, Wang Z, Xu Y, Song Y, Wu J, Xu H. CARMA3 is overexpressed in colon cancer and regulates NF-κB activity and cyclin D1 expression. Biochem Biophys Res Commun. 2012;425:781-787. [PubMed] [DOI] |
| 18. | 阮 妙华, 王 凯, 王 丹, 周 爱华, 褚 茂平, 陈 其, 钱 燕. 病毒性心肌炎小鼠心肌中MMP-2和NF-κB的表达. 中国病理生理杂志. 2016;32:1704-1707; 1712. [DOI] |
| 19. | 蒯 君, 秦 咏梅, 郭 晓鹤, 杨 芳, 张 兰芳. miRNA-24通过靶向CARMA3基因调控胃癌AGS细胞的增殖和凋亡. 中国肿瘤生物治疗杂志. 2017;24:1093-1100. |
| 21. | Yang Y, Hu R, Yan J, Chen Z, Lu Y, Jiang J, Jiang H. Sevoflurane inhibits the malignant potential of head and neck squamous cell carcinoma via activating the hypoxiainducible factor-1α signaling pathway in vitro. Int J Mol Med. 2018;41:995-1002. [PubMed] [DOI] |
| 22. | Blonska M, Lin X. NF-κB signaling pathways regulated by CARMA family of scaffold proteins. Cell Res. 2011;21:55-70. [PubMed] [DOI] |
| 23. | Fuchs-Telem D, Sarig O, van Steensel MA, Isakov O, Israeli S, Nousbeck J, Richard K, Winnepenninckx V, Vernooij M, Shomron N, Uitto J, Fleckman P, Richard G, Sprecher E. Familial pityriasis rubra pilaris is caused by mutations in CARD14. Am J Hum Genet. 2012;91:163-170. [PubMed] [DOI] |
| 24. | McAuley JR, Freeman TJ, Ekambaram P, Lucas PC, McAllister-Lucas LM. CARMA3 Is a Critical Mediator of G Protein-Coupled Receptor and Receptor Tyrosine Kinase-Driven Solid Tumor Pathogenesis. Front Immunol. 2018;9:1887. [PubMed] [DOI] |
| 26. | Stilo R, Liguoro D, Di Jeso B, Formisano S, Consiglio E, Leonardi A, Vito P. Physical and functional interaction of CARMA1 and CARMA3 with Ikappa kinase gamma-NFkappaB essential modulator. J Biol Chem. 2004;279:34323-34331. [PubMed] [DOI] |
| 27. | Ekambaram P, Lee JL, Hubel NE, Hu D, Yerneni S, Campbell PG, Pollock N, Klei LR, Concel VJ, Delekta PC, Chinnaiyan AM, Tomlins SA, Rhodes DR, Priedigkeit N, Lee AV, Oesterreich S, McAllister-Lucas LM, Lucas PC. The CARMA3-Bcl10-MALT1 Signalosome Drives NFκB Activation and Promotes Aggressiveness in Angiotensin II Receptor-Positive Breast Cancer. Cancer Res. 2018;78:1225-1240. [PubMed] [DOI] |