修回日期: 2019-07-02
接受日期: 2019-12-13
在线出版日期: 2019-12-28
谷胱甘肽过氧化物酶3(glutathione peroxidase 3, GPX3)在胃癌(gastric cancer, GC)中低表达, 但其表达与GC患者预后联系尚不明确.
分析GPX3基因在GC中的表达模式及预后价值.
首选, 利用Oncomine数据库分析GPX3基因在GC及正常胃黏膜组织中的表达情况; 利用KM Plotter数据库分析GPX3的表达对GC患者的预后进行分析. 其次, 运用TCGA数据集对GPX3的表达模式和预后价值进行验证. 最后, 通过免疫组织化学法检测含有90例胃腺癌及其癌旁组织的组织芯片对上述结果进一步验证.
利用Oncomine数据库分析, 发现GPX3基因在GC组中表达显著低于正常胃黏膜组织(P<0.05). 利用KM Plotter数据库分析, 发现GC组织中GPX3低表达与患者总体生存率显著相关(P<0.05). 利用TCGA数据集对GPX3的表达模式和预后价值进行验证, 提示GPX3低表达与患者GC患者总体生存率显著相关(P<0.05). 通过对90例GC及其癌旁组织的组织芯片研究分析发现, GPX3在癌组织中显著低表达(P = 0.037), GPX3低表达与患者的年龄、性别、肿瘤临床分期无关, 但与GC患者总体生存率显著相关(HR = 0.48, 95%CI: 0.28-0.85, P = 0.019).
GPX3在GC中呈低表达, 且与预后显著相关.
核心提要: 本文通过组织芯片技术证实谷胱甘肽过氧化物酶3(glutathione peroxidase 3, GPX3)在胃癌(gastric cancer, GC)中的表达及其与GC患者的预后联系, GPX3在GC中呈低表达, 表达越低, 预后越好.
引文著录: 张海平, 李蜀豫. GPX3在胃癌中的表达及临床意义. 世界华人消化杂志 2019; 27(24): 1483-1489
Revised: July 2, 2019
Accepted: December 13, 2019
Published online: December 28, 2019
Glutathione peroxidase 3 (GPX3) expression is down-regulated in gastric cancer (GC), but the relationship between GPX3 expression and prognosis in this malignancy is yet unknown.
To explore the expression pattern and prognostic value of GPX3 in GC.
GPX3 expression was analyzed based on the Oncomine database. The prognostic value of GPX3 in GC patients was investigated using the KM Plotter database. To validate the expression pattern and prognostic value of GPX3, TCGA GC dataset was also analyzed. Finally, the expression pattern and prognostic value of GPX3 was evaluated by tissue microarray and immunohistochemistry in 90 GC patients.
Oncomine database analysis showed that GPX3 was significantly down-regulated in GC tissues compared with normal tissues (P < 0.05). Data from the KM Plotter database showed that GPX3 low expression was significantly related with overall survival (P < 0.05). TCGA dataset analysis also showed that GPX3 low expression was an indicator of better prognosis (P < 0.05). Tissue microarray and immunohistochemistry showed that GPX3 was significantly down-regulated in GC tissue (P = 0.037). GPX3 expression was related with GC patient overall survival (HR = 0.48, 95%CI: 0.28-0.85, P = 0.019), rather than age, gender, and tumor clinical stage.
GPX3 is downregulated in GC, and GPX3 expression can be used to predict GC patients' prognosis.
- Citation: Zhang HP, Li SY. Clinical significance of expression of glutathione peroxidase 3 in gastric cancer. Shijie Huaren Xiaohua Zazhi 2019; 27(24): 1483-1489
- URL: https://www.wjgnet.com/1009-3079/full/v27/i24/1483.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i24.1483
胃癌(gastric cancer, GC)是人类常见的恶性肿瘤之一, 发病率高、早期诊断率低、预后差[1]. 据2018年全球癌症统计数据显示, GC死亡率居所有肿瘤中第三位, 死亡人数占癌症总死亡人数8.2%[2]. GC发病主要集中于亚洲, 尤其在部分东南亚国家(如中国、韩国、日本)GC全球发病率最高, 在GC的早期筛查及治疗方面, 给全球卫生经济带来了沉重的负担.
谷胱甘肽过氧化物酶3(glutathione peroxidase 3, GPX3)是机体抗氧化功能的重要基因, GPX3适度表达对维持机体正常新陈代谢有重要作用. 现有证据表明GPX3异常表达与消化道肿瘤的发生关系密切[3]. 目前关于GPX3基因甲基化导致GPX3表达下降的研究较多[4], 但GPX3异常表达与GC患者的临床预后关系尚不明确. 目前生物信息学正飞速发展, 肿瘤研究处于信息大爆炸时代. 国外公共基因芯片和RNA测序数据库(如Oncomine、KM Plotter、TCGA等)收集了大量关于肿瘤基因表达及预后的丰富信息, 可供学者挖掘潜在的肿瘤标志物[5-8]. 本研究中利用国外公共基因芯片和RNA测序数据库分析GPX3在GC中的表达和预后价值, 并运用组织芯片技术对上述结果进行证实, 为后续GPX3作为GC诊治标志物提供依据.
首先, 通过Oncomine数据库中的4个数据集(GSE13861、GSE27342、GSE13911和GSE19826)分析GPX3在GC中的表达; 利用KM Plotter数据库分析GPX3在GC患者中的预后, 共6个数据集(GSE14210, GSE15459, GSE22377, GSE29272, GSE51105和GSE62254)纳入此研究. 其次, 利用TCGA数据集对GPX3在GC患者中的表达和预后再次进行验证分析. 最后通过组织芯片技术对GPX3在GC中的表达及预后价值进行临床阶段的验证分析.
1.2.1 Oncomine数据库分析: Oncomine数据库(http://www.oncomine.org)是由美国密歇根大学创建的用于分析基因表达、基因共表达、突变、耐药、预后等的重要肿瘤数据库, 目前共收集715个数据集和86733样本[9]. 本研究中利用该数据库分析GPX3基因在GC组织与正常组织中的在mRNA水平上的表达情况, 共4个数据集(GSE13861、GSE27342、GSE13911和GSE19826)纳入此次研究. 基因表达差异倍数大于2且P值小于0.05视为差异具有统计学意义.最后, 运用组织芯片技术对GPX3在GC中的表达和预后进行临床验证分析.
1.2.2 KM Plotter数据库分析: KM Plotter数据库(http://kmplot.com/analysis/)是专门用于分析基因表达与肿瘤预后的重要数据库, 该数据库可分析10461肿瘤样本中的54675种基因在肿瘤患者中的预后价值[10]. 截止目前为止, 该数据库包含5143个乳腺癌样本, 1618个卵巢癌样本, 2437个肺癌样本和1065个GC样本, 平均随访周期分别为69、40、49、33 mo. 本研究中利用KM Plotter数据库分析GPX3在GC患者中的预后, 共6个数据集(GSE14210, GSE15459, GSE22377, GSE29272, GSE51105和GSE62254)纳入此次研究中. 根据GPX3表达中位值将GC患者分为低表达组和高表达组, 通过计算Log-rank P值和HR及95%CI来估算总体生存期.
1.2.3 TCGA数据集验证: 为进一步证实GPX3在GC患者中的表达和预后模式, 我们通过UALCAN网站(http://ualcan.path.uab.edu)对TCGA数据库中GPX3在GC患者中的表达和预后再次进行分析. UALCAN网站包含了TCGA数据库中31种肿瘤的RNA测序数据[11]. 该网站有助于用户寻找一些潜在的肿瘤标志物, 包括诊断标志物、预后标志物和治疗靶点.
1.2.4 组织芯片技术: 90对胃腺癌及癌旁组织标本取自上海芯超生物科技有限公司组织库2009-04/2009-11新鲜手术切除标本, 全部病例术前均未作化疗或放疗. 其中男性62例, 女性28例, 年龄32-89岁, 平均年龄64岁; AJCC第七版临床分期: Ⅰ期10例, Ⅱ期24例, Ⅲ期54例, Ⅳ期2例; 有淋巴结转移69例, 无淋巴结转移21例; 远处转移2例, 无远处转移78例. 随访周期3-75 mo. 所有患者均知情同意, 本研究经医院伦理委员会审核通过. 所有组织标本取出后迅速用10%中性甲醛溶液固定, 常规脱水、石蜡包埋备用.
免疫组化染色剂结果判读, 抗GPX3单克隆抗体购自美国Santa Cruz公司, 二抗由上海芯超生物科技有限公司提供. 组织芯片由上海芯超生物科技有限公司制作. 将组织芯片放入烘箱中, 温度调至63 ℃, 烘蜡一小时, 脱蜡处理后柠檬酸进行抗原修复. 滴加一抗, 室温孵育, 4 ℃冰箱过夜, 经PBS冲洗液冲洗; 滴加二抗即用工作液, 室温孵育, 计时30 min. 经DAB、苏木紫复染后, Aperio软件进行扫描. 免疫组化评分参考表达阳性率和染色强度两个指标: 阳性率≥50%记1分, <50%记0分; 阴性染色记0分, 轻度染色记1分, 中等染色记2, 强染色记3分. 两项乘积即为该例组织的免疫组化评分, 0-1分为低表达组, 2-3分为高表达组. 免疫组化评分参考文献[12]
统计学处理 应用SPSS 21.0统计软件进行数据, 计数资料采用t检验, 计量资料采用χ2检验. GPX3表达与GC预后的关系采用Kaplan-Meier模型分析, 采用Log-rank检验法. 以双侧P<0.05为差异有统计学意义.
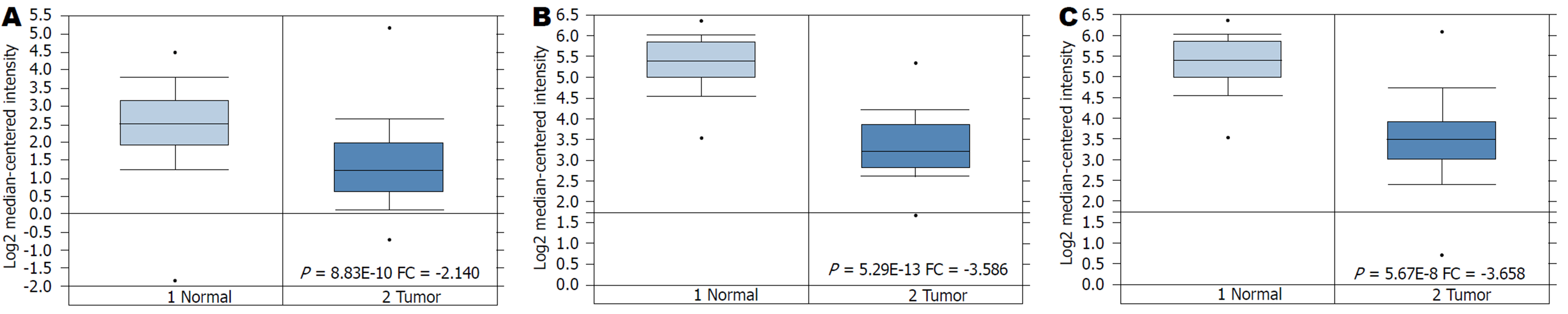
利用Oncomine数据库分析GPX3mRNA的表达, 发现GPX3基因在GC组织中的表达显著低于正常胃黏膜组织(P = 8.83E-10, FC = -2.140)(图1A). 对不同类型GC中GXP3mRNA的表达进行分析, 发现GPX3在弥漫型GC(P = 5.29E-13, FC = -3.586)、肠型GC(P = 5.67E-8, FC = -3.658)的表达均显著低于正常胃黏膜组织(图1B-C).
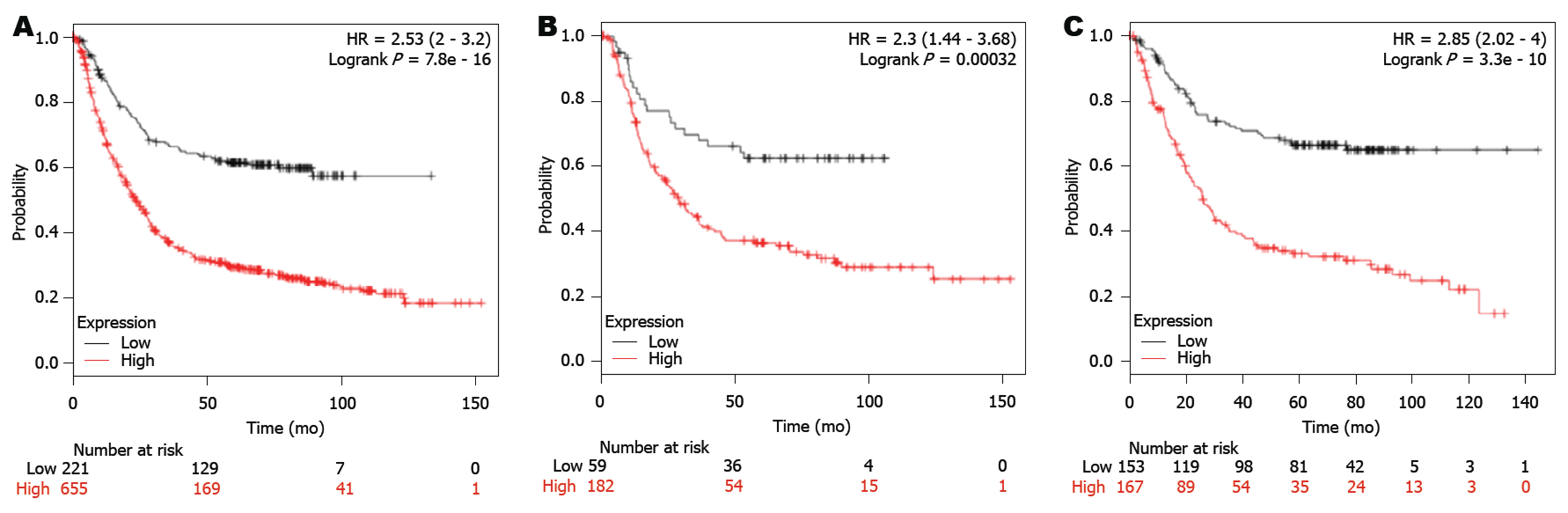
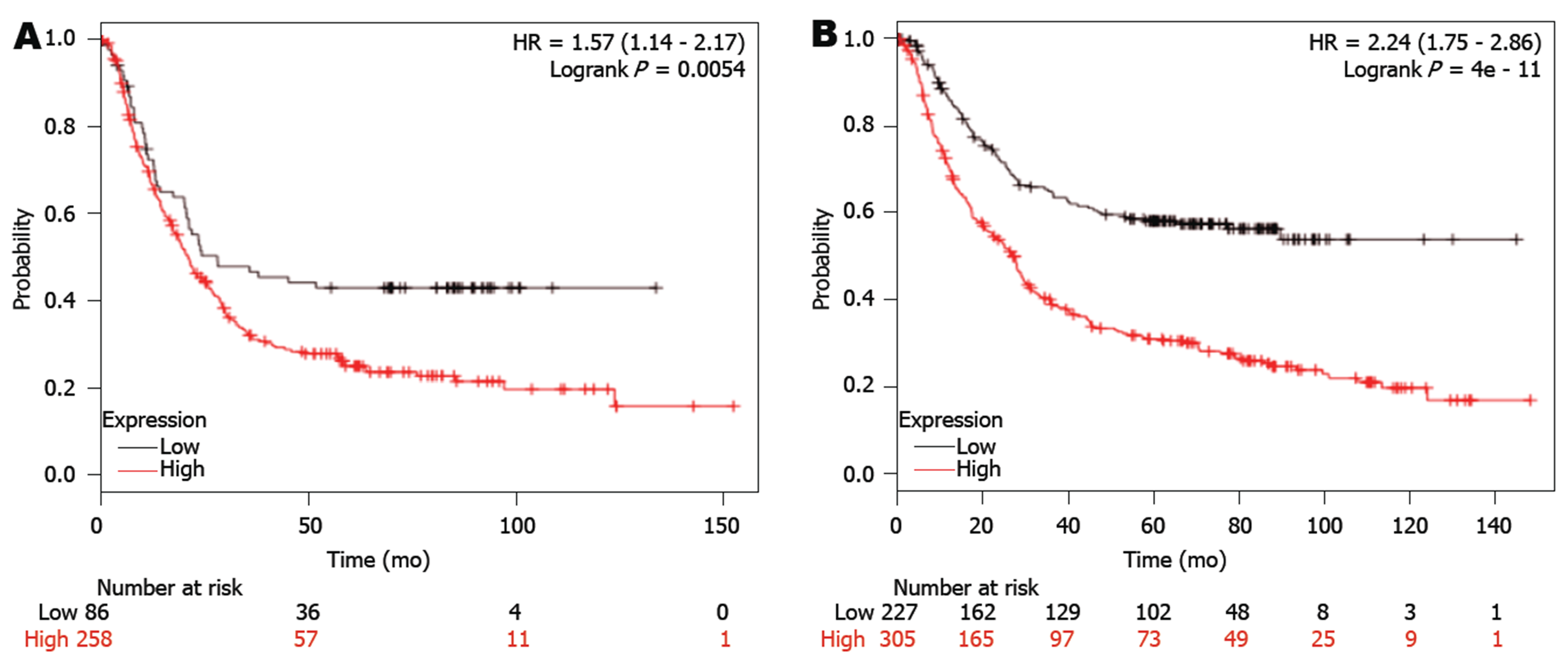
利用KM Plotter数据库分析GPX3的预后价值, 发现GPX3低表达与GC患者的预后呈负相关, GPX3表达越低, GC患者总体生存期越长(HR = 2.53, 95%CI: 2.0-3.2)(图2A). 进一步分析发现, GPX3表达在弥漫型GC患者(HR = 2.30, 95%CI: 1.44-3.68)和肠型GC患者(HR = 2.85, 95%CI: 2.02-4.00)中均有预后价值(图2B-C), GPX3表达越低, 总体生存率越好. 此外, GPX3表达在Her2阴性GC患者(HR = 2.57, 95%CI: 1.14-2.17)和Her2阳性GC患者(HR = 2.24, 95%CI: 1.75-2.86)中均有预后价值, GPX3表达越低, 总体生存率越好(图3).
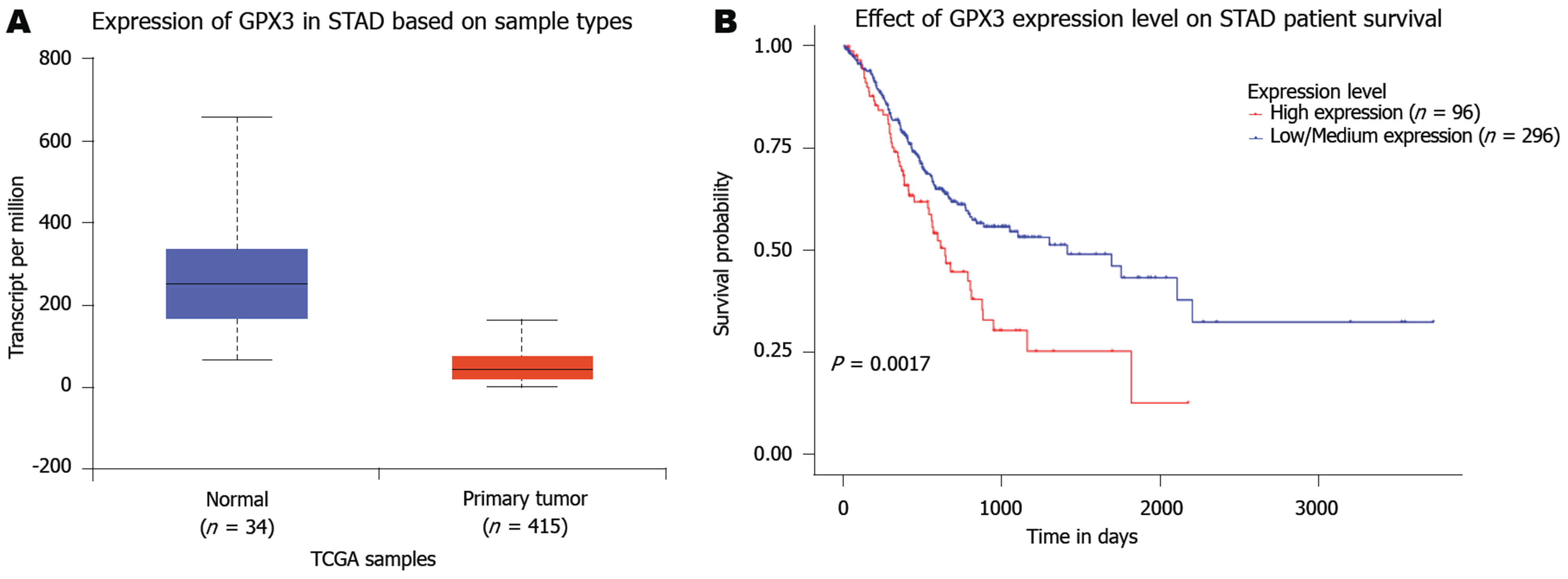
对TCGA数据库中GC患者GPX3的表达和预后模式进行分析发现, GPX3在GC中呈低表达状态, GPX3的低表达提示GC患者总体生存期更长(图4). 上述结果提示GPX3的低表达可能正常胃上皮黏膜转变为GC的重要分子生物学事件, GPX3或可作为GC诊治的新靶点.
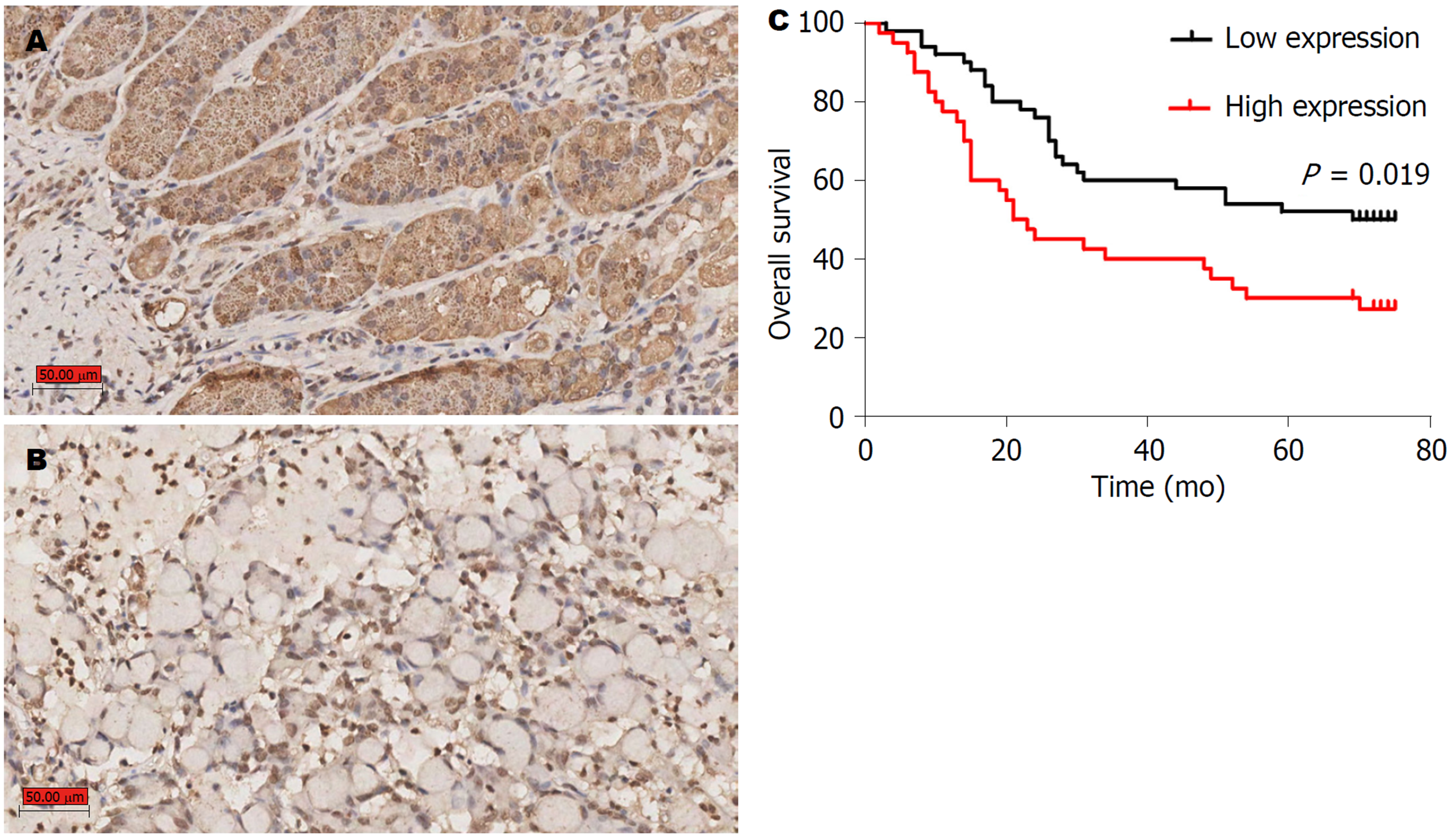
GPX3在GC组织中低表达为55.6%(50/90)、高表达为44.4%(40/90); 癌旁组织中GPX3低表达为40%(36/90)、高表达为60%(54/90); GPX3在GC组织中表达较癌旁组织明显降低, 差异有统计学意义(P = 0.037), 但与患者的年龄、性别、脉管浸润、肿瘤临床分期无关(表1). 生存分析提示GPX3表达与GC患者预后显著相关(HR = 0.48, 95%CI: 0.28-0.85, P = 0.019)(图5).
| GPX3低表达 | GPX3高表达 | χ2值 | P值 | |
| 年龄 | ||||
| ≥60岁 | 33 | 22 | 1.131 | 0.287 |
| <60岁 | 17 | 18 | ||
| 性别 | ||||
| 男 | 36 | 26 | 0.476 | 0.508 |
| 女 | 14 | 14 | ||
| 脉管浸润 | ||||
| 有 | 11 | 13 | 1.253 | 0.263 |
| 无 | 39 | 27 | ||
| T分期 | ||||
| T1+T2 | 11 | 4 | 2.304 | 0.129 |
| T3+T4 | 39 | 36 | ||
| N分期 | ||||
| NO | 14 | 6 | 2.173 | 0.14 |
| N1+N2+N3 | 36 | 34 | ||
| M分期 | ||||
| M0 | 49 | 39 | 0.025 | 0.873 |
| M1 | 1 | 1 | ||
| TNM分期 | ||||
| Ⅰ+Ⅱ | 21 | 13 | 0.853 | 0.396 |
| Ⅲ+Ⅳ | 29 | 27 | ||
GC作为全球最常见的消化道恶性肿瘤之一, 尽管药物治疗在不断改进, 然而GC总体生存期仍不容乐观. 因此寻找GC发生、发展的关键分子或靶点, 有助于GC早期诊断和GC的新靶向治疗方案具有重要的理论和临床意义.
GPX3在人体清除过氧化氢及脂质过氧化物中起重要作用, 是人体维持稳态的重要过氧化物分解酶. 越来越多的证据表明GPX3异常表达是多种恶性肿瘤发生发展的重要因素. 现有研究表明, GPX3异常表达与消化道肿瘤[3]、前列腺癌[13]、卵巢癌[14]、子宫内膜癌[15]、甲状腺癌[16]、乳腺癌[17]、肺癌[18]密切相关, 且GPX3表达异常与前列腺癌[19]、卵巢癌[14]、甲状腺癌[16]、肺癌[18]、膀胱癌[20]、口咽癌[21]、肝癌[22]预后显著相关. 但GPX3的异常表达与GC患者的临床预后关系尚不明确.
本研究为探索GPX3基因作为GC诊治标志物的价值, 利用数据挖掘的方法分析了GPX3在GC患者中的表达模式和预后价值. 我们发现GPX3在GC中呈低表达状态, 且在弥漫型和肠型GC中均呈现出低表达状态. 进一步分析GPX3作为GC预后标志物的价值, 我们发现GPX3对不同亚型GC患者(Luraen亚型、Her2亚型)的预后均有一定的指导意义. 组织芯片技术是近年来较为成熟技术并广泛运用于肿瘤标志物的研究. 我们通过组织芯片技术证实GPX3低表达与GC患者预后显著相关, 但GPX3与GC患者的年龄、性别、肿瘤分期、淋巴结转移、脉管浸润、远处转移等无明显相关性. 鉴于本研究中样本数量偏小, GPX3表达与GC患者的临床病理预后需进一步去证实.
与抑癌基因的预后模式相略有不同, 本研究提示GPX3表达越低, 预后越好. 关于GPX3参与GC进展的机制尚有待于进一步去挖掘. 部分研究还提示GPX3可通过诱导氧化应激是使癌细胞细胞周期停滞在G2/M期[23]. 另有证据提示GPX3可通过FAK/AKT信号通路调控癌细胞的侵袭迁移[24], 并影响顺铂类药物的化疗疗效[25]. 上述结果表明GPX3的表达变化可能正常胃上皮黏膜转变为GC的重要分子生物学事件, GPX3或可作为GC诊治的新靶点.
综上所述, GC组织中GPX3低表达与GC患者的预后显著相关. 结合目前已有的研究结果. 我们推测GPX3在GC的发生发展中发挥了重要作用, 有望成为GC诊治的新靶点. 关于GPX3在GC疾病发展中的具体作用机制, 尚需要更多的实验来探索证明.
目前关于谷胱甘肽过氧化物酶3(glutathione peroxidase 3, GPX3)在胃癌(gastric cancer, gc)中的研究主要集中于GPX3基因甲基化状态, GPX3在GC中程高度甲基化导致GPX3表达下降, 但GPX3表达与GC患者预后的联系尚不明确.
明确GPX3在GC中的表达及预后模式, 寻找GC早诊早治的新靶点.
本研究旨在分析GPX3在GC中的表达与GC患者预后的联系, 为GC患者的诊断、预后治疗策略提供政证据.
本研究中运用大量芯片数据从GPX3的表达、预后两方面同时进行科学分析, 并通过组织芯片技术对芯片数据进行验证.
GPX3在GC组织中表达较癌旁组织明显降低, 但与患者的年龄、性别、脉管浸润、肿瘤临床分期无关, 生存分析提示GPX3表达与GC患者预后显著相关.
我们分析了GPX3在GC中的表达及预后模式, GC组织中GPX3低表达与GC患者的预后显著相关. GPX3的表达变化可能正常胃上皮黏膜转变为GC的重要分子生物学事件, GPX3或可作为GC诊治的新靶点.
GPX3在GC的发生发展中发挥了重要作用, 有望成为GC诊治的新靶点. 关于GPX3在GC疾病发展中的具体作用机制, 尚需要更多的实验来探索证明.
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
编辑: 马亚娟 电编:刘继红
| 1. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 2. | Ferlay J, Colombet M, Soerjomataram I, Mathers C, Parkin DM, Piñeros M, Znaor A, Bray F. Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and methods. Int J Cancer. 2019;144:1941-1953. [PubMed] [DOI] |
| 3. | 沈 磊, 贺 远龙, 张 巍巍, 耿 长新. GPX3表达与消化系肿瘤关系的研究进展. 临床与实验病理学杂志. 2014;30:670-672. [DOI] |
| 4. | 范 红云, 李 超, 褚 茜茜, 段 志英, 韩 双双, 于 卫芳. 谷胱甘肽过氧化物酶3甲基化及蛋白表达在胃癌中的临床意义. 中国老年医学杂志. 2016;36:5634-5636. [DOI] |
| 5. | Rudy J, Valafar F. Empirical comparison of cross-platform normalization methods for gene expression data. BMC Bioinformatics. 2011;12:467. [PubMed] [DOI] |
| 6. | Grace JO, Malik A, Reichman H, Munitz A, Barski A, Fulkerson PC. Reuse of public, genome-wide, murine eosinophil expression data for hypotheses development. J Leukoc Biol. 2018;104:185-193. [PubMed] [DOI] |
| 7. | Nitsche BM, Ram AF, Meyer V. The use of open source bioinformatics tools to dissect transcriptomic data. Methods Mol Biol. 2012;835:311-331. [PubMed] [DOI] |
| 8. | Pepe MS, Feng Z. Improving biomarker identification with better designs and reporting. Clin Chem. 2011;57:1093-1095. [PubMed] [DOI] |
| 9. | Rhodes DR, Kalyana-Sundaram S, Mahavisno V, Varambally R, Yu J, Briggs BB, Barrette TR, Anstet MJ, Kincead-Beal C, Kulkarni P, Varambally S, Ghosh D, Chinnaiyan AM. Oncomine 3.0: genes, pathways, and networks in a collection of 18,000 cancer gene expression profiles. Neoplasia. 2007;9:166-180. [PubMed] [DOI] |
| 10. | Szász AM, Lánczky A, Nagy Á, Förster S, Hark K, Green JE, Boussioutas A, Busuttil R, Szabó A, Győrffy B. Cross-validation of survival associated biomarkers in gastric cancer using transcriptomic data of 1,065 patients. Oncotarget. 2016;7:49322-49333. [PubMed] [DOI] |
| 11. | Chandrashekar DS, Bashel B, Balasubramanya SAH, Creighton CJ, Ponce-Rodriguez I, Chakravarthi BVSK, Varambally S. UALCAN: A Portal for Facilitating Tumor Subgroup Gene Expression and Survival Analyses. Neoplasia. 2017;19:649-658. [PubMed] [DOI] |
| 12. | Hu D, Ansari D, Zhou Q, Sasor A, Said Hilmersson K, Andersson R. Low P4HA2 and high PRTN3 expression predicts poor survival in patients with pancreatic cancer. Scand J Gastroenterol. 2019;54:246-251. [PubMed] [DOI] |
| 13. | Yu YP, Yu G, Tseng G, Cieply K, Nelson J, Defrances M, Zarnegar R, Michalopoulos G, Luo JH. Glutathione peroxidase 3, deleted or methylated in prostate cancer, suppresses prostate cancer growth and metastasis. Cancer Res. 2007;67:8043-8050. [PubMed] [DOI] |
| 14. | Worley BL, Kim YS, Mardini J, Zaman R, Leon KE, Vallur PG, Nduwumwami A, Warrick JI, Timmins PF, Kesterson JP, Phaëton R, Lee NY, Walter V, Endres L, Mythreye K, Aird KM, Hempel N. GPx3 supports ovarian cancer progression by manipulating the extracellular redox environment. Redox Biol. 2018;. [PubMed] [DOI] |
| 15. | Falck E, Karlsson S, Carlsson J, Helenius G, Karlsson M, Klinga-Levan K. Loss of glutathione peroxidase 3 expression is correlated with epigenetic mechanisms in endometrial adenocarcinoma. Cancer Cell Int. 2010;10:46. [PubMed] [DOI] |
| 16. | Zhao H, Li J, Li X, Han C, Zhang Y, Zheng L, Guo M. Silencing GPX3 Expression Promotes Tumor Metastasis in Human Thyroid Cancer. Curr Protein Pept Sci. 2015;16:316-321. [PubMed] |
| 17. | Mohamed MM, Sabet S, Peng DF, Nouh MA, El-Shinawi M, El-Rifai W. Promoter hypermethylation and suppression of glutathione peroxidase 3 are associated with inflammatory breast carcinogenesis. Oxid Med Cell Longev. 2014;2014:787195. [PubMed] [DOI] |
| 18. | Liu K, Jin M, Xiao L, Liu H, Wei S. Distinct prognostic values of mRNA expression of glutathione peroxidases in non-small cell lung cancer. Cancer Manag Res. 2018;10:2997-3005. [PubMed] [DOI] |
| 19. | Gerstenberger JP, Bauer SR, Van Blarigan EL, Sosa E, Song X, Witte JS, Carroll PR, Chan JM. Selenoprotein and antioxidant genes and the risk of high-grade prostate cancer and prostate cancer recurrence. Prostate. 2015;75:60-69. [PubMed] [DOI] |
| 20. | Yang ZL, Yang L, Zou Q, Yuan Y, Li J, Liang L, Zeng G, Chen S. Positive ALDH1A3 and negative GPX3 expressions are biomarkers for poor prognosis of gallbladder cancer. Dis Markers. 2013;35:163-172. [PubMed] [DOI] |
| 21. | Zhang X, Zheng Z, Yingji S, Kim H, Jin R, Renshu L, Lee DY, Roh MR, Yang S. Downregulation of glutathione peroxidase 3 is associated with lymph node metastasis and prognosis in cervical cancer. Oncol Rep. 2014;31:2587-2592. [PubMed] [DOI] |
| 22. | Qi X, Ng KT, Lian QZ, Liu XB, Li CX, Geng W, Ling CC, Ma YY, Yeung WH, Tu WW, Fan ST, Lo CM, Man K. Clinical significance and therapeutic value of glutathione peroxidase 3 (GPx3) in hepatocellular carcinoma. Oncotarget. 2014;5:11103-11120. [PubMed] [DOI] |