修回日期: 2019-08-12
接受日期: 2019-09-08
在线出版日期: 2019-09-28
经导管肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)是通过微导管选择性插入至肿瘤主要供血动脉后, 栓塞动脉及注入化疗药物使肿瘤发生缺血坏死, 从而发挥灭活肿瘤作用. 有效的TACE治疗势必引起肿瘤微循环血流灌注状态改变, 而超声造影能准确反映肿瘤组织的血流灌注过程, 从而实现对TACE疗效的准确评估.
探讨运用增强CT(contrast-enhanced CT, CECT)、超声造影(contrast-enhanced ultrasound, CEUS)判定TACE后原发性肝细胞癌(hepatocellular carcinoma, HCC)残留状态的临床应用价值.
选取2016-09/2019-03期间, 在浙江省肿瘤医院行TACE术治疗的71例患者作为研究对象, 共125个病灶. 所有患者TACE术后1 mo均行CEUS、CECT检查, 以同期数字减影血管造影(digital subtraction angiography, DSA)检查结果作为"金标准", 比较CEUS与CECT在评估TACE 疗效中的应用价值.
DSA发现病灶残留97个, 无残留28个; CEUS判定病灶残留的准确度、灵敏度、特异度分别为96.00%、96.91%、92.86%; CECT判定病灶残留的准确度、灵敏度、特异度分别88.00%、87.63%、89.29%; CEUS判定病灶残留的准确度、灵敏度均高于CECT, 差异有统计学意义(P<0.05).
CEUS能显示TACE术后HCC病灶组织的血流灌注状态, 在判定病灶残留方面优于CECT, 可为临床评估TACE术后疗效提供新的有效手段.
核心提要: 临床常采用影像学方法评估经导管肝动脉化疗栓塞术对肝癌的治疗效果, 而超声造影能实时反映病灶的微循环血流灌注全过程, 对病灶是否存在残留具有较高的甄别能力.
引文著录: 黄浩峰, 庞强. 经导管肝动脉化疗栓塞术后原发性肝细胞癌残留状态的增强CT与超声造影比较. 世界华人消化杂志 2019; 27(18): 1161-1166
Revised: August 12, 2019
Accepted: September 8, 2019
Published online: September 28, 2019
Transcatheter arterial chemoembolization (TACE) can inactivate tumors by embolizing the main blood supply arteries of tumors through selectively inserting microcatheters into the arteries and injecting chemotherapy drugs. Effective TACE treatment will inevitably lead to changes of the microcirculation perfusion state of tumors. Contrast-enhanced ultrasound can accurately reflect the perfusion process of tumors to accurately evaluate the efficacy of TACE.
To evaluate the clinical value of contrast-enhanced CT (CECT) and contrast-enhanced ultrasound (CEUS) in determining the residual status of hepatocellular carcinoma (HCC) after TACE.
Seventy-one HCC patients with a total of 125 lesions who underwent TACE were selected as study subjects during September 2016 and March 2019. One month after TACE, all patients were examined by CEUS and CECT. The results of digital subtraction angiography (DSA) were used as the ¡°gold standard¡± to compare the value of CEUS and CECT in evaluating the efficacy of TACE.
DSA found 97 residual lesions and 28 non-residual lesions. The accuracy, sensitivity, and specificity of CEUS in determining residual lesions were 96.00%, 96.91%, and 92.86%, respectively, and the corresponding values for CECT were 88.00%, 87.63%, and 89.29%. The sensitivity and accuracy of CEUS in determining residual lesions were higher than those of CECT (P < 0.05).
CEUS can show the blood perfusion status of HCC after TACE, and is superior to CECT in determining residual lesions, thus providing a new and effective method for clinical evaluation of the efficacy of TACE.
- Citation: Huang HF, Pang Q. Comparison of contrast-enhanced CT and contrast-enhanced ultrasound for assessing residual status of primary hepatocellular carcinoma after transcatheter arterial chemoembolization. Shijie Huaren Xiaohua Zazhi 2019; 27(18): 1161-1166
- URL: https://www.wjgnet.com/1009-3079/full/v27/i18/1161.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i18.1161
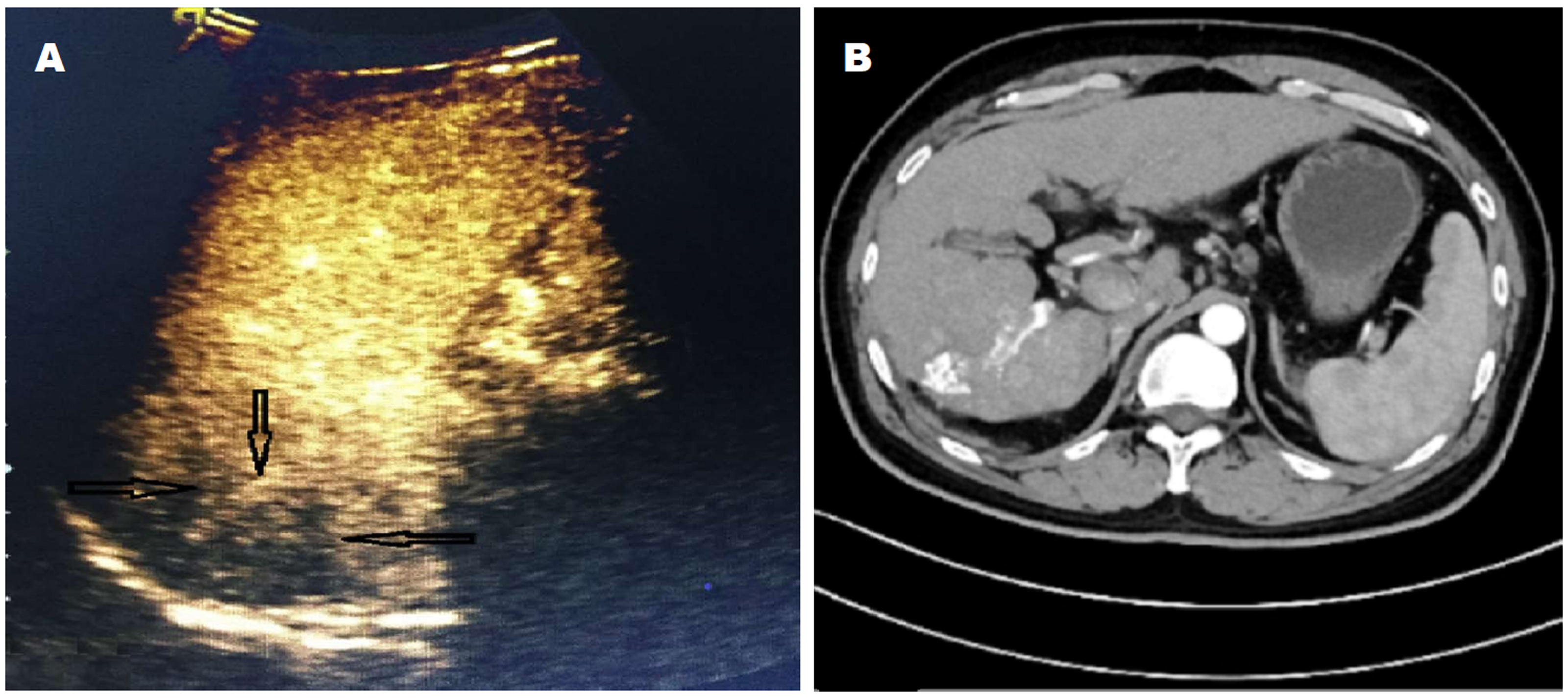
原发性肝细胞癌(hepatocellular carcinoma, HCC)是发生于肝细胞的肝脏恶性肿瘤, 在我国有着较高发病率及病死率, 其恶性程度高、进展速度快、起病隐匿, 导致大部分患者被确诊时已经处于中晚期, 错过手术切除治疗最佳时机, 而只能行非手术治疗[1]. 目前, 经导管肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)是临床非手术治疗HCC的重要方法之一[2]. 准确评估TACE术后病灶是否残留, 对病情判断, 指导临床制定下一步治疗方案具有重要意义. 本研究运用超声造影(contrast-enhanced ultrasound, CEUS)判定TACE术后HCC病灶残留状态, 并与增强CT(contrast-enhanced CT, CECT)进行比较, 探讨其临床应用价值(图1).
选取2016-09/2019-03期间, 在浙江省肿瘤医院行TACE治疗的71例HCC患者作为研究对象, 其中男53例, 女18例, 年龄32-74岁, 平均51.00岁±8.25 岁. 共125个病灶(20例3个病灶; 14例2个病灶; 37例单个病灶), 最大直径3.5-10.1 cm, 平均6.35 cm±1.43 cm. 纳入标准: (1)均为HCC; (2)Child-Pugh分级为A-B级; (3)患者能配合检查. 排除标准: (1)伴有其它恶性肿瘤; (2)严重感染; (3)肝肾功能衰竭; (4)凝血功能障碍. 本研究经本院医学伦理委员会同意, 患者均知情同意并签署知情同意书.
TACE术(化疗药物采用5-10 mL 40%超液化碘油、50-100 mg奥沙利铂、1.0-1.5 g氟尿嘧啶、20-40 mg多柔比星)后1 mo行CEUS、CECT以及DSA检查, 时间间隔不超过7 d.
CEUS检查: 采用西门子s2000超声诊断仪, 探头频率3-5 mHz. 首先行常规超声检查, 观察病灶位置、大小、回声、边界、血流等情况. 然后固定探头于某一体表位置, 可通过侧动探头观察目标病灶整体血流灌注状态. 启动CEUS模式. 采用声诺维(磷脂微囊六氯化硫)作为造影剂, 经肘部浅静脉团注2.4 mL造影剂, 并同步计时, 储存影像资料作后续分析. 观察造影各时相的病灶血流灌注情况: 动脉相(0-30 s)、门脉相(31-120 s)与延迟相(121- 300 s). 由一名高年资且经验丰富的超声科医生进行评估.
CECT扫描: 采用GE Discovery750HD CT机进行CECT检查. 嘱患者禁食8 h, 检查前15 min口服温开水1-1.5 L. 嘱患者取仰卧位, 上举双臂, 首先行常规扫描, 然后采用370 mg/mL的碘帕醇作为造影剂, 经肘静脉以3.0 mL/s流速注射后, 行增强扫描, 管电压: 120 kV, 管电流: 300 mA, 矩阵: 242×242, 螺距: 1.0, 层距: 5 mm, 层厚: 5 mm. 注射后20 s, 动脉期扫描; 注射后1 min, 门脉期扫描; 注射后5 min, 延迟期扫描. 由一名高年资且经验丰富的放射科医生进行评估.
CEUS评估标准: 病灶于动脉相或门脉相存在造影剂填充, 延迟相造影剂消退, 呈低或等增强, 即病灶残留, 判断为阳性; 病灶于造影全程均无造影剂填充, 边界清晰, 表现为"黑洞征", 即病灶无残留, 判断为阴性.
CECT评估标准: 病灶区域碘油沉积稀少或斑片状沉积, 于动脉期病灶存在可辨强化区, 即病灶残留, 判断为阳性; 病灶区域碘油沉积均匀分布, 于动脉期病灶无强化, 即病灶无残留, 判断为阴性.
以DSA检查结果作为判定"金标准", 计算各检查方法的灵敏度 = 真阳性人数/(真阳性人数+假阴性人数)×100%, 特异度 = 真阴性人数/(真阴性人数+假阳性人数)×100%, 准确度 = (真阳性例数+真阴性例数)/(真阳性例数+假阴性例数+假阳性例数+真阴性例数)×100%.
统计学处理 采用SPSS 20.0统计学软件进行数据处理. 计数资料以(%)表示, 组间比较行χ2检验. P<0.05为差异有统计学意义.
71例HCC患者, 共125个病灶, TACE术后1 mo DSA检查发现HCC残留病灶97个, 无残留病灶28个.
TACE术后1 mo CECT判定88个病灶残留, 表现为病灶区域碘油沉积稀少或呈斑片状分布, 动脉期局部存在强化区; CECT判定37个病灶无残留, 彻底灭活, 表现为病灶内碘油沉积均匀分布, 动脉期无强化区. 以DSA结果作为"金标准", CECT判定病灶残留的准确度、灵敏度、特异度分别88.00%、87.63%、89.29%(表1).
| CECT | DSA | 总计 | |
| 残留 | 无残留 | ||
| 残留 | 85 | 3 | 88 |
| 无残留 | 12 | 25 | 37 |
| 总计 | 97 | 28 | 125 |
TACE术后1 mo CEUS判定96个病灶残留, 表现为病灶局部或边缘呈不同程度增强, 其中63个病灶表现为动脉相呈高增强, 门脉相和(或)延迟相呈低增强; 21个病灶表现为动脉相呈等增强, 门脉相和(或)延迟相呈低增强; 12个病灶表现为动脉相呈等增强, 门脉相和(或)延迟相呈等增强; CEUS判定29个病灶无残留, 病灶被彻底灭活, 均表现为三期无造影剂填充, 病灶边界清晰, 呈"黑洞征". 以DSA结果作为"金标准", CEUS判定病灶残留的准确度、灵敏度、特异度分别为96.00%、96.91%、92.86%(表2).
| CEUS | DSA | 总计 | |
| 残留 | 无残留 | ||
| 残留 | 94 | 2 | 96 |
| 无残留 | 3 | 26 | 29 |
| 总计 | 97 | 28 | 125 |
CEUS判定HCC病灶残留的准确度(χ2 = 5.435, P = 0.02)及灵敏度(χ2 = 5.853, P = 0.016)均高于CECT, 差异有统计学意义(P<0.05); CEUS判定HCC病灶残留的特异度与CECT比较差异无统计学意义(χ2 = 0.220, P = 0.639).
HCC在我国有着较高发病率, 手术切除病灶是治疗HCC的最佳治疗手段, 但由于HCC发病隐匿, 大多数患者被确诊时已为中晚期而错过手术切除治疗最佳时机, 不得不选择非手术治疗[3]. TACE是HCC非手术治疗的常用治疗手段, 其原理是将微导管经股动脉选择性插入到病灶供血动脉, 然后注入碘化油及化疗药物, 导致肿瘤细胞发生缺血坏死, 从而发挥控制肿瘤生长, 杀灭肿瘤作用[4]. 由于HCC属于富血供肿瘤, 同时接受肝动脉及门静脉双重血供, 当供血动脉被栓塞后, 可通过建立侧支循环使病灶组织坏死不彻底, 发生残留[5]. 因此, 准确评估TACE术后病灶残留状态, 有助于临床制定下一步治疗措施.
TACE术后HCC病灶残留状态评估的主要手段包括甲胎蛋白定量、超声、CT、MRI以及 DSA等, 而DSA是目前公认的评估TACE疗效"金标准"[6], 可通过消除病灶碘油沉积影响而清晰显示病灶异常血供, 从而准确评估TACE术后病灶残留与否, 具有较高的诊断准确性[7]. 但DSA具有创伤性, 其临床应用受到一定限制.
CECT检查是临床评估TACE术后病灶残留的常用方法, 因其后处理技术强大, 扫描速度快, 能清晰显示肿瘤位置、大小、内部碘油沉积、强化区域分布等情况, 有助于临床评估TACE术后病灶残留, 若发现病灶存在强化区域, 即提示病灶残留[8]. 本研究中, CECT判定病灶残留的准确度、灵敏度、特异度分别88.00%、87.63%、89.29%, 证实了CECT有助于临床判定TACE术后病灶残留, 可用于评估TACE术后疗效. 虽然CECT在显示碘油沉积分布方面具有一定优势, 但是良好的碘油沉积不能完全代表病灶组织被彻底灭活坏死, 因为高密度的碘油沉积影响下, 可在一定程度上遮挡了肿瘤血管的真实分布状态, 同时治疗后病灶局部及周围发生炎症细胞浸润、纤维组织增生及肉芽组织增生, 均可影响CECT对病灶组织是否存活的判定[3].
超声造影剂是一种理想的血池显像剂, 造影剂微泡直径远小于病灶组织内微循环血管内径, 可清晰显示造影剂微泡对病灶组织的灌注及退出全程, 从而动态反映病灶组织在各时相的微循环血流灌注特征及血流动力学变化, 有助于临床根据病灶内是否存在血流灌注充填而判断其残留状态[9]. 本研究结果显示, CEUS判定病灶残留的准确度、灵敏度、特异度分别为96.00%、96.91%、92.86%, 提示CEUS能有效评估TACE术后HCC病灶残留状态, 其在TACE术后疗效评估中具有较高应用价值, 有助于指导临床进一步制定治疗方案. 本研究结果显示, CEUS判定HCC病灶残留的准确度及灵敏度均高于CECT(P<0.05), 提示在评估TACE术后病灶是否残留方面CEUS可能更优于CECT, 更有助于监测TACE疗效. 原因可能是: (1)CEUS以超声微泡作为血管示踪剂, 可清晰显示病灶微小血管分布及微循环灌注特征, 更有助于微小病变的准确判断[10]; (2)HCC病灶血供丰富, 含有大量异常新生微小血管, 其在CEUS下呈现出特有的"快进快出"增强模式, 有助于临床直观评估病灶性质[11]; (3)CEUS为即时性检查手段, 超声医师能实时动态观察病灶组织造影全过程, 而CECT即不能实时动态观察. 但需要注意的是, 本研究有2例病灶呈假阳性, 分析原因可能是病灶周围发生炎性充血带所致, 而3例病灶呈假阴性, 分析原因可能是病灶位置靠近膈顶或胃肠道, 受气体干扰所致[12]. 因此, 必要时CEUS应结合其它检查以进一步减少漏诊或误诊.
总之, CEUS能显示TACE术后HCC病灶组织的血流灌注状态, 在判定病灶残留方面优于CECT, 可为临床评估TACE术后疗效提供新的有效手段.
经导管肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)后病灶血流灌注发生改变, 而利用超声造影(contrast-enhanced ultrasound, CEUS)能实时反映微循环血供的特点, 可准确评估TACE治疗效果, 有着重要临床意义.
运用CEUS能无创性评估TACE疗效, 可为临床评估TACE疗效提供一种全新影像学方法, 有助于指导临床治疗.
本论文主要目标为采用CEUS评估TACE治疗后的原发性肝细胞癌(hepatocellular carcinoma, HCC)残留情况, 结果证实CEUS能有效反映TACE疗效, 可为临床评估TACE疗效提供有效手段.
本研究以CEUS评估TACE疗效. CEUS是一种十分灵敏的血流检测技术, 能实时显示肿瘤的微循环血流灌注过程.
本研究达到了实验目标, 研究结果提示CEUS能有效甄别TACE后HCC残留状态, 具有较高临床应用价值. 运用CEUS能有效评估TACE疗效, 为TACE疗效评估提供一种可靠的无创性方法.
在CEUS下TACE后HCC残留组织呈不同程度增强. TACE疗效可通过CEUS进行有效评估, 为临床评估TACE疗效提供血流动力学信息. CEUS能有效反映肿瘤的血流灌注状态, 能有效监测和无创性评估TACE疗效, 能准确有效地评估TACE后HCC残留状态, 其诊断能力在一定程度上优于增强CT. CEUS为临床准确评估TACE疗效提供了一种可靠的新方法.
肿瘤位置、患者呼吸配合程度、体型等因素可影响CEUS评估TACE疗效的准确性. 未来研究的方向是运用CEUS评估TACE后HCC的血流灌注参数变化. 未来研究的最佳方法是三维超声造影评估TACE后HCC残留情况.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 1. | Xu L, Zhang M, Zheng X, Yi P, Lan C, Xu M. The circular RNA ciRS-7 (Cdr1as) acts as a risk factor of hepatic microvascular invasion in hepatocellular carcinoma. J Cancer Res Clin Oncol. 2017;143:17-27. [PubMed] [DOI] |
| 2. | Nörthen A, Asendorf T, Shin HO, Hinrichs JB, Werncke T, Vogel A, Kirstein MM, Wacker FK, Rodt T. Parametric response mapping cut-off values that predict survival of hepatocellular carcinoma patients after TACE. Abdom Radiol (NY). 2018;43:3288-3300. [PubMed] [DOI] |
| 3. | Najmi Varzaneh F, Pandey A, Aliyari Ghasabeh M, Shao N, Khoshpouri P, Pandey P, Zarghampour M, Fouladi D, Liddell R, Anders RA, Kamel IR. Prediction of post-TACE necrosis of hepatocellular carcinoma usingvolumetric enhancement on MRI and volumetric oil deposition on CT, with pathological correlation. Eur Radiol. 2018;28:3032-3040. [PubMed] [DOI] |
| 4. | Zhao M, Xiang P, Jiang H. TransArterial ChemoEmbolization (TACE) with platinum versus anthracyclines for hepatocellular carcinoma: A meta-analysis. Int J Surg. 2018;53:151-158. [PubMed] [DOI] |
| 5. | Chintalapati SP, Patel A, Conjeevaram H. Gastric and duodenal ischaemia after transarterial chemoembolisation for hepatocellular carcinoma: an unexpected but significant complication. BMJ Case Rep. 2018;2018. [PubMed] [DOI] |
| 6. | 朱 风叶, 李 红, 乔 继红, 王 全华. CT与MRI在诊断原发性肝癌介入术后病灶残留及复发中的应用价值. 中国CT和MRI杂志. 2018;16:76-78. [DOI] |
| 9. | Lekht I, Nayyar M, Luu B, Guichet PL, Ho J, Ter-Oganesyan R, Katz M, Gulati M. Intra-arterial contrast-enhanced ultrasound (IA CEUS) for localization of hepatocellular carcinoma (HCC) supply during transarterial chemoembolization (TACE): a case series. Abdom Radiol (NY). 2017;42:1400-1407. [PubMed] [DOI] |
| 10. | Moudgil S, Kalra N, Prabhakar N, Dhiman RK, Behera A, Chawla YK, Khandelwal N. Comparison of Contrast Enhanced Ultrasound With Contrast Enhanced Computed Tomography for the Diagnosis of Hepatocellular Carcinoma. J Clin Exp Hepatol. 2017;7:222-229. [PubMed] [DOI] |
| 11. | Schellhaas B, Görtz RS, Pfeifer L, Kielisch C, Neurath MF, Strobel D. Diagnostic accuracy of contrast-enhanced ultrasound for the differential diagnosis of hepatocellular carcinoma: ESCULAP versus CEUS-LI-RADS. Eur J Gastroenterol Hepatol. 2017;29:1036-1044. [PubMed] [DOI] |
| 12. | Fetzer DT, Rafailidis V, Peterson C, Grant EG, Sidhu P, Barr RG. Artifacts in contrast-enhanced ultrasound: a pictorial essay. Abdom Radiol (NY). 2018;43:977-997. [PubMed] [DOI] |