修回日期: 2019-08-27
接受日期: 2019-09-02
在线出版日期: 2019-09-08
消化性溃疡(peptic ulcer, PU)和高血压病(hypertension, HTN)是两种常见病, 临床上两者常有合并. 本文介绍PU合并HTN患者的诊疗现状, 并阐述了其非特异性免疫中黏膜免疫功能变化和特异性免疫中细胞免疫功能变化研究进展, 以期为临床诊治提供一定参考.
核心提要: 消化性溃疡和高血压病在临床上常合并存在, 本文介绍了此类患者目前诊疗现状, 包括好发人群、无痛胃镜的运用、治疗药物选择等, 以及其黏膜免疫和体液免疫功能改变情况, 以期为临床诊治提供一定参考.
引文著录: 徐思楠, 陈鑫, 孙倚天, 李国熊. 消化性溃疡合并高血压诊疗现状及其免疫功能研究进展. 世界华人消化杂志 2019; 27(17): 1095-1099
Revised: August 27, 2019
Accepted: September 2, 2019
Published online: September 8, 2019
Peptic ulcer (PU) and hypertension, known as two clinically common diseases, often develop simultaneously. This paper introduces the status quo of the diagnosis and treatment of hypertensive patients with PU, and also expounds the progress in the understanding of the changes in the mucosal immune function and cellular immune function, with an aim to shed some light on the clinical diagnosis and treatment of PU with hypertension.
- Citation: Xu SN, Chen X, Sun YT, Li GX. Peptic ulcer complicated with hypertension: Diagnosis, treatment, and changes in immunologic function. Shijie Huaren Xiaohua Zazhi 2019; 27(17): 1095-1099
- URL: https://www.wjgnet.com/1009-3079/full/v27/i17/1095.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i17.1095
消化性溃疡(peptic ulcer, PU)和高血压病(hypertension, HTN)均是常见病, 且临床上两者常有合并. 幽门螺杆菌(Helicobacter pylori, H. pylori)感染是PU的首要致病因素, 与人体调节T细胞(regulatory T cell, Treg)引起的免疫调控和H. pylori自身产生的细胞毒素相关蛋白A(cytotoxin-associated protein A, CagA)及空泡细胞毒素A(vacuolating cytotoxin gene A, VacA)引起的炎症反应密切相关. HTN是一种以动脉血压持续升高为特征的"心血管综合征", 该病可能因机体细胞及体液免疫功能改变, 致一系列炎症反应形成.
临床上PU合并HTN患者不在少数, 尤以老年人群中多见. Mitsutake等[1]对2013-09/2014-08居住于日本东京的1311116名75岁以上老年人罹患多种慢性病情况的研究结果显示, 65.0%的老年人同时患有3种或者以上慢性疾病, 其中12.4%男性同时患者HTN、PU、心脏病, 12.8%女性同时患有HTN、PU、血脂异常, HTN及PU合并存在时患者临床治疗难度及诊治费用较高. 国内亦有报道[2]表明在年龄大于55岁的PU患者中, 约98.3%的人同时患有一种及以上心脑血管疾病, 如高血压、心脏病、脑卒中等. 老年HTN患者, 更易合并溃疡, 且一旦并发上消化道出血, 病情凶险, 不易止血. 马素云等[3]将112例HTN患者作为研究组, 对照组为170例非HTN患者, 比较两组PU检出率, 发现在H. pylori感染无明显统计学差异下, 研究组PU检出率为16.1%, 明显高于对照组4.7%(P<0.01, χ2 = 9.30), 尤其是胃溃疡检出率达10.7%, 对照组仅3.5%, 其原因可能是长期高血压致心功能不全, 使肝淤血加重, 门脉压力升高, 消化道黏膜进而缺血缺氧, 削弱黏膜保护能力; 且大部分HTN患者长期服用钙通道阻滞剂, 以致胆汁和胃酸返流及胃排空延迟, 促使溃疡形成.
有研究[4,5]发现在PU和HTN患者中往往出现人体免疫功能异常, PU患者外周血中IgG水平较正常人高, CD3、CD4、CD4/CD8、CD19、CD56、C3、C4水平较正常人低, 且当合并有上消化道出血时这种差异更加明显, 这表明机体免疫功能紊乱致消化道黏膜更易受损, 并且在出血时免疫抑制更加严重, 而进一步合并HTN后, 由于细胞免疫功能紊乱加剧, 使患者胃黏膜血管内炎症加重, 致局部血管内皮细胞损伤, 血栓形成, 可引起微循环障碍, 若在治疗PU同时合理控制血压, 将有助于溃疡愈合.
近年来, 无痛胃镜检查因其诸多优点, 在PU合并HTN患者中运用越来越多见. 2016年李艳等[6]将80例75岁以上HTN患者随机分为无痛胃镜组和常规胃镜组, 比较两组患者PU检出率、检查过程中不良反应(恶心呕吐、躁动、咳嗽等)、术前及术中血压情况, 结果显示无痛胃镜组溃疡检出率95.0%, 明显高于常规胃镜组52.5%, 且不良反应较常规胃镜组少, 值得注意的是无痛胃镜组患者检查过程中血压较检查前有所下降, 而常规胃镜则较检查前上升, 提示无痛胃镜应用在HTN合并PU患者中更安全. 其他研究[7]也认为高龄患者往往存在多种心脑血管疾病的潜在风险, 胃镜作为侵入性检查, 对消化道存在明显的刺激, 常规胃镜检查可引起患者精神紧张、不安、恐惧等负面心理, 导致血压升高, 而无痛胃镜则利用较低剂量的丙泊酚全身麻醉, 使患者处于浅睡眠状态, 有效降低呼吸道周围平滑肌和神经对胃镜软管的应激反应, 使心率及血压稳定, 利于检查.
治疗方面, 除了针对PU的规范化治疗外, 合理选用降压药物很关键. 柏铁君[8]将70例PU合并HTN患者随机对等分为两组, 均以奥美拉唑肠溶胶囊治疗PU, 比较硝苯地平(对照组)与氯压定(观察组)的疗效, 发现观察组不仅HTN改善优于对照组(P<0.05), 且溃疡疗效优于对照组(P = 0.023, χ2 = 5.185), 两种疾病治疗总有效率达88.57%, 明显高于对照组65.71%; 观察组的药物不良反应发生率为2.86%, 显著低于对照组22.86%. 其原因与氯压定可有效抑制交感神经, 减少胃酸分泌, 而硝苯地平可导致胃排空延迟和胃酸反流, 使PU发生风险增加有关. 有报道氯沙坦也是一种合适的选择. 因人体胃酸分泌受大脑迷走神经区域孤束核和背侧运动核的调控, 这些区域血管紧张素Ⅱ1型受体(angiotensin Ⅱtype 1 receptor, AT-1)密集, 氯沙坦可通过血脑屏障阻断AT-1受体, 减少胃酸和胃蛋白酶等侵袭性因子释放, 促进溃疡愈合[9]. 除上述药物干预外, 有研究[10]还发现饮用硫磺矿水可促进溃疡愈合和控制血压, 这主要归功于其中的活性分子硫化氢(H2S), 它作为人体的一种信号分子, 可通过硫化作用, 轻易穿过皮肤和黏膜, 在许多细胞保护性的生化反应中发挥作用, 目前发现其有以下三个作用: (1)通过增加血管内皮生长因子(vascular endothelial growth factor, VEGF)受体的表达和活化来促进新血管生长, 进而改善局部血供, 促进黏膜修复; (2)可去除血管内皮细胞中存在的一氧化氮合成酶抑制因子L-NAME, 有助于舒张血管; (3)抗炎作用, 主要通过影响MAP激酶信号传导使外周血淋巴细胞合成分泌白介素(interleukin, IL)-2及IL-8减少, 并减少细胞毒性反应.
非特异性免疫应答又称为固有免疫, 是人体长期进化过程中逐渐形成的天然免疫防御体系, 主要包括组织屏障、固有免疫细胞和固有免疫分子, 而在胃肠道主要以黏膜屏障的免疫作用为主.
众所周知, H. pylori是PU的首要病因, 它可影响人体Treg细胞功能和产生CagA及VacA来引起强烈的免疫反应, 破坏黏膜防护屏障. Robinson等[11]通过检测人黏膜内IL-10、Th1、Th2及CD4+等水平发现, 在H. pylori感染但未发生PU的患者中, 由于Treg细胞诱导释放高水平的抑炎因子IL-10及CD4+, 抑制IL-8等促炎因子作用, 减轻了H. pylori侵入黏膜后所造成的局部炎症反应, 达到免疫稳态, 相反的, 在发生PU的患者中, Treg细胞呈现下调免疫的作用, IL-10水平降低2.4倍, Th1和Th2等释放促炎因子的细胞水平分别提高3.2倍和6.1倍, 释放更多炎症介质, 打破免疫稳态, 剧烈炎症反应致溃疡形成. 另外, H. pylori感染后可致T细胞免疫调节功能缺陷, 黏膜内大量低活性、低表达IL-10的Treg细胞无效积聚本身亦可引起急性炎症反应损伤组织细胞, 破坏胃肠道黏膜, 严重时出现溃疡[12]. H. pylori除通过影响Treg细胞功能外, 还通过释放两种毒素(CagA、VacA)破坏黏膜免疫. 研究[13]表明, CagA是一种由致病性染色体岛(Cag-PAI)末端的cagA基因编码的分子量为128 kDa的免疫显性抗原, Cag-PAI中还可编码Ⅳ型分泌系统, H. pylori可通过该系统黏附到细胞上, 然后将CagA转移至宿主细胞的细胞质, 在那里CagA被Abl激酶或Src激酶磷酸化后, 干扰细胞内信号传导, 导致上皮细胞形态和功能改变, 此外, CagA还可直接以非磷酸化状态作用于宿主细胞, 影响细胞间紧密连接、细胞极性、细胞增殖和分化、细胞内部微结构、诱导炎症反应以及细胞纤维化; VacA除可破坏黏膜上皮细胞间的紧密连接外, 还可抑制T细胞增殖、活化和效应功能, 从而改变宿主炎症反应, 使细菌长期生存, 而且该毒素本身即可通过激活核因子NF-κB上调IL-8水平, 来诱导黏膜炎症反应发生, 目前认为上述两种毒素均与PU和慢性萎缩性胃炎的严重程度, 乃至胃癌发生上呈正相关.
近年来诸多研究[14,15]表明H. pylori与心血管疾病发生具有相关性, H. pylori感染5年内心血管病发生风险增加15%, 它诱导炎症因子释放, 引起局部强烈炎症反应破坏血管内皮细胞, 损伤黏膜血管, 使微循环障碍, 黏膜缺血缺氧严重, 导致了HTN、周围动脉疾病(peripheral arterial disease, PAD)等发生. Sawayama等[16]筛查了69例PAD患者H. pylori感染情况, 发现其感染率高达79.7%, 尤其在男性患者中更是达到84.8%, 认为H. pylori感染导致局部慢性炎症, 长此以往引起全身性慢性炎症, 使动脉斑块的不稳定, 增加PAD发病风险, 是PAD发病的独立危险因素. 我国一项针对5246例成年人的横断面研究[17]发现H. pylori感染与HTN发病呈正相关(OR = 1.23; 95%CI: 1.04-1.46), 也认为H. pylori是HTN的独立危险因素; 与H. pylori阴性者相比, H. pylori感染者舒张压增加了0.735 mmHg(95%CI: 0.101-1.369), 平均动脉压增加0.723 mmHg(95%CI: 0.034-1.413), 其原因与H. pylori感染后机体释放肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)、IL-6和C反应蛋白(C-reactive protein, CRP)等炎症因子, 引起胰岛素抵抗, 进一步致动脉粥样硬化, 动脉弹性降低致外周血管阻力增加相关. 如果早期根治H. pylori(尤其是年龄小于65岁)可以有效降低冠心病发病风险, 这与长期感染H. pylori可诱导局部炎症反应, 内皮损伤, 凝血级联的慢性低级激活, 脂质代谢失调和高同型半胱氨酸血症等原因相关, 根除H. pylori则可以提高HDL水平, 降低CRP和纤维蛋白原水平[18].
特异性免疫又称为适应性免疫或获得性免疫, 主要包括由T细胞介导的细胞免疫和B细胞介导的体液免疫. 目前研究认为在PU合并HTN患者体内主要由H. pylori、CagA及各类炎症介质等引起特异性免疫反应.
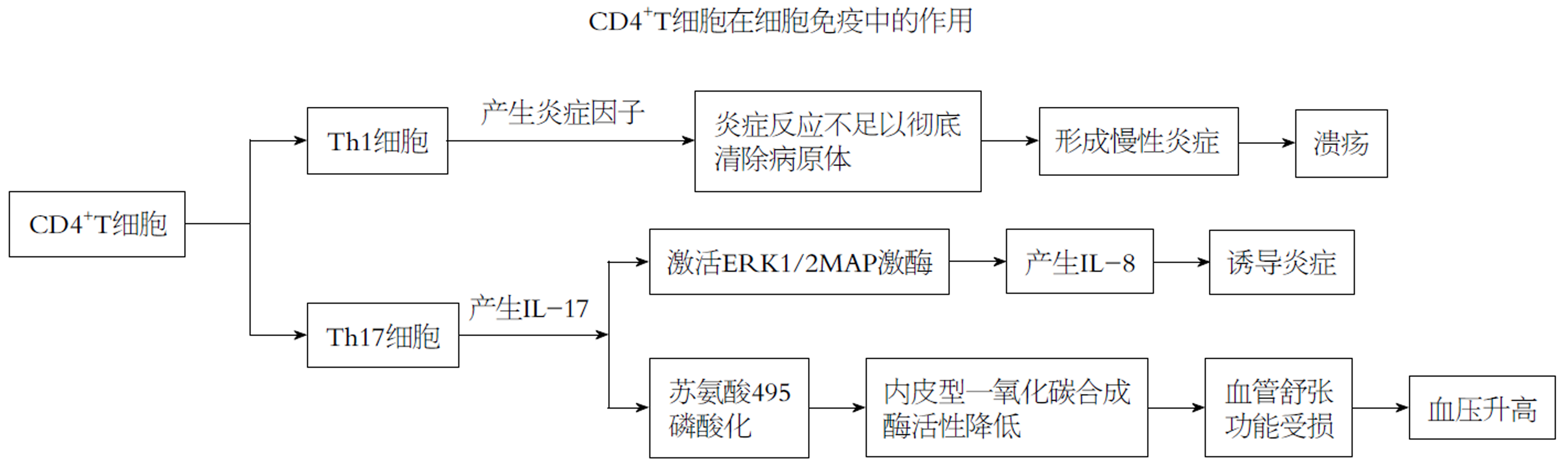
CD4+T细胞(主要是Th1细胞和Th17细胞)在免疫过程中起关键作用, 如图1. 巴西一项针对554名胃肠病患者的前瞻性研究[19]发现, H. pylori阳性的PU患者胃肠黏膜内γ干扰素(interferon-γ, IFN-γ)及IL-12水平分别高达1335 pg/mg±1.52 pg/mg和108 pg/mg±1.40 pg/mg, 而IL-4及IL-10水平低下, 这使得CD4+T细胞在受外界因素刺激后, 易分化为Th1细胞, 而此类细胞并不能彻底清除H. pylori等病原体, 反而导致炎症状态持续存在, 疾病慢性化, 乃至加重恶化. 同样, 胃黏膜中Th17细胞数及其表达的IL-17水平也与慢性炎症程度正相关, 当H. pylori感染及患PU时其细胞数明显增加, 炎症因子水平明显提高, 其产生的IL-17可以激活胃上皮细胞中ERK1/2MAP激酶, 促进制炎因子IL-8分泌, 诱导黏膜长期慢性炎症发生[20]. 此外, 一些研究[21,22]还发现, 内皮细胞分泌的一氧化氮可以舒展血管, 在防止白细胞黏附与外渗以及调节血压上起作用, 但IL-17可使肽链上苏氨酸495磷酸化, 致合成的内皮型一氧化氮合成酶(endothelial nitric oxide synthase, eNOS)活性降低, 即IL-17降低eNOS活性, 导致内皮依赖性血管舒张功能受损, 引起血压升高, 而血压过高又会作用于血管壁导致管壁机械应力改变, 促进大血管的周期性伸展, 延伸的管壁可以增加内皮细胞的生成, 并释放IL-6、IL-8、活性氧类(reactive oxygen species, ROS)、内皮素等促炎介质, 另外, 延伸的管壁还会增加血管细胞黏附分子、细胞内粘附分子和CD40的表达, 这些因素激活单核细胞、巨噬细胞和树突状细胞并浸润, 引起局部乃至全身炎症反应, 损伤黏膜微循环, 使局部缺血缺氧, 增加PU风险.
对于体液免疫改变的报道鲜见, 现有文献主要是关于其伴发其他并发症(如消化道出血)时的免疫情况. 刘建生等[23]在其研究中发现当PU并发出血时, 人体IgA、IgM、IgG、C3和C4水平下降, 其原因是机体损伤出血后皮质醇及细胞因子的大量释放, 与细胞的相应受体结合而干预前B细胞增殖分化, 影响成熟B细胞功能, 从而导致免疫球蛋白的改变, C4参与经典途径中的激活过程, 而C3则在补体激活的经典途径与旁路途径中起作用, 出血后的免疫抑制, 能激活经典途径和旁路途径.
PU合并HTN已逐渐成为临床上常见的一种慢病合并模式, 目前对其诊疗上, 无痛胃镜因安全性高等优点已逐渐得到认可, 氯压定、氯沙坦既可有效控制血压, 亦能减少胃酸分泌, 促进黏膜修复, 国外研究更是发现长期饮用含硫磺矿水可同时防治PU和HTN, 但结合此类患者本身黏膜免疫、特异性免疫等改变情况, 未来也许还可将其免疫数据变化作为评估病情及预后的一部分, 亦可继续完善相关实验研究, 充分明确其免疫功能变化, 从免疫靶向角度出发研制新型药物, 更有效的改善病症.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 1. | Mitsutake S, Ishizaki T, Teramoto C, Shimizu S, Ito H. Patterns of Co-Occurrence of Chronic Disease Among Older Adults in Tokyo, Japan. Prev Chronic Dis. 2019;16:E11. [PubMed] [DOI] |
| 5. | Fomina LA, Chernin VV. [Pathogenetic bases and efficacy of slow calcium channel blockers in the therapy of recurrent peptic ulcer disease associated with hypertension]. Ter Arkh. 2017;89:10-14. [PubMed] [DOI] |
| 7. | 迟 增凤, 高 兰美, 石 袒辉. 无痛胃镜在消化性溃疡伴发轻度高血压高龄患者中应用的安全性分析. 世界最新医学信息文摘. 2017;22:39. |
| 9. | Merai AH, Asad M, Prasad VS. Effect of centrally administered losartan on gastric and duodenal ulcers in rats. Pharmacology. 2009;84:93-98. [PubMed] [DOI] |
| 10. | Carbajo JM, Maraver F. Sulphurous Mineral Waters: New Applications for Health. Evid Based Complement Alternat Med. 2017;2017:8034084. [PubMed] [DOI] |
| 11. | Robinson K, Kenefeck R, Pidgeon EL, Shakib S, Patel S, Polson RJ, Zaitoun AM, Atherton JC. Helicobacter pylori-induced peptic ulcer disease is associated with inadequate regulatory T cell responses. Gut. 2008;57:1375-1385. [PubMed] [DOI] |
| 12. | Bagheri N, Azadegan-Dehkordi F, Rahimian G, Rafieian-Kopaei M, Shirzad H. Role of Regulatory T-cells in Different Clinical Expressions of Helicobacter pylori Infection. Arch Med Res. 2016;47:245-254. [PubMed] [DOI] |
| 13. | Nejati S, Karkhah A, Darvish H, Validi M, Ebrahimpour S, Nouri HR. Influence of Helicobacter pylori virulence factors CagA and VacA on pathogenesis of gastrointestinal disorders. Microb Pathog. 2018;117:43-48. [PubMed] [DOI] |
| 14. | Sun J, Rangan P, Bhat SS, Liu L. A Meta-Analysis of the Association between Helicobacter pylori Infection and Risk of Coronary Heart Disease from Published Prospective Studies. Helicobacter. 2016;21:11-23. [PubMed] [DOI] |
| 15. | Jiang J, Chen Y, Shi J, Song C, Zhang J, Wang K. Population attributable burden of Helicobacter pylori-related gastric cancer, coronary heart disease, and ischemic stroke in China. Eur J Clin Microbiol Infect Dis. 2017;36:199-212. [PubMed] [DOI] |
| 16. | Sawayama Y, Hamada M, Otaguro S, Maeda S, Ohnishi H, Fujimoto Y, Taira Y, Hayashi J. Chronic Helicobacter pylori infection is associated with peripheral arterial disease. J Infect Chemother. 2008;14:250-254. [PubMed] [DOI] |
| 17. | Wan Z, Hu L, Hu M, Lei X, Huang Y, Lv Y. Helicobacter pylori infection and prevalence of high blood pressure among Chinese adults. J Hum Hypertens. 2018;32:158-164. [PubMed] [DOI] |
| 18. | Wang JW, Tseng KL, Hsu CN, Liang CM, Tai WC, Ku MK, Hung TH, Yuan LT, Nguang SH, Yang SC, Wu CK, Chiu CH, Tsai KL, Chang MW, Huang CF, Hsu PI, Wu DC, Chuah SK. Association between Helicobacter pylori eradication and the risk of coronary heart diseases. PLoS One. 2018;13:e0190219. [PubMed] [DOI] |
| 19. | Vinagre RMDF, Vinagre IDF, Vilar-E-Silva A, Fecury AA, Martins LC. HELICOBACTER PYLORI INFECTION AND IMMUNE PROFILE OF PATIENTS WITH DIFFERENT GASTRODUODENAL DISEASES. Arq Gastroenterol. 2018;55:122-127. [PubMed] [DOI] |
| 20. | Bagheri N, Razavi A, Pourgheysari B, Azadegan-Dehkordi F, Rahimian G, Pirayesh A, Shafigh M, Rafieian-Kopaei M, Fereidani R, Tahmasbi K, Shirzad H. Up-regulated Th17 cell function is associated with increased peptic ulcer disease in Helicobacter pylori-infection. Infect Genet Evol. 2018;60:117-125. [PubMed] [DOI] |
| 21. | Norlander AE, Madhur MS, Harrison DG. Correction: The immunology of hypertension. J Exp Med. 2018;215:719. [PubMed] [DOI] |