修回日期: 2019-05-29
接受日期: 2019-07-15
在线出版日期: 2019-07-28
miRNA在癌症中的作用日益成为研究的热点, miR-567在癌症中的研究相对较少, 其在结直肠癌(colorectal cancer, CRC)中的功能作用尚缺乏参考.
研究miR-567对CRC细胞增殖、凋亡的影响及其机制.
运用qRT-PCR法检测CRC细胞SW480、SW1116、HT29和正常结直黏膜上皮细胞NCM460中miR-567、瞬时受体电位8(transient receptor potential melastatin 8, TRPM8)的表达; 将miR-NC组(转染miR-NC)、miR-567组(转染miR-567 mimics)、si-NC组(转染si-NC)、si-TRPM8组(转染si-TRPM8)、miR-567+pcDNA组(共转染miR-567和pcDNA)、miR-567+pcDNA-TRPM8组(共转染miR-567和pcDNA-TRPM8), 用脂质体法转染至SW480细胞. MTT法检测细胞的增殖; 流式细胞术检测细胞的凋亡; Western blot检测细胞中TRPM8、CyclinD1、p21、p23、Bcl-2、Bax、Cleaved-capase-3的蛋白表达; 双荧光素酶报告基因检测实验检测细胞的荧光活性.
与正常结直黏膜上皮细胞NCM460相比, CRC细胞中miR-567的表达明显降低, TRPM8的表达明显升高; 过表达miR-567或抑制TRPM8均可抑制SW480细胞的增殖, 促进其凋亡; miR-567可抑制野生型TRPM8细胞的荧光活性, 并负向调控TRPM8的表达; 过表达TRPM8逆转了过表达miR-567对SW480细胞的增殖抑制和凋亡促进作用.
miR-567可抑制CRC细胞的增殖, 促进凋亡, 其机制与靶向TRPM8有关, 将可为CRC的预防和治疗提供新方向.
核心提要: miR-567在结直肠癌(colorectal cancer, CRC)中具有抑制癌细胞增殖, 促进癌细胞凋亡的功能, 瞬时受体电位8(transient receptor potential melastatin 8, TRPM8)的敲减具有抑制CRC细胞增殖, 促进凋亡的功能, 二者之间具有miR-567靶向抑制TRPM8表达的关系.
引文著录: 杨庆华, 陈栋. miR-567靶向TRPM8调控结直肠癌细胞增殖凋亡的分子机制. 世界华人消化杂志 2019; 27(14): 864-871
Revised: May 29, 2019
Accepted: July 15, 2019
Published online: July 28, 2019
The role of miRNAs in cancer is increasingly becoming a hot research topic. There have been relatively few studies on miR-567 in cancer, and its functional role in colorectal cancer (CRC) is still little understood.
To investigate the effect of miR-567 on proliferation and apoptosis of CRC cells and the underlying mechanism.
qRT-PCR was used to detect the expression of miR-567 and transient receptor potential melastatin 8 (TRPM8) in the CRC cell lines SW480, SW1116, and HT29 as well as in the normal colorectal epithelial cell line NCM460. SW480 cells were transfected with miR-NC, miR-567 mimic, si-NC, si-TRPM8, miR-567 + pcDNA, or miR-567 + pcDNA-TRPM8 by using the liposome method. Cell proliferation was detected by MTT assay; cell apoptosis was detected by flow cytometry; protein expression of TRPM8, CyclinD1, p21, p23, Bcl-2, Bax, and cleaved Capase-3 was detected by Western blot; and the fluorescence activity was detected by double luciferase reporter gene assay.
Compared with normal colonic epithelial cells (NCM460), the expression of miR-567 was significantly decreased in CRC cells, and the expression of TRPM8 was significantly increased. Overexpression of miR-567 or inhibition of TRPM8 inhibited the proliferation and promoted apoptosis of SW480 cells. MiR-567 can inhibit the fluorescence activity of wild-type TRPM8 cells and negatively regulate the expression of TRPM8, while overexpression of TRPM8 reversed the proliferation inhibition and apoptosis-promoting effect of miR-567 overexpression in SW480 cells.
MiR-567 can inhibit the proliferation of CRC cells and promote their apoptosis via a mechanism possibly related to the targeting of TRPM8. This finding will provide a new direction for the prevention and treatment of CRC.
- Citation: Yang QH, Chen D. MiR-567 regulates proliferation and apoptosis of colorectal cancer cells by targeting TRPM8. Shijie Huaren Xiaohua Zazhi 2019; 27(14): 864-871
- URL: https://www.wjgnet.com/1009-3079/full/v27/i14/864.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i14.864
miRNA为长度在18-25个核苷酸之间的短链非编码内源性保守的微小RNA分子, 其参与人类的多种疾病的发生发展, 尤其是肿瘤[1]. 目前发现大量miRNA参与结直肠癌(, CRC)的恶性化进程, 但miR-567在CRC中的功能国内外研究甚少. 瞬时受体电位(transient receptor potential, TRP)阳离子通道超家族在多种过程中起关键作用, 包括温度感知、疼痛转导、血管舒张、男性生育能力和肿瘤发生[2]. TRP是七个离子通道超家族中的家族之一, TRPM家族包括八个结构和功能多样化的通道. 在TRPM亚科的所有成员中, TRPM8是最重要的成员[3]. 许多文献已经证明, 瞬时受体电位8(transient receptor potential melastatin 8, TRPM8)由具有3312个核苷酸的开放阅读框的cDNA编码, 其编码1104个氨基酸的蛋白质, 分子量为128 kDa, 六通跨膜蛋白, 跨膜结构域S5和S6之间的长链段形成该四聚体蛋白的推定孔环[4,5]. TRPM8在多种肿瘤中广泛异常表达, 调控肿瘤的增殖、凋亡、迁移、侵袭和转移等生物学行为[6]. 但其在CRC中的作用及调控机制尚未有人报道. 本研究拟以CRC细胞SW480为研究对象, 检测其中miR-567、TRPM8的表达, 观察过表达miR-567、抑制TRPM8对SW480细胞增殖、凋亡的影响, 揭示其机制与miR-567靶向调控TRPM8有关, 将为CRC的治疗研究提供新靶点.
CRC细胞SW480(编号: CVCL_0546)、SW1116(编号: CVCL_0544)、HT29(编号: CVCL_0320)和正常结直黏膜上皮细胞NCM460(编号: CVCL_0460)购自ATCC; DMEM培养基、胎牛血清、MTT、胰蛋白酶均购自美国Sellect公司; LipofectamineTM2000、BCA蛋白定量试剂盒、ECL发光液、RIPA蛋白裂解液、逆转录试剂盒购自大连Takara公司; 小鼠抗大鼠TRPM8、CyclinD1、p21、p23、Bcl-2、Bax、Cleaved-capase-3单克隆抗体、碱性磷酸酶标记的山羊抗小鼠二抗购自北京中山生物公司; PVDF膜购自德国罗氏公司; 双荧光素酶报告基因检测试剂盒购自美国Promega公司; Annexin V- FITC/PI凋亡检测试剂盒购自北京索莱宝公司; 半干转膜仪购自美国BIO-RAD公司; ABI 7500型实时荧光定量PCR系统购自美国ABI公司; Genesys 10紫外分光光度计购自美国Thermo公司; 细胞培养箱购自美国Forma Scientific公司; PCR 仪购自美国BIO-RAD公司. miR-NC、miR-567 mimics、si-NC、si-TRPM8序列的设计和合成均由上海吉玛生物公司完成
1.2.1细胞培养: 将CRC细胞SW480、SW1116、HT29和正常结直黏膜上皮细胞NCM460用含10%胎牛血清的DMEM培养基, 置于37 ℃, 5%CO2的恒温培养箱中常规培养, 待细胞生长至融合度75%左右, 用胰蛋白酶消化约1 min, 按照1:3的比例更换培养基, 每2 d传代一次.
1.2.2 细胞转染与分组: 将miR-NC、miR-567 mimics、si-NC、si-TRPM8、miR-NC+pcDNA、miR-567 mimics+pcDNA-TRPM8按照脂质体LipofectamineTM2000的说明书转染至SW480细胞, 分别标记为miR-NC组、miR-567组、si-NC组、si-TRPM8组、miR-NC+pcDNA组、miR-567+pcDNA-TRPM8组, 转染6 h后, 更换为新鲜培养基继续培养48 h, 用qRT-PCR法检测转染效率. 转染成功后, 用于后续试验.
1.2.3 qRT-PCR实验检测细胞中miR-567、TRPM8的表达: 取适量对数生长期1.2.2各组细胞, 遵照RNA抽提试剂盒说明书要求操作提取RNA, 进行定量, 然后按逆转录试剂盒按照说明书操作合成cDNA. 最后按qRT-PCR试剂盒说明书操作进行miR-567、TRPM8的检测. 以U6、GAPDH为内参, 用2-△△Ct法计算miR-567、TRPM8的mRNA表达.
1.2.4 Western blot实验检测细胞中TRPM8、CyclinD1、p21、p23、Bcl-2、Bax、Cleaved-capase-3的蛋白表达: 取适量对数生长期1.2.2各组细胞, RIPA裂解后用BCA进行定量, 变性离心后取上清进行蛋白上样. 按照Western blot实验常规操作流程进行电泳-转膜-封闭-Ⅰ抗(TRPM8、CyclinD1、p21、p23、Bcl-2、Bax、Cleaved-capase-3稀释倍数均为1:1000)孵育-Ⅱ抗(TRPM8、CyclinD1、p21、p23、Bcl-2、Bax、Cleaved-capase-3稀释倍数均为1:10000)孵育-显影曝光. Image J分析目的条带的灰度值, 以目的条带灰度值与GAPDH灰度值的比值表示目的蛋白的表达.
1.2.5 MTT法检测细胞增殖: 取适量细胞, 加入20 μL 5 g/L的MTT溶液, 培养4 h, 然后弃去上清, 每孔加入150 μL DMSO, 震荡, 使结晶溶解, 在490 nm波长下检测细胞吸光度(A). 每个样品做3个平行实验, 实验重复3次.
1.2.6 流式细胞术检测细胞凋亡: 用500 μL的Binding Buffer悬浮细胞, 分别加入5 μL的Annexin V-/FITC避光反应20 min后再加入5 μL的PI避光反应20 min, 用300目铜筛过滤, 最后在1 h内上流式细胞仪结束检测. 细胞的凋亡率(%)早期凋亡率+晚期凋亡率. 每个样品做3个平行实验, 实验重复3次.
1.2.7 双荧光素酶报告基因检测实验检测细胞中miR-567与TRPM8的结合力: 化学合成的目的基因序列(TRPM8-WT)和突变序列(TRPM8-MUT)的两端加上XhoⅠ和NotⅠ酶切位点, 由吉玛公司合成, 再将其克隆到PUC-T载体. 然后用XhoⅠ和NotⅠ酶切目的片段2 h, 进行琼脂糖凝胶电泳, 回收纯化酶切产物. psiCHECK-2载体也用同样的方法回收线性化的目的片段. 将连接目的序列与psiCHECK-2载体, 加入至冰浴的DH5α感受态细胞中, 42 ℃水浴热休克60 s, 快速将管转移至冰上, 静置3 min. 然后加入500 μL LB液体培养基, 在37 ℃的摇床上200 r/min振荡培养1 h. 将菌液涂抹在含氨苄青霉素的LB固体培养基上, 37 ℃培养过夜. 次日, 挑取单个菌落克隆, 再次进行电泳、测序鉴定, 保留所需克隆株, 并用含氨苄青霉素的LB液体培养基扩大培养, 提取质粒DNA. 取适量对数生长期的细胞, 遵照双荧光素酶报告基因检测试剂盒技术手册要求操作. psiCHECK2载体以萤火虫荧光素酶活性为内参, psiCHECK2-TRPM8-3ʹUTR WT和psiCHECK2-TRPM8-3ʹUTR MUT的表达为对照, 转染24 h后, 检测荧光强度. 海参荧光素酶的发光强度与萤火虫荧光素酶发光强度的比值即反应miR-567与TRPM8的结合力.
统计学处理 实验中所有数据均采用SPSS 21.0软件进行分析. 计量资料用mean±SD表示, 多组间数据比较采用单因素方差分析, 两组比较采用t检验, 以P<0.05表示差异有统计学意义.
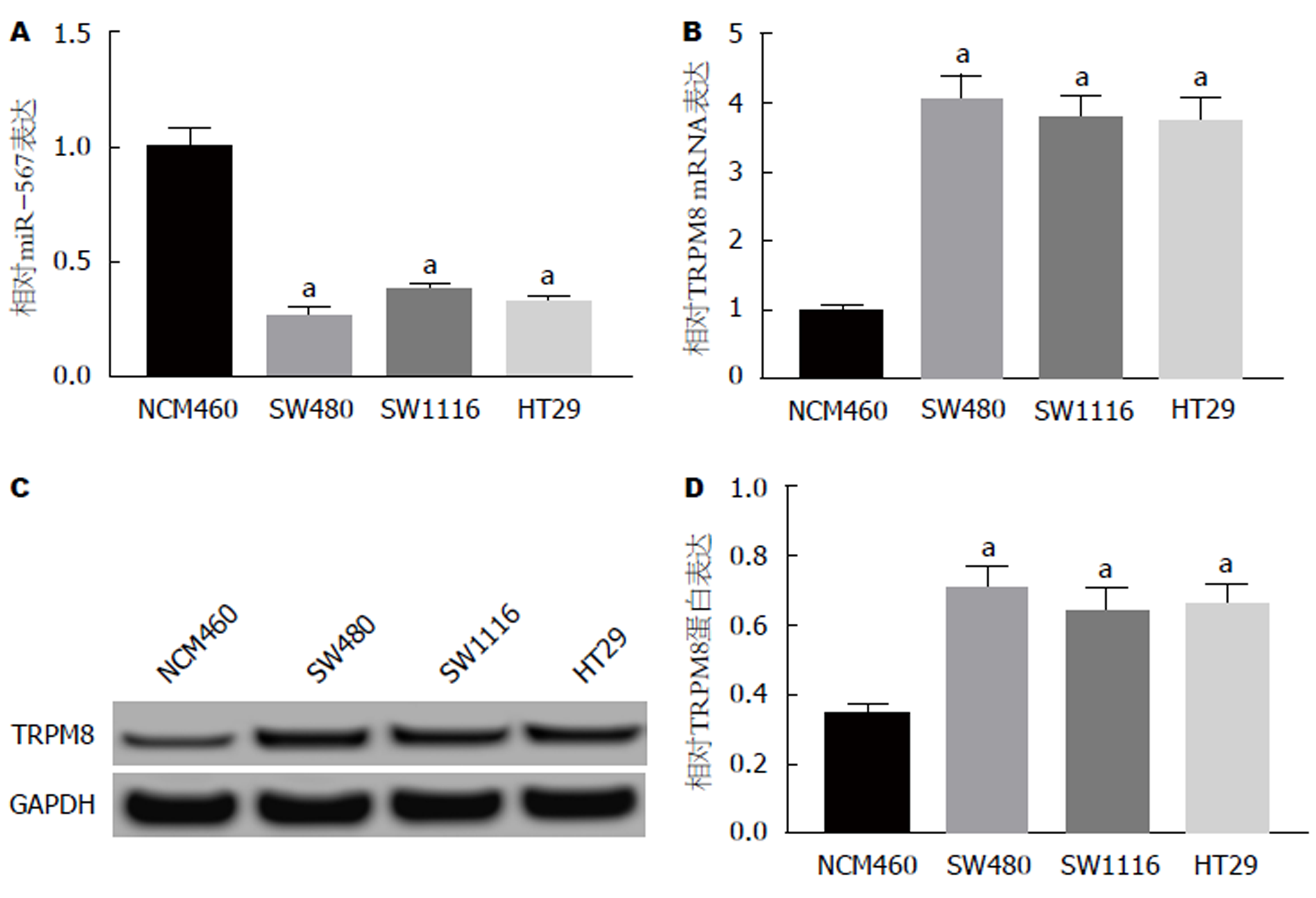
结果如图1所示, 与NCM460组相比, SW480、SW1116、HT29组细胞中miR-567表达显著降低, TRPM8的mRNA和蛋白表达均显著升高(P<0.05).
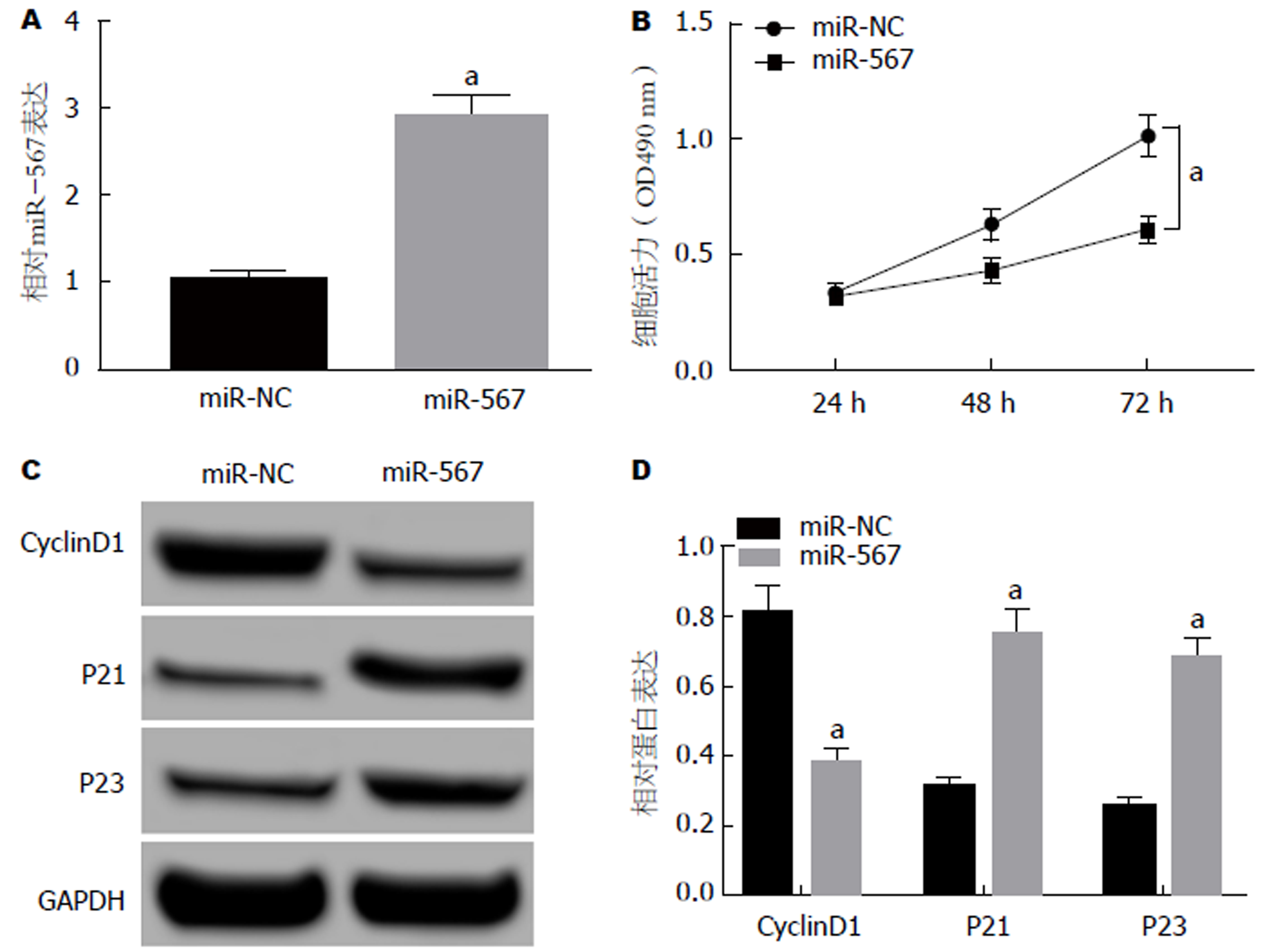
结果如图2所示, 与miR-NC组相比, miR-567组SW480细胞中miR-567表达显著升高, 细胞活性显著降低, 细胞中CyclinD1的蛋白表达量显著降低, p21、p23的蛋白表达量显著升高(P<0.05).
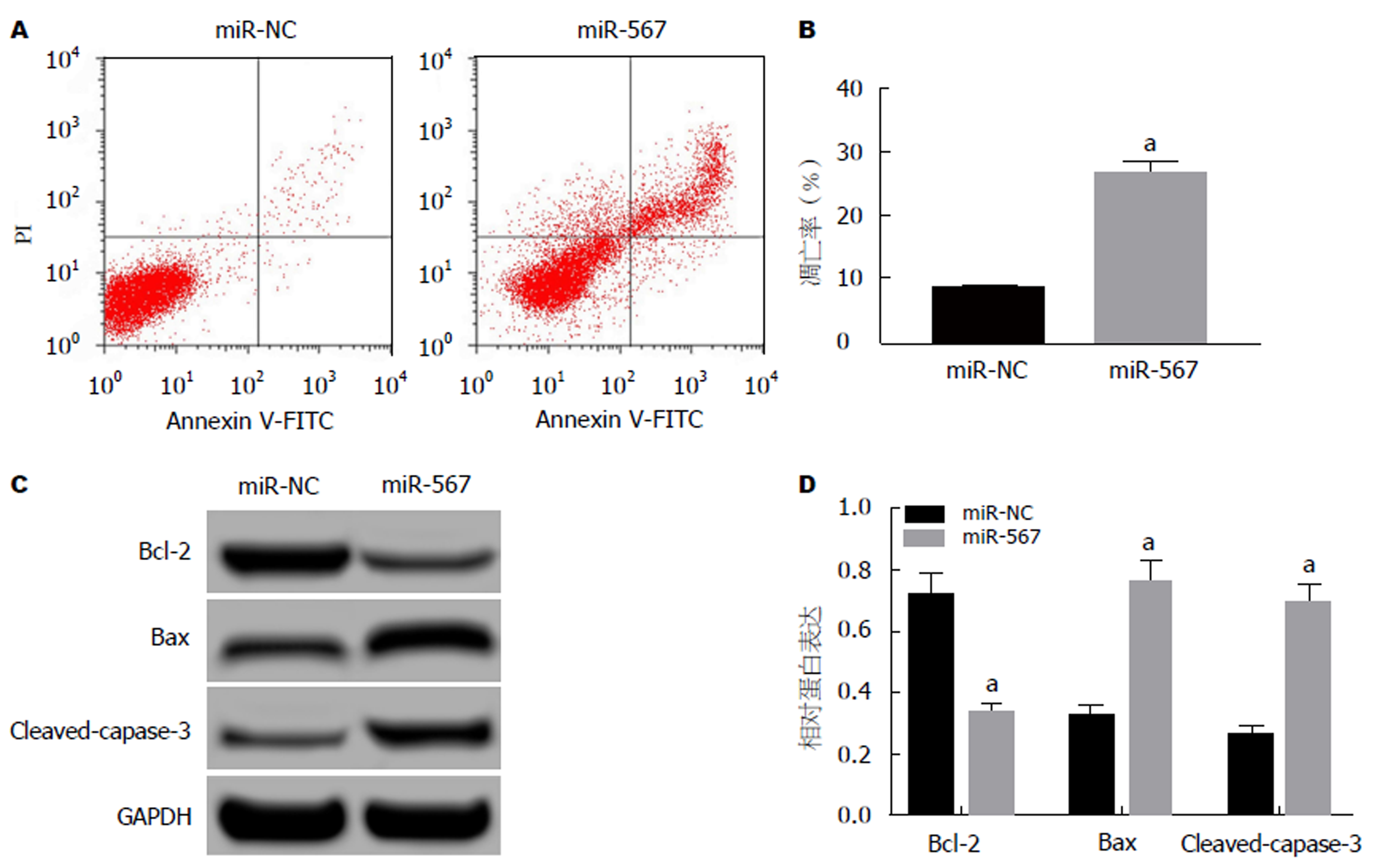
结果如图3所示, 与miR-NC组相比, miR-567组SW480细胞的凋亡率显著升高, 细胞中Bcl-2的蛋白表达量显著降低, Bax、Cleaved-capase-3的蛋白表达量显著升高(P<0.05).
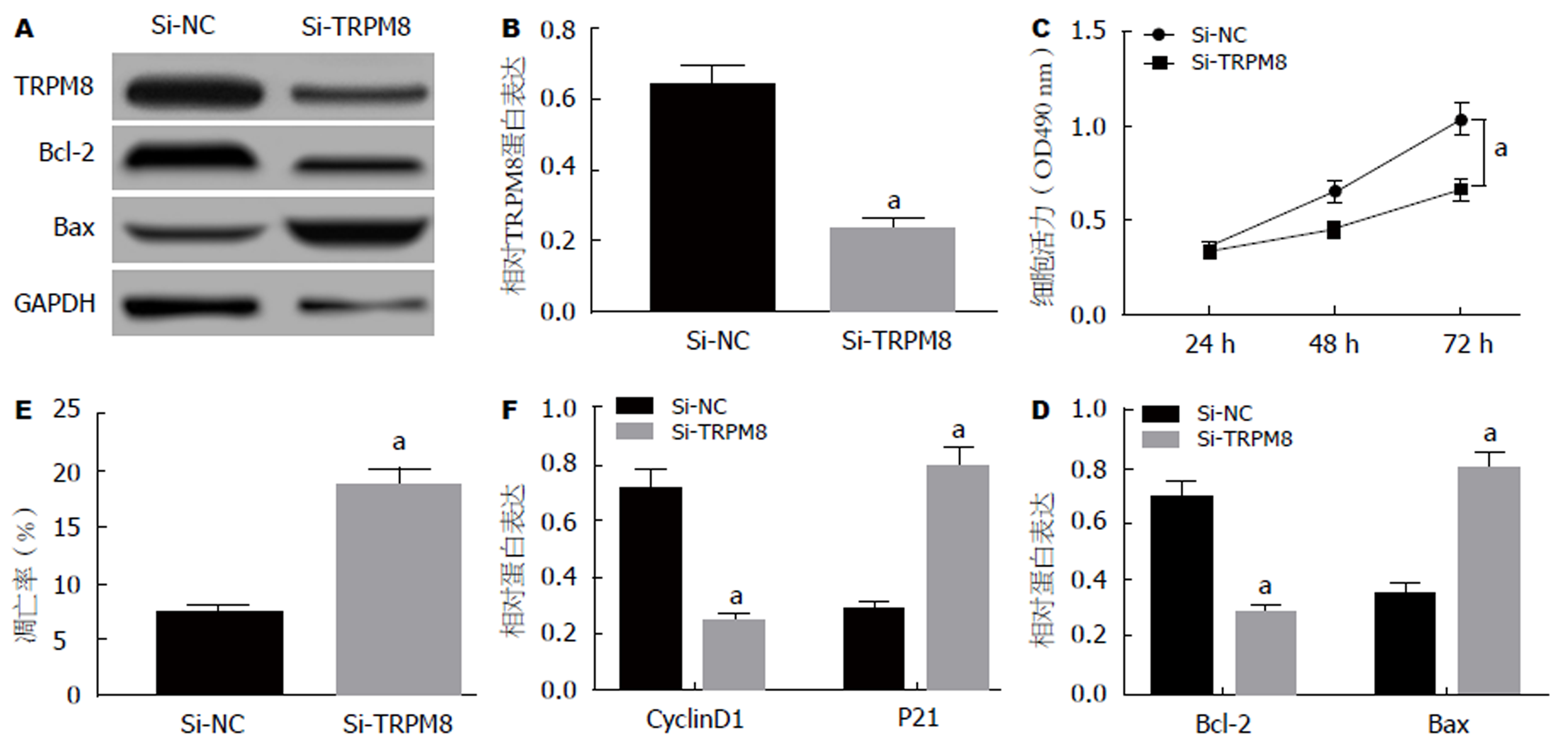
结果如图4所示, 与si-NC组相比, si-TRPM8组SW480细胞中TRPM8蛋白表达量显著降低, 细胞活性显著降低, 细胞凋亡率显著升高, 细胞中CyclinD1、Bcl-2的蛋白表达量显著降低, p21、Bax的蛋白表达量显著升高(P<0.05).
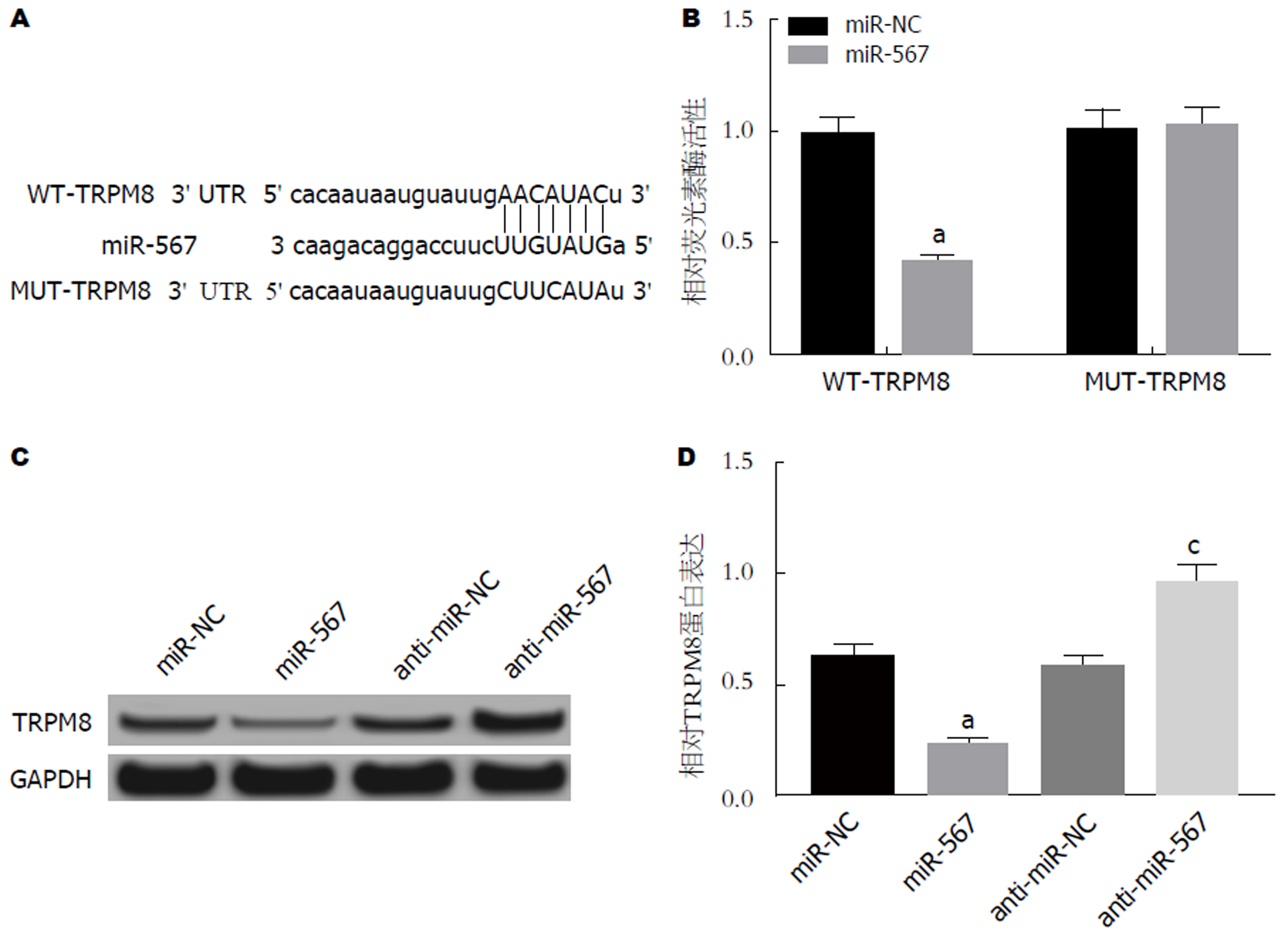
运用miRcode数据库预测到 miR-567与TRPM8 3ʹUTR存在结合位点(图5A); 双荧光素酶活性检测结果显示, 与miR-NC组相比, miR-567组WT-TRPM8细胞中荧光活性显著降低, MUT-TRPM8细胞中荧光活性不受影响(图5B); 与miR-NC组相比, miR-567组细胞中TRPM8表达显著降低, 与anti-miR-NC组相比, anti-miR-567组细胞中TRPM8表达显著升高(图5C和D, P<0.05).
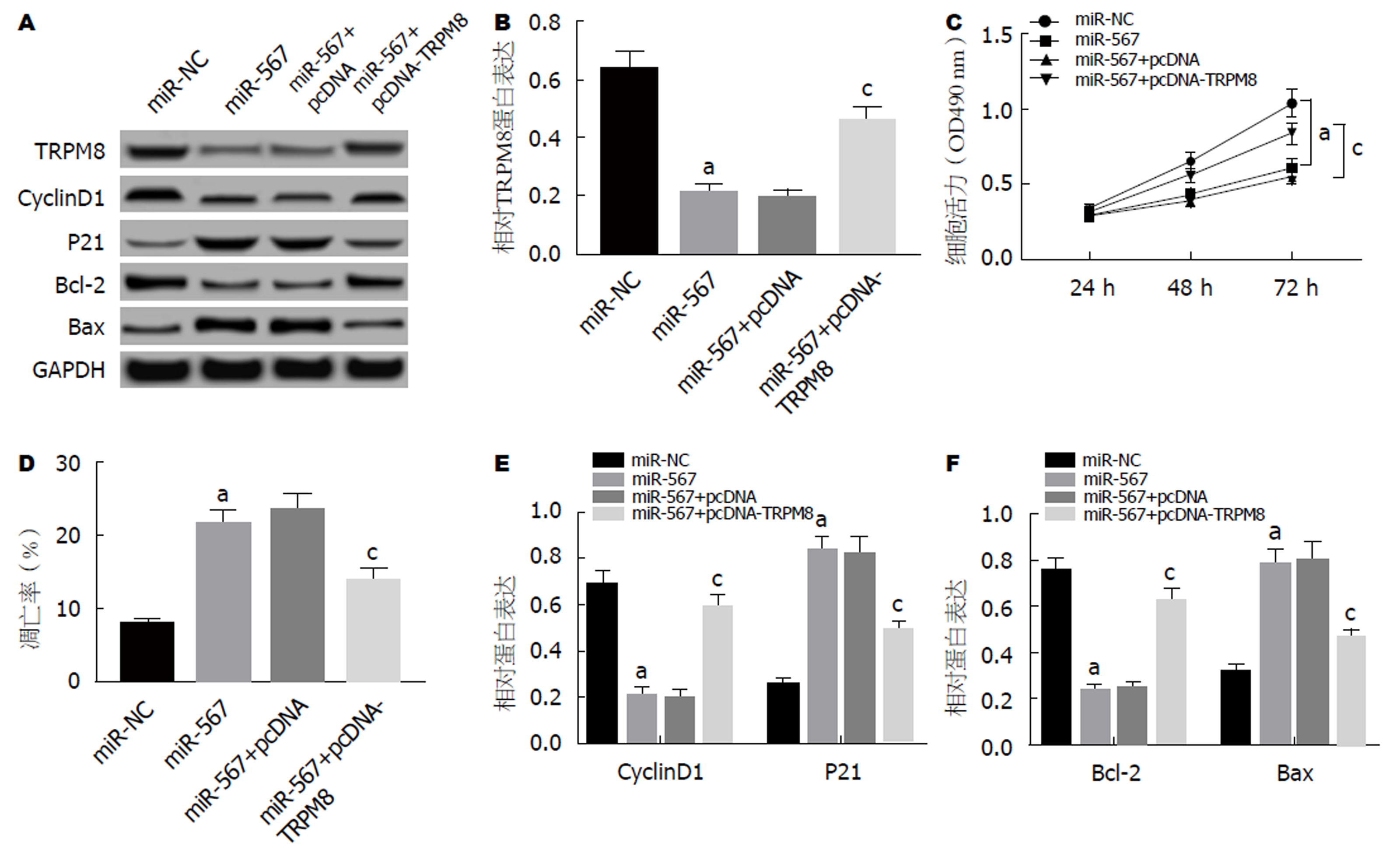
结果如图6所示, 与miR-NC组相比, miR-567组SW480细胞中TRPM8的蛋白表达量显著降低, 细胞活性显著降低, 细胞凋亡率显著升高, 细胞中CyclinD1、Bcl-2的蛋白表达量显著降低, p21、Bax的蛋白表达量显著升高; 与miR-NC+pcDNA组相比, miR-567+pcDNA-TRPM8组SW480细胞中TRPM8的蛋白表达量显著升高, 细胞活性显著升高, 细胞凋亡率显著降低, 细胞中CyclinD1、Bcl-2的蛋白表达量显著升高, p21、Bax的蛋白表达量显著降低(P<0.05).
miRNA在肿瘤领域的研究已成为热点, 其通过抑制靶基因的转录或蛋白翻译, 参与肿瘤的发生发展调控[7]. miR-567在癌症中的作用研究甚少, 目前仅在胰腺癌和乳腺癌中报道发挥抑制肿瘤进一步恶化的作用[8]. 有研究报道, 在CRC的研究中采用回归模型来鉴定明显相关的miRNA, 其靶向通常涉及结肠直肠癌微卫星不稳定性和染色体不稳定性途径的候选基因发现, SMAD4与CRC组织中的miR-567呈正相关[9], 而SMAD4在CRC中表达异常降低, 且与患者的预后差显著相关[10], 因此推测miR-567在CRC中也呈低表达. El-Murr等[11]在CRC的研究中发现, hsa-miR-567在80%的CRC中发生双等位基因突变, 提示miR-567在结直肠中具有潜在的调控功能. 本研究通过qRT-PCR法检测了CRC细胞SW480、SW1116、HT29和正常结直肠黏膜上皮细胞NCM460中miR-567的表达发现, miR-567在CRC细胞中的表达均异常降低, 这与前人的研究和我们的推测均相一致, 正式报道, miR-567在CRC细胞中的异常表达; 进一步研究发现, 过表达miR-567可抑制CRC细胞增殖, 促进其增殖, 这揭示了miR-567对CRC细胞表型增殖、凋亡的抑制作用, 为体内研究miR-567对CRC生长的影响奠定基础. 深入研究, 通过生物信息学、双荧光素酶报告基因检测实验验证miR-567可靶向调控TRPM8, 为研究miR-567在CRC中的调控机制提供参考. 我们还推测miR-567的功能可能与SMAD4也存在一定的相关性.
TRPM8在脊椎动物和无脊椎动物中发挥多种功能, 其除了在冷感中众所周知的功能外, TRPM8还在各种生物系统中发挥作用, 包括体温调节, 癌症, 膀胱功能和哮喘[2,12]. 最近的研究表明, TRPM8对于肿瘤的发生和发展是必需的, 并且TRPM8的异常表达在多种肿瘤中发现, 例如前列腺肿瘤、黑素瘤、乳腺癌、膀胱癌和结肠直肠癌, 使其成为一种新颖的分子靶标可能有助于癌症的诊断和治疗[13,14]. Borrelli等[15]在CRC的研究中发现, 通过电穿孔进行TRPM8的小发夹RNA-载体沉默具有与大麻素相同的在体内外抑制CRC细胞和肿瘤的生长的功能, 提示TRPM8抑制剂具有治疗CRC的潜力. 本研究通过qRT-PCR和Western blot检测了CRC细胞中TRPM8的表达发现, TRPM8在CRC细胞中表达异常升高, 这与TRPM8在其他癌症中的高表达的验结果相呼应, 证实了TRPM8在CRC细胞中的异常高表达; 进一步研究发现, 抑制TRPM8具有与过表达miR-567同样的抑制CRC细胞增殖, 促进其凋亡的作用, 深入研究发现, 过表达TRPM8可逆转过表达miR-567对CRC的增殖抑制和凋亡促进作用, 这不仅验证了miR-567可靶向负调控TRPM8, 反过来, TRPM8也可以负向调控miR-567的表达和功能. 这为miR-567在CRC中的功能机制的探索提供实验依据.
总之, miR-567可抑制CRC细胞的增殖, 促进凋亡, 其机制与靶向负调控TRPM8相关, 为CRC的治疗提供新靶点.
近期miRNA通过靶向下游因子, 调节癌症细胞的细胞表型或肿瘤的恶化已成为研究的热点. 但miR-567对结直肠癌(colorectal cancer, CRC)的作用机制国内外研究甚少.
本研究旨在研究miR-567对CRC细胞增殖、凋亡的影响, 并探讨其分子作用机制, 以期望为解决CRC靶向治疗的问题提供新线索.
探讨miR-567抑制CRC细胞增殖, 促进凋亡的作用, 及其机制, 以期为CRC的治疗提供新方向.
将CRC细胞SW480随机分成miR-NC组、miR-567组、si-NC组、si-瞬时受体电位8(transient receptor potential melastatin 8, TRPM8)组、miR-NC+pcDNA组、miR-567+pcDNA-TRPM8组, 用MTT法、流式细胞术分析miR-567对CRC细胞增殖、凋亡的影响, 双荧光素酶报告基因检测实验验证miR-567与TRPM8的靶向关系.
本研究成功构建过表达miR-567和沉默TRPM8的CRC细胞发现, CRC细胞增殖能力减弱, 凋亡能力增强, 同时miR-567靶向调控TRPM8, 且回复TRPM8又能反向调控miR-567.
miR-567可抑制CRC细胞的增殖, 促进凋亡, 其可能与靶向TRPM8有关, 提示miR-567可作为CRC细胞治疗的潜在靶点.
本研究仅在体外研究miR-567对CRC细胞增殖、凋亡的调控, 后期还需增加miR-567在裸鼠体内对CRC肿瘤的生长的对比实验, 以更清晰的展示miR-567对CRC细胞的治疗价值, 也为miR-567的靶向治疗提供更充分的理论依据.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 崔丽君 电编:刘继红
| 1. | Vishnoi A, Rani S. MiRNA Biogenesis and Regulation of Diseases: An Overview. Methods Mol Biol. 2017;1509:1-10. [PubMed] [DOI] |
| 2. | Abed E, Labelle D, Martineau C, Loghin A, Moreau R. Expression of transient receptor potential (TRP) channels in human and murine osteoblast-like cells. Mol Membr Biol. 2009;26:146-158. [PubMed] [DOI] |
| 3. | Valero ML, Mello de Queiroz F, Stuhmer W, Viana F, Pardo LA. TRPM8 ion channels differentially modulate proliferation and cell cycle distribution of normal and cancer prostate cells. PLoS One. 2012;7:e51825. [PubMed] [DOI] |
| 4. | DeFalco J, Duncton MA, Emerling D. TRPM8 biology and medicinal chemistry. Curr Top Med Chem. 2011;11:2237-2252. [PubMed] [DOI] |
| 5. | Asuthkar S, Velpula KK, Elustondo PA, Demirkhanyan L, Zakharian E. TRPM8 channel as a novel molecular target in androgen-regulated prostate cancer cells. Oncotarget. 2015;6:17221-17236. [PubMed] [DOI] |
| 6. | Fiorio Pla A, Gkika D. Emerging role of TRP channels in cell migration: from tumor vascularization to metastasis. Front Physiol. 2013;4:311. [PubMed] [DOI] |
| 7. | Mishra S, Yadav T, Rani V. Exploring miRNA based approaches in cancer diagnostics and therapeutics. Crit Rev Oncol Hematol. 2016;98:12-23. [PubMed] [DOI] |
| 9. | Wang F, Wong SC, Chan LW, Cho WC, Yip SP, Yung BY. Multiple regression analysis of mRNA-miRNA associations in colorectal cancer pathway. Biomed Res Int. 2014;2014:676724. [PubMed] [DOI] |
| 11. | El-Murr N, Abidi Z, Wanherdrick K, Svrcek M, Gaub MP, Flejou JF, Hamelin R, Duval A, Lesuffleur T. MiRNA genes constitute new targets for microsatellite instability in colorectal cancer. PLoS One. 2012;7:e31862. [PubMed] [DOI] |
| 12. | Andersson DA, Nash M, Bevan S. Modulation of the cold-activated channel TRPM8 by lysophospholipids and polyunsaturated fatty acids. J Neurosci. 2007;27:3347-3355. [PubMed] [DOI] |
| 13. | Liu Z, Wu H, Wei Z, Wang X, Shen P, Wang S, Wang A, Chen W, Lu Y. TRPM8: a potential target for cancer treatment. J Cancer Res Clin Oncol. 2016;142:1871-1881. [PubMed] [DOI] |
| 15. | Borrelli F, Pagano E, Romano B, Panzera S, Maiello F, Coppola D, De Petrocellis L, Buono L, Orlando P, Izzo AA. Colon carcinogenesis is inhibited by the TRPM8 antagonist cannabigerol, a Cannabis-derived non-psychotropic cannabinoid. Carcinogenesis. 2014;35:2787-2797. [PubMed] [DOI] |