修回日期: 2019-05-28
接受日期: 2019-06-17
在线出版日期: 2019-06-28
胃癌(gastric cancer, GC)为临床上常见的消化系统肿瘤, 确诊时大多为晚期患者预后不良, 且临床上缺乏预后预测相关因子.
应用Oncomie和Kaplan-Meier Plotter数据库分析Kruppel样因子5(kruppel-like factor 5, KLF5)在GC中的表达及其与患者预后相关性.
收集Oncomie和Kaplan-Meier Plotter数据库中关于KLF5基因表达的相关数据集, 深入挖掘KLF5基因在GC组织与正常胃组织中的差异表达情况, 根据KLF5中位表达水平分为高表达组和低表达组, 绘制生存曲线并用Log-rank检验比较KLF5高、低表达组患者总生存及无疾病进展生存是否存在差异. 同时回顾性分析天津市宝坻区人民医院收治并手术治疗的41例GC患者的临床资料, 采用免疫组化检测41例患者癌组织中KLF5表达情况, 探讨KLF5表达与患者临床病理特征的关系.
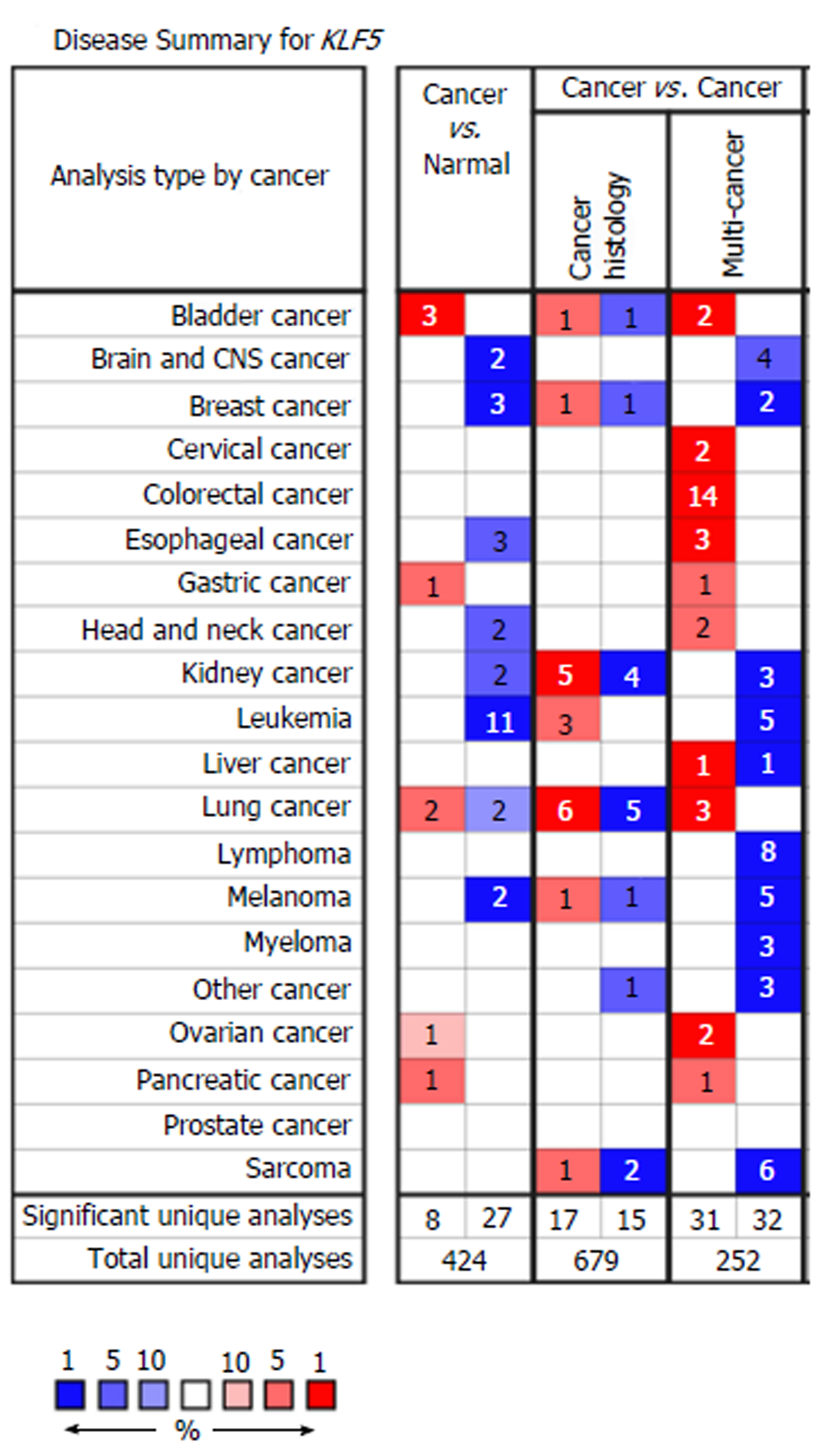
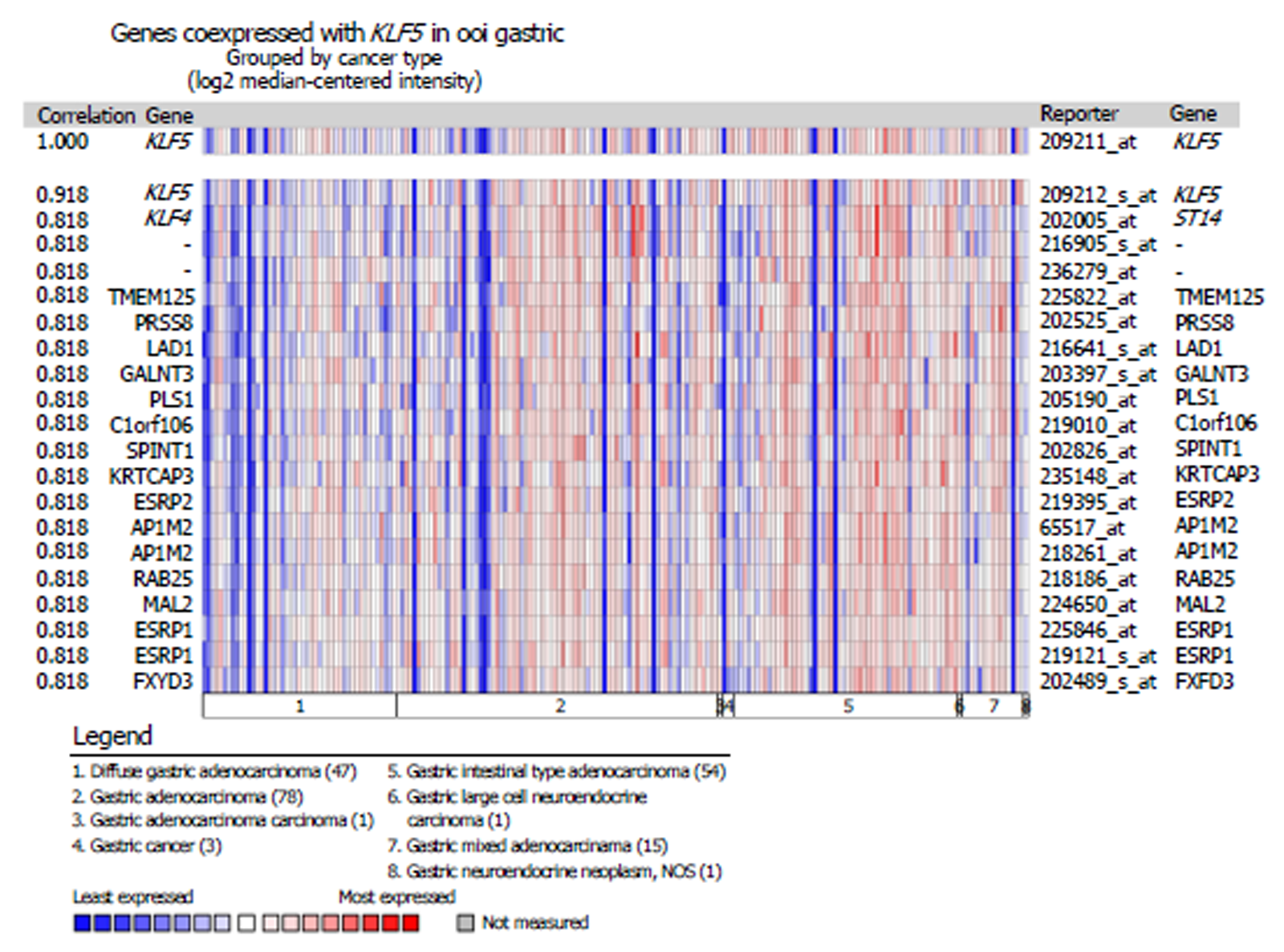
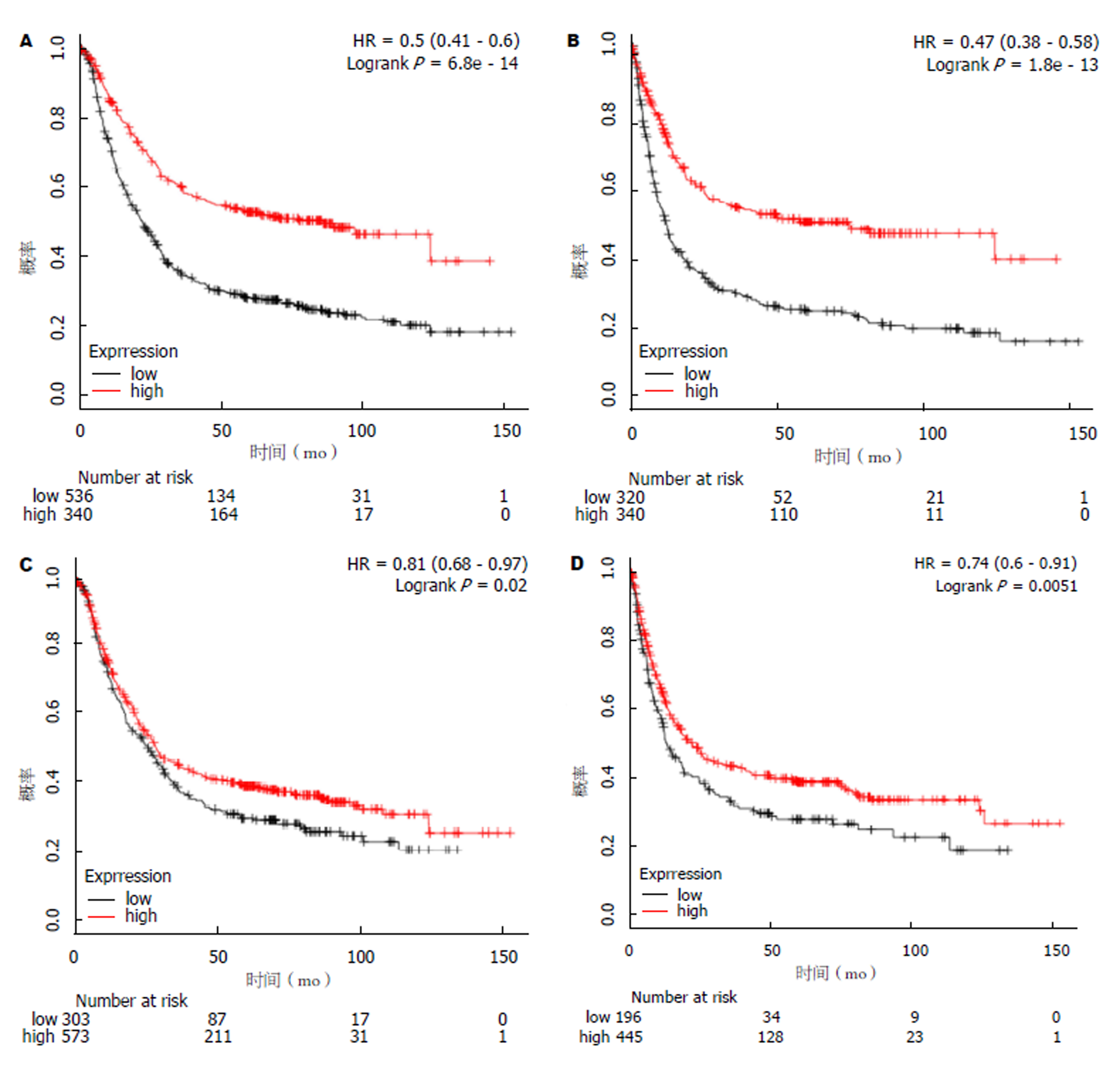
Oncomine数据库共收录了424个关于KLF5基因表达水平的相关研究, 其中在癌组织vs正常组织中差异表达的有35个, 与正常组织相比, 8个数据集结果提示KLF5在癌组织中高表达, 27个数据集在癌组织中低表达. 聚类分析显示, KLF5与ST14, TMEM125等20个基因存在共表达情况(在GC中共同低表达或高表达), 提示这些共表达基因在功能上可能存在相关性. Oncomine数据库中10个KLF5表达芯片数据集对比分析了GC组织与正常组织中KLF5基因的差异表达情况, 其中有4个芯片数据提示了GC组织中KLF5表达水平明显升高. Kaplan-Meier Plotter数据库中, 2个相关基因芯片数据分析了KLF5表达与GC患者预后的关系, Long-rank检验显示KLF5高表达患者总生存和无疾病进展生存均小于低表达组(P<0.05). 免疫组化分析显示41例GC患者中, KLF5阳性表达者29例, 阳性率为70.7(29/41). KLF5阳性表达与患者临床病理特征如性别、年龄、肿瘤分期、分级等无明显相关性(P>0.05).
KLF5在GC中高表达并与患者的不良预后有关, 而KLF5表达与患者临床病理特征无关.
核心提要: 本文通过分析Oncomie和Kaplan-Meier Plotter数据库Kruppel样因子5(kruppel-like factor 5, KLF5)在胃癌(gastric cancer, GC)中的表达及其与患者预后相关性, 同时采用免疫组织化学方法证实KLF5在GC中高表达并与患者的不良预后有关, 提示KLF5可作为GC预后的潜在生物学分子标记物.
引文著录: 冯福梅, 张磊. 基于Oncomie和Kaplan-Meier Plotter数据库分析KLF5在胃癌中的表达及其与患者预后相关性. 世界华人消化杂志 2019; 27(12): 734-741
Revised: May 28, 2019
Accepted: June 17, 2019
Published online: June 28, 2019
Gastric cancer (GC) is a common malignancy of the digestive system. Most patients with advanced GC have a poor prognosis and lack of prognostic predictors.
To analyze the expression of Kruppel-like factor 5 (KLF5) in GC and its correlation with patient prognosis by using Oncomie and Kaplan-Meier Plotter databases.
The data sets of KLF5 gene expression in Oncomie and Kaplan-Meier Plotter databases were collected. The differential expression of KLF5 gene in GC tissues was deeply mined. According to the median expression level of KLF5, the patients were divided into a high-expression group and low-expression group. Survival curves were drawn and log-rank test was used to compare the overall survival and disease-free survival of the two groups. Meanwhile, the clinical data of 41 patients with GC treated at our hospital were retrospectively analyzed. The expression of KLF5 in the 41 patients with GC was detected by immunohistochemistry, and the relationship between the expression of KLF5 and the clinicopathological characteristics of patients was analyzed.
A total of 424 studies on KLF5 gene expression were collected in Oncomine database, of which 35 showed differential expression of KLF5 in normal vs cancer tissues. Compared with normal tissues, 8 datasets showed that KLF5 was highly expressed in cancer tissues and 27 datasets showed low expression in cancer tissues. Cluster analysis showed that KLF5 was co-expressed with 20 genes such as ST14 and TMEM125 (co-down-regulated or up-regulated), suggesting that these co-expressed genes might be functionally related. The differential expression of KLF5 gene in GC tissues was analyzed by using 10 data sets of KLF5 expression chips from Oncomine database. Four of them indicated that the expression level of KLF5 in GC tissues was significantly increased. In the Kaplan-Meier Plotter database, two related gene chips were used to analyze the relationship between the expression of KLF5 and the prognosis of GC patients. The long-rank test showed that the overall survival and disease-free survival of patients with high expression of KLF5 were less than those of patients with low expression (P < 0.05). Immunohistochemical analysis showed that 29 (70.7%) of 41 patients with GC were KLF5 positive. There was no significant correlation between KLF5 positive expression and clinicopathological features such as gender, age, tumor stage, or tumor grade (P > 0.05).
The high expression of KLF5 in GC is associated with a poor prognosis, although the expression of KLF5 is not related to the clinicopathological characteristics of GC patients.
- Citation: Feng FM, Zhang L. Analysis of KLF5 expression and its prognostic significance in gastric cancer based on Oncomine and Kaplan-Meier Plotter. Shijie Huaren Xiaohua Zazhi 2019; 27(12): 734-741
- URL: https://www.wjgnet.com/1009-3079/full/v27/i12/734.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i12.734
胃癌(gastric cancer, GC)是临床上最为常见的消化道恶性肿瘤之一. 新近的流行病学数据显示, 2019年北美GC新确诊患者27510例, 而当年死亡人数为1140例, GC已成为癌症相关死亡的重要原因[1]. 我国GC患者整体预后较差, 主要原因为患者确诊时大多已发展为远处转移或区域淋巴结转移的进展期病变, 早期或超早期患者比例较少[2]. 近年来, 随着诊疗水平的提高和相关药物的研发, GC患者的整体预后有望得到改善. GC患者预后的影响因素较多, 包括临床分期、病理分级、术后辅助治疗等[3,4]. 同时已有研究发现, 部分肿瘤相关基因的表达水平与GC患者术后生存期存现相关性, 可作为GC患者预后或治疗反应率的生物学分子标志物[5,6]. 在本研究中, 我们探讨Kruppel样因子5(kruppel-like factor 5, KLF5)基因表达水平在GC组织中及正常胃粘膜中是否存在差异表达, 及其与患者临床病理特征和预后的关系.
选取Oncomine (https://http://www.oncomine.org/)和Kaplan-Meier plotter (http://www.kmplot.com)数据库为KLF5基因表达数据挖掘研究对象, 对GC组织与正常组织KLF5基因表达芯片数据进行分析. 同时回顾性分析天津市宝坻区人民医院2016-01/2018-12收治并手术治疗的GC患者41例为临床标本研究对象进行KLF5蛋白表达水平与患者临床病理特征相关性分析.
1.2.1 Oncomine数据分析: 在Oncomine数据库我们检索KLF5相关数据集, 限定条件为: (1)肿瘤类型: 胃肿瘤; (2)组织对比: 肿瘤组织vs正常组织; (3)数据类型: mRNA; (4)显著性: P<1E-4; (5)差异表达级别: 大于2倍; (6)基因排序: 前10%.
1.2.2 Kaplan-Meier Plotter数据分析: 在Kaplan-Meier Plotter数据分析平台中, 我们检索KLF5基因, 并应用在线分析软件绘制KLF5高低表达的生存曲线. 限定条件为总生存和无疾病进展生存, 对肿瘤病理类型, 临床分期, 分级等不做限制.
1.2.3 免疫组化: 石蜡切片脱蜡水化, 蒸馏水浸泡冲洗后行抗原修复, PBS冲洗后滴加动物非免疫血清, 室温孵育10 min后倾去. 滴加一抗, 室温孵育60 min, 阴性对照用PBS代替. PBS冲洗后, 滴加生物素标记的二抗, 室温孵育10 min. PBS冲洗干净后滴加链霉菌抗生物素-过氧化物酶溶液, 室温孵育30 min. PBS冲洗, DAB显色剂显色, 中性树胶封片. 根据肿瘤细胞显色的比例及染色强度, KLF5表达做半定量判定. 按显色程度评分: 弱染色为1分; 中等染色为2分; 强染色为3分. 按阳性细胞率评分: 阳性细胞数占10%<50%为2分; 50%<80%为3分; ≥80%为4分. 无论染色强度如何, 细胞阳性率<10%为阴性; (-); 评2分以上为阳性(+).
统计学处理 数据分析采用SPSS 17.0软件完成, 定量数据应用mean±SD表示, 组间比较采用t检验; 定性数据采用率表示, 组间采用χ2检验; 生存分析绘制生存曲线并进行log-rank检验, P<0.05为存在统计学差异.
截止到2019-03, Oncomine数据库共收录了424个关于KLF5基因表达水平的相关研究, 其中在癌组织vs正常组织中差异表达的有35个, 与正常组织相比, 8个数据集结果提示KLF5在癌组织中高表达, 27个数据集在癌组织中低表达(图1).
我们应用Oncomine提供的在线分析功能, 对KLF5在GC中的共表达基因进行了聚类分析(图2). 结果显示, KLF5与ST14, TMEM125等20个基因存在共表达情况(在GC中共同低表达或高表达), 提示这些共表达基因在功能上可能存在相关性.
通过对Oncomine数据挖掘, 我们发现10个mRNA芯片数据集对比分析了GC组织与正常组织中KLF5基因的差异表达情况(图3). 10个基因芯片中, 有4个芯片数据提示了GC组织中KLF5表达水平明显升高.
我们进一步对Kaplan-Meier Plotter数据库中, KLF5表达水平与GC患者预后的数据进行了挖掘, 并发现2个相关基因芯片数据, 分别为Affy ID: 209211_at和209212_s_at. 我们应用在线分析软件回执了KLF5高低表达的生存曲线(图4). 结果显示, KLF5高表达患者总生存和无疾病进展生存均小于低表达组(P<0.05)(表1).
| 基因编号 | 总生存(mo) | 风险比(95%CI) | P值 | 无疾病进展生存(mo) | 风险比(95%CI) | P值 | ||
| 低表达 | 高表达 | 低表达 | 高表达 | |||||
| 209211_at | 22.00 | 85.80 | 0.50 (0.41-0.60) | 6.8e-14 | 11.40 | 50.00 | 0.47 (0.38-0.58) | 1.8e-13 |
| 209212_s_at | 26.70 | 29.30 | 0.81 (0.68-0.97) | 0.02 | 12.6 | 21.9 | 0.74 (0.60-0.91) | 0.0051 |
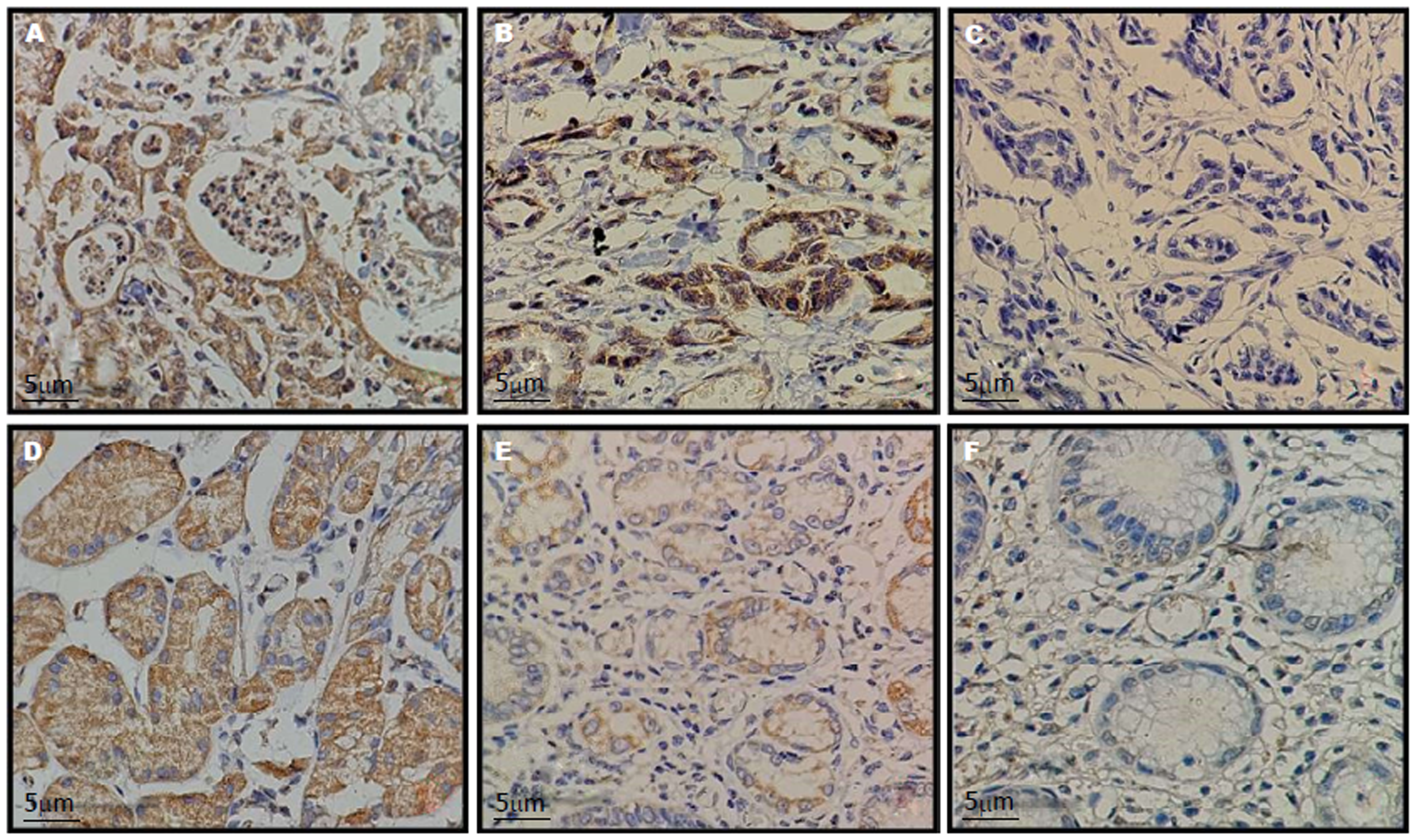
KLF5主要表达于细胞质, 呈棕褐色颗粒状均匀分布(图5). 41例GC患者中, KLF5阳性表达者29例, 阳性率为70.7(29/41). KLF5阳性表达与患者临床病理特征如性别、年龄、肿瘤分期、分级等无明显相关性(P>0.05)(表2).
| 临床特征 | n = 41 | KLF5表达 | χ2 | P值 | |
| +(n = 29) | -(n = 12) | ||||
| 性别 | 0.03 | 0.87 | |||
| 男性 | 38 | 27 | 11 | ||
| 女性 | 3 | 2 | 1 | ||
| 年龄(岁) | 0.54 | 0.46 | |||
| <50 | 6 | 5 | 1 | ||
| ≥50 | 35 | 24 | 11 | ||
| 肿瘤部位 | 1.51 | 0.45 | |||
| 贲门 | 22 | 18 | 4 | ||
| 胃体 | 8 | 5 | 3 | ||
| 幽门 | 11 | 6 | 5 | ||
| 侵犯血管 | 1.90 | 0.18 | |||
| 否 | 30 | 23 | 7 | ||
| 是 | 11 | 6 | 5 | ||
| 临床分期 | 1.93 | 0.58 | |||
| Ⅰ | 17 | 11 | 5 | ||
| Ⅱ | 11 | 9 | 3 | ||
| Ⅲ | 10 | 6 | 4 | ||
| Ⅳ | 3 | 3 | 0 | ||
| 浸润深度 | 1.28 | 0.53 | |||
| 黏膜或黏膜下层 | 9 | 5 | 4 | ||
| 肌层 | 24 | 18 | 6 | ||
| 浆膜层 | 8 | 6 | 2 | ||
| 分化程度 | 0.37 | 0.83 | |||
| 高分化 | 13 | 10 | 3 | ||
| 中分化 | 13 | 9 | 4 | ||
| 低分化 | 15 | 10 | 5 | ||
KLF5是真核生物中的基本转录元件结合蛋白2, 是一种锌指蛋白转录因子, 也被称为肠道富集Kruppel样因子(intestinal-enriched kruppel-Like factor, IKLF), 其通过激活或抑制目标基因的转录进一步调控基因表达的组织特异性和时间特异性, 同时在细胞的增殖、分化及细胞凋亡等过程中发挥着重要的作用[7-9]. 人KLF5染色体13q21区域, KLF5蛋白包含457个氨基酸, 分子量为55kDa, 其CDS编码区含有一个激活结构域和一个DNA结合结构域[7,10,11]. KLF5含有许多靶基因, 如核因子kB, 过氧化物酶增生物激活受体, 血小板源性生长因子a和T细胞抗原受体等, 在不同的细胞模型中这些基因都已被证实[12-14]. KLF5作为一种锌指转录因子, 通过调节富含GC的启动子区域的表达, 进一步参与调节细胞增殖、细胞分化、细胞凋亡、个体发育等过程.
已有研究显示, 与对应的正常组织相比, KLF5在多种肿瘤组织中呈现高表达, 如GC[15]、结直肠癌[16,17]、肺癌、乳腺癌等[18-20]. 但KLF5在肿瘤患者癌组织中的高表达是否与患者的预后及临床病理特征相关, 目前研究结果并不一致. 有研究认为, KLF5在肿瘤组织中的高表达往往与患者的预后不良有关, 高表达者中位生存时间及无疾病进展生存时间明显减低, 且KLF5的阳性表达往往与肿瘤的低分化及更高的临床分期有关[21]. 张小玲等[22]人采用采用免疫组化SP法检测79例GC组织和40例正常胃组织中KLF5的表达, 分析了KLF5表达与患者临床病例特征和预后的关系. 结果认为KLF5表达与GC分化程度、浸润和转移有关, 是GC不良预后的危险因素, 可作为GC预后评价的客观指标. 但亦有研究认为, KLF5表达水平与肿瘤患者的预后无关, 高低表达患者远期生存率无明显差异[23].
由于KLF5表达水平与GC患者预后及临床病理特征的关系并不明确, 我们采用Oncomie和Kaplan-Meier Plotter数据库中关于KLF5基因表达的相关数据进行深入挖掘, 探寻KLF5基因在GC组织与正常胃组织中的差异表达情况及其与患者预后的关系. 同时对41例GC患者的肿瘤组织切片进行免疫组织化学检测, 分析KLF5表达与患者临床病理特征的相关性. 在研究中我们发现, 与正常胃组织比较, GC组织中KLF5基因的mRNA表达水平明显上调, 且高表达与患者的预后不良有关. 而KLF5表达与患者的临床病理特征无相关性, 但由于纳入样本量较小, 这种弱的相关性可能并未被小样本实验所证实. 因此, KLF5高表达GC患者远期生存率低有关, 提示其可作为GC患者术后复发、转移的等预后不良的生物学标志物. 也可能成为GC靶向治疗的及药物研发的分子靶点. 但本研究也存现一定的局限性, 免疫组织化学验证部分入组患者例数较少, 统计学效能较低, 且未进行随访评价KLF5表达与患者预后的关系. 因此, 下一步我们将继续扩大样本量, 延长随访时间, 明确KLF5高低表达与GC患者生存期的关系.
胃癌(gastric cancer, GC)是较为常见的消化系统恶性肿瘤, 大多数患者就诊时已发展为晚期, 预后不良. 同时缺乏GC预后的分子标志物. Kruppel样因子5(kruppel-like factor 5, KLF5)在多种实体肿瘤中呈现差异表达, 并与患者的预后有关. 而KLF5在GC中的表达水平及其与GC患者的预后关系不清.
探讨KLF5在GC中的表达及其与GC患者预后的关系, 评价其作为GC预后分子标志物的可行性.
通过生物信息分析和组织标本验证, 揭示KLF5在GC中的差异表达情况, 并进一步明确其差异表达与患者生存期的关系.
通过Oncomine数据库分析KLF5在GC中的差异表达; 通过Kaplan-Meier Plotter数据库分析KLF5高低表达与GC患者生存期的关系; 最后通过免疫组织化学方法进行证实.
Oncomine数据库分析提示GC组织中KLF5表达水平明显升高. Kaplan-Meier Plotter数据分析显示KLF5高表达患者总生存和无疾病进展生存均小于低表达组(P<0.05). 免疫组化分析显示KLF5阳性表达与患者临床病理特征如性别、年龄、肿瘤分期、分级等无明显相关性(P>0.05).
本研究发现KLF5在GC中高表达并与患者的不良预后有关, 而KLF5表达与患者临床病理特征无关. 本研究提出KLF5高表达患者总生存和无疾病进展生存期较低. 检测KLF5在GC患者中的表达水平可作为GC预后的分子标志物. 为评估GC患者的生存期提供基础.
KLF5在GC中的差异表达为其预后评价提供了可行性, 并综合其他指标有望建立GC患者生存期预测模型, 为GC换的预后提供评价方法.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 崔丽君 电编:刘继红
| 1. | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019. CA Cancer J Clin. 2019;69:7-34. [PubMed] [DOI] |
| 2. | Chen W. Cancer statistics: updated cancer burden in China. Chin J Cancer Res. 2015;27:1. [PubMed] [DOI] |
| 3. | Wang S, Xu L, Wang Q, Li J, Bai B, Li Z, Wu X, Yu P, Li X, Yin J. Postoperative complications and prognosis after radical gastrectomy for gastric cancer: a systematic review and meta-analysis of observational studies. World J Surg Oncol. 2019;17:52. [PubMed] [DOI] |
| 4. | Machlowska J, Maciejewski R, Sitarz R. The Pattern of Signatures in Gastric Cancer Prognosis. Int J Mol Sci. 2018;19. [PubMed] [DOI] |
| 7. | Gao Y, Ding Y, Chen H, Chen H, Zhou J. Targeting Kruppel-like factor 5 (KLF5) for cancer therapy. Curr Top Med Chem. 2015;15:699-713. [PubMed] [DOI] |
| 8. | Marrero-Rodriguez D, la Cruz HA, Taniguchi-Ponciano K, Gomez-Virgilio L, Huerta-Padilla V, Ponce-Navarrete G, Andonegui-Elguera S, Jimenez-Vega F, Romero-Morelos P, Rodriguez-Esquivel M, Meraz-Rios M, Figueroa-Corona MDP, Monroy A, Perez-Gonzalez O, Salcedo M. Kruppel Like Factors Family Expression in Cervical Cancer Cells. Arch Med Res. 2017;48:314-322. [PubMed] [DOI] |
| 9. | Hart GT, Hogquist KA, Jameson SC. Kruppel-like factors in lymphocyte biology. J Immunol. 2012;188:521-526. [PubMed] [DOI] |
| 10. | Oishi Y, Manabe I, Nagai R. [Kruppel-like family of transcription factor 5 (KLF5). KLF5 is a key regulator of adipocyte differentiation]. Nihon Rinsho. 2011;69 Suppl 1:264-268. [PubMed] [DOI] |
| 11. | Oishi Y, Manabe I, Nagai R. [Kruppel-like transcription factor 5 (KLF5)]. Nihon Rinsho. 2006;64 Suppl 9:254-258. [PubMed] [DOI] |
| 12. | Guo L, He P, No YR, Yun CC. Kruppel-like factor 5 incorporates into the β-catenin/TCF complex in response to LPA in colon cancer cells. Cell Signal. 2015;27:961-968. [PubMed] [DOI] |
| 13. | Kuo PL, Hsu YL, Huang MS, Chiang SL, Ko YC. Bronchial epithelium-derived IL-8 and RANTES increased bronchial smooth muscle cell migration and proliferation by Kruppel-like factor 5 in areca nut-mediated airway remodeling. Toxicol Sci. 2011;121:177-190. [PubMed] [DOI] |
| 14. | Chanchevalap S, Nandan MO, McConnell BB, Charrier L, Merlin D, Katz JP, Yang VW. Kruppel-like factor 5 is an important mediator for lipopolysaccharide-induced proinflammatory response in intestinal epithelial cells. Nucleic Acids Res. 2006;34:1216-1223. [PubMed] [DOI] |
| 15. | Soon MS, Hsu LS, Chen CJ, Chu PY, Liou JH, Lin SH, Hsu JD, Yeh KT. Expression of Kruppel-like factor 5 in gastric cancer and its clinical correlation in Taiwan. Virchows Arch. 2011;459:161-166. [PubMed] [DOI] |
| 16. | Bialkowska AB, Crisp M, Bannister T, He Y, Chowdhury S, Schurer S, Chase P, Spicer T, Madoux F, Tian C, Hodder P, Zaharevitz D, Yang VW. Identification of small-molecule inhibitors of the colorectal cancer oncogene Kruppel-like factor 5 expression by ultrahigh-throughput screening. Mol Cancer Ther. 2011;10:2043-2051. [PubMed] [DOI] |
| 17. | Bialkowska AB, Du Y, Fu H, Yang VW. Identification of novel small-molecule compounds that inhibit the proproliferative Kruppel-like factor 5 in colorectal cancer cells by high-throughput screening. Mol Cancer Ther. 2009;8:563-570. [PubMed] [DOI] |
| 18. | Ge F, Chen W, Qin J, Zhou Z, Liu R, Liu L, Tan J, Zou T, Li H, Ren G, Chen C. Ataxin-3 like (ATXN3L), a member of the Josephin family of deubiquitinating enzymes, promotes breast cancer proliferation by deubiquitinating Kruppel-like factor 5 (KLF5). Oncotarget. 2015;6:21369-21378. [PubMed] [DOI] |
| 19. | Xia H, Wang C, Chen W, Zhang H, Chaudhury L, Zhou Z, Liu R, Chen C. Kruppel-like factor 5 transcription factor promotes microsomal prostaglandin E2 synthase 1 gene transcription in breast cancer. J Biol Chem. 2013;288:26731-26740. [PubMed] [DOI] |
| 20. | Chen CJ, Lin SE, Lin YM, Lin SH, Chen DR, Chen CL. Association of expression of kruppel-like factor 4 and kruppel-like factor 5 with the clinical manifestations of breast cancer. Pathol Oncol Res. 2012;18:161-168. [PubMed] [DOI] |
| 21. | Tong D, Czerwenka K, Heinze G, Ryffel M, Schuster E, Witt A, Leodolter S, Zeillinger R. Expression of KLF5 is a prognostic factor for disease-free survival and overall survival in patients with breast cancer. Clin Cancer Res. 2006;12:2442-2448. [PubMed] [DOI] |
| 22. | 张 小玲, 田 志逢, 王 萍, 王 现国. KLF5和Survivin蛋白异常表达与胃癌预后的关系. 临床与实验病理学杂志. 2016;32:142-145. [DOI] |