修回日期: 2018-12-08
接受日期: 2018-12-25
在线出版日期: 2019-01-08
探讨超声造影(contrast-enhanced ultrasound, CEUS)和增强CT对原发性肝癌(hepatocellular carcinoma, HCC)经导管肝动脉化疗栓塞术(transcatheter artery chemo-embolization, TACE)治疗后的疗效评估价值.
选取在我院接受TACE术治疗的96例HCC患者作为研究对象, 共计128个病灶. 均于术后1 mo接受数字减影血管造影(digital subtraction angiography, DSA)、CEUS和增强CT检查, 并以DSA结果作为"金标准", 比较CEUS和增强CT在评估TACE术后疗效的临床价值.
CEUS诊断HCC肿瘤残留的灵敏度(95.18%)、准确度(95.31%)分别为高于增强CT的灵敏度(84.34%)、准确度(88.28%), 差异有统计学意义(P<0.05); CEUS和增强CT诊断HCC肿瘤残留的特异度均为95.56%, 两者比较差异无统计学意义(P>0.05).
运用CEUS能准确地评估HCC经TACE术后的肿瘤残留状态, 具有较高的临床价值, 能为TACE术后疗效评估提供一种可靠的影像学方法.
核心提要: 超声造影能实时反映肿瘤组织的微循环血流灌注状态, 从而准确评估原发性肝癌经导管肝动脉化疗栓塞术(transcatheter artery chemo-embolization, TACE)术治疗后的残留情况, 可为TACE术后疗效评估提供一种可靠的影像学方法.
引文著录: 张心荣, 欧阳骏, 黄敬垣. CEUS和增强CT对原发性肝癌TACE术后疗效的评估价值比较. 世界华人消化杂志 2019; 27(1): 63-67
Revised: December 8, 2018
Accepted: December 25, 2018
Published online: January 8, 2019
To evaluate the value of contrast-enhanced ultrasound (CEUS) and enhanced computed tomography (CT) in evaluating the efficacy of transcatheter artery chemoembolization (TACE) for hepatocellular carcinoma (HCC).
A total of 96 patients with HCC who underwent TACE at Zhejiang Tumor Hospital were selected as research subjects (a total of 128 lesions). Digital subtraction angiography (DSA), CEUS, and enhanced CT were performed one month after operation, and the results of DSA were used as the "gold standard" to compare the clinical value of CEUS and enhanced CT in evaluating the efficacy of TACE.
The sensitivity (95.18%) and accuracy (95.31%) of CEUS in the diagnosis of residual lesions were higher than those (84.34% and 88.28%, respectively) of enhanced CT (P < 0.05). The specificities of CEUS and enhanced CT in the diagnosis of residual lesions were both 95.56%, and there was no significant difference between them (P > 0.05).
CEUS can accurately evaluate the residual lesions of HCC after TACE and has appreciated clinical value, thus providing a reliable imaging method for evaluating the efficacy of TACE.
- Citation: Zhang XR, Ouyang J, Huang JY. Comparison of CEUS and enhanced CT in evaluating efficacy of TACE for hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2019; 27(1): 63-67
- URL: https://www.wjgnet.com/1009-3079/full/v27/i1/63.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i1.63
原发性肝癌(hepatocellular carcinoma, HCC)是一种较为常见的肝脏恶性肿瘤, 手术切除是其首选治疗方法, 但因其发病隐匿、进展快速、早期转移等特点, 多数患者经临床确诊时已处于中晚期, 错过手术时机[1-3]. 经导管肝动脉化疗栓塞术(transcatheter artery chemo-embolization, TACE)是一种有效的非手术治疗中晚期HCC的重要方法, 因此准确有效地评估TACE术后疗效有着重要的临床意义. 超声造影(contrast-enhanced ultrasound, CEUS)通过实时动态观察超声微泡对比剂在器官组织中的增强过程, 准确反映器官组织微循环灌注的血流动力学状态[4-6]. 本研究运用CEUS评估HCC经TACE术后的疗效, 并与增强CT进行比较, 探讨其应用价值, 以期为临床治疗提供参考.
选择2016-03/2018-09期间, 在浙江省肿瘤医院接受TACE术治疗的96例HCC患者作为研究对象, 共计128个病灶. 年龄31-68岁, 平均年龄49.23岁±8.23岁, 其中男62例, 女34例. 纳入标准: (1)均符合2009年HCC诊断标准[7]; (2)Child-Pugh分级为A-B级; (3)均接受TACE术治疗; (4)术后1 mo均接受DSA、CEUS以及增强CT检查; (5)具有完整的相关资料. 排除标准: (1)肝肾功能衰竭; (2)凝血功能障碍; (3)合并严重感染及其它恶性肿瘤; (4)影像学图像不清晰者.
1.2.1 TACE治疗: 患者取平卧位, 对右侧股动脉拟穿刺部位行常规消毒铺巾, 采用5 mL 2%利多卡因行局部浸润麻醉后穿刺, 置入动脉鞘, 将肝导管置于腹腔干、肝总动脉、肝右动脉以及肝左动脉, 造影条件下明确肿瘤位置, 将导管伸至肿瘤供血动脉进行肝动脉灌注化疗以及肿瘤血管栓塞. 上述操作完成后拔出导管、动脉鞘, 并对穿刺部位进行加压包扎. TACE术后1 mo, 行DSA、CEUS以及增强CT检查.
1.2.2 检查方法: 首先行CEUS. 采用西门子S2000超声诊断仪, 配有频率为3-5 MHz低频探头. 首先行常规超声检查, 仔细观察记录TACE术后肿瘤部位、形态、大小、回声、边界以及血流等情况. 然后固定探头于肿瘤图像能清晰显影位置. 启动CEUS模式, 采用磷脂微囊六氟化硫(SF6)超声造影剂, 经左肘部浅静脉团注, 剂量为2.4 mL, 并同步计时. 观察并记录肿瘤分别在动脉相(0-30 s)、门脉相(31-120 s)以及延迟相(121-360 s)的超声造影特征. CEUS后7 d内行DSA以及增强CT检查(西门子Sensation64排螺旋CT).
1.2.3 诊断标准: CEUS: 动脉相、门脉相肿瘤有造影剂填充, 而延迟相消退, 呈低增强或等增强, 定义为"阳性"(肿瘤残留); 动脉相、门脉相以及延迟相肿瘤内均无造影剂填充, 呈"黑洞征", 定义为"阴性"(肿瘤彻底灭活). 增强CT: 肿瘤碘油斑片状沉积、稀少, 动脉期肿瘤有可辨增强区, 定义为"阳性"; 反之定义为"阴性".
统计学处理 采用SPSS 20.0统计软件进行数据处理. 计数资料以(%)表示, 组间比较采用χ2检验. P<0.05为差异有统计学意义.
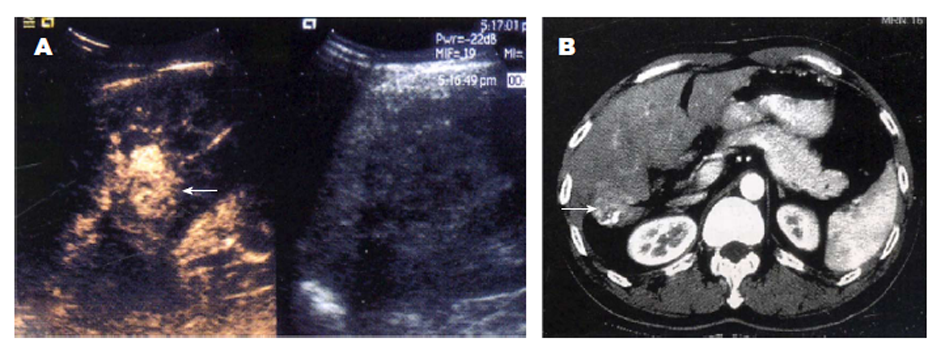
TACE术后1 mo, 经DSA诊断HCC肿瘤残留情况: 83个肿瘤呈阳性, 45个肿瘤呈阴性(图1).
TACE术后1 mo, 经CEUS诊断HCC残留情况: 81个肿瘤呈阳性, 表现为不同程度形状各异的增强, 其中52个肿瘤表现为动脉相高增强, 门脉相低增强, 延迟相低增强; 16个肿瘤表现为动脉相等增强, 门脉相低增强, 延迟相低增强; 13个肿瘤表现为动脉相等增强, 门脉相等增强, 延迟相等增强; 47个肿瘤呈阴性, 表现为造影全程肿瘤均无造影剂填充, 肿瘤与其周围肝组织边界清晰, 呈"黑洞征". CEUS诊断HCC肿瘤残留的灵敏度 = 95.18%, 特异度 = 95.56%, 准确度 = 95.31%. 见表1.
| CEUS | DSA | 总计 | |
| 阳性 | 阴性 | ||
| 阳性 | 79 | 2 | 81 |
| 阴性 | 4 | 43 | 47 |
| 总计 | 83 | 45 | 128 |
TACE术后1 mo, 增强CT诊断HCC肿瘤残留情况: 72个肿瘤呈阳性, 表现为肿瘤内部碘油沉积稀少、分布呈斑片状, 动脉期肿瘤存在不同程度强化; 56个肿瘤呈阴性, 表现为肿瘤内部碘油沉积分布均匀, 动脉期肿瘤无强化. 增强CT诊断HCC肿瘤残留的灵敏度 = 84.34%, 特异度 = 95.56%, 准确度 = 88.28%. 见表2.
| CEUS | DSA | 总计 | |
| 阳性 | 阴性 | ||
| 阳性 | 70 | 2 | 72 |
| 阴性 | 13 | 43 | 56 |
| 总计 | 83 | 45 | 128 |
CEUS诊断HCC肿瘤残留的灵敏度、准确度明显高于增强CT, 差异有统计学意义(χ2 = 5.308,4.202; P = 0.021,0.040); CEUS和增强CT诊断HCC肿瘤残留的特异度与增强CT比较, 差异无明显统计学意义(χ2 = 0.000, P = 1.000).
TACE术是以肿瘤以及正常肝组织的供血途径作为依据, 向靶血管内灌注化疗药物, 并栓塞肿瘤供血动脉, 以实现杀灭肿瘤细胞的目[8,9]. TACE术具有创伤小、疗效明确、起效快等优点, 已成为不能手术切除HCC治疗的重要手段, 但TACE术仍属于姑息性治疗手段, 难以一次性彻底清除肿瘤组织, 常常需重复多次治疗, 治疗过程中往往以前一次治疗作为后一次治疗的参考[10,11]. 因此, 准确有效地评估TAEC术后疗效, 对制定治疗方案, 指导治疗有着重要意义.
本研究以DSA作为TACE术后疗效评估的"金标准", DSA可通过消除原有碘油沉积影响, 准确反映肿瘤动脉血供状态, 从而清晰显示TACE术后肿瘤残留情况, 具有极高诊断价值[12]. 因其属于有创性操作, 且费用较高, 使其在临床上应用受限. 目前临床常常采用增强CT扫描肿瘤是否存在强化来判定肿瘤残留状态, 其扫描速度较常规CT快, 且能清晰显示肿瘤内碘油沉积分布情况, 有助于判断TACE术后肿瘤残留情况[13]. 曾春等[14]学者的研究结果显示增强CT在判定TACE术后肿瘤残留时, 具有较高的敏感度、特异度以及准确度分别为84.40%, 88.90%以及85.30%. 本研究结果与之相一致. 而在实际应用中, 碘油沉积可遮挡肿瘤血管, 从而影响增强CT诊断结果的准确性.
CEUS是一种敏感度极高的血流检测技术, 具有无创、无辐射、实时、便捷、短时间内可重复等优点, 目前被广泛应用于临床. 其原理是: 机体组织和微泡对比剂间声学阻抗差异较大, 经微泡对比剂灌注后, 含微泡对比剂组织和无微泡对比剂组织间声学阻抗差异增大, 从而使观察目标的超声图像反差明显增大, 并可同时清楚显示含微泡对比剂的微小血管信号[15-17]. 在肝肿瘤的诊疗应用中, CEUS通过增加肝肿瘤和周围组织的超声图像对比度, 动态观察造影剂在肿瘤组织中的灌注全程, 分析其增强特点及增强参数变化, 能显著提高超声对微小病灶及微小血管的检出率. 本研究结果中, CEUS诊断HCC肿瘤残留的灵敏度 = 95.18%, 特异度 = 95.56%, 准确度 = 95.31%, 提示CEUS诊断TACE术后肿瘤残留的能力不亚于增强CT, 能有效监测TACE术后疗效, 具有较高的临床应用价值. 本研究结果中, CEUS诊断HCC肿瘤残留的灵敏度、准确度分别高于增强CT灵敏度、准确度(P<0.05), 提示CEUS在诊断TACE术后疗效方面优于增强CT. 原因可能是: CEUS采用能进入血液循环的微泡对比剂作为血管示踪剂, 不受碘油沉积干扰, 能准确反映肿瘤组织的微循环血流灌注变化以及血管分布情况[4]; HCC内部新生微小血管密集, 其血供较为丰富, 该病理特点有利于CEUS诊断, 且表现出特定的造影增强模式, 呈"快进快出"特征[18,19]; CEUS具有实时性, 超声科医生能通过多切面, 多角度扫查, 实时动态观察分析肿瘤的整个造影过程, 能有效避免误诊漏诊情况的发生, 而增强CT无法进行实时动态观察.
总之, CEUS能准确有效地评估HCC经TACE术后的肿瘤残留状态, 具有较高的临床价值, 能为TACE术后疗效评估提供一种可靠的影像学方法.
导管肝动脉化疗栓塞术(transcatheter artery chemo-embolization, TACE)作为一种有效的非手术治疗原发性肝癌(hepatocellular carcinoma, HCC)重要手段, 准确评估其疗效有利于指导临床制定治疗方案, 有着重要临床意义.
本研究运用超声造影(contrast-enhanced ultrasound, CEUS)评估TACE术对HCC的疗效, 以期为TACE术后疗效评估提供一种有效的全新方法, 从而指导临床治疗.
本篇论文研究的主要目标是运用CEUS评估HCC经TACE术治疗后的肿瘤残留状态, 结果表明CEUS诊断TACE术后肿瘤残留的能力不亚于增强CT, 能有效监测TACE术后疗效, 具有较高临床价值.
本篇论文采用CEUS进行TACE术后疗效评估. CEUS是一种敏感度极高的血流检测技术, 能实时动态反映器官组织的微循环血流灌注状态.
本篇论文研究达到了实验目标, 研究结果显示CEUS诊断HCC肿瘤残留的灵敏度 = 95.18%, 特异度 = 95.56%, 准确度 = 95.31%, 且灵敏度、准确度均高于增强CT. 本研究结果说明CEUS能有效监测TACE术后疗效, 临床应用价值较高.
本研究发现CEUS能有效监测TACE术对HCC的疗效. CEUS能为TACE术后疗效评估提供一种可靠有效的影像学方法, 为临床治疗提供参考.
TACE术后肿瘤周围炎性充血带的出现可导致误诊. 本研究未来研究的方向是运用CEUS定量分析TACE术后肿瘤组织的血流灌注动力学变化. 本研究未来研究的最佳方法是CEUS联合肿瘤指标评估TACE术后肿瘤组织的残留状态.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Ozakyol A. Global Epidemiology of Hepatocellular Carcinoma (HCC Epidemiology). J Gastrointest Cancer. 2017;. [PubMed] [DOI] |
| 2. | Mittal S, El-Serag HB. Epidemiology of hepatocellular carcinoma: consider the population. J Clin Gastroenterol. 2013;47 Suppl:S2-S6. [PubMed] [DOI] |
| 3. | Merchante N, Merino E, López-Aldeguer J, Jover F, Delgado-Fernández M, Galindo MJ, Ortega E, Rivero A, Mínguez C, Romero-Palacios A, Padilla S, Márquez-Solero M, Amador C, Ríos-Villegas MJ, Téllez F, Portilla J, Pineda JA. Increasing incidence of hepatocellular carcinoma in HIV-infected patients in Spain. Clin Infect Dis. 2013;56:143-150. [PubMed] [DOI] |
| 4. | Pregler B, Beyer LP, Wiesinger I, Nießen C, Jung EM, Stroszczynski C, Wiggermann P. Microwave ablation of large HCC lesions: Added value of CEUS examinations for ablation success control. Clin Hemorheol Microcirc. 2016;64:483-490. [PubMed] [DOI] |
| 5. | Medhat E, Abdel Aziz A, Nabeel M, Elbaz T, Zakaria Z, Shousha H, Amer A, Fouad Fathalah W, Maher R, Musa S. Value of microwave ablation in treatment of large lesions of hepatocellular carcinoma. J Dig Dis. 2015;16:456-463. [PubMed] [DOI] |
| 6. | Vogl TJ, Farshid P, Naguib NN, Zangos S, Bodelle B, Paul J, Mbalisike EC, Beeres M, Nour-Eldin NE. Ablation therapy of hepatocellular carcinoma: a comparative study between radiofrequency and microwave ablation. Abdom Imaging. 2015;40:1829-1837. [PubMed] [DOI] |
| 8. | Luz JH, Luz PM, Martin HS, Gouveia HR, Levigard RB, Nogueira FD, Rodrigues BC, de Miranda TN, Mamede MH. DEB TACE for Intermediate and advanced HCC - Initial Experience in a Brazilian Cancer Center. Cancer Imaging. 2017;17:5. [PubMed] [DOI] |
| 9. | Lencioni R, Llovet JM, Han G, Tak WY, Yang J, Guglielmi A, Paik SW, Reig M, Kim DY, Chau GY, Luca A, Del Arbol LR, Leberre MA, Niu W, Nicholson K, Meinhardt G, Bruix J. Sorafenib or placebo plus TACE with doxorubicin-eluting beads for intermediate stage HCC: The SPACE trial. J Hepatol. 2016;64:1090-1098. [PubMed] [DOI] |
| 10. | Sciarra A, Ronot M, Di Tommaso L, Raschioni C, Castera L, Belghiti J, Bedossa P, Vilgrain V, Roncalli M, Paradis V. TRIP: a pathological score for transarterial chemoembolization resistance individualized prediction in hepatocellular carcinoma. Liver Int. 2015;35:2466-2473. [PubMed] [DOI] |
| 11. | Casadaban LC, Minocha J, Bui JT, Knuttinen MG, Gaba RC; Ray CE Jr. Conventional Ethiodized Oil Transarterial Chemoembolization for Treatment of Hepatocellular Carcinoma: Contemporary Single-Center Review of Clinical Outcomes. AJR Am J Roentgenol. 2016;206:645-654. [PubMed] [DOI] |
| 12. | 万 绪明, 许 祖闪, 侯 红军. 磁共振表观弥散系数变化率对肝细胞肝癌患者单次TACE术后疗效评价的应用价值. 国际放射医学核医学杂志. 2015;39:129-135. [DOI] |
| 13. | 黄 卫民, 徐 辉, 汪 继辉. CT增强扫描和DSA检测原发性肝癌TACE术后肿瘤残留及新发病灶. 中国CT和MRI杂志. 2016;14:77-79. [DOI] |
| 14. | 曾 春. DWI联合CT增强扫描在评估TACE治疗肝癌患者的临床价值. 中国CT和MRI杂志. 2016;14:80-83. [DOI] |
| 15. | Sidhu PS, Cantisani V, Deganello A, Dietrich CF, Duran C, Franke D, Harkanyi Z, Kosiak W, Miele V, Ntoulia A, Piskunowicz M, Sellars ME, Gilja OH. Role of Contrast-Enhanced Ultrasound (CEUS) in Paediatric Practice: An EFSUMB Position Statement. Ultraschall Med. 2017;38:33-43. [PubMed] [DOI] |
| 16. | Darge K, Papadopoulou F, Ntoulia A, Bulas DI, Coley BD, Fordham LA, Paltiel HJ, McCarville B, Volberg FM, Cosgrove DO, Goldberg BB, Wilson SR, Feinstein SB. Safety of contrast-enhanced ultrasound in children for non-cardiac applications: a review by the Society for Pediatric Radiology (SPR) and the International Contrast Ultrasound Society (ICUS). Pediatr Radiol. 2013;43:1063-1073. [PubMed] [DOI] |
| 17. | Cantisani V, Rubini A, Miniagio G. CEUS and strain elastography in gastric carcinoma. J Ultrasound. 2013;16:123-125. [PubMed] [DOI] |
| 18. | Schellhaas B, Wildner D, Pfeifer L, Goertz RS, Hagel A, Neurath MF, Strobel D. LI-RADS-CEUS - Proposal for a Contrast-Enhanced Ultrasound Algorithm for the Diagnosis of Hepatocellular Carcinoma in High-Risk Populations. Ultraschall Med. 2016;37:627-634. [PubMed] [DOI] |