修回日期: 2018-02-05
接受日期: 2018-02-10
在线出版日期: 2018-03-18
研究白藜芦醇(resveratrol, Res)对肝星状细胞(hepatic stellate cell, HSC)-T6细胞内Nod样受体蛋白3(nod-like receptor protein 3, NLRP3)炎性体活化的影响, 探讨Res抗肝纤维化的作用机制, 为Res的临床应用提供理论依据.
体外培养大鼠HSC系HSC-T6, 细胞用含10%胎牛血清的DMEM高糖培养基培养种板, 细胞贴壁后加入Res(4、8、16 μmol/L)或乙酰半胱氨酸(5 mmol/L)孵育24 h. 随后加入过氧化氢(0.2 mmol/L)孵育4 h制作氧化应激模型. 采用MTT法检测细胞增殖水平. ELISA法检测细胞培养上清液中的I型胶原(collagen type 1, COL-1)、转化生长因子(transforming growth factor β1, TGF-β1)、白介素-1β(interleukin-1β, IL-1β)、IL-18、丙二醛(malondialdehyde, MDA)和超氧化物歧化酶(superoxide dismutase, SOD)的含量. 荧光酶标仪检测细胞内活性氧(reactive oxygen species, ROS)含量. Western blot法检测细胞α-平滑肌肌动蛋白(alpha smooth muscle actin, α-SMA)、NLRP3、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein, ASC)、caspase1的表达.
与对照组比较, Res在浓度范围4-64 μmol/L对HSC-T6细胞均有显著的抑制效应(P<0.01). 与对照组比较, 氧化应激模型组细胞增殖率, 细胞上清液中COL-1、TGF-β1、MDA、IL-1β、IL-18含量, 细胞内ROS产量及α-SMA、NLRP3、caspase1-p10蛋白表达均呈显著增高趋势(P<0.01); 细胞上清液中SOD含量呈明显下降趋势(P<0.01). 与模型组比较, Res低、中、高剂量及阳性对照药NAC均可显著抑制HSC-T6细胞增殖率, 减少细胞上清液中COL-1、TGF-β1、MDA、IL-1β、IL-18含量, 细胞内ROS产量及α-SMA、NLRP3、ASC、caspase1-p10蛋白表达(P<0.01); 显著提高细胞上清液中SOD的含量(P<0.01).
Res能够通过调节ROS-NLRP3炎性体通路抑制HSC-T6细胞的增殖与活化.
核心提要: 本文在既往研究证实白藜芦醇(resveratrol, Res)抗氧化应激作用的基础上, 通过观察Res对活性氧(reactive oxygen species, ROS)下游Nod样受体蛋白3(nod-like receptor protein 3, NLRP3)炎性体激活的影响, 在细胞水平初步发现其抑制肝星状细胞的作用的机制与抑制ROS活化的NLRP3炎性体相关.
引文著录: 朱毅, 阙任烨, 李勇. 白藜芦醇对HSC-T6细胞NLRP3炎性体活化的影响. 世界华人消化杂志 2018; 26(8): 479-487
Revised: February 5, 2018
Accepted: February 10, 2018
Published online: March 18, 2018
To investigate the effect of resveratrol (Res) on the activation of nod-like receptor protein 3 (NLRP3) inflammasome in hepatic stellate cell (HSC)-T6 cells and to explore the anti-fibrotic mechanism of Res.
Rat hepatic stellate cell (HSC) line HSC-T6 was used. HSC-T6 cells were seeded into cell culture plates with high glucose DMEM medium containing 10% fetal bovine serum for 24 h. Then, the cells were incubated with Res (4, 8, and 16 μmol/L) or acetylcysteine (NAC; 5 mmol/L) for 24 h. Oxidative stress (OS) was induced by exposure to hydrogen peroxide (H2O2; 0.2 mmol/L) for 4 h. MTT method was used to observe the effect of Res on HSC-T6 cell proliferation. ELISA was used to detect the contents of type I collagen (COL-I), transforming growth factor β1 (TGF-β1), interleukin (IL)-1β, IL-18, malondialdehyde (MDA), and superoxide dismutase (SOD) in cell culture supernatant. Reactive oxygen species (ROS) production was measured with a fluorescence microplate reader following staining with DCFH-DA probe. Western blot analysis was used to detect the expression of alpha-smooth muscle actin (α-SMA), NLRP3, apoptosis-associated speck-like protein (ASC), and cysteinyl aspartate specific proteinase 1 (caspase 1) in HSC-T6 cells.
Compared with control cells, Res at concentrations from 4 μmol/L to 64 μmol/L significantly suppressed the proliferation of HSC-T6 cells. Compared with control cells, OS induction significantly increased the proliferation of HSC-T6 cells, the contents of COL-1, TGF-β1, MDA, IL-1β, and IL-18 in cell culture supernatant, intracellular ROS production, and the protein expression of α-SMA, NLRP3, ASC, and caspase 1-p10 (P < 0.01), but decreased the content of SOD in cell culture supernatant (P < 0.01). Compared with the OS group, treatment with low-, medium-, or high-dose Res or positive control NAC significantly decreased the proliferation of HSC-T6 cells, the contents of COL-1, TGF-β1, MDA, IL-1β, and IL-18 in cell culture supernatant, intracellcular ROS production, and the protein expression of α-SMA, NLRP3, ASC, and caspase 1-p10 (P < 0.01), but increased the content of SOD in cell culture supernatant (P < 0.01).
Res could suppress the proliferation and activation of HSC-T6 cells via down-regulation of ROS-NLRP3 inflammasome signaling.
- Citation: Zhu Y, Que RY, Li Y. Effects of resveratrol on activation of NLRP3 inflammasome in HSC-T6 cells. Shijie Huaren Xiaohua Zazhi 2018; 26(8): 479-487
- URL: https://www.wjgnet.com/1009-3079/full/v26/i8/479.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i8.479
肝纤维化(hepatic fibrosis, HF)是因各种致病因素所致的慢性肝损伤经反复修复, 过度创伤愈合的应答过程, 导致细胞外基质(extracellular matrix, ECM)在肝脏内过度生成与异常沉积, 最终引起肝脏结构和功能异常改变的一种病理变化. 肝星状细胞(hepatic stellate cell, HSC)是HF形成过程中起主要作用的细胞, 而氧化应激是HSC激活的重要因素之一. 目前认为HF仍是一个可逆的病理过程, 因此早期诊断, 早期药物干预, 可有效防止HF向肝硬化的发展.
Nod样受体蛋白3(nod-like receptor protein 3, NLRP3)炎性体是由NLRP3、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein, ASC)和炎性半胱天冬酶-1(caspase-1)组成, 在细胞质内发挥外源性微生物或内源性危险信号感受器的作用. NLRP3炎性体通过激活caspase-1, 促进白介素-1β(interleukin-1β, IL-1β)和 IL-18促炎因子的加工和成熟而发挥生物学效应[1]. 目前已有研究证实NLRP3炎性体参与了HF的发生发展过程[2].
白藜芦醇(resveratrol, Res)是提取自中药虎杖的一种主要有效成分, 目前研究表明, 其具有抗炎、抗氧化、抗纤维化、抗肿瘤、保肝利胆、保护心血管等多种药理作用[3]. 但目前对其抗纤维化的相关分子机制仍未能完全明确, 故本研究旨在深入研究Res对HSC-T6活化的影响及其作用机制与NLRP3炎性体的关系.
大鼠HSC株HSC-T6细胞由上海第二军医大学长征医院消化科惠赠, 其表型为活化的HSC. Res购于中国药品生物制品检定所, 批号111535-201703, 纯度≥99%; 乙酰半胱氨酸购自美国Sigma公司, 批号: D0005215; 大鼠I型胶原(collagen type 1, COL-1)、转化生长因子(transforming growth factor β1, TGF-β1)、超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA)、IL-1β、IL-18 ELISA试剂盒, 上海西唐生物有限公司产品, 批号: 201707; NLRP3一抗(兔抗大鼠IgG多克隆抗体), Santa Cruz公司, 批号: k1814; ASC一抗(兔抗大鼠IgG多克隆抗体), Santa Cruz公司, 批号: k0515 ; caspase1一抗(兔抗大鼠IgG多克隆抗体), Santa Cruz公司, 批号: b2615; ECL化学发光试剂盒, 批号: 1115702, 美国Millipore公司; DMEM高糖培养基, 批号: NZH1209, 美国Thermo Scientific公司; 胎牛血清(fetal bovine serum, FBS), 批号: A10106-0455, 奥地利PAA公司; 牛血清白蛋白(bovine serum albumin, BSA), 批号: 201705, 美国Amresco公司; 蛋白质分子量预染Marker, Pierce公司产品产品, 批号: 27681; 山羊抗兔HRP标记二抗, Cell Signaling公司产品, 批号: 8176; ROS检测试剂盒, 南京建成生物科技有限公司产品, 批号: E004.
1.2.1 细胞培养: HSC-T6细胞用含有10%热灭活胎牛血清的 DMEM完全培养基在37 ℃、体积分数为 50 ml/L CO2、完全饱和湿度条件下常规培养, 每48 h更换培养基, 细胞生长铺满培养瓶底80%后, 用0.25%胰蛋白酶联合0.02% EDTA消化传代, 实验选用对数生长期细胞[4].
1.2.2 MTT检测: 取对数生长期的大鼠HSC-T6, 常规消化、制备单细胞悬液, 接种于96孔培养板中, 1×104/100 μL/孔, 另设细胞空白对照组及单纯培养液本底组; 细胞铺板24 h后, 每孔加入完全培养基配制的药物, 每个浓度设6个复孔, 空白对照组加入等体积的三联液; 分别继续培养24 h; 加入5 mg/mL的MTT试剂, 10 μL/孔, 37 ℃孵育4 h; 弃孔内上清, 加入DMSO溶剂, 150 μL/孔; 37 ℃恒温摇床中震荡10 min, 使沉淀充分溶解后, 置于酶标仪上测定490 nm波长吸光度OD值, 按以下公式计算增殖率: 增殖率 = (实验组OD值-本底组OD值)/(对照组OD值-本底组OD值)×100%[5].
1.2.3 ELISA检测: 取对数生长期的HSC-T6细胞, 接种于96孔培养板中, 1×104/200 μL/孔; 24 h后分别采用Res、乙酰半胱氨酸预处理, 24 h后加入过氧化氢(0.2 mmol/L)制作氧化应激模型[6], 4 h后收获上清, 冻存于-20 ℃, 待测; 按照试剂盒说明检测[4].
1.2.4 ROS检测: 将按上述处理的细胞在氧化应激处理结束后, 加入DCFH-DA探针(10 μmol/L)处理半小时后, 弃去培养液, PBS洗涤细胞3次后用胰酶消化细胞, 离心1000 r/min, 5 min, 取沉淀, 用PBS重悬细胞后使用荧光酶标仪检测, 激发波长500 nm, 发射波长525 nm.
1.2.5 Western blot检测: 将药物处理后的细胞弃去培养液, PBS洗涤细胞3次后, 将6孔板置于冰上. 向培养板中加入150 μL细胞裂解液(含蛋白酶抑制剂1:100), 置于摇床上30 min(冰上), 用细胞刮刀将细胞刮下后, 将细胞悬液移入EP管内, 超声, 离心12000 r/min, 20 min, 取上清. 按照1:4体积比加入5×loading buffer, 100℃水浴10 min, 使蛋白变性. 分装, -20℃保存备用. 配制PAGE胶, 分离胶的浓度为8%, 积层胶为5%. 上样10 μL预染的SDS-GAGE蛋白分子量marker, 以确定所检测蛋白带的位置. 初始电压为80 V, 溴酚蓝电泳至积层胶和分离胶分界面后加大至120 V, 至凝胶底部时停止电泳. 将蛋白从SDS-PAGE胶上转移至相同大小的NC膜(Millipore公司)上, 转膜条件为电压100 V, 90 min. 使用5%的脱脂奶粉封闭1-2 h后, 加入按比例稀释的一抗, 4℃过夜, 使用TBST洗膜以后, 加入二抗, 即1:1000稀释的山羊抗小鼠或兔抗体(Cell Signaling, 室温慢摇1 h, TBST洗膜后, 在条带上滴加100 μL的荧光液, 使用ChemiDocTMXRS+凝胶成像分析系统进行半定量分析, 以积分光密度值(integral optical density, IOD)表示, 以目的蛋白/内参蛋白表示蛋白表达的相对水平[4].
统计学处理 数据均用mean±SD表示, 采用SPSS23.0软件用one way-ANOVA进行处理, P<0.05表示差异有统计学意义.
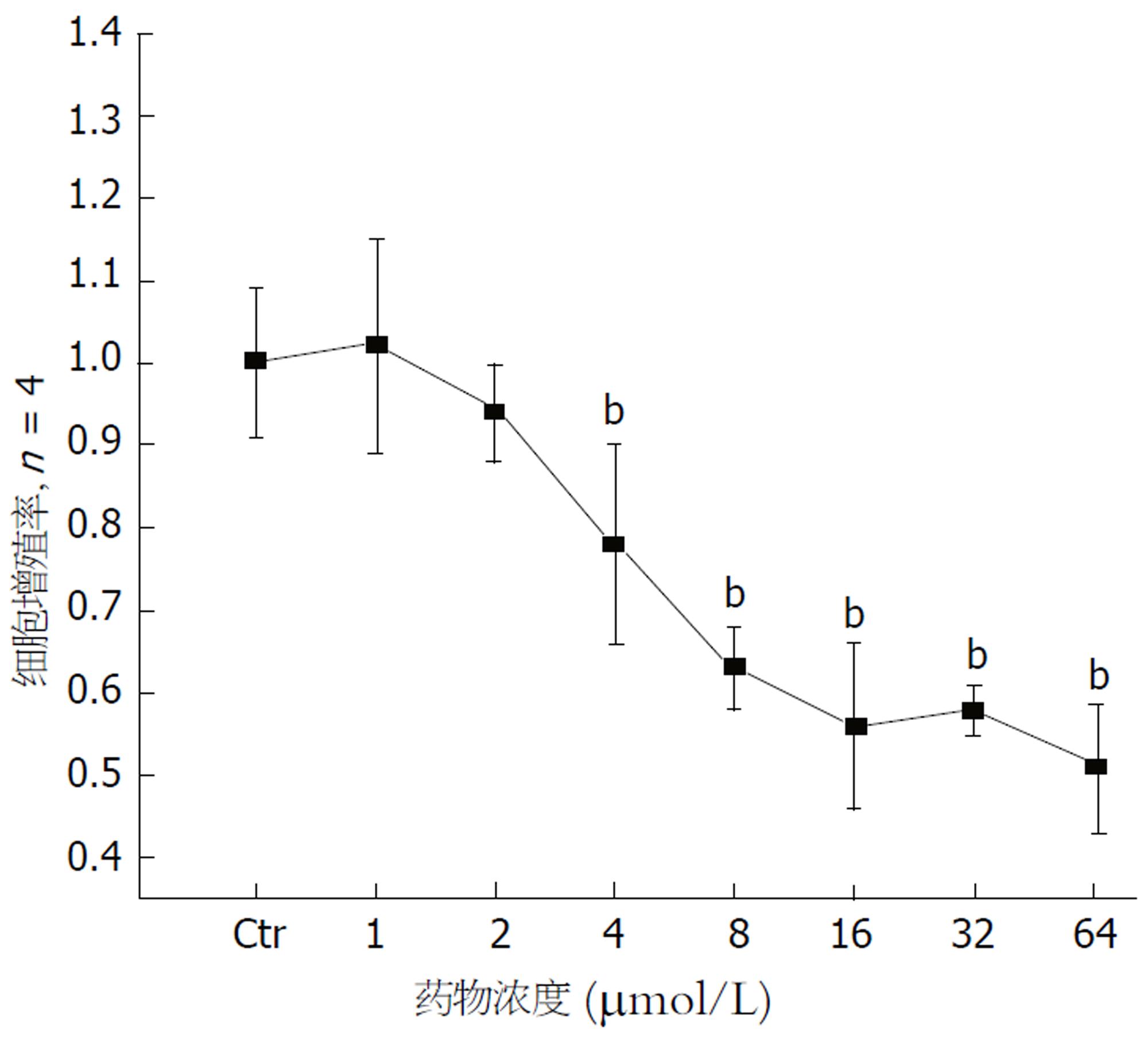
本次实验中, 我们首先采用MTT法观察Res从浓度1-64 μmol/L范围内, 药物对HSC-T6细胞增殖的抑制效应, 以筛选合适的药物浓度进行下一步实验. 结果表明, Res在浓度范围4-64 μmol/L(4 μmol/L Res 0.78±0.12, 8 μmol/L Res 0.63±0.05, 16 μmol/L Res 0.56±0.10, 32 μmol/L Res 0.58±0.03, 64 μmol/L Res 0.51±0.08 vs Ctr 1.00±0.09)对HSC-T6细胞均有显著的抑制效应, 与对照组比较具有统计学差异(P<0.01, 图1). 且Res浓度从16 μmol/L起, 药物对细胞增殖的抑制效果并不随浓度的增加而提高. 因此, 在后续实验中, 我们选取4、 8、 16 μmol/L三个浓度观察Res对HSC-T6抑制作用的机制.
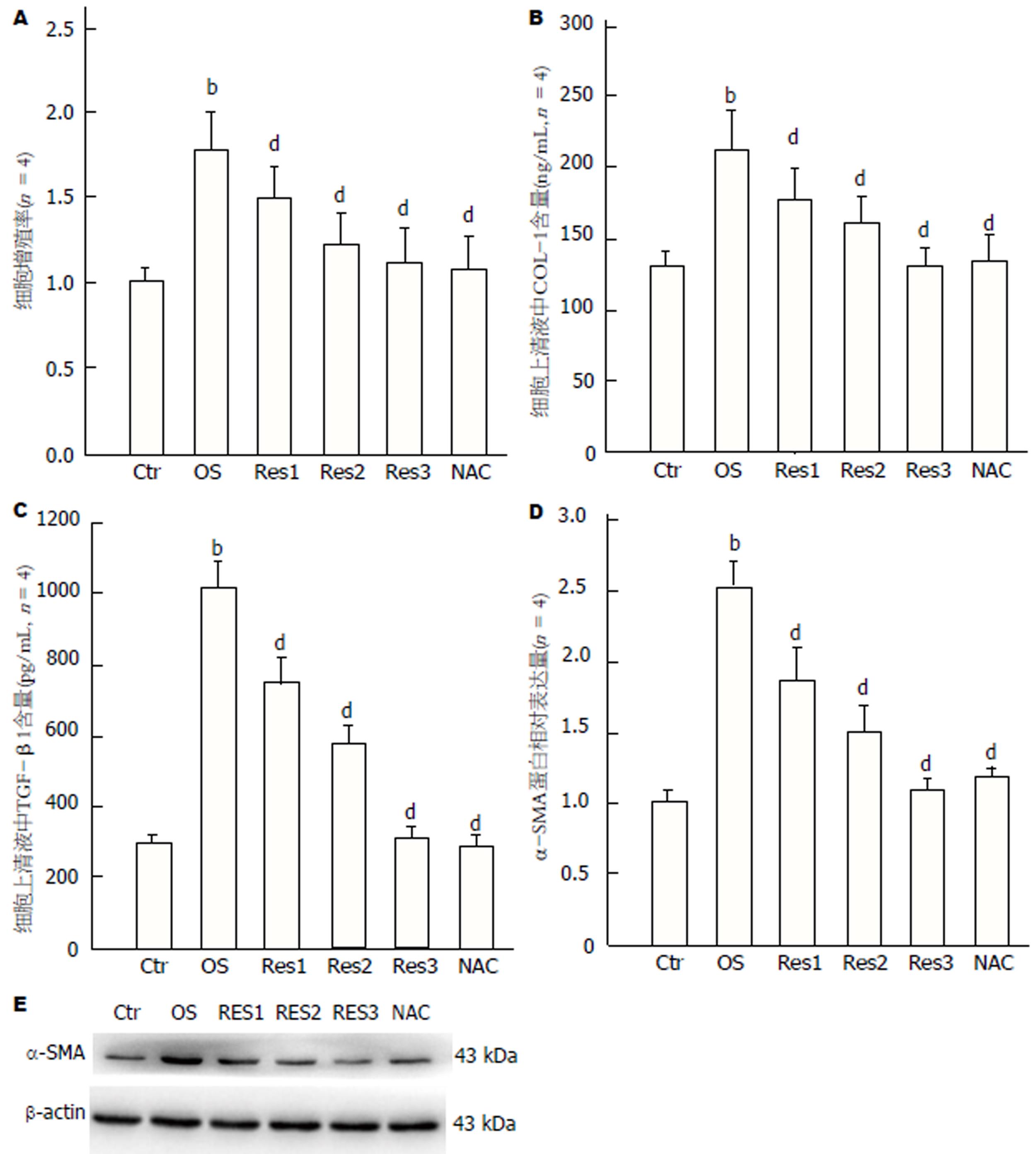
结果显示, 经氧化应激诱导后, HSC-T6细胞增殖率明显提高(OS 1.78±0.23 vs Ctr 1.00±0.07)(图2A), 细胞活化相关指标COL-1(OS 212.45±20.09 vs Ctr 130.78±8.76)(图2B)、TGF-β1(OS 1012.49±67.16 vs Ctr 296.38±22.07)(图2C)及α-SMA蛋白(OS 2.53±0.23 vs Ctr 1.00±0.05)(图2D, E)表达明显增多, 与对照组比较具有统计学差异(P<0.01). Res呈剂量依赖性抑制氧化应激诱导的HSC-T6细胞增殖与活化(增殖率: Res 4 μmol/L 1.49±0.13, Res 8 μmol/L 1.22±0.14, Res 16 μmol/L 1.09±0.18 vs OS 1.78±0.23)(COL-1: Res 4 μmol/L 177.37±20.84, Res 8 μmol/L 161.93±25.71, Res 16 μmol/L 129.28±12.04 vs OS 212.45±20.09)(TGF-β1: Res 4 μmol/L 749.82±59.95, Res 8 μmol/L 575.93±48.34, Res 16 μmol/L 306.74±21.18 vsOS 1012.49±67.16)(α-SMA: Res 4 μmol/L 1.86±0.18, Res 8 μmol/L 1.47±0.16, Res 16 μmol/L 1.08±0.13 vs OS 2.53±0.23), 与模型组比较, 均具有统计学差异(P<0.01). 阳性对照组(NAC)与模型组比较亦具有显著的抑制作用(P<0.01)(增殖率: NAC 1.06±0.09 vs OS 1.78±0.23)(COL-1: NAC 134.49±9.67 vs OS 212.45±20.09)(TGF-β1: NAC 287.88±24.58 vs OS 1012.49±67.16)(α-SMA: NAC 1.19±0.06 vs OS 2.53±0.23).
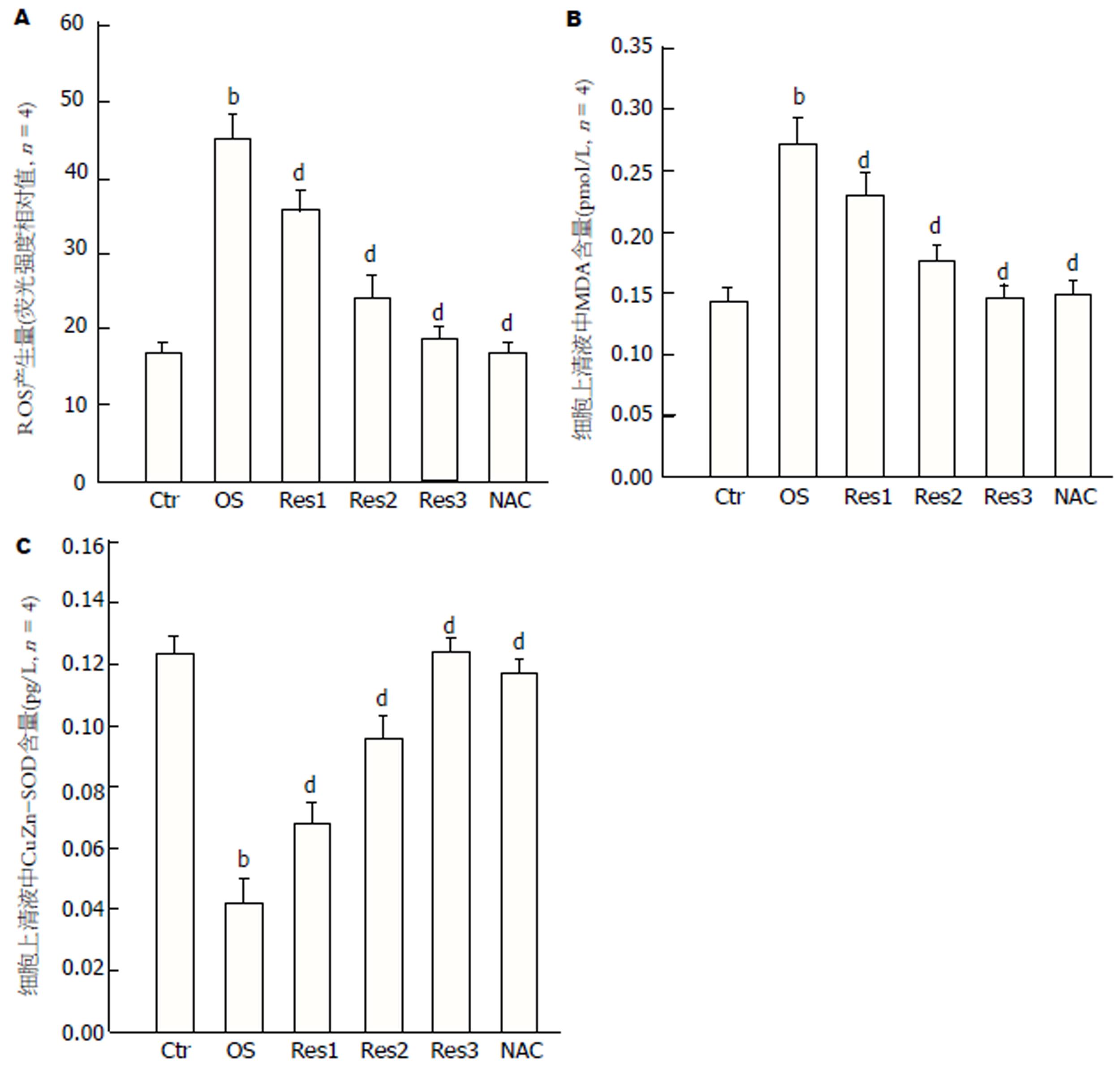
结果显示, 经氧化应激诱导后, HSC-T6细胞内ROS含量明显提高(OS 44.98±4.21 vs Ctr 16.86±2.17)(图3A), 细胞上清液中脂质过氧化终产物MDA含量(OS 0.272±0.014 vs Ctr 0.141±0.021)(图3B)明显提高, 抗氧化指标SOD活性(OS 0.042±0.006 vs Ctr 0.123±0.015)(图3C)明显下降, 与对照组比较具有统计学差异(P<0.01). Res呈剂量依赖性抑制过氧化氢诱导的HSC-T6细胞氧化应激状态(ROS: Res 4 μmol/L 35.56±2.05, Res 8 μmol/L 23.82±2.66, Res 16 μmol/L 18.74±1.46 vs OS 44.98±4.21)(MDA: Res 4 μmol/L 0.228±0.016, Res 8 μmol/L 0.174±0.012, Res 16 μmol/L 0.146±0.008 vs OS 0.272±0.014)(SOD: Res 4 μmol/L 0.068±0.006, Res 8 μmol/L 0.095±0.004, Res 16 μmol/L 0.122±0.010 vs OS 0.042±0.006), 与模型组比较, 均具有统计学差异(P<0.01). NAC与模型组比较亦具有显著的抑制作用(P<0.01)(ROS: NAC 16.90±1.22 vs OS 44.98±4.21)(MDA: NAC 0.150±0.010 vs OS 0.272±0.014)(SOD: 0.117±0.008 vs OS 0.042±0.006).
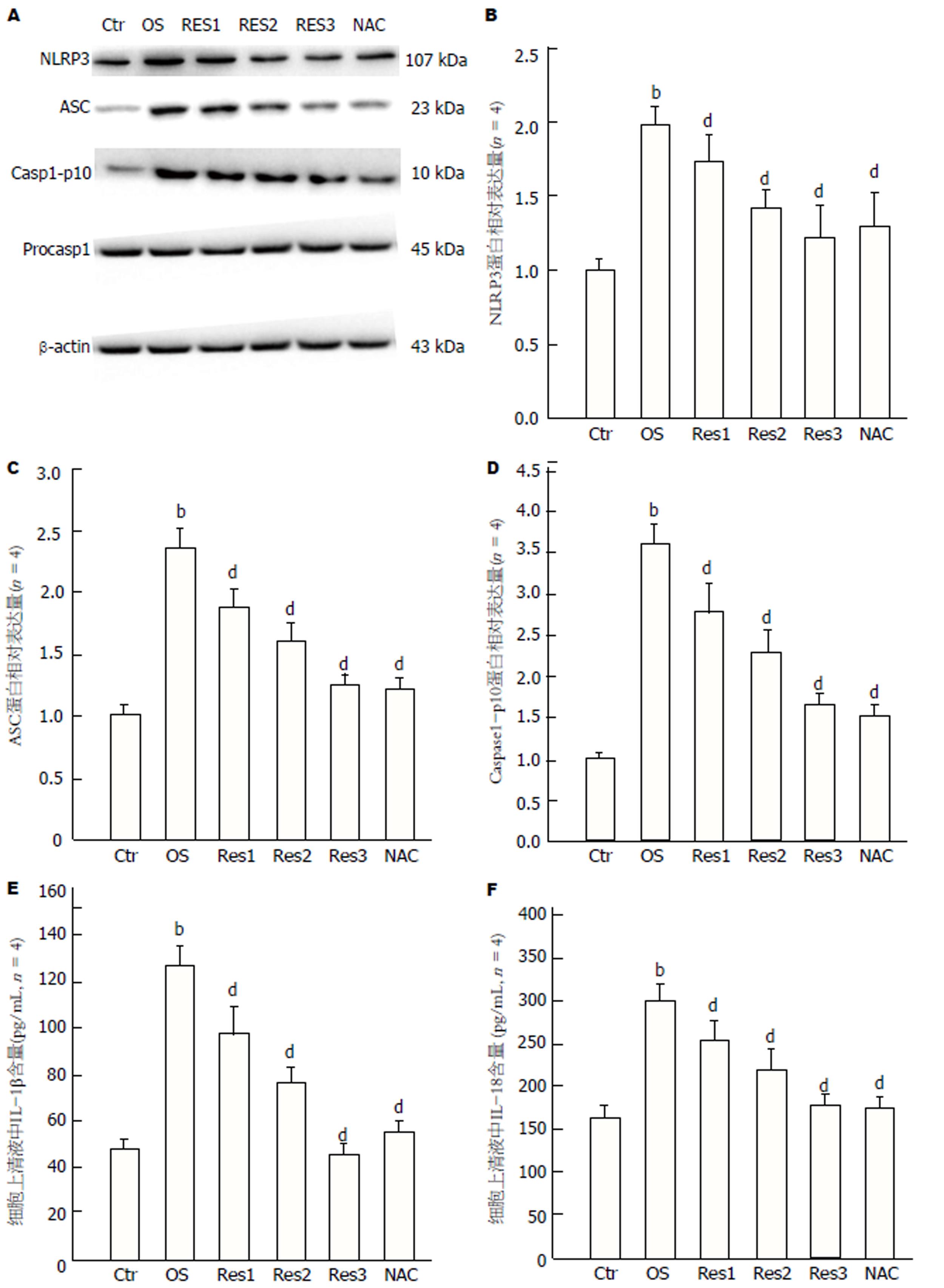
结果(图4A)显示, 经氧化应激诱导后, HSC-T6细胞内NLRP3(OS 1.97±0.25 vs Ctr 1.00±0.14)(图4B)、ASC(OS 2.36±0.19 vs Ctr 1.00±0.06)(图4C)、caspase-p10(OS 3.62±0.28 vs Ctr 1.00±0.09)(图4D)蛋白表达明显提高, 细胞上清液中IL-1β(OS 126.77±9.75 vs Ctr 48.69±3.16)(图4E)和IL-18(OS 299.84±34.18 vs Ctr 164.32±10.66)(图4F)含量明显增多, 与对照组比较具有统计学差异(P<0.01). Res呈剂量依赖性抑制活化HSC-T6细胞内NLRP3炎性体及其下游效应因子的表达(NLRP3: Res 4 μmol/L 1.74±0.16, Res 8 μmol/L 1.42±0.08, Res 16 μmol/L 1.21±0.17 vs OS 1.97±0.25)(ASC: Res 4 μmol/L 1.88±0.22, Res 8 μmol/L 1.60±0.06, Res 16 μmol/L 1.25±0.08 vs OS 2.36±0.19)(caspase1-p10: Res 4 μmol/L 2.77±0.32, Res 8 μmol/L 2.29±0.24, Res 16 μmol/L 1.64±0.12 vs OS 3.62±0.28)(IL-1β: Res 4 μmol/L 97.45±6.38, Res 8 μmol/L 76.63±7.52, Res 16 μmol/L 46.31±3.19 vs OS 126.77±9.75)(IL-18: Res 4 μmol/L 253.59±24.47, Res 8 μmol/L 219.73±23.81, Res 16 μmol/L 178.25±12.39 vs OS 299.84±34.18), 与模型组比较, 均具有统计学差异(P<0.01). NAC与模型组比较亦具有显著的抑制作用(P<0.01)(NLRP3: NAC 1.29±0.11 vs OS 1.97±0.25)(ASC: NAC 1.21±0.14 vs OS 2.36±0.19)(caspase1-p10: NAC 1.48±0.08 vs OS 3.62±0.28)(IL-1β: NAC 55.14±4.46 vs OS 126.77±9.75)(IL-18: NAC 173.98±15.92 vs OS 299.84±34.18). Pro-caspase-1蛋白表达各组间均无显著差异(P>0.05).
HF是严重威胁人类健康疾病之一肝硬化的发病重要环节. 多种致病因素诸如病毒、细菌、寄生虫、化学毒物、药物、酒精、自身免疫等都能引起肝脏炎症的发生致肝细胞的受损, 在多因素参与下导致HF的发生, 甚至进展为肝硬化. HF是一个动态的病理过程, 及早干预炎症-肝细胞损伤-HF-肝硬化的进程, 打破肝硬化发生发展的这条"死亡链"成为肝病研究领域的难点与热点.
NLRP3炎性体是一类相对分子质量约为700000的大分子蛋白复合体, 由NLRP3、ASC和caspase-1组成, 在细胞质内发挥外源性微生物或内源性危险信号感受器的作用. NLRP3炎性体通过激活caspase-1, 促进IL-1β和IL-18促炎因子的加工和成熟而发挥生物学效应, 参与机体的固有免疫反应, 并且介导宿主细胞形成细胞膜微孔导致细胞肿胀和渗透性溶解, 形成一种介于坏死和凋亡(apoptosis)之间的细胞死亡形式, 称为"pyroptosis"[1]. 与凋亡不同, pyroptosis依赖于caspase1的激活, 其特征为细胞膜上形成微孔和囊泡, 细胞肿胀、破裂, 分泌促炎症反应细胞因子和释放细胞质成分至细胞外而引起炎症反应, 是促炎症反应的细胞程序性死亡方式. 目前有研究发现, 在非酒精性脂肪性肝炎、酒精性脂肪性肝炎、肝脏缺血再灌注损伤、药物性肝损伤及HF[7-12]等急慢性肝脏疾病的发生发展过程中都存在有NLRP3炎性体的激活. 这是否意味着在肝炎-肝细胞损伤-HF的演变过程中, NLRP3炎性体活化持续存在? 近期发表在Hepatology上的文献[2]报道, NLRP3转基因小鼠肝脏中存在着炎症-损伤-纤维化的演变过程. NLRP3炎性体活化似乎是肝脏炎症、损伤、纤维化的共同致病机制.
HF的进展过程是肝脏中多种细胞综合作用的结果. 传统的观点认为, HSC的激活是纤维化发生、发展的中心环节. 正常情况下HSC处于静止状态, 他在肝脏中的生理功能主要有参与维生素A的代谢, 储存脂肪的功能, HSC的胞浆中含有类视黄醇物质的脂滴, 是维生素A的主要储存处, HSC还有调节血管和肝窦血流的作用. 在病理条件下如肝脏受到物理、化学及病毒感染生物因素的刺激时, HSC增殖并激活, 转变为"肌成纤维细胞", 表达α-SMA、合成ECM, 导致纤维化的发生发展. 而肝细胞的受损及库普弗细胞的激活所释放的生长因子、炎症因子、活性氧自由基等是激活HSC的关键因素[13,14]. 研究发现[2,13], NLRP3炎性体在肝脏多种细胞中都有表达, 在库普弗细胞和窦内皮细胞中表达最多, 其次是门脉周围的肌成纤维细胞和HSC, 而在原代肝细胞中几乎不表达. 然而从胆总管结扎诱导的HF大鼠肝细胞中, 却发现NLRP3的表达明显增加; 另外, 使用LPS及H2O2激活HSC后NLRP3的表达亦会显著增加. 这也充分说明在炎症加重肝损伤和HF的同时, 在细胞水平不仅仅有巨噬细胞NLRP3的活化, 肝细胞及HSC中NLRP3的活化也参与了这一过程. 然而, NLRP3的活化是如何加重HF进程的, 是否与促进HSC的活化相关, 至今并未有相关文献报道.
众所周知, ROS的产生是机体或细胞内氧自由基的产生与清除失衡所导致的, 他在肝炎-肝损伤-HF过程中始终存在并且扮演了十分重要的角色. 目前实验证实[15], ROS作为细胞的第二信使参与了对NLRP3炎性体活化过程的调节, 并且抑制ROS的产生能够有效的减少活化的NLRP3. 因此, ROS被认为是NLRP3炎性体活化的关键上游效应因子. 然而, 机体内ROS的来源途径很多, 主要有线粒体途径与NADPH氧化酶途径. 研究证实线粒体来源的ROS对NLRP3的激活具有诱导作用, 而非NADPH氧化酶途径来源[16]. 目前线粒体ROS激活NLRP3炎性体的过程已被许多动物模型(结肠炎、间质性肾炎)[17,18], 及细胞模型(巨噬细胞、支气管上皮细胞)[19,20]等所证实. 然而, 在HF模型中是否也能够复制出相同的线粒体ROS-NLRP3通路, 肝细胞、HSC中是否也存在同样的线粒体ROS-NLRP3途径, 目前并见报道. 本次研究采用过氧化氢诱导HSC-T6细胞氧化应激模型, 再次证实ROS能够活化HSC-T6细胞中NLRP3炎性体及其下游效应分子, 初步证实HSC-T6细胞中NLRP3炎性体活化对HF进展具有促进作用. 但肝脏中激活NLRP3的ROS是否为线粒体来源仍需实验进一步证实.
中医药在抗HF方面具有独特优势. 大量的临床实践和实验研究表明, 一些中药复方、单味中药及中药单体已经被证实抗HF疗效肯定, 不良反应少. Res是提取自中药虎杖的主要活性成分, 具有显著的抗氧化应激作用[21]. 现代研究表明, 在整体水平, Res对四氯化碳、DMN、TAA等药物诱导的大鼠慢性HF均具有显著的改善作用, 可以明显降低血清中ALT、AST活性, 以及肝组织中羟脯氨酸及胶原化程度, 在一定程度上阻止或逆转HF的进程[22-25]. 在细胞水平, Res可以显著抑制HSC的增殖与活化, 阻止HSC转化为活化的肌成纤维细胞, 抑制其分泌胶原, 减少细胞外基质的生成, 从而改善纤维化[26]. 有研究认为, 其抗HSC的机制与其抗氧化应激的作用相关[27]. 亦有学者认为, Res是通过抑制Notch信号通路来调节HSC的活化[28]. 另外, 通过调节细胞内NF-κB及PI3K/Akt信号通路亦已被初步证实与Res的抗HF药理作用有关[29]. 本此研究中我们发现Res能够通过其抗氧化应激作用抑制其下游NLRP3炎性体活化, 从而达到抑制HSC-T6细胞增殖及活化的作用, 推测该作用可能是Res抗HF的机制之一, 但尚需动物实验证实. 白藜芦醇具有多途径对靶点防治HF的药理作用, 但仍需要进一步深入研究, 从而为其在临床上的应用推广提供可靠的实验依据.
白藜芦醇(resveratrol, Res)是提取自中药虎杖的主要活性成分, 其在体内外均具有显著的抗肝纤维化作用. 有研究表明, 活性氧(reactive oxygen species, ROS)所致的Nod样受体蛋白3(nod-like receptor protein 3, NLRP3)炎性体活化可能参与肝纤维化(hepatic fibrosis, HF)的整个形成过程. 然而, 目前有关Res是否能通过抑制NLRP3炎性体调节肝星状细胞(hepatic stellate cell, HSC)-T6细胞的增殖与活化暂未见相关报道. 故本研究旨在深入研究Res对HSC-T6活化的影响及其作用机制与NLRP3炎性体的关系.
目前对Res抗HF的机制研究较少, 而Res已被证实为疗效明确的抗HF药物, 故而, 本次是实验通过研究Res对HSC-T6增殖与活化的影响及其作用机制与NLRP3炎性体的关系. 初步探讨其分子机制及药物靶点, 为其在临床上的应用推广提供可靠的实验依据.
本次实验拟初步证实Res对HSC-T6细胞的增殖与活化的抑制作用与其调节ROS-NLRP3炎性体活化有关. 本研究初步明确了Res抗HSC的分子机制, 为进一步深化研究Res的药理学机制, 为中医药现代化研究作出了一定的贡献.
本次实验通过体外培养大鼠HSC系HSC-T6, 采用过氧化氢制作氧化应激模型, Res低、中、高浓度进行药物干预, 乙酰半胱氨酸作为阳性对照药物. 实验中涉及MTT、ELISA、荧光酶标仪、Western blot等检测技术, 实现对HSC-T6细胞增殖活化、氧化应激及NLRP3炎性体等相关指标的检测.
本次实验基本完成预期目标. 结果发现, Res能够呈剂量依赖性抑制过氧化氢诱导的HSC-T6细胞增殖及活化过程, 并且能够抑制细胞氧化应激及其下游NLRP3炎性体活化. 研究结果完善了Res抗HSC的药理学作用机制.
本次研究发现Res对HSC-T6细胞的增殖活化的抑制作用可能与其抑制ROS活化的NLRP3炎性体有关. 通过总结既往Res抗氧化应激作用的研究, 进一步对其下游NLRP3炎性体展开研究, 不仅对ROS活化NLRP3炎性体这一理论重新在HSC中得以证实, 而且发现抑制ROS-NLRP3可能是Res的重要分子机制, 为Res作为临床抗HF药物的应用推广提供可靠的实验依据.
本次研究由于受经费及实验条件限制, 仅初步完成细胞水平有关实验, 对于动物水平的相关研究仍需进一步完善. 目前已有研究表明, 细胞自噬能够负调控ROS-NLRP3炎性体活化, 因此, 采用自噬检测相关技术, 进一步研究自噬在HSC中是否可以调节ROS-NLRP3炎性体将会是未来本课题组的重点研究方向.
学科分类: 胃肠病学和肝病学
手稿来源地: 上海市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 马亚娟 电编:闫晋利
| 1. | Fink SL, Cookson BT. Caspase-1-dependent pore formation during pyroptosis leads to osmotic lysis of infected host macrophages. Cell Microbiol. 2006;8:1812-1825. [PubMed] [DOI] |
| 2. | Wree A, Eguchi A, McGeough MD, Pena CA, Johnson CD, Canbay A, Hoffman HM, Feldstein AE. NLRP3 inflammasome activation results in hepatocyte pyroptosis, liver inflammation, and fibrosis in mice. Hepatology. 2014;59:898-910. [PubMed] [DOI] |
| 3. | 林 家禾. 白藜芦醇对大鼠肝纤维化的防治及相关机制的研究. 广州: 广州中医药大学 2009; . |
| 4. | 林 柳兵, 阙 任烨, 刘 进锴, 沈 艳婷, 陶 智会, 李 勇. 柴胡皂苷d对活化的HSC-T6细胞MMP-1、TIMP-1表达的影响及其分子机制. 世界华人消化杂志. 2016;24:1159-1165. |
| 6. | Que R, Shen Y, Ren J, Tao Z, Zhu X, Li Y. Estrogen receptorβdependent effects of saikosaponind on the suppression of oxidative stressinduced rat hepatic stellate cell activation. Int J Mol Med. 2018;41:1357-1364. [PubMed] [DOI] |
| 7. | Vandanmagsar B, Youm YH, Ravussin A, Galgani JE, Stadler K, Mynatt RL, Ravussin E, Stephens JM, Dixit VD. The NLRP3 inflammasome instigates obesity-induced inflammation and insulin resistance. Nat Med. 2011;17:179-188. [PubMed] [DOI] |
| 8. | Csak T, Ganz M, Pespisa J, Kodys K, Dolganiuc A, Szabo G. Fatty acid and endotoxin activate inflammasomes in mouse hepatocytes that release danger signals to stimulate immune cells. Hepatology. 2011;54:133-144. [PubMed] [DOI] |
| 9. | Petrasek J, Bala S, Csak T, Lippai D, Kodys K, Menashy V, Barrieau M, Min SY, Kurt-Jones EA, Szabo G. IL-1 receptor antagonist ameliorates inflammasome-dependent alcoholic steatohepatitis in mice. J Clin Invest. 2012;122:3476-3489. [PubMed] [DOI] |
| 10. | Zhu P, Duan L, Chen J, Xiong A, Xu Q, Zhang H, Zheng F, Tan Z, Gong F, Fang M. Gene silencing of NALP3 protects against liver ischemia-reperfusion injury in mice. Hum Gene Ther. 2011;22:853-864. [PubMed] [DOI] |
| 11. | Williams CD, Antoine DJ, Shaw PJ, Benson C, Farhood A, Williams DP, Kanneganti TD, Park BK, Jaeschke H. Role of the Nalp3 inflammasome in acetaminophen-induced sterile inflammation and liver injury. Toxicol Appl Pharmacol. 2011;252:289-297. [PubMed] [DOI] |
| 13. | Kusano KF, Pola R, Murayama T, Curry C, Kawamoto A, Iwakura A, Shintani S, Ii M, Asai J, Tkebuchava T. Sonic hedgehog myocardial gene therapy: tissue repair through transient reconstitution of embryonic signaling. Nat Med. 2005;11:1197-1204. [PubMed] [DOI] |
| 14. | Williams JA. Hedgehog and spinal cord injury. Expert Opin Ther Targets. 2005;9:1137-1145. [PubMed] [DOI] |
| 15. | Martinon F, Mayor A, Tschopp J. The inflammasomes: guardians of the body. Annu Rev Immunol. 2009;27:229-265. [PubMed] [DOI] |
| 16. | Zhou R, Yazdi AS, Menu P, Tschopp J. A role for mitochondria in NLRP3 inflammasome activation. Nature. 2011;469:221-225. [PubMed] [DOI] |
| 17. | Guo W, Liu W, Jin B, Geng J, Li J, Ding H, Wu X, Xu Q, Sun Y, Gao J. Asiatic acid ameliorates dextran sulfate sodium-induced murine experimental colitis via suppressing mitochondria-mediated NLRP3 inflammasome activation. Int Immunopharmacol. 2015;24:232-238. [PubMed] [DOI] |
| 18. | Liu D, Xu M, Ding LH, Lv LL, Liu H, Ma KL, Zhang AH, Crowley SD, Liu BC. Activation of the Nlrp3 inflammasome by mitochondrial reactive oxygen species: a novel mechanism of albumin-induced tubulointerstitial inflammation. Int J Biochem Cell Biol. 2014;57:7-19. [PubMed] [DOI] |
| 19. | Ding Z, Liu S, Wang X, Dai Y, Khaidakov M, Deng X, Fan Y, Xiang D, Mehta JL. LOX-1, mtDNA damage, and NLRP3 inflammasome activation in macrophages: implications in atherogenesis. Cardiovasc Res. 2014;103:619-628. [PubMed] [DOI] |
| 20. | Kim SR, Kim DI, Kim SH, Lee H, Lee KS, Cho SH, Lee YC. NLRP3 inflammasome activation by mitochondrial ROS in bronchial epithelial cells is required for allergic inflammation. Cell Death Dis. 2014;5:e1498. [PubMed] [DOI] |
| 24. | Lee ES, Shin MO, Yoon S, Moon JO. Resveratrol inhibits dimethylnitrosamine-induced hepatic fibrosis in rats. Arch Pharm Res. 2010;33:925-932. [PubMed] [DOI] |
| 25. | Hessin AF, Hegazy RR, Hassan AA, Yassin NZ, Kenawy SA. Resveratrol prevents liver fibrosis via two possible pathways: Modulation of alpha fetoprotein transcriptional levels and normalization of protein kinase C responses. Indian J Pharmacol. 2017;49:282-289. [PubMed] [DOI] |
| 26. | Souza IC, Martins LA, Coelho BP, Grivicich I, Guaragna RM, Gottfried C, Borojevic R, Guma FC. Resveratrol inhibits cell growth by inducing cell cycle arrest in activated hepatic stellate cells. Mol Cell Biochem. 2008;315:1-7. [PubMed] [DOI] |
| 28. | Tanriverdi G, Kaya-Dagistanli F, Ayla S, Demirci S, Eser M, Unal ZS, Cengiz M, Oktar H. Resveratrol can prevent CCl₄-induced liver injury by inhibiting Notch signaling pathway. Histol Histopathol. 2016;31:769-784. [PubMed] [DOI] |
| 29. | Zhang DQ, Sun P, Jin Q, Li X, Zhang Y, Zhang YJ, Wu YL, Nan JX, Lian LH. Resveratrol Regulates Activated Hepatic Stellate Cells by Modulating NF-κB and the PI3K/Akt Signaling Pathway. J Food Sci. 2016;81:H240-H245. [PubMed] [DOI] |