修回日期: 2018-01-14
接受日期: 2018-01-22
在线出版日期: 2018-02-18
探讨枳葛口服液对酒精性肝病模型大鼠的防治作用及分子机制.
以酒精灌胃加普通饲料造模酒精性肝损伤大鼠, 干预组酒精灌胃同时给予不同剂量(高、中、低剂量) 枳葛口服液, 对照组酒精灌胃同时给予解酒灵口服液. 12 wk后处死动物检测各组大鼠肝功、肝脏指数、脂质代谢、氧化应激及乙醇代谢酶活性等相关指标, 同时观察各组肝组织病理学变化.
相比正常组, 除高剂量组外, 各组大鼠肝脏指数、谷丙转氨酶、谷草转氨酶、总胆固醇、三酰甘油、乙醇脱氢酶(alcohol dehydrogenase, ADH)、乙醛脱氢酶(aldehyde dehydrogenase, ALDH)及CYP450 2E1含量均有明显变化(P<0.01或0.05), 且各组肝组织HE染色可见不同程度大面积的泡性脂肪空泡, 其中模型组和枳葛口服液低剂量组差异最大(P<0.01). 相比模型组, 各治疗组以上指标均呈现不同程度地逆转(P<0.01或0.05), 其中高剂量组逆转最显著(P<0.01). 枳葛口服液中剂量组疗效与解酒灵口服液对照组疗效近似(P>0.05).
枳葛口服液解酒护肝之功效可能与逆转ADH、ALDH等乙醇代谢酶活性进而抑制自由基、乙醛生成, 抑制机体氧化应激, 改善大鼠脂质代谢紊乱等密切相关.
核心提要: 枳葛口服液, 其组成药方主要含枳椇子、葛根、山楂等几味纯中药的解酒经验组方, 对长期大量饮酒造成的酒精性肝损伤具有良好的预防效果, 枳葛口服液的解酒护肝之功效可能与逆转乙醇代谢酶活性, 抑制机体氧化应激, 改善大鼠脂质代谢紊乱等密切相关.
引文著录: 侯英, 刘友平, 李志, 李波, 杨国川, 魏嵋. 枳葛口服液防治大鼠酒精性肝病的相关机制. 世界华人消化杂志 2018; 26(5): 296-304
Revised: January 14, 2018
Accepted: January 22, 2018
Published online: February 18, 2018
To explore the preventive and therapeutic effects of Zhige oral solution on alcoholic liver disease in rats and the underlying mechanisms.
Ninety male SD rats were randomly divided into six groups: a normal group, a model group, a positive control group, and three intervention groups. The normal group was only given distilled water at 1.0 mL per 100 g/d by gavage, and the other groups were given 52% Luzhou Laobaigan 1.0 mL per 100 g/d by gavage. In addition, the intervention groups were also given different doses (low, medium, and high) of Zhige oral solution and the positive control group was given Jiejiuling oral solution. All groups were allowed free access to water, and fed a normal diet. All the rats were killed at the end of the 12th week. Hematoxylin and eosin (HE) staining was used to observe the structural changes of liver tissue. Serum levels of alanine aminotransferase (ALT), aspartate aminotransferase (AST), triglycerides (TG), and total cholesterol (TC) were measured with an automatic biochemical analyzer. Serum levels of alcohol dehydrogenase (ADH) and aldehyde dehydrogenase (ALDH) were detected by enzyme-linked immunosorbent assay (ELISA). The contents of TC and TG in the liver were measured by colorimetric assay. The protein expression of cytochrome P450 2E1 (CYP450 2E1) in the liver was detected by Western blot.
Compared with the normal group, the liver index and the levels of ALT, AST, TC, TG, ADH, ALDH, and CYP450 2E1 were significantly altered in all groups except the high-dose group (P < 0.01 or 0.05), with the model group and low-dose group exhibiting the most significant changes (P < 0.01). Varying degrees of fat vacuolation can be seen in the liver in all groups. Compared with the model group, all the tested indicators above showed varying degrees of reversal in the positive control group and the three intervention groups (P < 0.01 or 0.05), and the reverse effect was best in the high-dose group (P < 0.01). The therapeutic effect of the medium-dose group was similar to that of the positive control group (P > 0.05).
The anti-alcoholic and liver-protective effects of Zhige oral solution may be related to reversing the activities of ADH, ALDH, and other enzymes, inhibiting free radicals and acetaldehyde production, reducing oxidative stress, and improving lipid metabolism disorder in rats.
- Citation: Hou Y, Liu YP, Li Z, Li B, Yang GC, Wei M. Mechanisms for Zhige oral solution to prevent and treat alcoholic liver disease in rats. Shijie Huaren Xiaohua Zazhi 2018; 26(5): 296-304
- URL: https://www.wjgnet.com/1009-3079/full/v26/i5/296.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i5.296
酒精性肝病(alcoholic liver disease, ALD)是指长期大量饮酒后所出现的肝脏病理性损伤, 从病理形态学上将ALD分为以下几种形式: 即轻症ALD、酒精性脂肪肝、酒精性肝炎、酒精性肝纤维化和肝硬化等[1-3], 且这几种形式是循序渐进发展的. 因此如何有效预防酒精性肝损伤的发生发展是现代医学研究的热点之一. 研究显示中医药在治未病方面取得了较好的成效, 所谓治未病即未病养生防病于先、欲病施治防微杜渐, 对于酒精性肝病的防治也不例外[4,5]. 西南医科大学附属中医医院全国中西医结合肝病著名专家孙同郊教授勤求古训, 博采众医家之长, 认为酒含湿热之毒, 湿热隐伏于血分, 最终导致肝脾肾三脏的亏虚及气血的虚损性改变. 鉴于以上理解并经过几十年的临床探索, 孙同郊教授总结出了具有明显解酒护肝、健脾利湿活血之功效的解酒经验方--枳葛口服液, 对长期大量饮酒造成的醉酒及预防酒精性肝损伤收到良好的效果, 但具体作用机制不详. 西医认为ALD的发病机制复杂, 主要与酒精代谢、氧化应激、免疫调节、脂质代谢等有关[6,7]. 为了探讨枳葛口服液的解酒保肝机制, 本研究侧重观察枳葛口服液对酒精性肝损伤模型大鼠乙醇代谢酶活性、氧化应激及脂质代谢的影响.
1.1.1 实验动物及药品: 清洁级SD♂大鼠共90只, 体质量170-210 g, 由西南医科大学实验动物中心提供. 枳葛口服液由西南医科大学附属中医医院制剂室提供, 规格20 mL×6支/盒, 处方组成有枳椇子、葛根、山楂等, 有效期2年, 批号20151026. 解酒灵口服液由黄石市今阳保健品厂提供, 规格10 mL×6支/盒, 处方组成有甘草、枸杞子等, 有效期18 mo, 生产批号20150401.
1.1.2 试剂: 泸州老白干购自中国•泸州老窖股份有限公司, 酒精度52%VOL, 生产批号20150604; 普通饲料由西南医科大学实验动物中心提供; 苏木素-伊红(hematoxylin and eosin, HE)染液及丙氨酸氨基转移酶(alartine arninotransferase, ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)、甘油三酯(triglycerides, TG)、总胆固醇(total cholesterol, TC)测定试剂盒均购自南京建成生物工程研究所; 乙醇脱氢酶(alcohol dehydrogenase, ADH)、乙醛脱氢酶(aldehyde dehydrogenase, ALDH)ELISA检测试剂盒购自上海桥杜试剂公司; 抗细胞色素P450 2E1(cytochrome P450 2E1, CYP450 2E)抗体购自abcam试剂公司.
1.2.1 造模及给药: SD♂大鼠90只适应性喂养1 wk后随机分为6组: 正常组、ALD动物模型组(模型组)、枳葛口服液高剂量组(高剂量组)、枳葛口服液中剂量组(中剂量组)、枳葛口服液低剂量组(低剂量组)及解酒灵口服液阳性对照组(对照组), 每组15只. 每天9时灌胃: 正常组采用蒸馏水灌胃1.0 mL/100 g/d, 其余每组均给予52%泸州老白干灌胃1.0 mL/100 g/d, 同时高、中、低剂量3组各分别灌服枳葛口服液1.0 mL/100 g/d、0.5 mL/100 g/d和0.25 mL/100 g/d(1.0 mL/100 g/d用药量与人体体质量当量相当), 对照组灌胃解酒灵口服液0.5 mL/100 g/d. 以上各组均自由饮水, 普通饲料, 每天20 h以后禁食不禁水, 持续12 wk.
1.2.2 标本采集及相应指标检测: 最后1次给药后12 h禁食, 用1%戊巴比妥钠按照0.4 mL/100 g体质量腹腔注射麻醉, 腹主动脉取血后, 4 ℃冰箱放置12 h后离心留取血清, -80 ℃冰箱保存, 全自动生化分析仪检测血清ALT、AST、TG、TC等指标含量, ELISA检测ADH及ALDH; 肝脏称重(肝脏指数 = 完整肝脏湿重/体质量×100%)后取部分肝左叶以4%甲醛固定, 采用HE染色观察肝组织的结构; 剩余肝组织采用比色法检测肝组织TC、TG含量, 采用Western blotting检测肝组织CYP450 2E1表达量(一抗为1:1000鼠来源抗P4502E1, 二抗为1:3000羊抗鼠HRP, 曝光显影结果采用Bandscan图像分析软件进行光密度积分值分析).
统计学处理 统计软件SPSS20.0进行数据分析, 定量资料采用均数及标准差表示, 组间对比采用单因素方差分析, 组间两两比较采用最小差异显著性法(least significance of difference, LSD), 检验水准α = 0.05, 当P<0.05时为差异具有统计学意义.
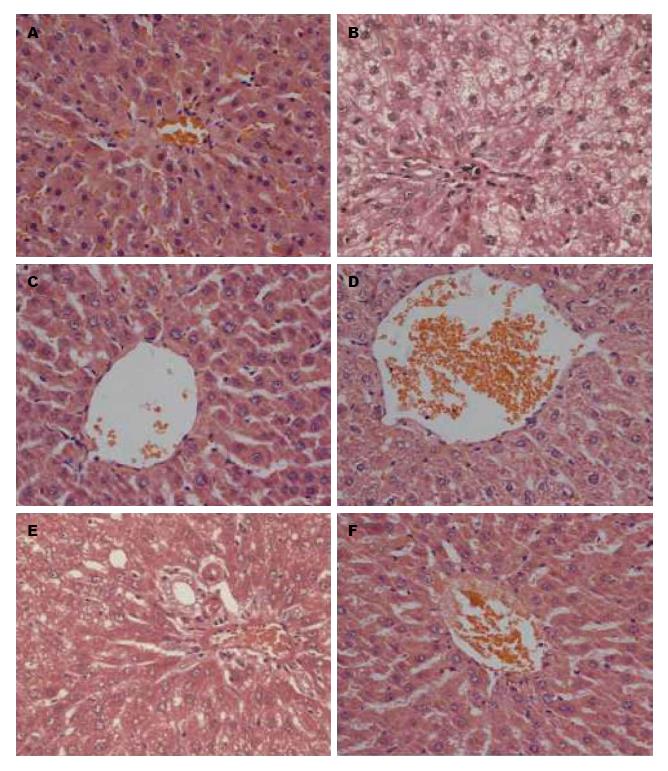
正常组大鼠肝小叶及细胞形状大小结构均匀, 边界分明、呈现放射状布列整齐规则; 模型组大鼠肝小叶结构不规则, 边界模糊, 细胞内可见大面积大小泡性脂肪空泡, 部分细胞核偏移; 高剂量组肝细胞结构接近正常组; 与模型组相比, 中剂量组和对照组均有所改善; 模型组和低剂量组基本类似(图1) .
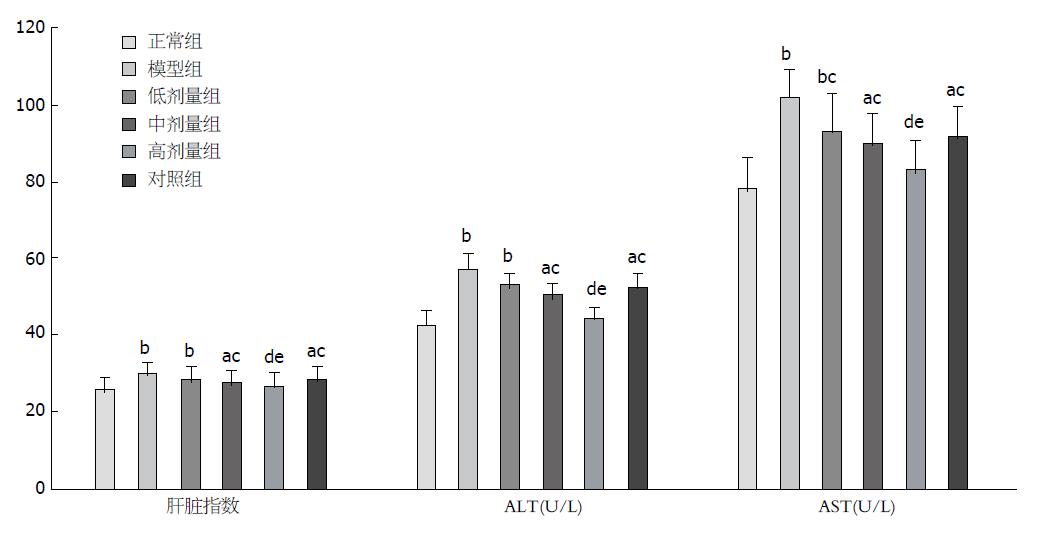
与正常组比较, 除高剂量组外各组肝脏指数均显著升高(P<0.01或0.05), 其中模型组和低剂量组升高最为明显(P<0.01). 与模型组比较, 各组肝脏指数在高、中、低剂量组及对照组均有所下降, 但下降趋势分别呈现一定的递减趋势: 即枳葛口服液高剂量组下降最为明显(P<0.01), 几乎接近正常组; 其次是中剂量组及对照组(P<0.05); 低剂量组降低最不显著. 与解酒灵口服液对照组比较, 仅高剂量组肝脏指数有显著性差异(P<0.05), 中、低剂量组差异无明显统计学意义(P>0.05, 表1, 图2). 与正常组比较, 除高剂量组外各组血清ALT、AST含量均显著升高(P<0.01或0.05), 其中模型组和低剂量组升高最为明显(P<0.01). 与模型组比较, ALT、AST血清含量在高、中、低剂量组及对照组均有所下降, 且组间下降趋势同以上肝脏指数的下降趋势: 即枳葛口服液高剂量组下降最为明显(P<0.01), 其次是中剂量组及对照组(P<0.05), 低剂量组降低最不显著. 同样与解酒灵口服液对照组比较, 仅高剂量组血清ALT、AST含量有显著性差异(P<0.05), 中、低剂量组差异无明显统计学意义(P>0.05, 表1, 图2).
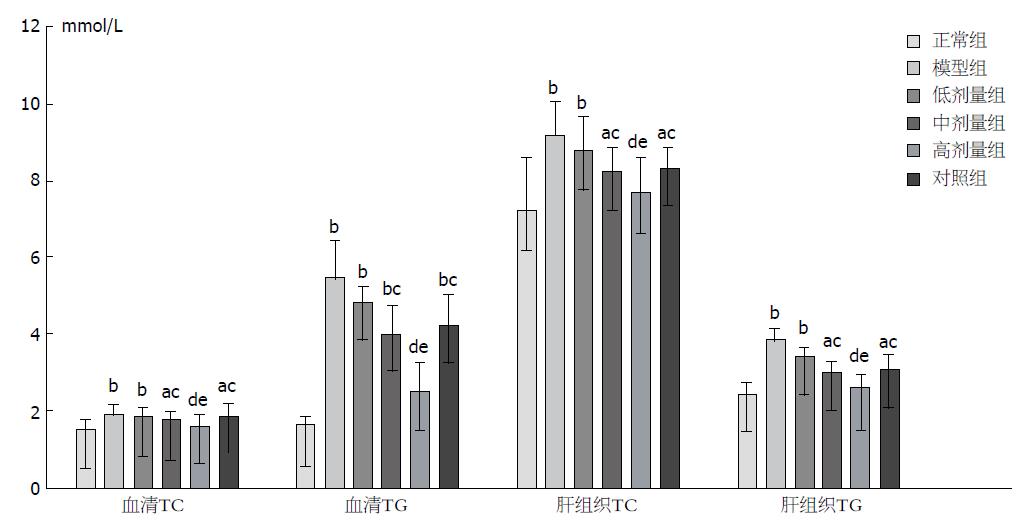
与正常组比较, 除高剂量组外各组血清TC、TG及肝组织TC、TG含量均显著升高(P<0.01或0.05), 其中模型组和低剂量组升高最为明显(P<0.01). 与模型组比较, 血清TC、TG及肝组织TC、TG含量在高、中、低剂量组及对照组均有所下降, 且组间下降趋势及组间比较显著性差异性比较均同以上肝脏指数及肝功指标下降趋势. 同样与解酒灵口服液对照组比较, 仅高剂量组血清TC、TG及肝组织TC、TG含量有显著性差异(P<0.05), 中、低剂量组差异无明显统计学意义(P>0.05, 表2, 图3).
| 分组 | 血清TC | 血清TG | 肝组织TC | 肝组织TG |
| 正常组 | 1.58 ± 0.24 | 0.17 ± 0.02 | 7.25 ± 1.41 | 2.48 ± 0.33 |
| 模型组 | 1.98 ± 0.24b | 0.55 ± 0.10b | 9.22 ± 0.88b | 3.91 ± 0.30b |
| 高剂量组 | 1.67 ± 0.22de | 0.26 ± 0.04de | 7.71 ± 0.90de | 2.68 ± 0.23de |
| 中剂量组 | 1.84 ± 0.22ac | 0.41 ± 0.07bc | 8.28 ± 0.65ac | 3.08 ± 0.26ac |
| 低剂量组 | 1.93 ± 0.29b | 0.49 ± 0.07b | 8.83 ± 0.93b | 3.49 ± 0.33b |
| 对照组 | 1.91 ± 0.34ac | 0.43 ± 0.08bc | 8.37 ± 0.54ac | 3.15 ± 0.36ac |
| F值 | 3.59 | 34.67 | 6.69 | 30.36 |
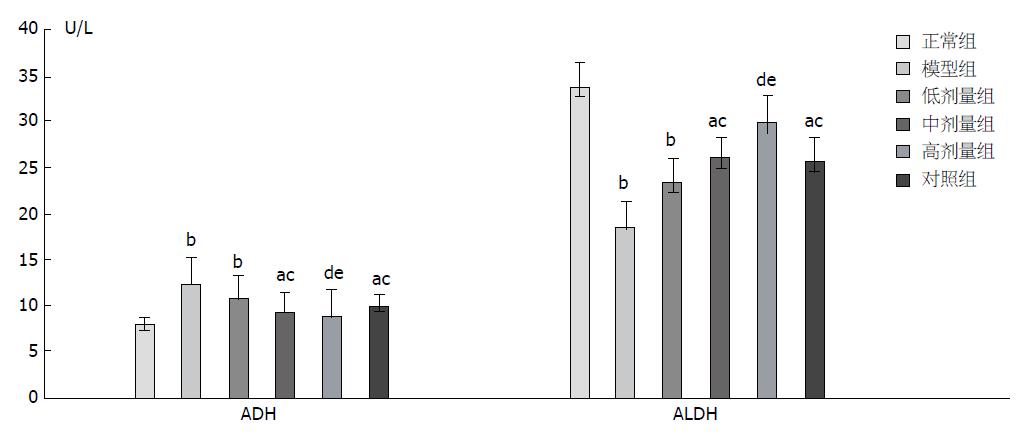
与正常组比较, 模型组及中、低剂量组ADH值升高明显(P<0.05), 高剂量组升高不明显(P>0.05); 与模型组比较, 高、中、低剂量组ADH值均下降, 其中高、中剂量组具有统计学意义(P<0.05), 低剂量组ADH值无统计学差异(P>0.05); 与正常组比较, 模型组及中、低剂量组ALDH值显著降低(P<0.05), 高剂量组降低不明显(P>0.05); 与模型组相比, 高、中、低剂量组ALDH的含量均上升, 其中高、中剂量组差异具有统计学意义(P<0.05), 低剂量组无统计学意义(P>0.05, 表3, 图4).
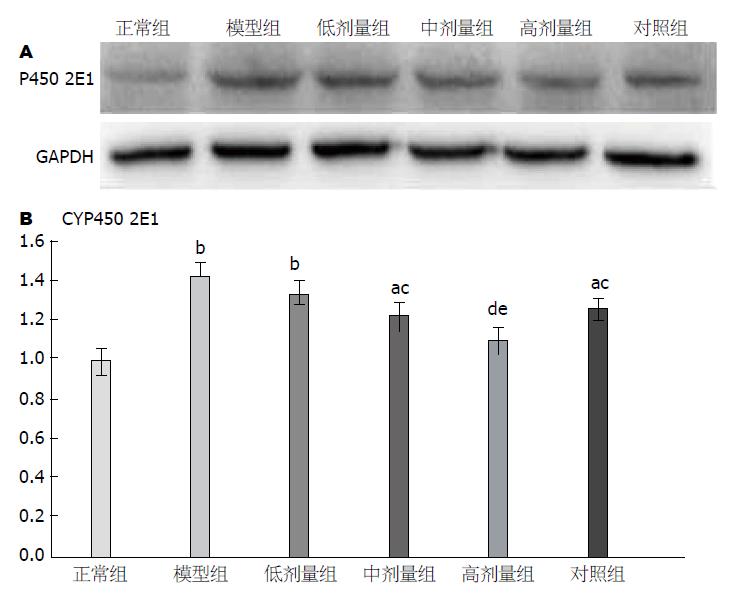
与正常组比较, 除高剂量组外各组CYP450 2E1表达量均显著升高(P<0.01或0.05), 其中模型组和低剂量组升高最为明显(P<0.01). 与模型组比较, CYP450 2E1表达量在高、中、低剂量组及对照组均有所下降, 且组间下降趋势及组间显著差异性比较均同以上指标呈下降趋势. 与解酒灵口服液对照组比较, 差异均无明显统计学意义(P>0.05, 表4, 图5).
ALD的发病机制尽管十分复杂, 但诱因肯定是乙醇及其代谢产物. 肝脏为乙醇代谢的主要场所, 在一系列乙醇代谢酶系(即ADH、ALDH、CYP450 2E1)作用下会产生大量的氧自由基及乙醛等有害物质[8,9], 这些有害物质将导致肝细胞膜及线粒体脂质过氧化反应、脂质代谢紊乱等最终造成肝组织细胞损伤[10,11]. 本研究通过单纯酒精性肝损伤大鼠模型观察枳葛口服液的解酒护肝机制发现: 与正常组比较, 模型组大鼠肝脏指数及肝功指标ALT、AST均显著升高(P<0.01), 肝组织HE染色可见细胞内大面积的泡性脂肪空泡(表1, 图1及图2), 这与其他相关实验较一致[12-14], 说明酒精性肝损伤造模成功; 同时在模型组发现, 相比正常组, 乙醇代谢酶ALDH表现为显著降低(P<0.01), 而ADH及CYP450 2E1均显著升高(P<0.01, 表3, 4及图4, 5), 血清TC、TG及肝组织TC、TG均明显升高(P<0.01, 表2, 图3). 由于ADH、CYP450 2E1升高及ALDH降低均可导致模型组大鼠机体产生大量氧自由基及大量乙醛堆积[15,16], 而乙醛和氧自由基都是导致肝损伤的罪魁祸首, 即二者均会引起肝细胞膜及肝线粒体脂质过氧化反应、脂质代谢明显紊乱最终致肝细胞损伤严重[17,18]. 其次P450 2E1是微粒体乙醇氧化酶体系的主要成分, 随着该酶的量和活性升高, 除了产生大量氧自由基及乙醛外, 还将诱导氧化应激反应, 进一步促成慢性酒精性肝病形成, 所以肝组织中P450 2E1活性越高, 肝组织损伤就越大[19]. 当给予乙醇刺激的同时给予不同剂量枳葛口服液并解酒灵口服液做对照时, 相比模型组各实验组大鼠肝脏指数、肝组织病理学、肝功、乙醇代谢酶活性、脂代谢紊乱以及氧化应激反应均得到了一定程度的转归(P<0.01或0.05), 其中高剂量枳葛口服液组转归最明显(P<0.01), 几乎接近正常组值. 对照组解酒灵口服液与中剂量枳葛口服液疗效相当(表1-3). 通过各组各数据柱状图发现, 以上所有数据在这六组中的变化趋势非常一致(图2-5). 说明一定剂量的枳葛口服液确实能在饮酒人群中起到一定的降脂保肝作用.
枳葛口服液组方有枳椇子、山楂、葛根等, 其中枳椇子、葛根为君药, 二者均有解酒毒、生津解郁之功效[20,21], 有研究发现, 葛花枳椇子均可降低血中乙醇浓度[22,23], 推测其可能增强了胃的首过代谢, 抑制了乙醇的胃肠道吸收进而抑制其在肝中的代谢[24]; 同时葛花还具有消除患者肝内活性氧成分以减少脂质过氧化反应[25], 使血清TC、TG的含量降低, 从而抑制糖脂代谢紊乱[26,27]以进一步改善肝功能之功效; 枳椇子水煎液还可以显著降低TC、TG[28,29]. 山楂可消食和胃、活血化瘀, 能够抑制机体氧化与炎症反应, 对酒精性肝损伤具有防治和保健的疗效[30], 同时山楂含有黄酮类及解脂酶, 能够通过促使脂肪分解、清除, 从而降低血脂[31,32]. 可见, 枳葛口服液对酒精性肝病的防治作用是该复方药物多靶点、多途径共同协同的结果.
总之, 早期、定量的枳葛口服液对酒精性肝损伤有一定的阻断或抑制作用, 其机制可能与逆转ADH、ALDH等乙醇代谢酶的活性进而抑制自由基生成, 促进毒物乙醛分解, 抑制机体氧化应激, 改善大鼠脂质代谢紊乱密切相关, 最终起到解酒保肝以延缓或逆转酒精性肝损伤发展进程的作用.
酒精性肝病(alcoholic liver disease, ALD)是长期大量饮酒导致肝脏循序渐进发展的病理性损伤, 因此如何有效预防酒精性肝损伤的发生发展是现代医学研究的热点之一. 中医药在治未病方面取得了较好的成效, 枳葛口服液是西南医科大学附属中医院著名专家教授经过长期临床探索总结出的纯中药解酒经验组方, 对长期大量饮酒者具有良好的解酒护肝之功效, 但其作用机制不详.
为了给广大饮酒人群提供安全可靠、行之有效的解酒护肝之保健制剂, 我们将对枳葛口服液作用的分子机制进行深度研究并促使其成果转化.
ALD的发病机制尽管十分复杂, 但诱因肯定是乙醇及其代谢产物. 肝脏为乙醇代谢的主要场所, 在一系列乙醇代谢酶系作用下会产生大量的氧自由基及乙醛等有害物质, 这些有害物质将导致肝细胞膜及线粒体脂质过氧化反应、脂质代谢紊乱等最终造成肝组织细胞损伤. 本研究侧重观察枳葛口服液对酒精性肝损伤模型大鼠乙醇代谢酶活性、氧化应激及脂质代谢的影响.
本研究通过酒精灌胃+普通食料造模酒精性肝病大鼠, 干预组酒精灌胃同时给予不同剂量(高、中、低剂量组)枳葛口服液, 阳性对照组酒精灌胃同时给予解酒灵口服液, 正常组以蒸馏水灌胃. 12 wk后处死动物检测各组大鼠肝功、肝脏指数、脂质代谢、氧化应激及乙醇代谢酶活性等相关指标. 该动物模型造模简单, 实验分组对比鲜明, 实验效果明显.
实验结果发现: 相比正常组, 除高剂量组外, 各组大鼠肝脏指数、谷丙转氨酶、谷草转氨酶、总胆固醇、三酰甘油、乙醇脱氢酶、乙醛脱氢酶及CYP450 2E1含量均有显著变化(P<0.01或0.05), 其中模型组和枳葛口服液低剂量组差异最大(P<0.01). 相比模型组, 各治疗组以上指标均呈现不同程度地逆转(P<0.01或0.05), 其中高剂量组逆转最显著(P<0.01). 枳葛口服液中剂量组疗效与解酒灵口服液对照组疗效近似(P>0.05). 说明枳葛口服液的解酒护肝之功效可能与逆转乙醇代谢酶活性进而抑制自由基、乙醛生成, 抑制机体氧化应激, 改善大鼠脂质代谢紊乱密切相关.
枳葛口服液可通过调节乙醇代谢酶活性, 抑制机体氧化应激反应, 改善大鼠脂质代谢紊乱等以防治酒精性肝损伤发生发展的作用, 且存在一定的量效关系.
本文通过动物模型实验初步阐述了枳葛口服液预防酒精性肝损伤相关的分子机制, 接下来将通过体外细胞实验进一步深入探究以上相关分子调控酒精性肝损伤与肝再生的因果关系及机制.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 四川省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
编辑: 马亚娟 电编:杜冉冉
| 1. | Torruellas C, French SW, Medici V. Diagnosis of alcoholic liver disease. World J Gastroenterol. 2014;20:11684-11699. [PubMed] [DOI] |
| 3. | Rehm J, Samokhvalov AV, Shield KD. Global burden of alcoholic liver diseases. J Hepatol. 2013;59:160-168. [PubMed] [DOI] |
| 5. | Ding RB, Tian K, Huang LL, He CW, Jiang Y, Wang YT, Wan JB. Herbal medicines for the prevention of alcoholic liver disease: a review. J Ethnopharmacol. 2012;144:457-465. [PubMed] [DOI] |
| 6. | Lin H, Zhou Z, Zhong W, Huang P, Ma N, Zhang Y, Zhou C, Lai Y, Huang S, An H. Naringenin inhibits alcoholic injury by improving lipid metabolism and reducing apoptosis in zebrafish larvae. Oncol Rep. 2017;38:2877-2884. [PubMed] [DOI] |
| 7. | Osna NA, Donohue TM Jr, Kharbanda KK. Alcoholic Liver Disease: Pathogenesis and Current Management. Alcohol Res. 2017;38:147-161. [PubMed] |
| 11. | Sun F, Tsuritani I, Honda R, Ma ZY, Yamada Y. Association of genetic polymorphisms of alcohol-metabolizing enzymes with excessive alcohol consumption in Japanese men. Hum Genet. 1999;105:295-300. [PubMed] |
| 12. | 何 培元, 侯 志平, 高 淑梅, 王 明娟, 马 立新, 李 炳庆. 酒精性肝纤维化大鼠模型的建立及Smad7/TGF-β表达变化. 世界华人消化杂志. 2014;22:2692-2702. [DOI] |
| 17. | Galli A, Pinaire J, Fischer M, Dorris R, Crabb DW. The transcriptional and DNA binding activity of peroxisome proliferator-activated receptor alpha is inhibited by ethanol metabolism. A novel mechanism for the development of ethanol-induced fatty liver. J Biol Chem. 2001;276:68-75. [PubMed] [DOI] |
| 18. | Wang Y, Millonig G, Nair J, Patsenker E, Stickel F, Mueller S, Bartsch H, Seitz HK. Ethanol-induced cytochrome P4502E1 causes carcinogenic etheno-DNA lesions in alcoholic liver disease. Hepatology. 2009;50:453-461. [PubMed] [DOI] |
| 22. | 刘 明, 陈 绍红, 钟 赣生, 柳 海艳, 赵 桐. 葛花枳椇子配伍对酒精性肝损伤大鼠血中乙醇浓度和肝中乙醇脱氢酶活性的量-时-效影响. 环球中医药. 2015;3:299-303. [DOI] |
| 27. | Wang JW, Chen XY, Hu PY, Tan MM, Tang XG, Huang MC, Lou ZH. Effects of Linderae radix extracts on a rat model of alcoholic liver injury. Exp Ther Med. 2016;11:2185-2192. [PubMed] [DOI] |
| 29. | Guo J, Meng Y, Zhao Y, Hu Y, Ren D, Yang X. Myricetin derived from Hovenia dulcis Thunb. ameliorates vascular endothelial dysfunction and liver injury in high choline-fed mice. Food Funct. 2015;6:1620-1634. [PubMed] [DOI] |
| 30. | Oh YC, Kang OH, Choi JG, Chae HS, Lee YS, Brice OO, Jung HJ, Hong SH, Lee YM, Kwon DY. Anti-inflammatory effect of resveratrol by inhibition of IL-8 production in LPS-induced THP-1 cells. Am J Chin Med. 2009;37:1203-1214. [PubMed] [DOI] |
| 31. | Yin J, Qu J, Zhang W, Lu D, Gao Y, Ying X, Kang T. Tissue distribution comparison between healthy and fatty liver rats after oral administration of hawthorn leaf extract. Biomed Chromatogr. 2014;28:637-647. [PubMed] [DOI] |
| 32. | Zhu RG, Sun YD, Li TP, Chen G, Peng X, Duan WB, Zheng ZZ, Shi SL, Xu JG, Liu YH. Comparative effects of hawthorn (Crataegus pinnatifida Bunge) pectin and pectin hydrolyzates on the cholesterol homeostasis of hamsters fed high-cholesterol diets. Chem Biol Interact. 2015;238:42-47. [PubMed] [DOI] |