修回日期: 2017-12-26
接受日期: 2018-01-06
在线出版日期: 2018-02-08
探讨尾加压素II(urotensin II, UII)及其受体系统(urotensin II receptor, UT)对急性肝衰竭(acute liver failure, ALF)小鼠肝脏自噬水平的影响.
♂Balb/c小鼠随机分为4组(每组6只). A组: 健康对照组; B组: 预处理对照组; C组: 模型组; D组: 预处理模型组. B组和D组给予0.6 mg/kg Urantide尾静脉注射预处理. 30 min后, C组和D组立即以脂多糖(lipopolysaccharide, LPS)联合D-半乳糖胺(D-galactosamine, D-GalN)腹腔注射诱导急性肝衰竭. LPS/D-GalN攻击6 h后采集小鼠血清和肝组织样本. 测量血清谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate transaminase, AST)水平以评价肝损伤情况. 采用实时荧光定量PCR(real-time PCR, RT-PCR)检测Beclin-1、Atg5(autophagy related 5)、Atg7、Sqstm1(sequestosome 1)/p62和LC3 mRNA(microtubule-associated protein 1 light chain 3)水平, 采用免疫印记技术(Western blot)检测LC3及p62蛋白质含量.
模型组和预处理模型组ALT和AST水平与健康对照组和预处理对照组相比较均明显增高(P<0.01), 其中预处理模型组较模型组明显降低(P<0.01). RT-PCR结果显示模型组和预处理模型组小鼠肝组织中Beclin-1、Atg5、Atg7、p62和LC3 mRNA水平均较健康对照组和预处理对照组低(P<0.05); 而模型组和预处理模型组、健康对照组和预处理对照组各自间比较均无统计学差异(P>0.05). Western blot结果也显示, 模型组和预处理模型组小鼠肝组织中LC3和p62蛋白水平均较健康对照组和预处理对照组低(P<0.05); 而模型组和预处理模型组、健康对照组和预处理对照组各自间比较均无统计学差异(P>0.05).
UII/UT系统对LPS/D-GalN诱导ALF小鼠下调的肝组织自噬水平无明显影响.
核心提要: 脂多糖(lipopolysaccharide, LPS)/右旋半乳糖胺(D-galactosamine, D-GalN)攻击诱导急性肝衰竭(acute liver failure, ALF)小鼠肝脏自噬相关基因Beclin-1、Atg5、Atg7、p62和LC3 mRNA水平降低, 自噬相关蛋白LC3II和p62含量下降. 采用尾加压素II(urotensin II, UII)及其受体系统(urotensin II receptor, UT)特异性受体拮抗剂Urantide预处理后, 并未对上述指标产生明显影响. 这提示UII/UT系统对LPS/D-GalN诱导ALF小鼠下调的肝组织自噬水平无明显影响.
引文著录: 钟欢, 何玉, 谈志丽, 刘亮明. UII/UT系统对急性肝衰竭小鼠肝组织自噬水平的影响. 世界华人消化杂志 2018; 26(4): 228-235
Revised: December 26, 2017
Accepted: January 6, 2018
Published online: February 8, 2018
To investigate the effect of urotensin II/urotensin II receptor (UII/UT) system on the levels of hepatic autophagy in mice with acute liver failure (ALF).
Male Balb/c mice were randomly divided into four groups (n = 6 each): normal controls (group A), pre-treated controls (group B), model mice (group C), and pre-treated model mice (group D). Groups B and D received urantide (0.6 mg/kg body weight) via caudal vein injection. At 30 min post-injection, groups C and D were intraperitoneally injected with LPS/D-GalN to induce acute liver injury. Serum and liver tissue samples were collected 6 h later. Serum alanine transaminase (ALT) and aspartate aminotransferase (AST) levels were determined to assess liver injury. The expression of autophagy related genes such as Beclin-1, autophagy related 5 (Atg5), Atg7, sequestosome 1 (Sqstm1/p62), and microtubule-associated protein 1 light chain 3 (LC3) was detected by quantitative PCR. The expression of autophagic proteins LC3 and p62 was tested by Western blot.
Serum ALT and AST levels in group C were significantly higher than those in groups A and B (P < 0.01), while they were significantly lower in group D than in group C (P < 0.01). RT-PCR analysis showed that the expression of autophagy related genes such as Beclin-1, Atg5, Atg7, p62, LC3 was downregulated in groups C and D compared to groups A and B (P < 0.05), although there was no difference between groups C and D as well as between groups A and B (P > 0.05). LC3II and p62 protein levels tested by Western blot were significantly lower in groups C and D than in groups A and B (P < 0.05), but there was no difference between groups C and D as well as between groups A and B (P > 0.05).
UII/UT system has no influence on the suppressed hepatic autophagy in ALF mice.
- Citation: Zhong H, He Y, Tan ZL, Liu LM. Effect of urotensin II/urotensin II receptor system on autophagy in acute liver failure in mice. Shijie Huaren Xiaohua Zazhi 2018; 26(4): 228-235
- URL: https://www.wjgnet.com/1009-3079/full/v26/i4/228.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i4.228
急性肝衰竭(acute liver failure, ALF)是一种与免疫炎性反应密切相关的肝损伤性疾病. 近年发现, 尾加压素II(urotensin II, UII)及其受体系统(urotensin II receptor, UT)在炎症损伤性疾病的发生发展中起重要作用[1]. 已知UII是11个氨基酸环状多肽分子, 有多种生理和病理学活性[2]. UT是UII的特异性孤儿G-蛋白偶联受体14[3]. 已证实, ALF患者肝内UII/UT的表达显著增高[4]. 我们前期对UII/UT信号系统与ALF的关系进行了研究. 我们发现在脂多糖(lipopolysaccharide, LPS)/右旋半乳糖胺(D-galactosamine, D-GalN)攻击诱导ALF实验鼠极早期肝内UII/UT表达即显著升高[5]. 采用UT特异性拮抗剂Urantide阻断UII/UT信号传导, 不仅抑制了LPS/D-GalN诱导ALF实验鼠肝内UII/UT的表达, 也保护了实验鼠免于LPS/D-GalN攻击造成的死亡和肝组织炎症损伤[6]. 进一步研究发现, UII/UT主要是通过对肝内TLR4信号通路及其下游促炎细胞因子如肿瘤坏死因子-α等的级联式激活作用, 介导ALF肝组织免疫炎症损伤效应的发生[7]. 另外, 我们研究的结果还提示UII/UT系统可能是LPS/D-GalN诱导ALF肝内炎症损伤反应的触发者(trigger)[5]. 但是, UII/UT系统是否对ALF肝内的保护机制存在影响目前却并不清楚. 已知, 在组织细胞的保护机制中, 自噬(autophagy)起着十分重要的作用. 自噬是真核生物体内普遍存在且进化保守的自我保护机制. 通过自噬, 细胞可将胞内产生的异常大分子物质及受损的细胞器包裹并运输至溶酶体进行降解, 以消除这些成份对细胞的毒害, 并提供能量和维持营养物质代谢平衡[8]. 自噬通常有起始(initiation)、成核(nucleation)、扩张(expansion)和降解(degradation)4个阶段, 并受到超过30个自噬相关基因的调控[8]. 在这些调控基因中, Beclin-1参与了自噬的成核过程; Atg5和Atg7等则参与了自噬的扩张过程. 在多种相关蛋白催化作用下, 微管相关蛋白轻链I(microtubule-associated protein 1 light chain 3, LC3I)可与磷脂酰乙醇胺共价结合形成自噬体内膜特异性的LC3II, LC3II能促进自噬体膜的延伸. p62蛋白(又称SQSTM1蛋白)是一个重要的自噬受体蛋白, 其主要功能在于协助LC3II与需降解的靶蛋白或受损细胞器结合. 自噬溶酶体功能不足会导致p62的堆积, 因此其细胞内含量能用以评估自噬溶酶体的活性[8,9]. 许多肝病如酒精性肝病和非酒精性脂肪肝等的发病被证实都与自噬有关[10]. 近年发现, ALF发病过程中自噬水平也明显异常[11]. 抑制自噬可使ALF肝损伤加重, 疾病进展加快[11,12]; 增强自噬则能减轻ALF肝损伤, 并降低死亡率[11,12]. 这提示自噬在ALF的发生中具有重要保护性作用. 本项研究拟进一步探讨UII/UT系统对ALF肝组织自噬水平的影响, 以期更加全面深入地阐明UII/UT系统介导ALF发生的机制.
6周龄♂健康Balb/c小鼠, 清洁级, 质量22-24 g, 购自上海杰思捷实验动物有限公司, 生产许可证号码为: SCXK(沪)2013-0006, 动物饲养于上海交通大学附属第一人民医院实验动物中心清洁级动物房. 环境温度: 20 ℃-23 ℃. 湿度: 40%-80%. 设施内动物换气次数为8-15次, 噪声<50 dB, 滤过后空气洁净度10000级. 自由饮水和采食. 每12 h开灯或关灯. 实验前禁食12 h. 实验动物的使用符合国家动物保护法. 试剂: LPS和D-GalN购自美国Sigma公司; Urantide购自日本PEPTIDES公司; PCR引物由上海生工生物工程有限公司合成; 逆转录试剂盒和PCR反应试剂盒购自TAKARA宝生物工程(大连)有限公司; LC3、SQSTM1/p62抗体购自美国cell signaling technology公司.
1.2.1 动物分组和ALF模型制备: ALF实验动物模型制备参考文献[6]. 24只Balb/c小鼠按照随机排列表随机分为4组(每组6只). A组: 健康对照组; B组: 预处理对照组; C组: 模型组; D组预处理模型组. 预处理对照组和预处理模型组给予尾静脉注射0.6 mg/kg Urantide预处理, 健康对照组和模型组则给予相同体积生理盐水. 30 min后立即将含有LPS 50 μg/kg和D-GalN 800 mg/kg的0.2 mL无菌生理盐水注射于模型组和预处理模型组动物腹腔. 对照组小鼠尾静脉和腹腔内仅注射无菌生理盐水. 4组均在腹腔注射后6 h处死, 采集动物血清和肝组织标本.
1.2.2 实时荧光定量PCR检测: 操作方法参考文献[7]. 具体操作步骤简要介绍如下: 取50-100 mg肝组织, 采用TRIzol法提取总RNA, 按照试剂盒说明书进行操作. 取1 μg总RNA作为模板用于第一链cDNA的合成. 引物序列及其产物如表1. Real-time PCR操作方法按试剂盒说明书进行. 反应体系中加入2×Premix Ex TaqTM II、正反义链引物、ROX Reference Dye II和DNA模板. 在ABI 7500仪器中按2步法进行扩增, 第1步: 95 ℃ 30 s, 1个循环; 第2步: 95 ℃ 5 s, 60 ℃ 34 s, 40个循环. 以GAPDH作为内参. 用计算机分析Ct值, 采用2-△△Ct公式计算mRNA相对表达量.
| 基因 | 引物序列5'→3' | 产物 (bp) |
| Beclin-1 | 上游: AGCCTCTGAAACTGGACACG | 117 |
| 下游: CCTCTTCCTCCTGGGTCTCT | ||
| Atg5 | 上游: GGAGAGAAGAGGAGCCAGGT | 124 |
| 下游: GCTGGGGGACAATGCTAAT | ||
| Atg7 | 上游: TTTCCAGTCCGTTGAAGTCC | 120 |
| 下游: GGACAATCTGGGCTAAATGC | ||
| p62 | 上游: CTGTGGTGGGAACTCGCTAT | 115 |
| 下游: AAGGGGTTGGGAAAGATGAG | ||
| LC3 | 上游: TTCTTCCTCCTGGTGAATGG | 134 |
| 下游: ATTGCTGTCCCGAATGTCTC | ||
| GAPDH | 上游: ATCACTGCCACCCAGAAG | 191 |
| 下游: TCCACGACGGACACATTG |
1.2.3 免疫印迹(Western blot)分析: 操作方法参考文献[7]. 具体操作步骤简要介绍如下: 将组织剪成细小的碎片, 按每20 mg组织加入150-250 μL的比例加入裂解液(裂解液中加入蛋白酶和磷酸酶抑制剂), 匀浆器匀浆直至完全裂解. 裂解后的样品4 ℃ 12000 g离心15 min, 取上清, 进行蛋白质定量后贮存于-80 ℃冰箱. 取50 μg蛋白, 水浴煮沸10 min后进行15%十二烷基硫酸钠/聚丙烯酰胺(SDS-PAGE)电泳, 转移至NC膜上. 5%脱脂牛奶常温封闭2 h后, 加入适量的LC3、p62和内参β-actin抗体4 ℃孵育过夜, 0.1%的TBST漂洗3次, 每次5 min. 加辣根过氧化物酶标记的二抗, 室温下孵育2 h后, 0.1%的TBST漂洗3次, 每次5 min. 结果用ECL-Plus化学发光试剂盒检测, X光片曝光. X光片显影和定影后观察结果.
统计学处理 实验数据用mean±SD表示. 采用SPSS22.0进行统计学处理, 多组均数比较采用单因素方差分析(one-way ANOVA), 方差不齐采用welch校正; 组间比较采用LSD或Tamhane, 组间t检验, P<0.05为差异有统计学意义.
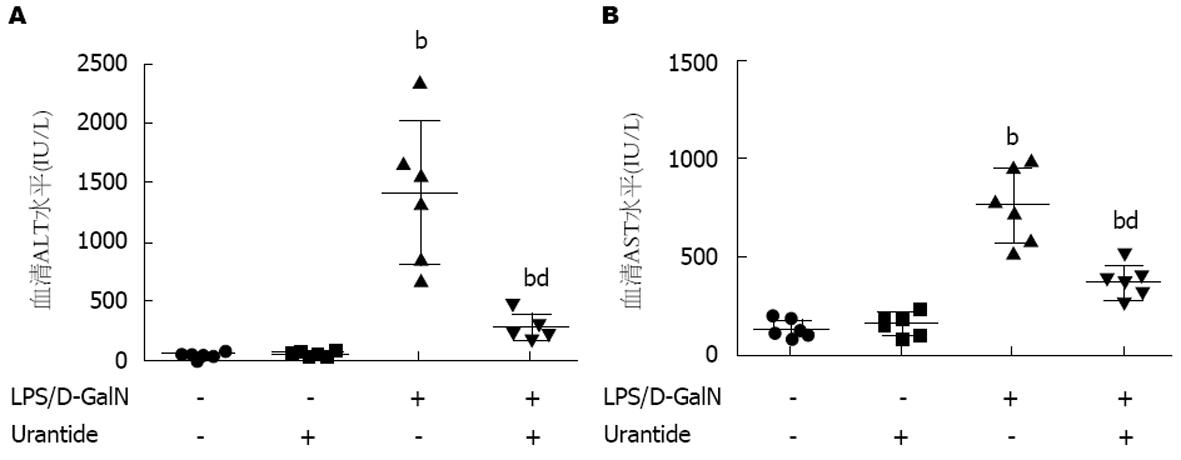
各组小鼠血清转氨酶水平见(图1). 经统计学分析, 校正后welch值分别为9.889和10.444, 均P<0.01, 说明各组间转氨酶水平存在差异. 进一步组间比较分析显示: 与健康对照组和预处理对照组相比, 模型组和预处理模型组ALT和AST水平均明显升高(P<0.05); 与模型组相比, 预处理组ALT和AST水平均明显下降(P<0.05). 其他肝脏损伤评价指标以及小鼠死亡率见本课题组已发表文章[6]. 结果表明, 采用Urantide抑制UII/UT系统能显著减轻ALF肝损伤.
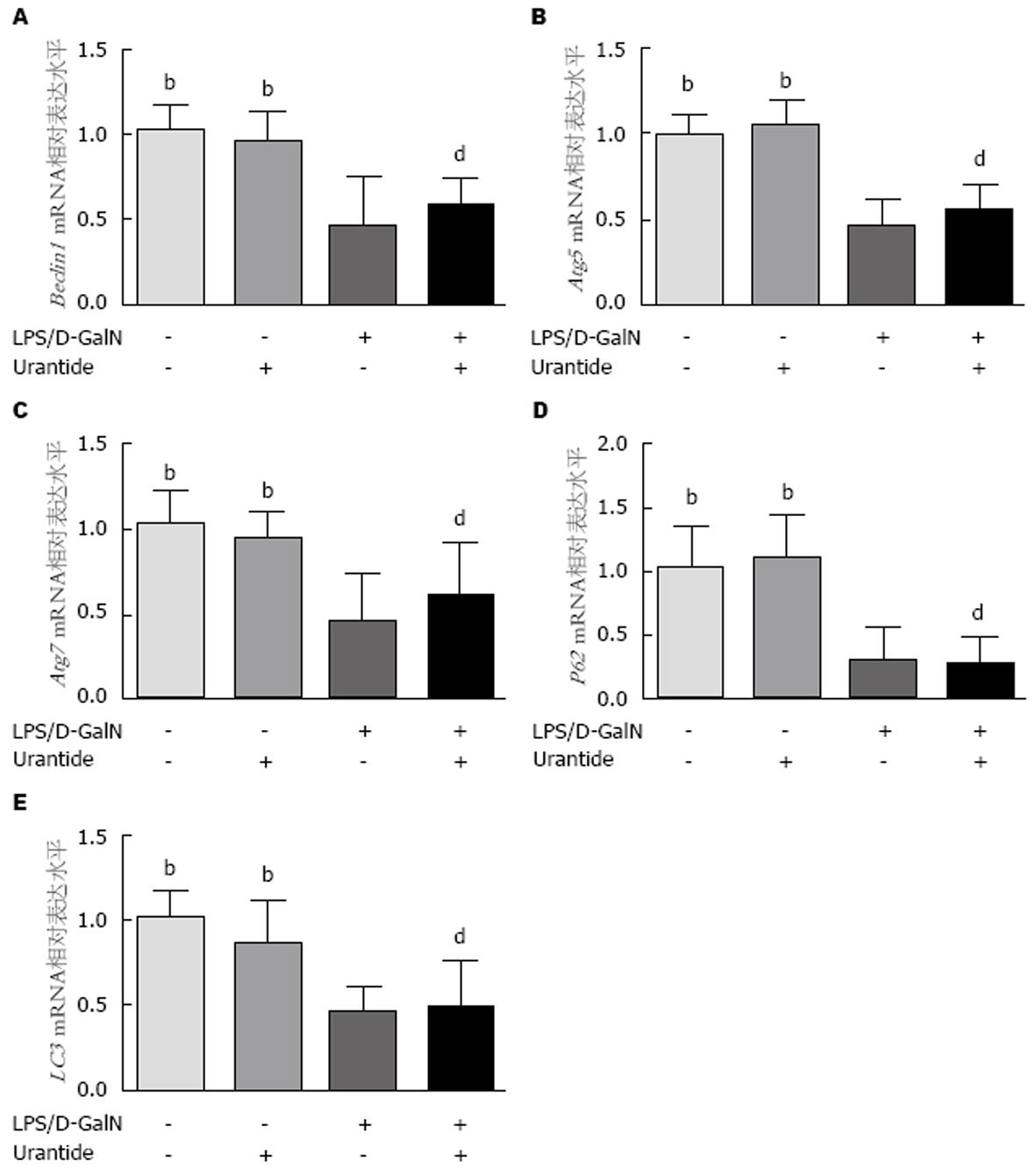
各组小鼠肝组织自噬相关基因Beclin-1、Atg5、Atg7、p62和LC3 mRNA水平如图2. 经统计学分析, F值分别为8.93、28.67、7.21、15.15及12.47, 均P<0.01. 进一步组间比较分析显示: 与健康对照组和预处理对照组相比, 模型组和预处理模型组Beclin-1、Atg5、Atg7、p62和LC3 mRNA水平明显下调, 差异有统计学意义(P<0.01); 而健康对照组和预处理对照组以及模型组和预处理模型组各自组间Beclin-1、Atg5、Atg7、p62和LC3 mRNA表达水平的差异均无统计学意义(P>0.05). 这结果提示, ALF小鼠肝脏自噬相关基因Beclin-1、Atg5、Atg7、p62和LC3在转录水平明显下调, Urantide对这些基因的表达无明显影响.
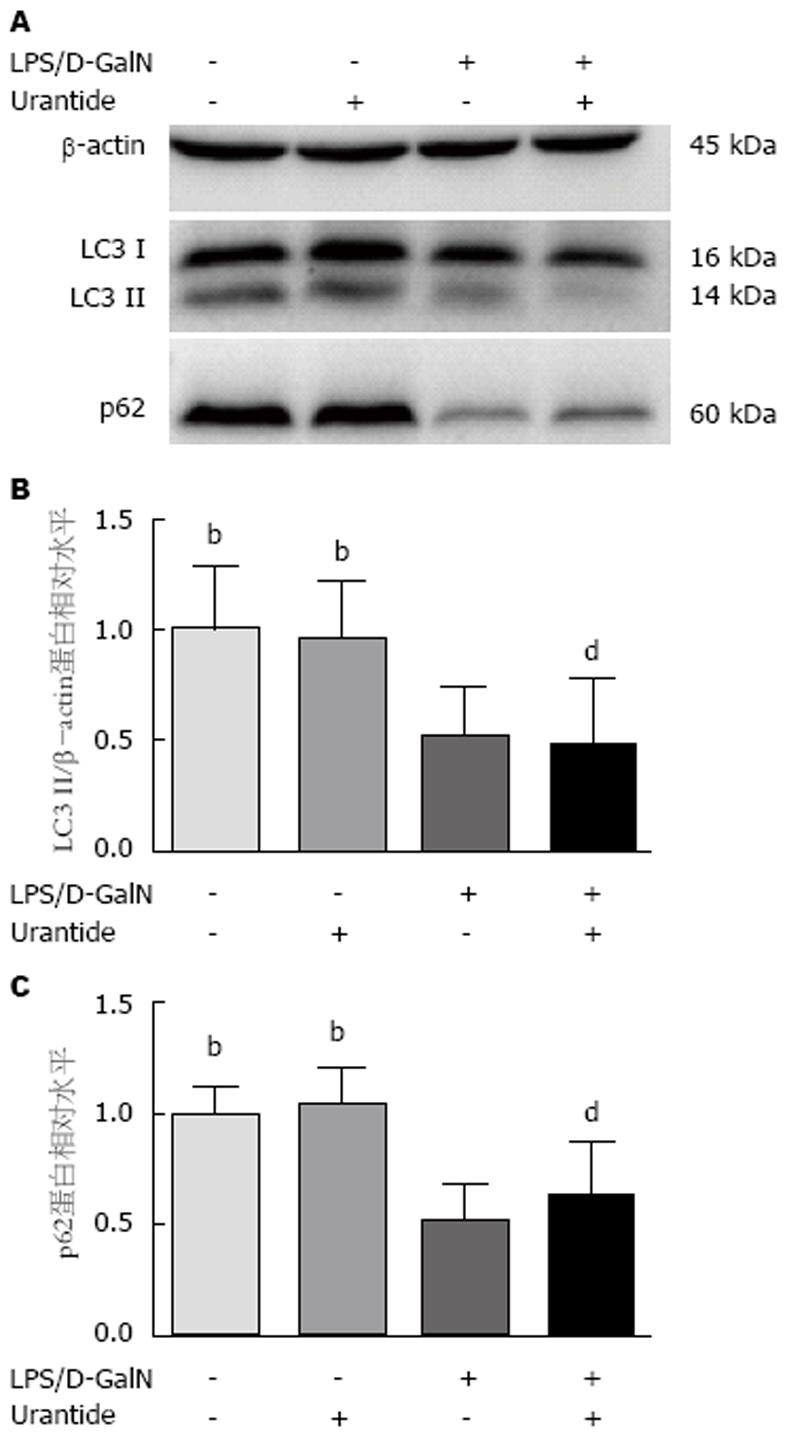
采用Western blot检测各组小鼠肝组织自噬相关蛋白LC3(包括LC3 I和LC3 II)和p62蛋白水平, 结果如图3. 经统计学分析, F值分别6.76和12.75, 均P<0.01. 进一步组间比较分析显示: 与健康对照组和预处理对照组相比, 模型组和预处理模型组LC3和p62蛋白水平明显下调, 差异有统计学意义(P<0.01); 而健康对照组和预处理对照组以及模型组和预处理模型组各自组间LC3和p62蛋白水平的差异均无统计学意义(P值分别为0.78和0.27). 这结果提示, ALF小鼠肝脏自噬相关蛋白LC3和p62明显下调, Urantide对这些蛋白的表达无明显影响.
UII/UT系统有多种生物学活性[13], 其活性增高与肺动脉高压[14]、冠脉粥样硬化[15]、肾脏疾病[16]、糖尿病[17]和肿瘤[18]等多种疾病密切相关. UII/UT系统存在炎症损伤效应是近年免疫学研究的重要进展[1]. 我们课题组的研究提示, UII/UT系统介导了ALF小鼠肝组织的固有免疫炎症反应[19]. 自噬是近年备受关注的细胞内维持稳态的一种方式, 已证实ALF期间肝内自噬水平出现先增强后受抑的表现[11]. 同时也证实, 诱导并增强自噬可减轻ALF肝内炎症损伤, 而抑制自噬则加重ALF肝损伤[11,12]. 这表明, 自噬在ALF发生中有关键作用. 但是, UII/UT系统是否对ALF自噬水平存在影响目前并不清楚. 在本实验中, LPS/D-GalN攻击6 h后, 肝内炎症损伤已明显[20]. 此期间自噬相关基因Beclin-1、Atg5、Atg7、p62和LC3的表达水平显示, 在ALF明显期, 上述基因的表达明显下调. 这提示自噬过程的各个阶段均受到抑制, 也表明ALF期间肝内自噬水平降低. 我们并未发现ALF肝内自噬增强的现象, 这可能与LPS/D-GalN攻击的时间有关. LPS/D-GalN攻击早期(ALF前期), 由于应激反应, 实验鼠可能会出现一过性自噬增强状态, 随后转入自噬抑制, 肝细胞保护机制下调或丧失, 肝组织损伤修复能力降低, 进而发生ALF.
本实验结果表明 Urantide的应用并未影响到LPS/D-GalN攻击鼠肝内自噬水平的下调. 这表明UII/UT信号系统对ALF肝脏自噬无影响. 有文献显示, UII/UT系统可抑制自噬[21,22]. Coly等[21]发现在肿瘤细胞中UII/UT系统能通过激活其下游钙蛋白酶(calpain), 可对Beclin-1进行剪切并进而抑制自噬体的形成. Chen等[22]应用UT受体拮抗剂SB-657510逆转了糖尿病小鼠肾脏上皮细胞内自噬水平的下降. 本实验阻断肝内UII/UT信号传导后并未对ALF肝脏自噬水平产生影响. 我们分析其原因可能与ALF过程中肝内外钙离子稳态失衡有关. 钙离子是细胞内信号转导的第二信使, 在调节细胞凋亡和自噬等方面有重要作用[23]. 研究发现UII/UT系统发挥作用需依赖(或至少部分依赖)细胞内外钙离子的信号传递作用[24,25]; 而细胞内钙离子增加能激活calpain, 并进而抑制细胞自噬[26,27]. 在ALF, 肝细胞内钙离子调节显著异常, 破裂坏死的肝细胞释放的钙离子可导致肝细胞内外钙离子稳态失衡[28,29]. 因而, UII/UT信号可能难以通过失衡的钙离子来进行传导. 但是, 相关的原因和机制还需要进一步证实和研究.
急性肝衰竭(acute liver failure, ALF)是一种与免疫炎性反应密切相关的肝损伤性疾病. 我们早期的研究显示, 尾加压素II(urotensin II, UII)及其受体系统(urotensin II receptor, UT)介导了ALF肝组织的免疫炎症损伤反应. 作为一种组织的自我保护性机制, 自噬在ALF肝损伤发生发展过程中受到明显的抑制. 然而, UII/UT系统与肝组织细胞自噬的关系尚不明确. 鉴于此, 我们在本实验中探讨了UII/UT系统对ALF肝组织自噬水平的影响. 研究成果有助于更加全面深入地阐明UII/UT系统介导ALF发生的机制.
本文研究的主题是UII/UT系统对ALF肝组织自噬水平的影响. 拟解决的关键问题及意义: (1)UII/UT系统信号增强与抑制问题. 我们前期研究已证实, LPS/D-GalN诱导ALF实验鼠肝组织UII/UT信号显著增强, 而UT拮抗剂可抑制UII/UT表达和信号传导. 该问题的解决对研究UII/UT系统的生物学功能具有关键性影响; (2)自噬水平的检测问题. 自噬是一个多步骤渐进式的主动过程, 每一个步骤或环节均有许多自噬相关基因的参与. 本研究选取了不同阶段中关键性的自噬相关基因进行检测, 这对了解UII/UT对自噬过程或某些阶段的影响有重要意义.
本研究主要目标是探讨ALF肝组织自噬发生情况及UII/UT的影响. 实验研究的完成对进一步了解UII/UT介导ALF的肝损伤机制有意义.
本实验采用UT特异性拮抗剂Urantide尾静脉注射预处理抑制ALF肝内UII/UT系统, 采用RT-PCR和Western blot等实验方法, 对自噬各个关键分子进行检测.
实验结果显示, LPS/D-GalN诱导ALF实验鼠肝组织的自噬水平显著下调, 而UII/UT系统对ALF自噬水平的下调无明显影响. 这提示, UII/UT系统并不影响ALF肝内实质细胞的自噬. 该结果为我们下一步进行细胞水平如免疫炎症细胞枯否细胞自噬的研究提供了基础和动因.
ALF是肝组织的免疫炎症损伤性疾病, 自噬是ALF最近发现的可用以缓解ALF的重要保护机制, UII/UT系统也是最近发现的可调节ALF炎症反应的重要因素, 此实验表明抑制UII/UT系统对肝脏自噬无影响, UII/UT系统和自噬可同时作为抑制ALF的药物靶点, 从而协同缓解ALF.
尽管自噬作为真核细胞中普遍存在的保护机制, 且被多条信号通路调控, 但是并非所有保护作用均是通过调节自噬发挥作用的. 作者下一步将进行细胞水平如免疫炎症细胞枯否细胞自噬的研究, 因为枯否细胞是表达UII/UT系统的主要细胞. 未来研究的最佳方法是利用胶原酶消化, 密度梯度离心提取原代枯否细胞, 在枯否细胞水平观察UII/UT系统对自噬的影响以及其与炎症调控的关系.
感谢本院中心实验室娄晓丽在本试验中给予的大力帮助.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 上海市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): D
E级 (差): 0
编辑: 闫晋利 电编:闫晋利
| 2. | Vaudry H, Do Rego JC, Le Mevel JC, Chatenet D, Tostivint H, Fournier A, Tonon MC, Pelletier G, Conlon JM, Leprince J. Urotensin II, from fish to human. Ann N Y Acad Sci. 2010;1200:53-66. [PubMed] [DOI] |
| 3. | Douglas SA, Ohlstein EH. Human urotensin-II, the most potent mammalian vasoconstrictor identified to date, as a therapeutic target for the management of cardiovascular disease. Trends Cardiovasc Med. 2000;10:229-237. [PubMed] |
| 4. | Leifeld L, Clemens C, Heller J, Trebicka J, Sauerbruch T, Spengler U. Expression of urotensin II and its receptor in human liver cirrhosis and fulminant hepatic failure. Dig Dis Sci. 2010;55:1458-1464. [PubMed] [DOI] |
| 5. | Liu LM, Zhao L, Liang DY, Yu FP, Ye CG, Tu WJ, Zhu T. Effects of urotensin-II on cytokines in early acute liver failure in mice. World J Gastroenterol. 2015;21:3239-3244. [PubMed] [DOI] |
| 6. | 刘 亮明, 梁 冬雨, 张 芳芳, 于 芳苹, 赵 亮, 叶 长根. Urotensin II在急性肝衰竭小鼠肝组织中的表达及损伤作用. 世界华人消化杂志. 2012;20:1616-1622. [DOI] |
| 7. | Liang DY, Liu LM, Ye CG, Zhao L, Yu FP, Gao DY, Wang YY, Yang ZW, Wang YY. Inhibition of UII/UTR system relieves acute inflammation of liver through preventing activation of NF-κB pathway in ALF mice. PLoS One. 2013;8:e64895. [PubMed] [DOI] |
| 8. | Kaur J, Debnath J. Autophagy at the crossroads of catabolism and anabolism. Nat Rev Mol Cell Biol. 2015;16:461-472. [PubMed] [DOI] |
| 9. | Deretic V, Saitoh T, Akira S. Autophagy in infection, inflammation and immunity. Nat Rev Immunol. 2013;13:722-737. [PubMed] [DOI] |
| 10. | Gual P, Gilgenkrantz H, Lotersztajn S. Autophagy in chronic liver diseases: the two faces of Janus. Am J Physiol Cell Physiol. 2017;312:C263-C273. [PubMed] [DOI] |
| 11. | Ren F, Zhang L, Zhang X, Shi H, Wen T, Bai L, Zheng S, Chen Y, Chen D, Li L. Inhibition of glycogen synthase kinase 3β promotes autophagy to protect mice from acute liver failure mediated by peroxisome proliferator-activated receptor α. Cell Death Dis. 2016;7:e2151. [PubMed] [DOI] |
| 12. | Amir M, Zhao E, Fontana L, Rosenberg H, Tanaka K, Gao G, Czaja MJ. Inhibition of hepatocyte autophagy increases tumor necrosis factor-dependent liver injury by promoting caspase-8 activation. Cell Death Differ. 2013;20:878-887. [PubMed] [DOI] |
| 13. | Ross B, McKendy K, Giaid A. Role of urotensin II in health and disease. Am J Physiol Regul Integr Comp Physiol. 2010;298:R1156-R1172. [PubMed] [DOI] |
| 14. | Lee JH, Park BK, Oh KS, Yi KY, Lim CJ, Seo HW, Lee BH. A urotensin II receptor antagonist, KR36676, decreases vascular remodeling and inflammation in experimental pulmonary hypertension. Int Immunopharmacol. 2016;40:196-202. [PubMed] [DOI] |
| 15. | Zhao J, Yu QX, Kong W, Gao HC, Sun B, Xie YQ, Ren LQ. The urotensin II receptor antagonist, urantide, protects against atherosclerosis in rats. Exp Ther Med. 2013;5:1765-1769. [PubMed] [DOI] |
| 16. | Balat A, Büyükçelik M. Urotensin-II: More Than a Mediator for Kidney. Int J Nephrol. 2012;2012:249790. [PubMed] [DOI] |
| 17. | Li YY, Shi ZM, Yu XY, Feng P, Wang XJ. Urotensin II-induced insulin resistance is mediated by NADPH oxidase-derived reactive oxygen species in HepG2 cells. World J Gastroenterol. 2016;22:5769-5779. [PubMed] [DOI] |
| 18. | Li YY, Shi ZM, Yu XT, Feng P, Wang XJ. The effects of urotensin II on migration and invasion are mediated by NADPH oxidase-derived reactive oxygen species through the c-Jun N-terminal kinase pathway in human hepatoma cells. Peptides. 2017;88:106-114. [PubMed] [DOI] |
| 19. | Liu LM, Liang DY, Ye CG, Tu WJ, Zhu T. The UII/UT system mediates upregulation of proinflammatory cytokines through p38 MAPK and NF-κB pathways in LPS-stimulated Kupffer cells. PLoS One. 2015;10:e0121383. [PubMed] [DOI] |
| 20. | Liu LM, Zhang JX, Luo J, Guo HX, Deng H, Chen JY, Sun SL. A role of cell apoptosis in lipopolysaccharide (LPS)-induced nonlethal liver injury in D-galactosamine (D-GalN)-sensitized rats. Dig Dis Sci. 2008;53:1316-1324. [PubMed] [DOI] |
| 21. | Coly PM, Perzo N, Le Joncour V, Lecointre C, Schouft MT, Desrues L, Tonon MC, Wurtz O, Gandolfo P, Castel H. Chemotactic G protein-coupled receptors control cell migration by repressing autophagosome biogenesis. Autophagy. 2016;12:2344-2362. [PubMed] [DOI] |
| 22. | Chen GJ, Wu F, Pang XX, Zhang AH, Shi JB, Lu M, Tang CS. Urotensin II inhibits autophagy in renal tubular epithelial cells and induces extracellular matrix production in early diabetic mice. J Diabetes Investig. 2016; Jul 26. [Epub ahead of print]. [PubMed] [DOI] |
| 23. | Kondratskyi A, Yassine M, Kondratska K, Skryma R, Slomianny C, Prevarskaya N. Calcium-permeable ion channels in control of autophagy and cancer. Front Physiol. 2013;4:272. [PubMed] [DOI] |
| 24. | Filipeanu CM, Brailoiu E, Le Dun S, Dun NJ. Urotensin-II regulates intracellular calcium in dissociated rat spinal cord neurons. J Neurochem. 2002;83:879-884. [PubMed] |
| 25. | Zhang Y, Ying J, Jiang D, Chang Z, Li H, Zhang G, Gong S, Jiang X, Tao J. Urotensin-II receptor stimulation of cardiac L-type Ca2+ channels requires the βγ subunits of Gi/o-protein and phosphatidylinositol 3-kinase-dependent protein kinase C β1 isoform. J Biol Chem. 2015;290:8644-8655. [PubMed] [DOI] |
| 26. | Mehendale HM, Limaye PB. Calpain: a death protein that mediates progression of liver injury. Trends Pharmacol Sci. 2005;26:232-236. [PubMed] [DOI] |
| 27. | Shi M, Zhang T, Sun L, Luo Y, Liu DH, Xie ST, Song XY, Wang GF, Chen XL, Zhou BC. Calpain, Atg5 and Bak play important roles in the crosstalk between apoptosis and autophagy induced by influx of extracellular calcium. Apoptosis. 2013;18:435-451. [PubMed] [DOI] |
| 28. | Limaye PB, Apte UM, Shankar K, Bucci TJ, Warbritton A, Mehendale HM. Calpain released from dying hepatocytes mediates progression of acute liver injury induced by model hepatotoxicants. Toxicol Appl Pharmacol. 2003;191:211-226. [PubMed] |
| 29. | Tang XH, Chen J, Yang XL, Yan LF, Gao J. Preservation on calcium homeostasis is involved in mitochondrial protection of Limonium sinense against liver damage in mice. Pharmacogn Mag. 2010;6:191-197. [PubMed] [DOI] |