修回日期: 2018-11-02
接受日期: 2018-11-15
在线出版日期: 2018-12-18
胃癌(gastric cancer, GC)术后放、化疗等治疗引起的毒副作用导致患者生活质量下降, 出现癌症恶病质态. 饮食辅助治疗能够显著地促进GC患者机体功能的恢复、缓解炎症反应、提高抗癌治疗耐受力, 改善GC患者术后的生活质量、延长生存期. 结合饮食在GC术后治疗的优势作用, 本文分析了现代医学的元素营养饮食和传统中医食疗在GC术后的饮食辅助治疗作用, 能够更好地了解中医传统食疗在缓解机体整体性功能失调的状态下的运用价值, 促进中医食疗能够借鉴现代医学营养饮食的评估体系和扩大中医食疗在GC临床治疗程中的运用.
核心提要: 胃癌(gastric cancer, GC)术后合理饮食对改善患者的生活质量和延长生存期有着显著的作用. 在我国, 临床指导患者术后饮食禁忌等方面, 发现结合传统中医食疗验方能够很好地缓解现代医疗手段无法达到的改善患者术后水肿炎症状态、免疫抑制、骨髓抑制等症状. 中医汤药在GC术后改善患者机体功能上有很大的突破, 而传统"药食同源"的药膳饮食理念还鲜少报道. 因此, 系统性地认识现代医学和传统中医食疗饮食的差异和运用现状, 有其必要性.
引文著录: 刘磊, 洪裕玲, 刘国彦. 合理饮食在胃癌术后治疗的作用与中医食疗的应用前景. 世界华人消化杂志 2018; 26(35): 2057-2063
Revised: November 2, 2018
Accepted: November 15, 2018
Published online: December 18, 2018
The toxic side effects of postoperative radiotherapy and chemotherapy in gastric cancer (GC) often cause patients to have cancer cachexia and poor quality of life. Dietary adjuvant therapy can significantly promote GC patients to recover the body function, alleviate inflammation, improve anticancer treatment tolerance, improve postoperative quality of life and prolong survival. Given the advantages of diet in the postoperative treatment of GC, this paper discusses the role of modern medicine's elemental nutrition diet and traditional Chinese medicine diet in the postoperative treatment of GC, which can help clinicians better understand traditional Chinese medicine treatment in relieving the overall dysfunction of the body. Furthermore, the combination of traditional Chinese medicine diet with the modern medical nutrition diet evaluation system can expand the use of traditional Chinese medicine diet in the clinical treatment of GC.
- Citation: Liu L, Hong YL, Liu GY. Role of rational diet in postoperative treatment of gastric cancer and application prospect of traditional Chinese medicine diet. Shijie Huaren Xiaohua Zazhi 2018; 26(35): 2057-2063
- URL: https://www.wjgnet.com/1009-3079/full/v26/i35/2057.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i35.2057
胃癌(gastric cancer, GC)是全球第五大常见癌症, 并且致死率是全球第三的癌症[1]. 由于胃是人体重要的消化器官, 在GC发病过程中患者胃肠功能下降、消化不良、溃疡、炎症等问题层出不穷; GC手术创伤和围手术期等过程中饮食控制和低热量摄入等导致GC患者营养不良、精神萎靡、免疫功能低下, 一定程度上影响患者的生存和预后[2]. 文献报道, 饮食习惯对慢性病如癌症的发病率有很大影响[3]. 另一方面, 越来越多的证据表明合理饮食对癌症预防和治疗都具有重要作用[4]. 在亚洲和欧洲大陆, GC术后患者健康的生活质量评估是被高度重视的, 饮食的辅助治疗渐渐成为GC术后康复治疗过程中的重要环节[5]. 中医食疗认为寓治于食, 是药物治疗的有益补充, 能够有效地改善诸如GC这类消化道疾病术后的康复治疗、提高患者生活质量、延长生存期. 但是对于GC患者中医食疗的现状调查以及中医食疗在各种GC术后治疗的影响尚且没有一个清晰的认识, 本文将对GC术后治疗对机体功能的影响、饮食在GC术后治疗过程中的作用及中医食疗的作用等方面作一综述.
GC根治性手术是通过切除原发灶并清扫相关区域的淋巴结以期达到治愈或控制GC的主要手段. 由于病期的不同, GC根治手术后, 胃周围淋巴管、血管及腹腔其他脏器可能存在微小的转移灶, 这是术后复发的根本原因, 故GC患者术后需进行辅助放、化疗或术后同步放、化疗以降低局部复发率[6]. 手术应激会导致全身性的炎症反应, 从而降低生活质量, 甚至影响预后情况[7]. 此外, 炎症反应对患者的免疫功能也有一定的损伤, 这对术后创伤愈合、机体免疫和蛋白质代谢等方面有明显的不良影响. 在围手术期间, GC患者的身体功能下降、抗癌治疗耐受性低、食物摄入减少、骨骼肌质量下降等癌症恶病质态[8], 导致白细胞下降、消化道不适反应等毒副反应, 最终影响患者的生活质量和预后情况. 所以改善GC患者术后状况成为一个重要的关注点[9,10].
GC术后放疗可以消灭潜在的局部癌灶, 延长患者的生存期[11]. 随着精准放疗技术的发展, 对三维适形放射治疗和调强放射治疗的优化, 精准地照射肿瘤组织, 最大限度的避开靶区内的正常组织器官, 可以降低放疗的毒副作用[12]. 但放疗的毒副作用仍旧是存在的, 对GC患者造成一定程度的如皮肤充血、瘙痒及灼痛的皮肤反应、肝肾损伤、放射性肠炎、食欲不振等毒副作用[13,14]. 其中放射性肠炎是影响放疗进程的重要因素之一, 肠道上皮细胞和血管内皮细胞受到放射性损伤可能会使患者出现小肠梗阻、肠穿孔、肠瘘等症状; 放射性结直肠炎导致患者出现腹泻、便血等症状, 严重影响患者生活质量[15]. 此外放疗会上调患者的分解代谢能力并产生一定程度上的免疫抑制, 造成患者免疫力低下[16].
GC术后化疗如奥沙利铂、替吉奥、卡培他滨、5-氟尿嘧啶等治疗对患者存活有益, 能够延长患者生存期[17]. 但与此同时也会引起胃肠道毒性、骨髓抑制、口腔黏膜病变、肝肾功能损伤等并发症, 导致患者生活质量下降、体力下降、耐受力差等情况[18-20]. 随着新辅助化疗的出现在提高临床治疗效果的同时, 感染并发症和骨髓抑制等毒副作用也相应产生[21]. 研究发现, 接受新辅助化疗治疗的GC患者可能由于肠道屏障的损害以及益生菌的减少导致术后感染发生率升高[22]. GC术后化疗产生如上毒副作用会导致患者体力消耗, 头晕无力, 恶心呕吐, 严重脱水, 食欲不振, 大便稀溏等不良反应; 骨髓抑制还会增加炎症反应的产生, 免疫力低下, 影响患者的机体恢复能力及精神状态.
大多数癌细胞表现出符合Warburg effect的代谢适应性, 表现为增加对葡萄糖和营养的摄取以促进自身增殖[23,24]. 由于这一癌症生理和代谢的影响, 消耗了GC患者的大部分营养需求, 导致GC患者难以获得有效的机体营养供给从而影响生存期[25]. GC患者术后一段时间内, 其饮食形式要根据手术情况进行改变, 这一改变可能会导致显著的体重减轻、营养不良, 影响伤口愈合和病人机体功能的恢复[5]. 手术伤口愈合是一种进化上保守、高度协调、时空调节的过程, 需经过止血, 炎症, 增殖和重塑的连续且重叠的一系列阶段, 涉及多种细胞包括成纤维细胞和免疫细胞、内皮细胞和祖细胞在内的协同作用[26-28]. 显然伤口愈合需要提供大量的营养以支持细胞的一系列生理活动. 临床上这段围手术期间, 患者常规需要禁食、肠外营养支持, 以保证伤口愈合和机体功能恢复. 但长期的肠外营养会有一系列并发症产生, 并可能导致胃肠道功能减退. 此外, 术后患者机体的应激状态和重复长期的放、化疗治疗, 极易导致患者出现恶病质态, 此时的饮食作用不仅在于供给机体营养也在于恢复患者胃肠道功能和减轻放、化疗带来的胃肠道不适、炎症反应、骨髓抑制、免疫低下、食欲不振等毒副作用来改善患者的生活质量, 提高生存率.
美国癌症协会(American Cancer Society, ACS)制定的癌症患者饮食营养指南提到充分的饮食摄取可以改善几乎所有癌症患者的营养状况. 在癌症生存的所有阶段, 甚至对于没有明显营养问题的癌症患者来说, 饮食和营养与癌症的预防、复发等都应该被视为是健康饮食的基础[29]. 罗小燕等[30]对120例GC患者进行分组饮食指导, 发现饮食指导组淋巴细胞的下降值明显小于对照组, 血红蛋白、白蛋白水平也明显高于对照组(P<0.05), 并且表现出治疗耐受性好, 精神状态好转等, 表明术后饮食管理有利于患者健康. 倪春玲[31]同样地对30例GC患者进行饮食护理干预, 明显改善患者生活质量, 减少了腹胀、肠梗阻等并发症的产生(χ2 = 11.063, P = 0.001). 邱正芳[32]对90例GC术后患者进行心理干预和饮食指导, 改善了患者的焦虑抑郁情绪和体重下降的现象(P<0.05). 目前有营养机构对癌症患者的术后饮食生活质量作出精准评估和护理, 其中以获取患者营养状况的工具患者生成的主观全局评估(Patient-Generated Subjective Global Assessment, PG-SGA)应用最为广泛, 以此评判癌症患者恶病质和预后相关信息[33]. 这些表明GC术后饮食对改善患者的生活质量, 延长患者生存期有极其重要的意义.
快速康复外科(Fast-Track Surgery, FTS)由丹麦Kehlet教授于1997年提出[34], 欧洲指南同样推荐术后早期经口进食(early oral feeding, EOF)可以加速肿瘤患者术后康复[35]. 由于GC患者术后的胃部损伤, 传统的进食标准是等待病人术后伤口痊愈、病人肛门排气、排便, 胃肠功能恢复后才可进行流质或半流质饮食. 患者在术前的进食减少和术后应激的情况下, 禁食往往导致患者机体消耗增加, 虽临床上有肠外营养, 但蛋白质、维生素等摄入不足仍会影响患者伤口愈合和组织修复, 且早期少量的进食能够降低肠麻痹、刺激胃肠道蠕动, 促进胃肠功能的恢复, 还可避免静脉营养的副作用[36,37]. 此外, 加速康复外科的早期进食能够明显改善术后患者的炎症反应, 研究发现FTS组反映机体损伤和炎症应激程度的细胞因子如CRP、IL-6等水平均有明显低于对照组, 有效地改善了患者的炎症反应[38]. FTS同样可以加速患者免疫系统的恢复. 肖端等[39]发现GC患者术后FTS组一周后CD4+、CD8+、CD4+/CD8+等指标能够恢复到术前水平, 说明FTS能够有效促进机体免疫功能的恢复.
现代医学中, 为了加强术后恢复, 注重减少术后复发和并发症的产生、缩短住院时间, 通过对GC患者进行术后早期口服要素饮食来辅助癌症患者术后恢复[40]. 研究认为, 早期干预要素饮食对远端胃切除术后减少围手术期体重减轻和改善营养管理是有价值的, 并可能与加强GC患者的术后康复有关[41]. 要素饮食尤以精氨酸(可改善啮齿动物和健康人的伤口愈合)[42]、ω-3PUFA(调节炎症反应)[43]、支链氨基酸[44]、维生素C/E等抗氧化剂等作为主要的营养补充. 一项研究表明, 在早期和长期的术后阶段, 要素饮食的及早干预显著减少了胃切除术后老年患者的体重下降和BMI的减少, 提高了血液总蛋白、白蛋白和血红蛋白水平, 减少了并发症[45]. GC术后消化/吸收功能低下的患者体重减轻是早期中断S-1辅助化疗的危险因素. 一项前瞻性随机对照研究表明, 口服要素饮食(element diet, ED)和对照组之间体重减轻百分比(%BWL)存在显着差异(4.88%±3.41%和6.91%±5.06%; P = 0.015), 表明ED产品可预防GC患者术后体重减轻的现象[46]. 此外, 一项前瞻性干预研究利用PG-SGA评估患者的营养, 期间患者还接受了营养咨询和高热量/蛋白质补充剂. 进行术前、术后的对比发现患者术前CRP(0.1-1.5 mg·dL)和IL-6(2.0-14.2 pg/mL)增加、蛋白质较低(1.2±0.5 g/kg/d)、CD4/CD8比值较低(1.7±0.5); 进行免疫调节饮食后CD4/CD8比率增加(2.3±1.0), CRP和IL-6水平有所下降, 发生并发症和死亡率为35%, 表明含有免疫调节饮食的高热量/蛋白质补充剂能够维持GC患者的营养和免疫功能状态[47].
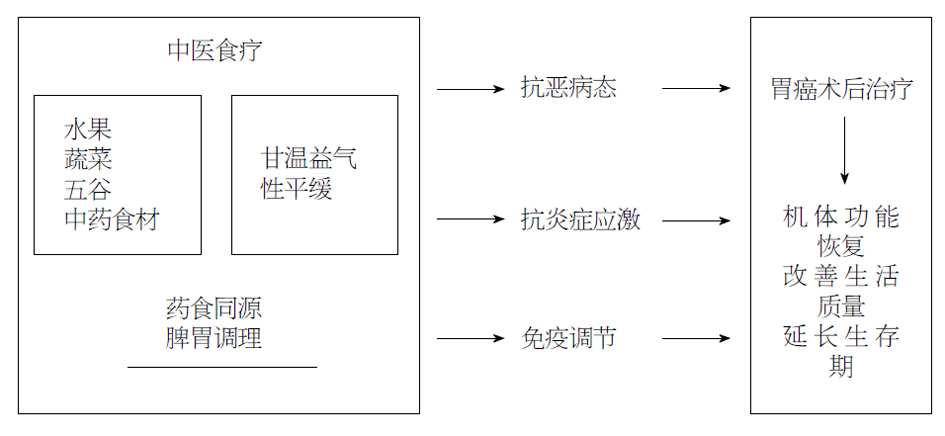
相对于现代医学的要素营养饮食, 中医更注重对机体整体性和系统性的调理, 认为GC术后放、化疗破坏了机体功能的协调性是导致全身性炎症反应出现癌症恶病质态的原因. 中医食疗通过辩证理论改变患者的不良饮食和营养, 从而应对肿瘤患者术后的机体遭受内外环境冲击破坏的状态下造成的消瘦、贫血、乏力等恶病质症状. 利用传统中药和食物的配搭进行食疗, 修复肿瘤浸润性生长破坏的脏器结构和功能、补充肿瘤生长消耗的机体能量, 并在术后恢复阶段进一步扶正祛邪, 从而最终调节机体系统的稳态平衡恢复, 改善患者生活质量, 恢复免疫, 甚至是带瘤生存. 这与将癌症视为一种慢性疾病并运用饮食护理来改善患者生活质量的现代护理观念是一致的[48]. 在传统中医的思想体系中, 认为脾胃乃后天之本, 脾胃是中医食疗中最为关注的攻坚对象, 是营养吸收、人体气血阴阳调和的中心. 放、化疗导致的种种毒副作用, 中医食疗同样亦是针对脾胃调理来促进胃肠道功能的恢复、免疫系统的恢复(图1).
根据患者术后的体质情况辩证饮食治疗, 气虚型患者需健脾益气, 选用香砂六君子汤; 阴虚型患者, 需滋阴养, 选用养胃汤; 痰湿型患者需健脾利湿, 选用二陈汤; 血瘀型患者需活血化瘀, 选用桃红四物汤, 对症施食, 辩证调理, 使患者在消化功能、体重及免疫功能恢复情况都优于静脉营养的患者[49]. GC患者术后放、化疗出现的恶病质状态, 中医认为属于"虚劳"范畴, 是由于术后治疗过程中出现五脏阴阳气血的虚损, 将其症状以中医术语归于纳差、消瘦等. 手术创伤炎症反应未获全愈的情况下, 加上放、化疗等一系列应激反应易导致患者气血阴阳不足、脏腑功能出现障碍、脾气运化不畅. 韩冬梅等[50]对GC术后化疗期间患者进行特制莲肉膏(莲肉、梗米、茯苓)药膳饮食治疗, 发现药膳饮食可减低患者化疗期间餐后腹胀、烧心, 增进单餐进食量, 改善患者生活质量. GC术后治疗过程中常出现免疫抑制, 尤其以放射治疗较为明显. 中医理论认为免疫功能低下以脾胃虚寒为主要症状. 术后脾胃受损, 免疫功能低下易导致恶性肿瘤的转移和复发. 故行之以健脾益气的药膳食疗改善GC术后免疫力低下, 降低术后转移复发的几率[51]. 杨宏辉等[52]在GC患者术后的常规饮食基础上加以赤小豆、龙眼肉、黄芪、当归、阿胶为主的中医药膳, 结果显著改善GC患者术后的营养状况, 提高机体的免疫功能. 尚云青等[53]在中药治疗瘀血型胃溃疡的基础上, 根据食物性味、归经、功效、主治、药理等食疗原则, 选用粳米、猪肚、牛肚、鱼类、鸡蛋等食物及性温热或性平的水果和蔬菜进行辅助治疗, 发现食疗配合中药治疗在临床上的疗效优于单纯的中药治疗(P<0.05).
虽然, 中医食疗在GC上的应用还尚少, 多以中药汤剂辅助GC术后放、化疗的治疗[54], 但中医食疗的临床运用效果确实能够有效改善GC患者术后的炎症反应、恢复免疫系统, 改善生活质量, 延长生存期.
中医食疗饮食管理, 《黄帝内经》提出: "五谷为养、五果为助、五畜为益、五菜为充, 气味合而服之, 以补精益气"的基本原则; 结合食物的性味功效, "虚则补、实则泻、寒则热、热则寒"的治疗原则[55], 改善GC患者术后正气亏虚、脾胃虚弱. GC患者术后饮食应少食苦寒、生冷, 忌食辛辣之物, 以调理脾胃受损之症. 根据中医阴阳学说, 阴性食物如鸭肉、鸡蛋清、绿豆、芹菜、菠菜、萝卜、芦笋、西红柿、黄瓜、冬瓜、苹果、梨等; 阳性食物如猪肝、羊肉、鸡肉、韭菜、南瓜、山药、葱、姜、蒜、橘子、龙眼等[56]. 所以中医食疗认为根据GC患者体质和术后情况, 阳虚者可适当多食温性食物, 以补阳气不足, 而阴虚患者可适当多食寒凉食物, 以滋阴补阴[57]. 阳燥阴燥反之则需降阳补阴、降阴补阳.
放、化疗后人体胃肠功能下降、正气受损, 可进食五谷杂粮、甘温益气、易于消化的食物, 慢慢培扶人体的脾胃之气; 以脾胃受纳吸收为标准, GC术后脾胃虚弱者先进食五谷和甘温益气等食物同煮以养脾胃, 蛋白少量摄入, 使脾胃逐步恢复运作.
(1)放疗后宜采取滋养肺胃之阴法. GC术后放疗后, 由于放射线偏热, 属"火邪", 易损伤人体阴津, 脾胃阴虚可适量进食酸甘、养阴, 清热生津的食物果品[58,59], 如冬瓜、莲藕、山药、苦瓜、黄瓜、银耳、黄豆、梨子、百合、西红柿、鸭肉、乌鱼等. (2)化疗后宜采取健脾补中、祛痰利湿之法. GC术后化疗后, 胃肠功能下降, 食欲不振, 食而腹胀, 脾胃受病, 脾气运化不畅, 可食用人参茯苓粥, 薏米莲子粥, 补益脾胃[56,60], 或加入山楂、陈皮、山药、红豆、扁豆、萝卜等同煮. (3)术后恶病质态出现气血虚弱、气短乏力, 形气不足, 精神萎靡阳虚症者, 中医以甘能补能缓, 可食用小米粥、红豆、大枣、山药、薏米、海带、鸡汤、鸽子肉、阿胶、花生之类, 甘温益气[60]. 以上食物可与粥、肉糜炖煮至软烂食用或如淮山药、薏米、百合等中药食材可磨制成粉与粥同煮, 以便患者易消化吸收, 待慢慢恢复肠胃功能则可以食用日常做法的相应食物. 此外, 还可以通过医生辨症施食后加入适症的药材如当归, 白芍, 党参, 丹参, 黄芪, 甘草, 枸杞等, 做成药膳食用[61].
由于每个患者抗癌耐受力和术后不良反应因人而异, 故GC术后放、化疗以保守饮食, 甘温益气为主, 若深究阴阳虚燥, 还需经验丰富的中医学者根据患者个体化情况进行指导, 四诊合参, 辨症施食, 综合调理.
曹艳辉等[57]认为中医体质学应该与现代营养学找到结合的契合点, 中医体质学通过辨识患者体质, 辨体施食, 合理饮食来调整肿瘤患者体质. 续延军等[62]认为中医食疗可以改善适合与肠内营养联合治疗的粉剂、制剂等形式的剂型, 将食疗与肠内营养有机结合起来. 中医食疗、药膳本就具有其自身的应用规律, 严格遵守中药入食的基本原则, 注重个体辨证的准确性与选药的精当性, 选药配膳, 选用能够起到调理阴阳之效、性平和缓的药食以缓解症状, 是最宜GC术后患者的机体恢复延长生存期[63,64]. 国内外研究学者在研究中药作用机制的基础上, 也应扩大对药食同源的中药食材的研究, 进而开发并生产能够符合患者术后体质食用或服用的保健食品、饮品等, 如海带、山药、葛根相关研究和产品的开发应用[65-67]. 此外, 中医食疗在四诊合参的体系中还可以借鉴现代医学的评估体系诸如PG-SGA评价工具、中性粒细胞与淋巴细胞的比例(the neutrophil to lymphocyte ratio, NLR)预后模型和改良版Glasgow预后评估模型对患者炎症反应和营养状况作出评估, 以进一步诊断GC患者的恢复状态, 作出下一步的治疗方案, 以望完善中医食疗临床运用体系[33].
不论是快速康复饮食还是现代医学的要素营养饮食、传统的中医药膳饮食, 都表明饮食在GC术后康复的重要性. 一定程度上, 中医食疗即秉持中医"药食同源"的理论, 对GC患者术后康复进行辩证用食有一定的应用前景, 具有取材方便、原料充足、实用安全等优势, 临床上也体现出整体性疗效. 此外, 相对于现代医学的要素治疗而言, 传统中医更注重病人的整体生活质量和精神状态, 也容易被中国患者接受.
学科分类: 胃肠病学和肝病学
手稿来源地: 福建省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Choi YJ, Kim N. Gastric cancer and family history. Korean J Intern Med. 2016;31:1042-1053. [PubMed] [DOI] |
| 2. | Baker A, Wooten LA, Malloy M. Nutritional considerations after gastrectomy and esophagectomy for malignancy. Curr Treat Options Oncol. 2011;12:85-95. [PubMed] [DOI] |
| 3. | Sung B, Prasad S, Yadav VR, Lavasanifar A. Aggarwal B. B. Cancer and diet: How are they related? 2011. Free Radic Res. 2011;8:864-879. [PubMed] [DOI] |
| 4. | Javadi B. Diet Therapy for Cancer Prevention and Treatment Based on Traditional Persian Medicine. Nutr Cancer. 2018;70:376-403. [PubMed] [DOI] |
| 5. | Sun V, Kim J, Kim JY, Raz DJ, Merchant S, Chao J, Chung V, Jimenez T, Wittenberg E, Grant M. Dietary alterations and restrictions following surgery for upper gastrointestinal cancers: Key components of a health-related quality of life intervention. Eur J Oncol Nurs. 2015;19:343-348. [PubMed] [DOI] |
| 6. | Dewar SL, Porter J. The Effect of Evidence-Based Nutrition Clinical Care Pathways on Nutrition Outcomes in Adult Patients Receiving Non-Surgical Cancer Treatment: A Systematic Review. Nutr Cancer. 2018;70:404-412. [PubMed] [DOI] |
| 7. | Ding D, Feng Y, Song B, Gao S, Zhao J. Effects of preoperative and postoperative enteral nutrition on postoperative nutritional status and immune function of gastric cancer patients, 2015. Turk J Gastroenterol. 2015;2:181-185. [PubMed] [DOI] |
| 8. | Fearon K, Strasser F, Anker SD, Bosaeus I, Bruera E, Fainsinger RL, Jatoi A, Loprinzi C, MacDonald N, Mantovani G. Definition and classification of cancer cachexia: an international consensus. Lancet Oncol. 2011;12:489-495. [PubMed] [DOI] |
| 9. | McKenzie F, Biessy C, Ferrari P, Freisling H, Rinaldi S, Chajès V, Dahm CC, Overvad K, Dossus L, Lagiou P. Healthy Lifestyle and Risk of Cancer in the European Prospective Investigation Into Cancer and Nutrition Cohort Study. Medicine (Baltimore). 2016;95:e2850. [PubMed] [DOI] |
| 10. | Liu H, Ling W, Shen ZY, Jin X, Cao H. Clinical application of immune-enhanced enteral nutrition in patients with advanced gastric cancer after total gastrectomy. J Dig Dis. 2012;13:401-406. [PubMed] [DOI] |
| 11. | Gao P, Tsai C, Yang Y, Xu Y, Zhang C, Zhang C, Wang L, Liu H, Wang Z. Intraoperative radiotherapy in gastric and esophageal cancer: meta-analysis of long-term outcomes and complications. Minerva Med. 2017;108:74-83. [PubMed] [DOI] |
| 12. | Liu GF, Bair RJ, Bair E, Liauw SL, Koshy M. Clinical outcomes for gastric cancer following adjuvant chemoradiation utilizing intensity modulated versus three-dimensional conformal radiotherapy. PLoS One. 2014;9:e82642. [PubMed] [DOI] |
| 13. | Li G, Wang J, Hu W, Zhang Z. Radiation-Induced Liver Injury in Three-Dimensional Conformal Radiation Therapy (3D-CRT) for Postoperative or Locoregional Recurrent Gastric Cancer: Risk Factors and Dose Limitations. PLoS One. 2015;10:e0136288. [PubMed] [DOI] |
| 14. | Stansborough RL, Al-Dasooqi N, Bateman EH, Keefe DM, Gibson RJ. Radiotherapy-induced gut toxicity: Involvement of matrix metalloproteinases and the intestinal microvasculature. Int J Radiat Biol. 2016;92:241-248. [PubMed] [DOI] |
| 15. | Beck PL, Wong JF, Li Y, Swaminathan S, Xavier RJ, Devaney KL, Podolsky DK. Chemotherapy- and radiotherapy-induced intestinal damage is regulated by intestinal trefoil factor. Gastroenterology. 2004;126:796-808. [PubMed] |
| 16. | Brenner RM, Kivity S, Kundel Y, Purim O, Peled N, Idelevich E, Lavrenkov K, Kovel S, Fenig E, Sulkes A. Ethnic variation in toxicity and outcome of adjuvant chemoradiation for gastric cancer in Israel. Anticancer Res. 2013;33:5151-5157. [PubMed] |
| 17. | Liu Y, Feng Y, Gao Y, Hou R. Clinical benefits of combined chemotherapy with S-1, oxaliplatin, and docetaxel in advanced gastric cancer patients with palliative surgery. Onco Targets Ther. 2016;9:1269-1273. [PubMed] [DOI] |
| 18. | Navari RM. Pathogenesis-based treatment of chemotherapy-induced nausea and vomiting--two new agents. J Support Oncol. 2003;1:89-103. [PubMed] |
| 19. | Saito M, Tsukuda M. Review of palonosetron: emerging data distinguishing it as a novel 5-HT(3) receptor antagonist for chemotherapy-induced nausea and vomiting. Expert Opin Pharmacother. 2010;11:1003-1014. [PubMed] [DOI] |
| 20. | Chen Z, Chen W, Wang J, Zhu M, Zhuang Z. Pretreated baseline neutrophil count and chemotherapy-induced neutropenia may be conveniently available as prognostic biomarkers in advanced gastric cancer. Intern Med J. 2015;45:854-859. [PubMed] [DOI] |
| 21. | Ueda S, Yoshida M, Hashida H, Tada M, Takabayashi A, Kanai M. [Case report of gastric cancer patient who suffered life-threatening adverse events including severe myelosuppression during neoadjuvant chemotherapy with S-1 and CDDP combination]. Gan To Kagaku Ryoho. 2008;35:1577-1581. [PubMed] |
| 22. | Wei Z, Tan B, Cao S, Liu S, Tan X, Yao Z, Yin N, Li J, Zhang D, Zhou Y. The influence of neoadjuvant chemotherapy on gastric cancer patients' postoperative infectious complications: What is the negative role played by the intestinal barrier dysfunction? Oncotarget. 2017;8:43376-43388. [PubMed] [DOI] |
| 23. | Liberti MV, Locasale JW. The Warburg Effect: How Does it Benefit Cancer Cells? Trends Biochem Sci. 2016;41:211-218. [PubMed] [DOI] |
| 24. | Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011;144:646-674. [PubMed] [DOI] |
| 25. | Pressoir M, Desné S, Berchery D, Rossignol G, Poiree B, Meslier M, Traversier S, Vittot M, Simon M, Gekiere JP. Prevalence, risk factors and clinical implications of malnutrition in French Comprehensive Cancer Centres. Br J Cancer. 2010;102:966-971. [PubMed] [DOI] |
| 26. | Eming SA, Martin P, Tomic-Canic M. Wound repair and regeneration: mechanisms, signaling, and translation. Sci Transl Med. 2014;6:265sr6. [PubMed] [DOI] |
| 27. | Mustoe TA, O'Shaughnessy K, Kloeters O. Chronic wound pathogenesis and current treatment strategies: a unifying hypothesis. Plast Reconstr Surg. 2006;117:35S-41S. [PubMed] [DOI] |
| 28. | Midwood KS, Williams LV, Schwarzbauer JE. Tissue repair and the dynamics of the extracellular matrix. Int J Biochem Cell Biol. 2004;36:1031-1037. [PubMed] [DOI] |
| 29. | Marx W, Kiss N, McCarthy AL, McKavanagh D, Isenring L. Chemotherapy-Induced Nausea and Vomiting: A Narrative Review to Inform Dietetics Practice. J Acad Nutr Diet. 2016;116:819-827. [PubMed] [DOI] |
| 33. | Hsieh MC, Wang SH, Chuah SK, Lin YH, Lan J, Rau KM. A Prognostic Model Using Inflammation- and Nutrition-Based Scores in Patients With Metastatic Gastric Adenocarcinoma Treated With Chemotherapy. Medicine (Baltimore). 2016;95:e3504. [PubMed] [DOI] |
| 34. | Kehlet H. Multimodal approach to control postoperative pathophysiology and rehabilitation. Br J Anaesth. 1997;78:606-617. [PubMed] |
| 35. | Agudo A, Cayssials V, Bonet C, Tjønneland A, Overvad K, Boutron-Ruault MC, Affret A, Fagherazzi G, Katzke V, Schübel R. Inflammatory potential of the diet and risk of gastric cancer in the European Prospective Investigation into Cancer and Nutrition (EPIC) study. Am J Clin Nutr. 2018;107:607-616. [PubMed] [DOI] |
| 36. | Suehiro T, Matsumata T, Shikada Y, Sugimachi K. Accelerated rehabilitation with early postoperative oral feeding following gastrectomy. Hepatogastroenterology. 2004;51:1852-1855. [PubMed] |
| 37. | Shimizu N, Oki E, Tanizawa Y, Suzuki Y, Aikou S, Kunisaki C, Tsuchiya T, Fukushima R, Doki Y, Natsugoe S. Effect of early oral feeding on length of hospital stay following gastrectomy for gastric cancer: a Japanese multicenter, randomized controlled trial. Surg Today. 2018;48:865-874. [PubMed] [DOI] |
| 38. | Chen Hu J, Xin Jiang L, Cai L, Tao Zheng H, Yuan Hu S, Bing Chen H, Chang Wu G, Fei Zhang Y, Chuan Lv Z. Preliminary experience of fast-track surgery combined with laparoscopy-assisted radical distal gastrectomy for gastric cancer. J Gastrointest Surg. 2012;10:1830-1839. [PubMed] [DOI] |
| 40. | Kosuga T, Hiki N, Nunobe S, Noma H, Honda M, Tanimura S, Sano T, Yamaguchi T. Feasibility and nutritional impact of laparoscopy-assisted subtotal gastrectomy for early gastric cancer in the upper stomach. Ann Surg Oncol. 2014;21:2028-2035. [PubMed] [DOI] |
| 41. | Imamura H, Nishikawa K, Kishi K, Inoue K, Matsuyama J, Akamaru Y, Kimura Y, Tamura S, Kawabata R, Kawada J. Effects of an Oral Elemental Nutritional Supplement on Post-gastrectomy Body Weight Loss in Gastric Cancer Patients: A Randomized Controlled Clinical Trial. Ann Surg Oncol. 2016;23:2928-2935. [PubMed] [DOI] |
| 42. | De Luis DA, Izaola O, Terroba MC, Cuellar L, Ventosa M, Martin T. Effect of three different doses of arginine enhanced enteral nutrition on nutritional status and outcomes in well nourished postsurgical cancer patients: a randomized single blinded prospective trial. Eur Rev Med Pharmacol Sci. 2015;19:950-955. [PubMed] |
| 43. | Fabian CJ, Kimler BF, Hursting SD. Omega-3 fatty acids for breast cancer prevention and survivorship. Breast Cancer Res. 2015;17:62. [PubMed] [DOI] |
| 44. | Huang HH, Wu PC, Kang SP, Wang JH, Hsu CW, Chwang LC, Chang SJ. Postoperative hypocaloric peripheral parenteral nutrition with branched-chain-enriched amino acids provides no better clinical advantage than fluid management in nonmalnourished colorectal cancer patients. Nutr Cancer. 2014;66:1269-1278. [PubMed] [DOI] |
| 45. | Ohkura Y, Haruta S, Tanaka T, Ueno M, Udagawa H. Effectiveness of postoperative elemental diet (Elental®) in elderly patients after gastrectomy. World J Surg Oncol. 2016;14:268. [PubMed] [DOI] |
| 46. | Nishikawa K, Kishi K, Inoue K, Matsuyama J, Akamaru Y, Kimura Y, Tamura S, Kawabata R, Kawada J, Fujiwara Y. Evaluation of the effects of postoperative oral nutrition support on body weight in gastric cancer patients by using an elemental diet: A randomized study. J Clin Oncol. 2014;3. [DOI] |
| 47. | Dias Rodrigues V, Barroso de Pinho N, Abdelhay E, Viola JP, Correia MI, Brum Martucci R. Nutrition and Immune-Modulatory Intervention in Surgical Patients With Gastric Cancer. Nutr Clin Pract. 2017;32:122-129. [PubMed] [DOI] |
| 48. | McCorkle R, Ercolano E, Lazenby M, Schulman-Green D, Schilling LS, Lorig K, Wagner EH. Self-management: Enabling and empowering patients living with cancer as a chronic illness. CA Cancer J Clin. 2011;61:50-62. [PubMed] [DOI] |
| 52. | 杨 宏辉, 王 喜华, 冯 春古. 中医饮食调护对胃癌术后化疗患者营养状况的影响. 中国中医药现代远程教育. 2015;23:132-133. [DOI] |
| 55. | 肖 龙妹. 中医食疗在肿瘤患者中的应用效果观察. 中西医结合心血管病杂志. 2017;5:133. [DOI] |
| 57. | 曹 艳辉, 赵 丽婷, 刘 连云. 中医营养在肿瘤临床治疗中的应用进展. 肿瘤代谢与营养电子杂志. 2018;5:22. [DOI] |
| 59. | 吴 琼. 中医食疗在肿瘤患者康复中应用效果观察. 中西医结合心血管病杂志. 2016;4:121. [DOI] |