修回日期: 2018-09-30
接受日期: 2018-10-19
在线出版日期: 2018-11-18
胆汁反流性胃炎(bile reflux gastritis, BRG)是消化科常见疾病, 以腹痛、腹胀、恶心、呕吐等为临床特点, 严重影响患者生活质量.但目前其病因及发病机制尚不清楚, 可能与胃肠道手术、胆囊疾病、幽门螺杆菌感染、精神心理等因素有关, 其诊断方法较多, 但缺少统一诊断标准, 目前对其治疗多是对症治疗, 但总体疗效欠佳. 本文对BRG的病因、发病机制、诊断及治疗进行了综述, 以期为进一步研究BRG提供参考.
核心提要: 胆汁反流性胃炎(bile reflux gastritis, BRG)是消化科常见疾病, 可促进胃黏膜向肠上皮化生、不典型增生甚至癌变进展, 但存在疗效差、易复发等缺点, 本文综述了BRG的病因、发病机制、诊断及治疗, 以期为进一步研究BRG提供参考.
引文著录: 赵亚男, 许翠萍. 胆汁反流性胃炎病因病机及诊治进展. 世界华人消化杂志 2018; 26(32): 1886-1892
Revised: September 30, 2018
Accepted: October 19, 2018
Published online: November 18, 2018
Bile reflux gastritis is a common disease of the digestive system, whose clinical characteristics are abdominal pain, abdominal distention and nausea and vomiting, affecting the quality of life of patients seriously. However, the etiology and pathogenesis of bile reflux gastritis are still unclear, which may be related to gastrointestinal surgery, gallbladder disease, Helicobacter pylori infection, psychological factors, etc. There are many diagnostic methods, but a consensus on diagnosis is still lacking. Most of the current treatments are symptomatic treatments, but the overall efficacy is poor. This article reviews the etiology, pathogenesis, diagnosis and treatment of bile reflux gastritis, with an aim to provide a reference for further research of this disease.
- Citation: Zhao YN, Xu CP. Etiology, pathogenesis, diagnosis and treatment of bile reflux gastritis. Shijie Huaren Xiaohua Zazhi 2018; 26(32): 1886-1892
- URL: https://www.wjgnet.com/1009-3079/full/v26/i32/1886.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i32.1886
生理状态下, 胃肠收缩活动具有特定的周期性和规律性变化, 这种变化称为消化间期移行性运动复合波(migrating motorcomplex, MMC). MMC分为四相: Ⅰ相: 无收缩; Ⅱ相: 不规律收缩; Ⅲ相: 规律、高频、高幅收缩; Ⅳ相: 收缩快速衰减[1]. MMCⅡ相和Ⅲ相末期可出现生理性十二指肠逆蠕动, 此时少量的胆汁不会对胃黏膜造成损害, 但当继发(手术)或原发(神经、体液、内分泌)因素导致含有胆酸、溶血磷脂酰胆碱、胰酶的大量十二指肠液反流入胃时, 则会破坏胃黏膜并引起胃黏膜炎症, 称为胆汁反流性胃炎(bile reflux gastritis, BRG). BRG可分为继发性和原发性, 是慢性胃炎的一种特殊类型, 其反流的十二指肠液可导致胃黏膜腺体萎缩, 向肠上皮化生、不典型增生甚至癌变进展[2,3], 因此BRG越来越受到临床医生的重视.
学者最早在胃大部切除术后发现残胃胆汁反流, 之后逐渐发现幽门成形术、迷走神经切断术后等亦可出现胆汁反流[4].幽门管具有1.5 cm高压带, 使胃比十二指肠压力高5 mmHg, 上述手术破坏了幽门管高压带的解剖结构, 使十二指肠压力高于胃, 造成十二指肠内容物频繁、大量、持久地反流至胃, 引起胃黏膜炎症.综合多项[5-7]关于Roux-en-Y、毕Ⅰ式、毕Ⅱ式三种吻合术式对胆汁反流发生率的影响, Roux-en-Y吻合与其它吻合方式相比, 胆汁反流的发生率较低, 而由于毕Ⅱ式术后胃腔是胆汁进入下段肠腔的必经之路, 胆汁反流发生几率较高.
胆道系统、oddi括约肌、神经体液内分泌系统三者的正常运行保证了胆汁的规律排放[8]. 当机体存在胆囊炎、胆结石等疾病时, 胆道系统的充血、水肿、疼痛会刺激周围组织引起迷走神经兴奋, 一方面导致胃泌素(gastrin, GAS)、胃动素(motilin, MTL)等胃肠激素分泌增加, 引起胃肠蠕动紊乱, 另一方面消化间期oddi括约肌舒张, 导致排入十二指肠的胆汁增多, 以上两种机制共同促使胆汁反流的发生[9]. 胆囊切除术后病人因储存、浓缩胆汁的生理结构消失, 胆总管压力升高, 胆汁大量、无规律地排入十二指肠, 在MMCⅡ相和Ⅲ相末期反流入胃, 再者胆囊切除术后GAS、MLT、胆囊收缩素(cholecystokinin, CCK)、P物质(substance P, SP)等激素水平改变, 更容易引发胃肠蠕动功能紊乱, 导致胆汁逆流入胃[10].
张举垚等[11]运用症状自评量表评定BRG病人精神心理状况, 结果显示BRG病人躯体化、强迫症状、焦虑、抑郁、人际关系、敌对性、恐怖、偏执、精神病性等9个因子评分均高于对照组, 且评分越高, 反流程度可能越重. Agostini等[12]发现生活压力、焦虑等精神心理因素会影响内脏敏感性和胃肠动力. MLT、CCK和促胰液素等这些调节胆囊、胆管和胃肠运动的激素, 由胃肠神经、自主神经、中枢神经等多种神经递质介导产生, 因在脑和胃肠道双重分布, 称为脑肠肽[13]. 异常的精神心理变化可对大脑边缘系统造成不良刺激, 从而通过脑-肠轴影响脑肠肽的分泌, 导致胃肠蠕动紊乱及胆汁排放异常, 引起BRG的发生.
幽门螺杆菌(Helicobacter pylori, H. pylori)是否在BRG中起致病作用目前尚有争议. Manifold[14]认为H. pylori感染与胆汁反流是两个互相独立的状态, 但有研究[15]发现H. pylori阳性的BRG病人胃腔内胆汁酸浓度远高于H. pylori阴性的BRG病人, 且胃黏膜损伤更严重. 还有研究[16]表明, H. pylori阳性病人血浆中GAS高于H. pylori阴性病人, 高水平的GAS可引起胃-幽门-十二指肠运动失调, 导致过量的十二指肠液反流入胃. 总之, 多数研究者认为H. pylori感染可显著增加胆汁反流的程度, 是加重BRG胃黏膜损伤的一个重要因素[17,18].
BRG还与糖尿病、肝炎、胰腺炎、消化性溃疡、性别、年龄、嗜烟酒、缺乏运动、便秘以及长期服用阿片类止疼药等有关[19]. 糖尿病病人常因胃肠植物神经受损发生糖尿病性胃轻瘫, 导致胃排空延迟, 易发生胆汁反流; 肝炎、胰腺炎病人各种消化酶产生减少, 消化功能下降, 胃窦-幽门-十二指肠协同运动失调, 不能及时清除反流入胃的胆汁; 消化性溃疡病人幽门或球腔变形, 导致幽门关闭不全, 胆汁易向胃腔反流; 有研究[20]表明, BRG与吸烟、酗酒、年龄、性别有关, 以30-50岁发病居多, 女性多于男性; BRG病人常存在餐后缺乏运动、夜间加餐等不良生活习惯, 加强运动可改善症状; 便秘病人胃肠动力差, 易发生胆汁反流; 阿片类药物在胃肠道的分布比例较高, 长期口服可引起阿片类药物相关的肠功能紊乱(opioid-induced bowel dysfunction, OIBD), 增加胆汁反流的可能[21]. 在临床上还有许多BRG病人病因不明, 还需我们探索更多与之相关的因素.
当胆汁酸浓度>2.0 mmol/L时即有胃黏膜损伤, 关于胆汁损伤胃黏膜机制存在以下观点: (1)胆汁中的次级胆汁酸和游离胆汁酸反流入胃, 可破坏上皮细胞的脂蛋白层, 导致胃黏膜屏障受损, 使H+逆向弥散, 刺激肥大细胞产生组胺, 从而引起胃黏膜充血等变化; (2)胰液中的磷脂酶A2与胆汁中卵磷脂可被转化成有活性的溶血性卵磷脂, 它可降低黏液黏滞性及弹性, 溶解上皮细胞膜的磷脂, 使反流液中的胰酶进入胃壁深层组织; (3)胆盐能刺激胃黏膜释放GAS, 使胃酸和胃蛋白酶分泌增加, 加重胃黏膜损伤[22]; (4)胆汁与胃酸可起协同致病作用, 当胃液pH≤3.5时, 胆汁酸对胃黏膜的侵袭力增强, 在消化酶等成分的作用下进入细胞与细胞间的紧密连接, 导致黏膜细胞和组织损伤, 同时减弱胃黏膜的多种保护机制; (5)反流的十二指肠液中含有大量有毒的肠道细菌, 造成胃微生物菌群紊乱, 当胃黏膜被胆汁破坏后, 有害菌群可进入胃黏膜加重炎症反应[23]; (6)胆汁酸还可通过与法尼酯衍生物受体(farnesoid derivative receptor, FXR)结合, 上调尾型相关同源盒转录因子-2(caudal type homeobox transcription factor-2, CDX2)和黏液蛋白基因(mucin 2, MUC2)的表达, 诱导胃黏膜肠上皮化生[24], 并可通过激活G蛋白胆汁酸耦连受体5促进胃腺癌细胞增殖[25].
(1)H. pylori加重胆汁反流的程度: H. pylori可以分泌大量尿素酶产生氨, 改变局部酸性环境, 使H+反渗至胃黏膜引起炎症, 胃的酸性环境被破坏后可干扰正常胃酸对GAS的反馈抑制, 促使G细胞分泌GAS, 另外胃黏膜炎症释放出的炎性介质亦促使G细胞释放GAS, 从而抑制幽门括约肌的收缩、延缓胃排空, 导致胆汁与胃黏膜的接触时间延长, 加重胆汁反流[26]; (2)胆汁反流加重H. pylori对胃黏膜的炎症反应: 有研究发现在H. pylori阳性的病人中, 胆汁酸浓度与胃黏膜萎缩和肠化生存在显著相关性.胆汁和H. pylori两种致病因子对胃黏膜起协同损害作用[27].
BRG临床表现缺乏特异性, 腹痛、腹胀、恶心、呕吐胆汁是其显著特征, 亦可表现为嗳气、烧心、反酸、肠鸣、排便不畅、食欲减退以及体重下降等; 严重者还可有消化道出血, 表现为呕血或黑便.除此之外, BRG还可导致反流性食管炎、咽炎、声带炎, 甚至气管炎、肺炎、急性胆源性胰腺炎, 出现声音嘶哑、咳嗽、咳痰、急性腹痛等临床症状[28-30].
内镜插入静止1 min以上, 幽门口仍有胆汁反流或黏液湖黄染、附壁可见胆汁斑, 胃窦部近幽门处或吻合口周围可见充血、水肿、变脆、糜烂等炎症表现.
3.2.1 BRG内镜下分级: 参照Kellosalo[31]分级, 根据黏液湖量和颜色将BRG分Ⅰ、Ⅱ、Ⅲ三度. Ⅰ度指少量黄色泡沫从幽门口涌出和(或)黏液湖呈淡黄色; Ⅱ度指黄色泡沫从幽门口涌出和(或)黏液湖呈黄绿色; Ⅲ度指黄色泡沫从幽门口频繁流出和(或)持续性喷射出或胃内布满黄绿色黏液. Ⅰ度通常为常规内镜对咽喉部等产生刺激时胃底体肌肉舒张及体积增大、胃窦逆向蠕动或幽门口松弛诱发的假性反流[32], 不作为BRG的诊断标准.
3.2.2 不同病因BRG内镜下表现比较: 因胃大部切除术引起的胆汁反流黏液湖多呈金黄色, 不易冲洗; 因胆道疾病引起的胆汁反流内镜下多呈现黄绿色, 多以绿色为主; 因精神压力引起的胆汁反流内镜下多呈深黄色, 黏液湖稠腻[33]. 临床上各种病因引起的内镜下表现并非如此绝对, 还需结合病史进行诊断.
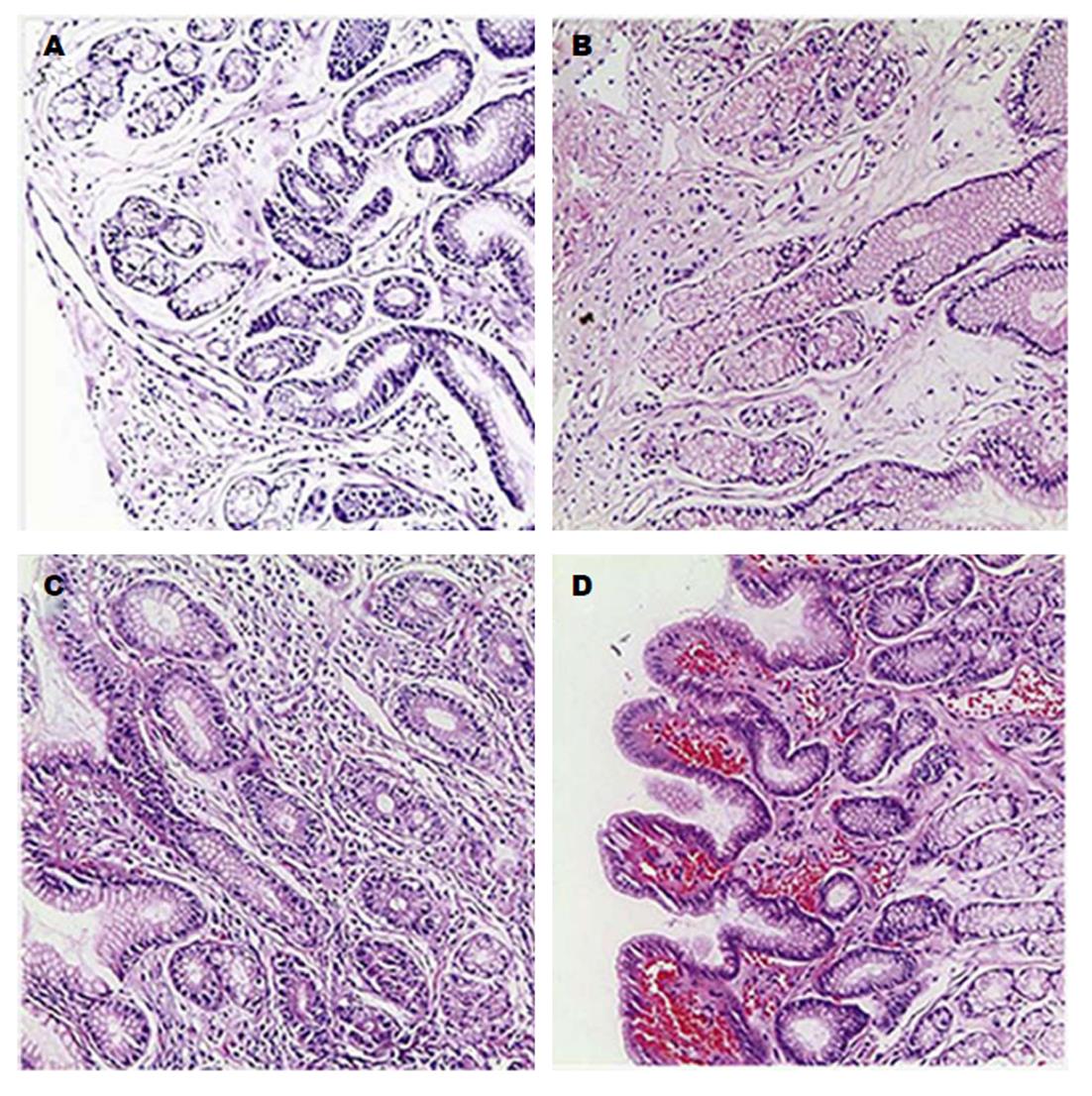
组织学检查可见胃小凹增生、间质水肿、固有膜平滑肌纤维增生、黏膜表面毛细血管扩张和炎细胞浸润等表现, 严重者可出现肠化生、腺体萎缩和异型增生[34](图1). 根据Dixon等[35]提出的病理积分标准, 手术胃积分>10分考虑BRG, 但其在非手术胃中的诊断未得到肯定. 1993年Sobala等[36]提出了胆汁反流指数(bile reflux index, BRI)概念, 根据黏膜固有层水肿、肠上皮化生、慢性炎症程度及幽门螺杆菌定植密度分别记0-3分, BRI = 7×固有层水肿+3×肠化生+4×慢性炎症-6×H. pylori密度, 当胃内胆汁酸浓度>1.00 mmol/L时, BRI>14诊断BRG具有较高的敏感性(70%)和特异性(85%).
此方法是经静脉注入99mTc-EHIDA(二乙基乙酰苯胺亚氨二醋酸), 该核素经肝由胆汁排泄, 通过追踪核素观察是否有胆汁反流入胃, 当胃内放射性与静脉注入总量比率>1 %时即呈阳性[37], 能精确测定胆汁反流量, 具有敏感性高、非侵入性等优点.其缺点为会因肝脏和胃肠道显影的重叠造成诊断偏差, 以致影响十二指肠胃反流定量的结果.近年来有国外学者[38]在放射性核素扫描基础上, 基于流体力学和光流技术, 利用SPECT/CT二维图像分析和三维重建技术, 可准确定位胃的位置并对反流的胆汁进行定量检测.
Bilitec2000是通过经鼻留置含分光光度计探头的导管, 检测食管和胃内吸收光波长在450-470 nm(胆红素吸收峰)的物质, 定量检测反流胆汁.胆红素吸收值>0.14 U为存在胆汁反流, 以胆红素吸收值>0.14 U时间的百分比表示胆汁反流严重程度.该检查能较准确反映胃内胆汁酸浓度, 是目前监测胃内胆汁反流最可靠可行的方法.但其存在易受胡萝卜等吸光度值与胆红素相近的食物影响、价格昂贵、酸性环境吸收峰会发生偏移等缺点.
临床上通常以胃液pH≥4.0诊断为胆汁反流, 但有研究表明, 胃液pH值的变化与胆汁反流无明显相关性, 因为此检查并不能区别胆汁、唾液和碳酸氢盐对胃液pH值的影响, 仅能单纯反映胃液的酸碱度, 因此该检查对胆汁反流的诊断价值还有待商榷.
BRG的治疗策略主要分为以下两点: (1)结合、吸附胆汁, 保护胃黏膜, 减少胆汁对胃黏膜的损伤; (2)预防反流, 使胃-幽门-十二指肠协同运动得到改善.
BRG病人应改正不良生活习惯, 比如: 细嚼慢咽; 忌暴饮暴食、高脂饮食; 忌浓茶、烈酒、浓咖啡、辛辣、过冷过热、过甜、粗糙等刺激性食物; 减少精神压力、保持心情舒畅; 饭后适量运动, 避免久坐.
4.2.1 抑酸剂: 胆汁在胃黏膜细胞中的累积呈pH依赖, 当pH≤4.0时, 胆汁可加速正常细胞致癌因子的表达[39], 对胃黏膜损害更重, 因此需加用抑酸剂提高胃液pH. 临床常用的抑酸剂为质子泵抑制剂(proton pump inhibitor, PPI), 它是通过与壁细胞H+-K+-ATP酶的半胱氨酸残基结合来减少胃酸、胃蛋白酶、胰液、胆汁的分泌, 从而减轻胃黏膜的损伤[40]. 临床常用的PPI有: 泮托拉唑、雷贝拉唑、奥美拉唑、艾司奥美拉唑、艾普拉唑等.
4.2.2 胃黏膜保护剂: 胃黏膜保护剂的使用可有效抵御胆汁对胃壁深层组织进一步侵害, 其主要分为以下几类: 前列腺素及其衍生物(米索前列醇)、铝剂(硫糖铝、铝碳酸镁)、铋剂(枸橼酸铋钾)以及新型胃黏膜保护剂(替普瑞酮、瑞巴派特), 它们通过不同机制在胃黏膜形成一层保护屏障, 促进胃黏膜修复.
4.2.3 促胃肠动力剂: 胆汁反流发生的基础是胃-十二指肠协同运动失调, 因此恢复胃-十二指肠协同运动尤为关键.临床上最常用的为5-HT4受体激动剂和多巴胺D2受体拮抗剂. 5-HT4受体激动剂可以激动肠肌间神经丛的5-HT4受体, 使神经末梢的乙酰胆碱释放增加, 从而促进胃肠道平滑肌的运动, 临床上最常用的为莫沙必利. 多巴胺D2受体拮抗剂通过特异性拮抗胃肠道平滑肌的D2受体发挥其促动力作用, 最具代表性的是多潘立酮, 多潘立酮能够增加餐后胆囊收缩幅度, 促进胆囊排空, 在调节胃动力和胆囊功能方面有独特优势. 另外, 有许多中成药也有促胃动力作用, 如枳术宽中, 其对抑制胆汁反流有很好的疗效[41].
4.2.4 调节胆汁成分药: 熊去氧胆酸治疗BRG的主要机制是使胆汁内各类胆酸的比例产生变化, 使胆汁酸主要成分变为具有很高亲水性且无细胞毒性的熊去氧胆酸, 其能与胃黏膜中的黏蛋白络合形成一层保护膜, 并促进胃黏膜上皮细胞的移行与修复, 从而有效减轻反流的胆汁与胃酸对胃黏膜的刺激[42]. 除此之外, 熊去氧胆酸能够对胆汁中胆固醇含量进行调整, 有效降低胆汁中胆固醇的相对浓度, 有利于结石表面上胆固醇的溶解[43].
4.2.5 抗焦虑药: 临床研究[44]发现, 对于伴焦虑抑郁的BRG病人, 在使用胃黏膜保护剂和促胃肠动力剂的基础上加用黛力新, 能显著提高治疗有效率. 黛力新是由美利曲辛和氟哌噻吨组成的合剂, 氟哌噻吨属于神经阻滞剂, 可作用于突触前膜多巴胺受体(D2受体), 促进多巴胺的合成和释放, 小剂量具有抗焦虑抑郁作用. 美利曲辛是双向抗抑郁剂, 通过抑制突触前膜对去甲肾上腺素及5-羟色胺的再摄取, 提高突触间隙单胺类递质的含量[45]. 二者综合作用提高了多种神经递质的含量, 从而改善病人精神症状.
4.2.6 BRG合并H. pylori感染的治疗: 鉴于胆汁酸和H. pylori两者对胃黏膜的协同损害以及H. pylori胃炎京都全球共识[46]提出的治疗意见, 对H. pylori阳性病人应积极根除H. pylori治疗. 但有研究[47]显示PPI在抑制胃酸分泌的同时会增加甘氨胆酸等可溶性胆汁酸的浓度, 进而会影响胃炎的类型和严重程度.相反, 也有研究认为低酸环境下高浓度胆汁酸可使H. pylori变形死亡, PPI抑制胃酸分泌后可反馈性增强胆汁酸对H. pylori的抑制[27]. 因此对BRG合并H. pylori感染的治疗有待我们进一步探讨.
症状严重而内科治疗无效者可行手术治疗, 对毕Ⅰ式或毕Ⅱ式胃切除术后病人, 可采用Roux-en-Y术; 对胆囊切除术后病人, 可采用胆道-空肠吻合术; 对Roux-en-Y术式胃大部切除术后病人, 有国外学者[48]建议, 行残胃切除术可有效缓解胆汁反流引起的上腹痛、反酸、恶心等症状.
随着内镜技术的开展, 人们不断深入对BRG的认识. 本文对BRG的病因、发病机制、诊断、治疗进行了综述, 其中还有许多未知, 比如: (1)部分原发性BRG病人病因及发病机制不明, 可能与精神压力大、不良生活习惯有关(见表1), 需进一步制定多中心、大规模临床试验; (2)原发性BRG缺乏统一的诊断标准, 临床表现、内镜表现及病理改变均无特异性, 胆汁反流的量和胃黏膜炎症程度缺乏量化指标, 24 h Bilitec2000诊断价值高, 但因价格昂贵难以在临床广泛开展; (3)治疗上无共识指南可供参考, 多是对症及经验性治疗, 但存在疗效差、易复发等特点; (4)胆汁反流与H. pylori感染的关系尚不明确, 且是否根除H. pylori尚存在争议. 这些问题需要学者们进行更精细化、系统化的研究和探讨.
| 病因 | 相关发病机制 |
| 胃肠道手术 | 胃肠道手术破坏了幽门的解剖结构, 使胃内压力低于十二指肠 |
| 胆囊疾病 | 胆囊疾病可影响胃肠激素的分泌, 导致胆汁排放异常 |
| 精神心理因素 | 精神心理因素可通过肠脑轴影响脑肠肽分泌, 引起胃肠蠕动紊乱 |
| H. pylori感染 | 具体机制尚无定论, 可能与高水平的GAS引起胃-十二指肠运动失调有关 |
| 其他 | |
| 糖尿病 | 糖尿病病人胃肠植物神经受损可发生糖尿病性胃轻瘫, 导致胃排空延迟, |
| 肝炎、胰腺炎 | 各种消化酶产生减少, 消化功能下降, 胃-十二指肠协同运动失调 |
| 消化性溃疡 | 幽门或球腔变形, 导致幽门关闭不全, 使胆汁反流入胃的机会增加 |
| 不良生活习惯 | 吸烟、饮酒、缺乏运动等可导致BRG, 具体机制尚不明确 |
| 便秘 | 可能与便秘病人胃肠动力差有关 |
| 阿片类药物 | 阿片类药物可减少胃酸的分泌, 减慢胃肠蠕动, 增加BRG发生的可能 |
学科分类: 胃肠病学和肝病学
手稿来源地: 山西省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Deloose E, Janssen P, Depoortere I, Tack J. The migrating motor complex: control mechanisms and its role in health and disease. Nat Rev Gastroenterol Hepatol. 2012;9:271-285. [PubMed] [DOI] |
| 2. | Matsuhisa T, Arakawa T, Watanabe T, Tokutomi T, Sakurai K, Okamura S, Chono S, Kamada T, Sugiyama A, Fujimura Y. Relation between bile acid reflux into the stomach and the risk of atrophic gastritis and intestinal metaplasia: a multicenter study of 2283 cases. Dig Endosc. 2013;25:519-525. [PubMed] [DOI] |
| 3. | Wang X, Sun L, Wang X, Kang H, Ma X, Wang M, Lin S, Liu M, Dai C, Dai Z. Acidified bile acids enhance tumor progression and telomerase activity of gastric cancer in mice dependent on c-Myc expression. Cancer Med. 2017;6:788-797. [PubMed] [DOI] |
| 5. | Shim JH, Oh SI, Yoo HM, Jeon HM, Park CH, Song KY. Roux-en-Y gastrojejunostomy after totally laparoscopic distal gastrectomy: comparison with Billorth II reconstruction. Surg Laparosc Endosc Percutan Tech. 2014;24:448-451. [PubMed] [DOI] |
| 6. | Cai Z, Zhou Y, Wang C, Yin Y, Yin Y, Shen C, Yin X, Chen Z, Zhang B. Optimal reconstruction methods after distal gastrectomy for gastric cancer: A systematic review and network meta-analysis. Medicine (Baltimore). 2018;97:e10823. [PubMed] [DOI] |
| 7. | Wu JZ, Fukunaga T, Oka S, Kanda S, Ishibashi Y, Yube Y, Shen GH. Comparative study of outcomes of Roux-en-Y reconstruction and Billroth Ⅰ reconstruction performed after radical distal gastrectomy. Asian J Surg. 2018;pii:S1015-9584(18)30254-9. [PubMed] [DOI] |
| 8. | Xia HT, Wang J, Yang T, Liang B, Zeng JP, Dong JH. Sphincter of Oddi Dysfunction and the Formation of Adult Choledochal Cyst Following Cholecystectomy: A Retrospective Cohort Study. Medicine (Baltimore). 2015;94:e2088. [PubMed] [DOI] |
| 9. | 商 西丹, 赵 新华, 敬 长春, 岳 宗柱, 李 之慧. 胆汁反流性胃炎与胆囊炎的临床相关性研究. 中华消化病与影像杂志(电子版). 2015;5:234-237. [DOI] |
| 12. | Agostini A, Ballotta D, Righi S, Moretti M, Bertani A, Scarcelli A, Sartini A, Ercolani M, Nichelli P, Campieri M. Stress and brain functional changes in patients with Crohn's disease: A functional magnetic resonance imaging study. Neurogastroenterol Motil. 2017;29:1-10. [PubMed] [DOI] |
| 13. | Bliss ES, Whiteside E. The Gut-Brain Axis, the Human Gut Microbiota and Their Integration in the Development of Obesity. Front Physiol. 2018;9:900. [PubMed] [DOI] |
| 14. | Manifold DK, Anggiansah A, Rowe I, Sanderson JD, Chinyama CN, Owen WJ. Gastro-oesophageal reflux and duodenogastric reflux before and after eradication in Helicobacter pylori gastritis. Eur J Gastroenterol Hepatol. 2001;13:535-539. [PubMed] |
| 15. | Tatsugami M, Ito M, Tanaka S, Yoshihara M, Matsui H, Haruma K, Chayama K. Bile acid promotes intestinal metaplasia and gastric carcinogenesis. Cancer Epidemiol Biomarkers Prev. 2012;21:2101-2107. [PubMed] [DOI] |
| 16. | Matsuhisa T, Tsukui T. Relation between reflux of bile acids into the stomach and gastric mucosal atrophy, intestinal metaplasia in biopsy specimens. J Clin Biochem Nutr. 2012;50:217-221. [PubMed] [DOI] |
| 17. | Mukaisho K, Nakayama T, Hagiwara T, Hattori T, Sugihara H. Two distinct etiologies of gastric cardia adenocarcinoma: interactions among pH, Helicobacter pylori, and bile acids. Front Microbiol. 2015;6:412. [PubMed] [DOI] |
| 18. | Huang H, Tian J, Xu X, Liang Q, Huang X, Lu J, Yao Y. A study on the roles of Helicobacter pylori in bile reflux gastritis and gastric cancer. J BUON. 2018;23:659-664. [PubMed] |
| 19. | McCabe ME 4th, Dilly CK. New Causes for the Old Problem of Bile Reflux Gastritis. Clin Gastroenterol Hepatol. 2018;16:1389-1392. [PubMed] [DOI] |
| 21. | Candy B, Jones L, Vickerstaff V, Larkin PJ, Stone P. Mu-opioid antagonists for opioid-induced bowel dysfunction in people with cancer and people receiving palliative care. Cochrane Database Syst Rev. 2018;6:CD006332. [PubMed] [DOI] |
| 22. | Nogi K, Haruma K, Taniguchi H, Yomota E, Okajima M, Hananoki M, Hata J, Kusunoki H, Onoda Y. Duodenogastric reflux following cholecystectomy in the dog: role of antroduodenal motor function. Aliment Pharmacol Ther. 2001;15:1233-1238. [PubMed] |
| 23. | Igarashi M, Nakae H, Matsuoka T, Takahashi S, Hisada T, Tomita J, Koga Y. Alteration in the gastric microbiota and its restoration by probiotics in patients with functional dyspepsia. BMJ Open Gastroenterol. 2017;4:e000144. [PubMed] [DOI] |
| 24. | Xu Y, Watanabe T, Tanigawa T, Machida H, Okazaki H, Yamagami H, Watanabe K, Tominaga K, Fujiwara Y, Oshitani N. Bile acids induce cdx2 expression through the farnesoid x receptor in gastric epithelial cells. J Clin Biochem Nutr. 2010;46:81-86. [PubMed] [DOI] |
| 25. | Cao W, Tian W, Hong J, Li D, Tavares R, Noble L, Moss SF, Resnick MB. Expression of bile acid receptor TGR5 in gastric adenocarcinoma. Am J Physiol Gastrointest Liver Physiol. 2013;304:G322-G327. [PubMed] [DOI] |
| 28. | Aldhahrani A, Powell J, Ladak S, Ali M, Ali S, Verdon B, Pearson J, Ward C. The Potential Role of Bile Acids in Acquired Laryngotracheal Stenosis. Laryngoscope. 2018;128:2029-2033. [PubMed] [DOI] |
| 29. | Hunt EB, Sullivan A, Galvin J, MacSharry J, Murphy DM. Gastric Aspiration and Its Role in Airway Inflammation. Open Respir Med J. 2018;12:1-10. [PubMed] [DOI] |
| 30. | Ferdek PE, Jakubowska MA, Gerasimenko JV, Gerasimenko OV, Petersen OH. Bile acids induce necrosis in pancreatic stellate cells dependent on calcium entry and sodium-driven bile uptake. J Physiol. 2016;594:6147-6164. [PubMed] [DOI] |
| 31. | Kellosalo J, Alavaikko M, Laitinen S. Effect of biliary tract procedures on duodenogastric reflux and the gastric mucosa. Scand J Gastroenterol. 1991;26:1272-1278. [PubMed] |
| 32. | 衡 南桦. 无痛胃镜在诊断胆汁反流性胃炎中的临床应用探析. 中国医学前沿杂志(电子版). 2014;6:106-108. [DOI] |
| 34. | Zhang Y, Yang X, Gu W, Shu X, Zhang T, Jiang M. Histological features of the gastric mucosa in children with primary bile reflux gastritis. World J Surg Oncol. 2012;10:27. [PubMed] [DOI] |
| 35. | Dixon MF, O'Connor HJ, Axon AT, King RF, Johnston D. Reflux gastritis: distinct histopathological entity? J Clin Pathol. 1986;39:524-530. [PubMed] |
| 36. | Sobala GM, O'Connor HJ, Dewar EP, King RF, Axon AT, Dixon MF. Bile reflux and intestinal metaplasia in gastric mucosa. J Clin Pathol. 1993;46:235-240. [PubMed] |
| 38. | Lo RC, Huang WL, Fan YM. Evaluation of bile reflux in HIDA images based on fluid mechanics. Comput Biol Med. 2015;60:51-65. [PubMed] [DOI] |
| 39. | Vageli DP, Doukas SG, Spock T, Sasaki CT. Curcumin prevents the bile reflux-induced NF-κB-related mRNA oncogenic phenotype, in human hypopharyngeal cells. J Cell Mol Med. 2018;22:4209-4220. [PubMed] [DOI] |
| 40. | Mermelstein J, Chait Mermelstein A, Chait MM. Proton pump inhibitor-refractory gastroesophageal reflux disease: challenges and solutions. Clin Exp Gastroenterol. 2018;11:119-134. [PubMed] [DOI] |
| 41. | Zhang C, Guo L, Guo X, Guo X, Li G. Clinical curative effect of electroacupuncture combined with zhizhukuanzhong capsules for treating gastroesophageal reflux disease. J Tradit Chin Med. 2012;32:364-371. [PubMed] |
| 42. | Mroz MS, Lajczak NK, Goggins BJ, Keely S, Keely SJ. The bile acids, deoxycholic acid and ursodeoxycholic acid, regulate colonic epithelial wound healing. Am J Physiol Gastrointest Liver Physiol. 2018;314:G378-G387. [PubMed] [DOI] |
| 43. | Desai AJ, Dong M, Harikumar KG, Miller LJ. Impact of ursodeoxycholic acid on a CCK1R cholesterol-binding site may contribute to its positive effects in digestive function. Am J Physiol Gastrointest Liver Physiol. 2015;309:G377-G386. [PubMed] [DOI] |
| 45. | Wang L, Zhong Z, Hu J, Rong X, Liu J, Xiao S, Liu Z. Sertraline plus deanxit to treat patients with depression and anxiety in chronic somatic diseases: a randomized controlled trial. BMC Psychiatry. 2015;15:84. [PubMed] [DOI] |
| 46. | Sugano K, Tack J, Kuipers EJ, Graham DY, El-Omar EM, Miura S, Haruma K, Asaka M, Uemura N, Malfertheiner P; faculty members of Kyoto Global Consensus Conference. Kyoto global consensus report on Helicobacter pylori gastritis. Gut. 2015;64:1353-1367. [PubMed] [DOI] |
| 47. | Mukaisho K, Hagiwara T, Nakayama T, Hattori T, Sugihara H. Potential mechanism of corpus-predominant gastritis after PPI therapy in Helicobacter pylori-positive patients with GERD. World J Gastroenterol. 2014;20:11962-11965. [PubMed] [DOI] |
| 48. | Vella E, Hovorka Z, Yarbrough DE, McQuitty E. Bile reflux of the remnant stomach following Roux-en-Y gastric bypass: an etiology of chronic abdominal pain treated with remnant gastrectomy. Surg Obes Relat Dis. 2017;13:1278-1283. [PubMed] [DOI] |