修回日期: 2018-09-29
接受日期: 2018-10-19
在线出版日期: 2018-11-08
诱导非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)合并2型糖尿病(type 2 diabetes,T2DM)大鼠模型.
高脂高糖饮食结合小剂量链脲佐菌素(streptozotocin, STZ)腹腔注射建立非酒精性脂肪肝T2DM-大鼠模型. 70只无特定病原体(specific pathogen free, SPF)级200-220 g雌性Wistar大鼠随机分为2组: 正常对照组(普通饮食喂养, n = 15)及模型组(高糖高脂喂养后腹腔注射30 mg/kg STZ, n = 55). 比较喂养4 wk、7 wk时,各组大鼠饮食量、饮水量、体重、葡萄糖耐量试验(oral glucose tolerance test, OGTT)及其曲线下面积(area under the curve, AUC)变化, 比较喂养7 wk时各组大鼠血清甘油三酯(triglyceride, TG)、血清总胆固醇(total cholesterol, TC)、谷丙转氨酶(alanine amino transferase, ALT)、谷草转氨酶(glutamic-oxalacetic transaminase, AST)、Ⅲ型前胶原氨端肽(procollagen Ⅲ amino-terminal peptide, PⅢNP)及透明质酸(hyal- uronic acid, HA)、胰岛素(fasting serum insulin, FINs)、胰岛素抵抗指数(insulin resistence index, HOMA-IR)水平变化, 并于喂养2 wk、4 wk和7 wk时观察各组大鼠肝脏病理结构的改变.
喂养7 wk时, 与正常对照组相比, 模型组大鼠OGTT及其AUC、体重、饮食量、饮水量、TG、TC、FINs、HOMA-IR、ALT、AST、PⅢNP、HA明显高升高有显著统计学差异(P<0.01), 随着造模时间的延长, 光镜下肝细胞由单纯脂肪变性加重, 最终出现大泡型或以大泡为主的混合性肝细胞脂肪变, 胶原蛋白明显增多, 为典型NAFLD病理改变.
小剂量腹腔注射STZ并高糖高脂饲料喂养可诱导稳定的NAFLD T2DM大鼠模型.
核心提要: 非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)并非单一的肝脏疾病, 是胰岛素抵抗及2型糖尿病等代谢综合征相关组分在肝脏集中表现, 目前营养和药物复合诱导的NAFLD动物模型, 因能涵盖NAFLD疾病特征, 广泛应用于基础研究, 但仍普遍存在造模方法及判定模型成功标准不统一的问题, 以葡萄糖耐量试验及时间-血糖曲线下面积作为判定模型成功标准之一, 能模拟NAFLD代谢紊乱背景并尽可能减少诱导药物的不良影响.
引文著录: 柯淑红, 郑承红, 彭聪, 周扬, 马威. 非酒精性脂肪性肝病合并2型糖尿病大鼠模型的建立. 世界华人消化杂志 2018; 26(31): 1805-1811
Revised: September 29, 2018
Accepted: October 19, 2018
Published online: November 8, 2018
To develop a rat model of non-alcoholic fatty liver disease combined with type 2 diabetes (T2DM).
T2DM combined with nonalcoholic fatty liver disease was induced in rats by feeding a high-glucose and high-fat diet and injection of low dose streptozotocin. Seventy specific pathogen free female Wistar rats (200-220 g) were randomly divided into two groups: a model group (injection with 30 mg/kg streptozotocin after feeding a high-glucose and high-fat diet, n = 55) and a normal control group (n = 15). At 4 wk and 7 wk, the level of blood glucose was evaluated by the oral glucose tolerance test (OGTT), and body weight (BW), food intake, and water intake were measured. At 7 wk, fasting serum insulin (FINs), triglyceride (TG) , total cholesterol (TC), alanine aminotransferase (ALT), glutamic-oxalacetic transaminase (AST), procollagen Ⅲ amino-terminal peptide (PIIINP), and hyaluronic acid (HA) were tested, and insulin resistance index (HOMA-IR) and the area under the curve (AUC) were calculated. At 2 wk, 4 wk, and 7 wk, pathological changes of liver tissues were detected by Masson staining and HE staining.
At 7 wk, the levels of OGTT, AUC, BW, food intake, and water intake were significantly higher in the model group compared with the normal control group (P < 0.01). The levels of serum TG, TC, FINs, HOMA-IR, ALT, AST, PⅢNP, and HA were also significantly higher (P < 0.01) in the model group than in the normal control group (P < 0.01). With the prolongation of model making time, simple fatty degeneration of hepatocytes observed under a light microscope was aggravated as large vacuole type or large vacuole predominant mixed type fatty degeneration, with obviously increased collagen deposition, which were consistent with typical pathological changes of non-alcoholic fatty liver disease. These findings indicated that a rat model of nonalcoholic fatty liver disease combined with T2DM was successfully developed.
Low dose STZ injection plus a high-glucose and high-fat diet can induce nonalcoholic fatty liver disease combined with T2DM in rats.
- Citation: Ke SH, Zheng CH, Peng C, Zhou Y, Ma W. Establishment of a rat model of non-alcoholic fatty liver disease combined with type 2 diabetes. Shijie Huaren Xiaohua Zazhi 2018; 26(31): 1805-1811
- URL: https://www.wjgnet.com/1009-3079/full/v26/i31/1805.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i31.1805
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)是种以肝细胞脂质过多为特征的连续性疾病, 包括非酒精性单纯性肝脂肪变、非酒精性脂肪性肝炎(non-alcoholic steato hepatitis, NASH)、肝硬化和肝细胞癌(hepatocellular carcinoma, HCC), 是一种与胰岛素抵抗(insulin resistance, IR)和遗传易感密切相关的代谢应激性肝损伤[1], 目前已成为我国第一大慢性肝病和健康查体肝酶异常的首要原因[2,3], 而2型糖尿病(type 2 diabetes, T2DM)是引起NAFLD主要病因之一, 两种疾病经常相伴出现, 根据NAFLD的临床特点及其复杂的发病机制, 本文以高脂高糖饮食结合小剂量链脲佐菌素(streptozotocin, STZ)注射方法, 模拟与临床人类T2DM并发NAFLD病变相似的动物模型.
♀Wistar大鼠70只, SPF级, 体重200-220 g, 购于湖北省实验动物研究中心, 合格证号SCXK(鄂)2003-0005, 饲养于SPF动物房, 自由摄食, 12 h光照周期. 链脲佐菌素(streptozotocin, STZ)(Sigma, 39H1482); 高糖高脂饲料: 按如下配方(基础饲料:蔗糖:猪油:胆固醇:胆酸盐:奶粉:鸡蛋 = 66.5:20:10:2.5:1:4:1.5, 于湖北省疾病控制中心订购、加工); FINS剂盒(北京北方生物技术有限公司提供); 甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)、总蛋白(total protein, TP)、白蛋白(albumin, ALB)、球蛋白(globulin, GLO)、谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(glutamic-oxalacetic transaminase, AST)(本院岛津CL-7200全自动生化分析仪检测); 血糖(美国强生稳步倍加型血糖仪和配套试纸, CODE 008); PⅢNP及HA试剂盒(上海太阳生物技术有限公司). 岛津CL-7200全自动生化分析仪检测血液生化指标; DFM-96型多管放射免疫计数器(安徽众成机电技术公司); 日立H-600型透射电镜; LKB-V型超薄切片机(瑞典); 华中科技大学同济医学院千屏影像工程公司HPIAS-1000高清晰度彩色病理图文分析系统; 美国Thermo公司Multiskan MK3型酶标仪; 美国Thermo公司Wellwash4 MK2型洗板机.
1.2.1 造模方法: 将实验动物先适应性喂养1 wk, 随机选择15只作为正常对照组, 喂以普通饲料(动湖北省疾病控制中心物房提供); 其余55只用于制备模型, 喂以高糖高脂饲料(湖北省疾病控制中心订购), 饲养4 wk时, 所有大鼠行第一次糖耐量检测后, 模型组按30 mg/kg的剂量, 腹腔注射1% STZ(0.1 mol/L柠檬酸缓冲液配制, pH为4.5)[4], 正常对照组仅注射等体积柠檬酸-柠檬酸钠缓冲液, 继续喂养3 wk后, 所有大鼠行第二次糖耐量检测, 按2 g/kg葡萄糖的剂量灌胃, 测0 h、0.5 h、1 h、2 h血糖值, 将三个点血糖值高于正常大鼠相应点均数2个标准差以上者认为是糖尿病大鼠[5], 分别于实验第2、4、7周, 随机抽取造模组大鼠1只, 禁食8 h以上, 按40 mg/kg腹腔注射2%戊巴比妥钠, 麻醉满意后, 分离肝脏, 取0.5 cm固定于4%多聚甲醛, 经石蜡包埋后切片备用, 行HE及Masson染色, 观察光镜下肝脏病理结构的改变. 将出现大泡性或以大泡为主的混合性肝细胞脂肪变,伴或不伴有肝细胞气球样变、小叶内混合性炎症细胞浸润以及窦周纤维化者认为是NAFLD T2DM大鼠模型(参照《非酒精性脂肪性肝病诊疗指南》2010年修订版)[6]. 共有50只成模(3只大鼠分别于第2、4、7周被处死行肝脏病理检查, 2只大鼠死亡, 活检均未见明显异常, 考虑STZ毒性或血糖过高导致死亡).
1.2.2 标本的收集: 分别于实验第4周、7周分别称体重、记录饮水量及饮食量, 行糖耐量试验并计算OGTT时间-血糖曲线的AUC值, 大鼠禁食10 h后, 按2 g/kg剂量, 用50%葡萄糖溶液灌胃, 于0 h、0.5 h、1 h、2 h取尾静脉血测血糖; 于实验第7周空腹尾静脉采血, 分离血清, 测血清FINs并计算HOMA-IR、TG、TC、TP、ALB、GLO、ALT、AST、PⅢNP、HA; 分别于第2、4、7周随机抽取造模组大鼠1只, 禁食8 h以上, 按40 mg/kg腹腔注射2%戊巴比妥钠, 麻醉满意后, 分离肝脏, 用冷等渗盐水洗净, 滤纸吸干. 取0.5 cm固定于4%多聚甲醛, 经石蜡包埋后切片备用, 行HE及Masson染色.
1.2.3 生化指标的测定: (1)OGTT: 葡萄糖氧化酶法检测; (2)TG、TC和TP、ALB、GLO、ALT、AST: 自动生化分析仪检测; (3)FINs用放免法检测; (4)HOMA-IR = FBG×FINS/22.5; AUC(mmol/L·h) = 0.5 h×(o hBG+0.5 hBG)/2+0.5 h×(0.5 hBG+1 hBG)/2+1 h×(1 hBG+2 hBG)/2; (5)PⅢNP、HA: 均采用ELISA法检测.
1.2.4 肝组织HE染色石蜡包埋切片: 厚度约1 μm, 常规HE染色, 先用低倍镜观察肝脏的大体情况, 再调至高倍镜下观察.
1.2.5 肝脏Masson染色: 石蜡包埋切片, 厚度约1 μm, 常规Masson染色, 先用低倍镜观察肝脏的大体情况, 再调至高倍镜下观察.
统计学处理 采用SPSS 17.00统计软件, 计量数据以mean±SD表示, 组间对比采用样本t检验; 以P<0.05为差异有统计学意义.
喂养4 wk后, 与正常对照组相比, 模型组大鼠0 h及2 h血糖无明显差异, 0.5 h及1 h血糖增高(P<0.01), AUC值增高, 体重、饮水量、饮食量增加(P<0.01或P<0.05), 喂养7 wk后, 与正常对照组相比, 模型组大鼠0 h、0.5 h、1 h、2 h血糖明显升高有显著性差异(P<0.01), 且体重、饮水量、饮食量明显增加有显著性差异(P<0.01), TG、TC、FINs、HOMA-IR、AUC值明显升高有显著性差异(P<0.01)(表1-3).
| 分组 | n | 4 wk(mmol/L) | AUC | 7 wk(mmol/L) | AUC | ||||||
| 0 h | 0.5 h | 1 h | 2 h | 0 h | 0.5 h | 1 h | 2 h | ||||
| 模型组 | 50 | 3.95 ± 0.42 | 10.49 ± 2.17b | 6.12 ± 0.78 b | 4.9 ± 0.46 | 13.31 ± 1.42b | 6.11 ± 2.11b | 19.03 ± 5.94b | 18.7 ± 6.75b | 10.88 ± 6.21b | 30.54 ± 10.26b |
| 正常对照组 | 15 | 4.05 ± 0.24 | 6.14 ± 0.63 | 5.5 ± 0.32 | 4.35 ± 0.21 | 10.42 ± 0.56 | 3.63 ± 0.42 | 6.97 ± 0.84 | 7.02 ± 0.66 | 4.91 ± 0.47 | 12.13 ± 1.01 |
与正常组比较, 模型组大鼠血浆AST、ALT、PⅢNP、HA、TP、GLO水平明显升高有显著性差异(P<0.01), 但ALB变化不大(P>0.05)(表4和表5).
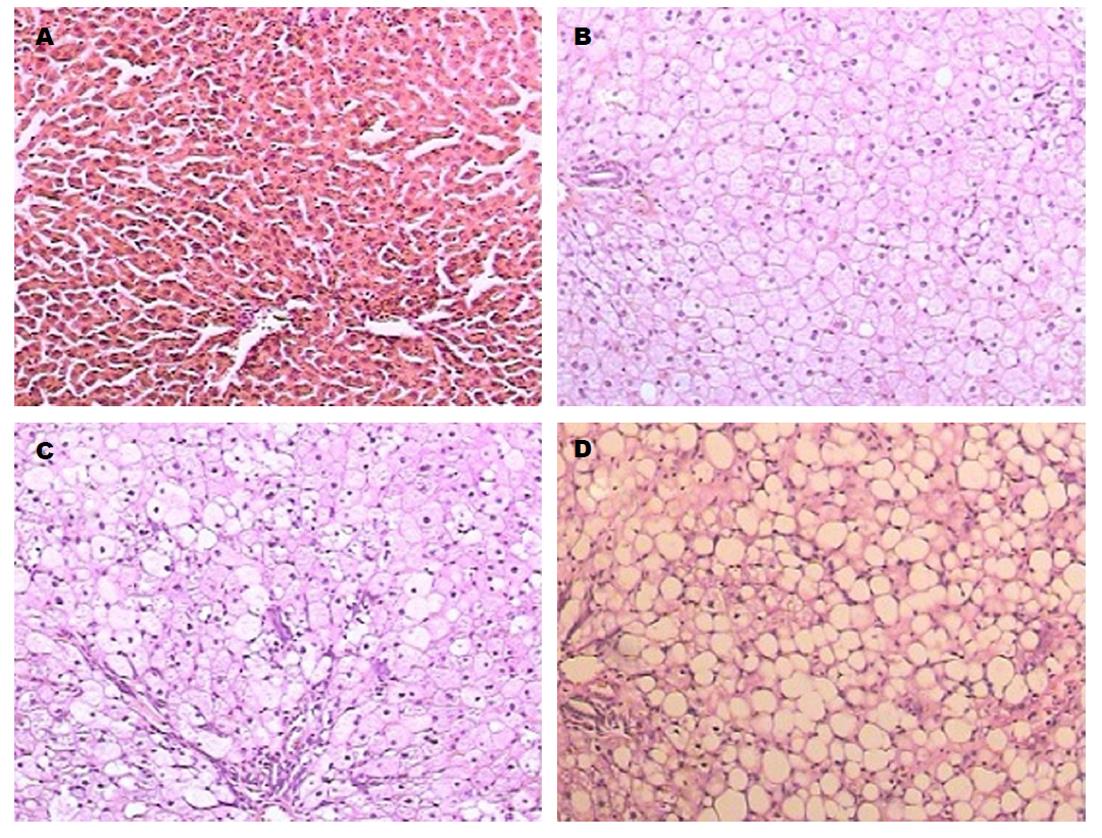
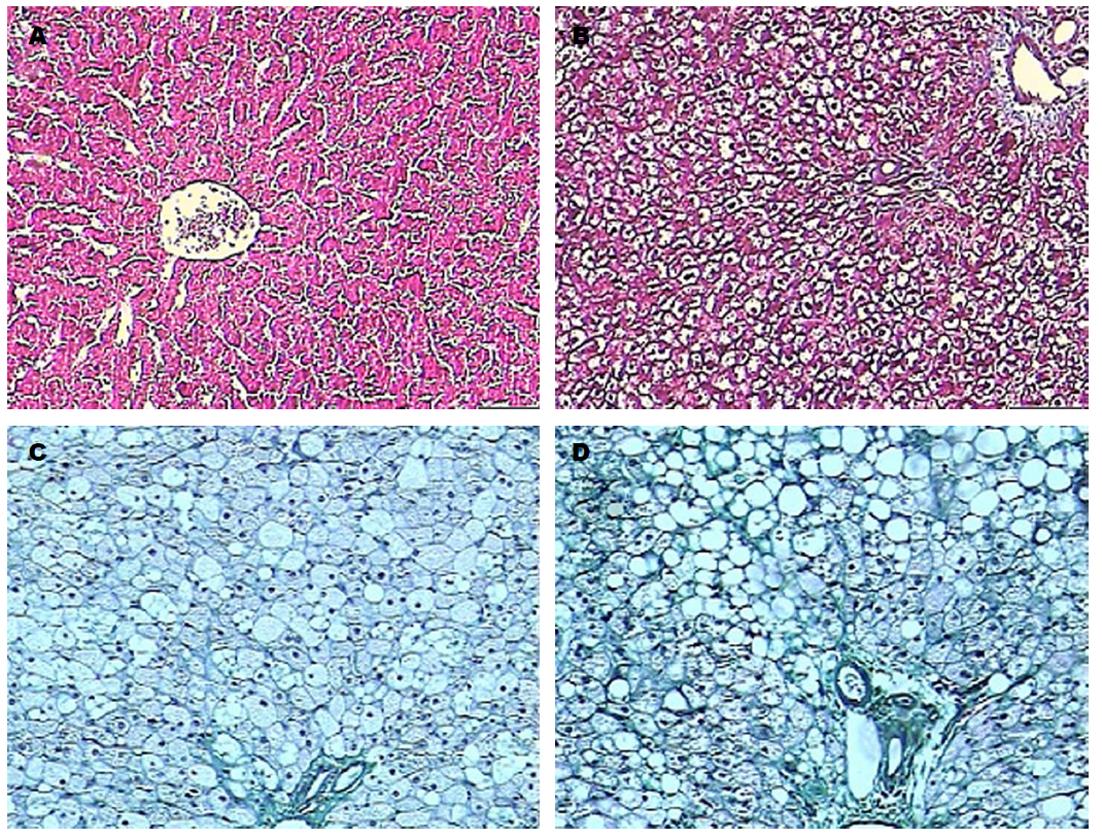
于实验第2、4、7周末, 肝脏HE染色, 观察光镜下肝脏病理结构的改变: 正常对照组: 肝脏光滑, 色泽无显著变化. 镜下见肝细胞呈多角形, 细胞核呈椭圆形, 位于中央大小均一, 胞浆染色均匀. 小叶结构和汇管区未见异常. 2 wk末模型组肝肝细胞变大, 胞质内充满大量大小不等的圆形脂滴, 4 wk末模型组肝肝细胞逐渐出现小泡型脂肪变, 7 wk末模型组肝肝细胞最终出现大泡型或以大泡为主的混合性肝细胞脂肪变, 伴有肝细胞气球样变, 小叶内混合性炎症细胞浸润, 窦周纤维化(图1); 肝脏Masson染色, 观察光镜下肝脏病理结构的改变: 正常对照组: 未见胶原纤维, 2 wk、4 wk及7 wk末模型组: 肝脏内胶原组织逐渐增多, 围绕肝细胞的胶原纤维排列紊乱, 染色呈亮绿色(图2).
根据流行病学调查显示中国NAFLD患病率变化与肥胖症、T2DM和代谢综合征(MetS)流行趋势相平行[7,8], 而"胰岛素抵抗"是上述疾病发病机制的"共同土壤", 为进一步研究NAFLD疾病的发病机制, 建立一个接近于临床的NAFLD合并T2DM动物模型极为重要. 目前NAFLD合并T2DM动物模型造模方法很多, 然而大部分模型只是部分模拟了人类NAFLD合并T2DM的发病特征, 药物中毒性脂肪肝模型与人类脂肪肝的发病机制和病理生理学改变有着本质的区别, 营养失调性脂肪肝模型, 病变过程与人类脂肪肝形成过程类似, 但是造模时间长, 实验动物易产生厌食、腹泻等不良反应[9-11], 所以, 在实际研究中需要联合应用营养及药物诱发模型, 最大程度地模拟人类NAFLD的复杂性, 高糖高脂饮食结合剂量STZ注射是目前NAFLD基础研究中应用最广泛的动物模型, 但具体操作方法及判定模型成功的标准仍不统一, 导致动物模型最终临床表现仍与人类NAFLD临床表现差异较大, 本实验在经典造模方法上进行了操作方法及模型判定标准的改进, 先以更符合东方人饮食习惯的高糖高脂饮食(蔗糖含量66.5%, 胆固醇含量10%)喂养Wistar大鼠4 wk, 成功诱导肥胖、胰岛素抵抗及脂肪肝, 再以小剂量STZ(30 mg/kg)破坏胰腺B细胞, 造成大鼠胰岛素代偿性分泌障碍, 引发高血糖, 从而加速非酒精性脂肪肝病模型形成, STZ注射3 wk后, 摒弃既往以随机血糖或空腹血糖作为血糖水平判定标准的做法, 以阳性率更高的OGTT以及时间-血糖曲线的AUC作为新的血糖水平判定标准, 并在造模第2周、4周和7周末, 联合HE染色及Masson染色动态观察大鼠肝脏病理改变过程.
本实验的结果显示: 喂养4 wk时, 0 h及2 h血糖变化不明显(P>0.05), 体重及饮食量增加(P<0.01), 饮水量轻度增加(P<0.05), AUC、0.5 h及1 h血糖升高(P<0.01), 4 wk时模型组大鼠已有肥胖, 但血糖变化不明显, OGTT中仅0.5 h及1 h血糖升高, 但AUC已有明显升高, AUC作为OGTT中4点血糖的几何平均值, 更能体现血糖水平的变化趋势及时间的累积效应, 相较空腹血糖或随机血糖具有更高敏感性, 既往空腹血糖或随机血糖10-16.7 mmol/L常作为血糖判定标准, 此标准下造模成功的糖尿病大鼠, 通常胰岛B细胞损伤过重, 胰岛素抵抗不明显; 而在喂养7 wk(STZ注射3 wk后)时体重增加更明显、饮食量及饮水量明显增加、OGTT任一点血糖明显增高(均P<0.01), 肥胖T2DM大鼠模型造模成功, 加用STZ注射后, 血糖明显增高, 进一步缩短造模时间并保证了动物模型稳定性, 在实际造模过程中, 常因胰岛B细胞存在自身修复可能, 导致STZ注射后3 wk内血糖可能会逐渐恢复接近正常, 既往选择在STZ注射后48 h、72 h或1 wk后等血糖监测方式均可能导致动物模型不稳定; 同时血清TG、TC、FINs水平及HOMA-IR明显增高(P<0.01), 大鼠出现高脂血症并伴有明显胰岛素抵抗, 而且, 喂养7 wk时模型组大鼠血浆AST、ALT、PⅢNP及HA水平明显升高有显著性差异(P<0.01), 说明脂质流向肝脏, 脂质在肝脏沉积, 导致肝细胞机构及功能损伤, 使肝细胞内AST及ALT释放入血, 同时肝纤维化指标PⅢNP及HA也明显增高, 上述血清生化指标变化均表明了T2DM大鼠存在肝损伤.
血清生化指标只能反应肝脏存在损伤, 但不一定是NAFLD所致, 不能反应具体病因, 也不能确定NAFLD的疾病病程及严重程度, 病理改变是才是诊断NAFLD的金标准[12,13], 本实验在模型组大鼠喂养2 wk、4 wk和7 wk时分别通过HE染色观察肝细胞脂肪变性, 肝脏炎症反应、肝纤维化等病理改变, 并通过Masson染色进一步观察肝纤维病理改变, 病理改变显示, 模型组大鼠呈现出从"单纯性脂肪肝→脂肪性肝炎→肝纤维化"典型病理改变过程, 同时Masson染色在造模4 wk时就可看到肝组织纤维化改变, 较HE染色敏感性更高.
本模型是根据流行病学调查及临床研究确定胰岛素抵抗是NAFLD重要发病机制之一, 而T2DM是常见的发病原因, 通过高脂高糖饮食结合小剂量STZ注射方法建立的T2DM并发NAFLD动物模型, 基于本模型的发病原因、病理改变、肝功能及肝纤维化指标、糖脂代谢紊乱、胰岛素抵抗与临床NAFLD合并T2DM表现一致, 因此可以作为NAFLD发病机制及药物研发的良好的动物模型. 然而, 遗传易感密切是NAFLD发病机制中不可忽视的原因之一, 下一步研究, 如果能在遗传因素模型基础上联合应用营养及药物建立三因素复合模型, 将能最大限度模拟人类NAFLD发病机制的复杂性, 将具有更广阔的应用前景.
高脂高糖饮食结合小剂量链脲佐菌素注射诱导非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)合并2型糖尿病(type 2 diabetes, T2DM)动物模型是目前常用的造模方法, 该方法因普遍存在具体实验操作及判定模型成功标准不统一, 导致成模后动物临床表现差异较大, 不利于NAFLD的标准化研究.
目前大部分血糖判定标准过高, 导致成模后动物的临床表现接近1型糖尿病, 并缺乏NAFLD典型的病理改变进程, 本实在常用造模方法基础上对血糖判定标准进行改进.
诱导出更接近人类临床表现的NAFLD合并T2DM动物模型.
本实验目标是诱导具备胰岛素抵抗、肥胖、高血糖、高脂血症等代谢紊乱特征及NAFLD典型的病理改变进程的NAFLD合并T2DM动物模型, 以便更好的研究和治疗NAFLD. 本实验采用葡萄糖耐量试验(oral glucose tolerance test, OGTT)及其时间-血糖其曲线下面积(area under the curve, AUC)作为血糖判定标准, 以肝功能、血脂、肝纤维化、空腹胰岛素等血清学指标反映代谢紊乱, 以动态HE染色及Masson染色反应肝脏病理改变.
本实验结果显示: 单纯高糖高脂饮食4 wk, 可以成功诱导胰岛素抵抗, 虽然此时0 h及2 h血糖无明显变化, 但OGTT时间-血糖曲线的AUC已有明显变化, AUC比点血糖更敏感; 研究还发现HE染色对早期轻度肝纤维化反应不敏感, 但Masson染色示造模第4 wk时就可见肝组织纤维化, 因此, Masson染色方法可以更早观察到纤维化.
(1)联合营养及药物因素制备的NAFLD合并T2DM动物模型, 稳定好, 而且可呈现出典型的NAFLD病理发展过程, 具备多种代谢综合征的相关组分, 充分模拟了人类代谢紊乱背景, 成模率高, 死亡率低, 操作简单, 造模时间相对较短, 价格低廉, 可以广泛应用于NAFLD的基础研究; (2)以OGTT及其AUC作为模型成功血糖判定标准, 可以避免胰岛B细胞损伤过重, 胰岛素抵抗不明显; (3)动态HE染色及Masson染色观察病理改变, 可以更早发现关键的肝纤维病理改变, 判断疾病的预后.
本实验不足之处是诱导的动物模型未能涵盖遗传因素, 因此, 有必要在遗传因素基础上联合应用营养、药物又发模型建立三因素复合模型, 最大程度模拟人类NAFLD发病机制的复杂性及典型发病进程, 更好的用于NAFLD的基础研究.
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): 0
D级 (一般): D
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Diehl AM, Day C. Cause, Pathogenesis, and Treatment of Nonalcoholic Steatohepatitis. N Engl J Med. 2017;377:2063-2072. [PubMed] [DOI] |
| 2. | Guo Y, Wang H, Tian Y, Wang Y, Lip GYH. Time Trends of Aspirin and Warfarin Use on Stroke and Bleeding Events in Chinese Patients With New-Onset Atrial Fibrillation. Chest. 2015;148:62-72. [PubMed] [DOI] |
| 3. | Fan JG, Kim SU, Wong VW. New trends on obesity and NAFLD in Asia. J Hepatol. 2017;67:862-873. [PubMed] [DOI] |
| 4. | Holmes A, Coppey LJ, Davidson EP, Yorek MA. Rat Models of Diet-Induced Obesity and High Fat/Low Dose Streptozotocin Type 2 Diabetes: Effect of Reversal of High Fat Diet Compared to Treatment with Enalapril or Menhaden Oil on Glucose Utilization and Neuropathic Endpoints. J Diabetes Res. 2015;2015:307285. [PubMed] [DOI] |
| 5. | 廖二元, 超楚生主编. 内分泌学. 人民卫生出版(第一版). 2001;1413-1414. |
| 6. | 中华医学会肝病学分会脂肪肝和酒精性肝病学组. 非酒精性脂肪性肝病诊疗指南(2010年修订版). 胃肠病学和肝病学杂志. 2010;19:483-487. [DOI] |
| 7. | Kwok R, Choi KC, Wong GL, Zhang Y, Chan HL, Luk AO, Shu SS, Chan AW, Yeung MW, Chan JC. Screening diabetic patients for non-alcoholic fatty liver disease with controlled attenuation parameter and liver stiffness measurements: a prospective cohort study. Gut. 2016;65:1359-1368. [PubMed] [DOI] |
| 8. | Benedict M, Zhang X. Non-alcoholic fatty liver disease: An expanded review. World J Hepatol. 2017;9:715-732. [PubMed] [DOI] |
| 9. | Kucera O, Cervinkova Z. Experimental models of non-alcoholic fatty liver disease in rats. World J Gastroenterol. 2014;20:8364-8376. [PubMed] [DOI] |
| 10. | Santhekadur PK, Kumar DP, Sanyal AJ. Preclinical models of non-alcoholic fatty liver disease. J Hepatol. 2018;68:230-237. [PubMed] [DOI] |
| 11. | Hodges FR. Barodontalgia at 12,000 feet. J Am Dent Assoc. 1978;97:66-68. [PubMed] [DOI] |
| 12. | Dumitrascu DL, Neuman MG. Non-alcoholic fatty liver disease: an update on diagnosis. Clujul Med. 2018;91:147-150. [PubMed] [DOI] |