修回日期: 2017-12-19
接受日期: 2017-12-24
在线出版日期: 2018-01-28
研究乳腺癌缺失基因-1(deleted in breast cancer-1, DBC-1)在胃癌(gastric cancer, GC)中的表达及潜在的临床意义.
采用RT-PCR方法检测DBC1在胃黏膜细胞(SGC-7901、BGC-823)和GC细胞(SGC-7901、BGC-823)中的表达差异, 利用免疫组织化学染色方法检测DBC1在201例GC及癌旁组织的表达差异, 分析DBC1表达与临床数据的相关性.
DBC1在GC细胞中的相对表达量明显高于其在胃黏膜细胞中的表达量(P<0.05). DBC1在GC组织中表达明显高于癌旁组织(75.12% vs 20.90%, P<0.05). DBC1表达水平与Bormann分型(P<0.05)、肿瘤大小(P<0.05)、肿瘤分化程度(P<0.05)、Lauren分型(P<0.05)、脉管浸润(P<0.05)、神经侵犯(P<0.05)、TNM分期密切相关(P<0.05), 但与患者性别(P>0.05)、年龄无相关(P>0.05). DBC1表达与GC的无病生存时间、总生存时间密切相关, DBC1表达水平越高, 患者的无病生存时间(P<0.05)和总生存时间越短(P<0.05).
DBC1在GC中高表达, 可能是GC预后的判断指标, 在GC发生发展中起重要作用.
核心提要: 胃癌(gastric cancer, GC)是我国常见的恶性肿瘤, 死亡率高. 有研究表明乳腺癌缺失基因-1(deleted in breast cancer-1, DBC-1)在恶性肿瘤中呈过表达. 本研究首次对DBC1在GC细胞和组织中的水平进行检测, 并分析得到其与患者总体生存时间、无病生存时间等临床指标密切相关.
引文著录: 王兆平, 陆航. 乳腺癌缺失基因-1在胃癌中的表达及其临床意义. 世界华人消化杂志 2018; 26(3): 150-158
Revised: December 19, 2017
Accepted: December 24, 2017
Published online: January 28, 2018
To detect the expression of deleted in breast cancer-1 (DBC1) in gastric cancer (GC) and analyze its potential clinical significance.
The expression of DBC-1 in normal gastric mucosa cells (GSE-1) and GC cells (SGC-7901 and BGC-823) was detected by RT-PCR. Immunohistochemistry was performed to detect the expression of DBC1 in 201 cases of GC and matched tumor-adjacent non-tumor tissues. The correlation between DBC1 expression and clinicopathologic features was analyzed.
The relative expression level of DBC1 in GC cells was significantly higher than that in normal gastric mucosa cells (P < 0.05). A higher positive rate of DBC1 was detected in GC tissues than in non-cancer tissues (75.12% vs 20.90%, P < 0.05). The expression level of DBC1 was correlated with Bormann type (P < 0.05), tumor size (P < 0.05), Lauren type (P < 0.05), tumor differentiation (P < 0.05), vessel invasion (P < 0.05), perinerural invasion (P < 0.05), and TNM stage (P < 0.05), but there was no difference between DBC1 expression and gender (P > 0.05) or age (P > 0.05). Kaplan-Meier and Cox analyses showed that DBC1 expression was associated with shorter disease-free survival (P < 0.05) and overall survival (P < 0.05).
DBC1 is overexpressed in GC and can act as a prognostic factor in GC. These findings indicate that DBC1 may play an important role in the development of GC.
- Citation: Wang ZP, Lu H. Clinical significance of expression of deleted in breast cancer-1 in human gastric cancer. Shijie Huaren Xiaohua Zazhi 2018; 26(3): 150-158
- URL: https://www.wjgnet.com/1009-3079/full/v26/i3/150.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i3.150
胃癌(gastric cancer, GC)是一种常见的恶性肿瘤, 是一种多步骤、多因素复杂作用的疾病. 我国GC在恶性肿瘤中发病率居第4位[1], 死亡率居第2位[2]. 目前GC的治疗仍以手术为主, 虽然放化疗、分子靶向治疗等综合治疗手段虽然已在开展, 但其疗效一般. 因此寻找新的GC的治疗手段和靶点愈发重要, 寻求特异性与敏感性高的肿瘤标志物是临床开展进一步治疗最重要的一环. 乳腺癌缺失基因-1(deleted in breast cancer-1, DBC-1)最初由Hamaguchi应用代表性差异分析筛选获得, 因其在乳腺癌组织中杂合性缺失, 而得名乳腺癌缺失基因, 定位于8p2l[3,4]. 但是在体外培养的肿瘤细胞系和实体肿瘤组织标本中, DBC1并未出现表达缺失, 且在癌组织中的表达明显高于相应的正常组织[5-7], 且与组织分化程度、TNM分期、淋巴结转移、总体生存时间、无病生存时间等临床指标密切相关[8-10], 但其在GC中的表达及对GC恶性生物学表型的影响还知之甚少[11,12]. 本研究利用逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction, RT-PCR)方法检测DBC1在GC细胞系和胃黏膜细胞系中的表达差异, 利用免疫组织化学染色的方法检测DBC1在GC和癌旁组织中的表达, 探讨分析了DBC1表达水平与患者生存时间等临床参数间的相关性.
1.1.1 组织标本: 本研究方案经锦州医科大学附属第一医院医学伦理委员会审核通过. 收集2011-2016年锦州医科大学附属第一医院治疗的201例GC病例资料, 通过电话随访获取预后生存资料(最长随访时间72 mo, 表1). 其中男性143例, 女性58例; 病理组织分级高、中分化67例, 低分化134例; TNM分期, Ⅰ期43例, Ⅱ期47例, Ⅲ期111例所有病例均经病理诊断证实. 标本经40 g/L甲醛溶液固定后石蜡包埋, 连续切片, 厚5 μm, 常规HE染色.
| 临床病理因素 | n (%) | 无病生存时间 | 总生存时间 | ||||
| 时间 (mo) | P值 | Z值 | 时间 (mo) | P值 | Z值 | ||
| 年龄(岁) | 0.502 | -0.671 | 0.804 | -0.248 | |||
| <60 | 94 (46.8) | 38.00 | 50.00 | ||||
| ≥60 | 107 (53.2) | 32.69 | 45.86 | ||||
| 性别 | 0.272 | -1.098 | 0.278 | -1.086 | |||
| Male | 143 (71.0) | 33.25 | 45.89 | ||||
| Female | 58 (28.9) | 48.00 | 62.00 | ||||
| Bormann分型 | 0.000 | 3 | 0.000 | 3 | |||
| Ⅰ | 15 (7.5) | 75.00 | 75.00 | ||||
| Ⅱ | 89 (44.3) | 53.50 | 64.20 | ||||
| Ⅲ | 94 (46.8) | 17.13 | 28.17 | ||||
| Ⅴ | 3 (1.5) | 8.00 | 25.00 | ||||
| 肿瘤大小 (cm) | 0.000 | -4.441 | 0.000 | -4.266 | |||
| <5 | 113 (56.2) | 63.00 | 65.30 | ||||
| ≥5 | 88 (43.8) | 18.50 | 29.88 | ||||
| 肿瘤部位 | 0.132 | 1 | 0.200 | 1 | |||
| Up | 44 (21.9) | 23.00 | 36.67 | ||||
| Middle | 56 (27.9) | 36.67 | 48.50 | ||||
| Low | 101 (50.2) | 40.00 | 55.00 | ||||
| Lauren分型 | 0.000 | 2 | 0.000 | 2 | |||
| Intestinal | 108 (53.7) | 56.60 | 64.60 | ||||
| Mixed type | 47 (23.4) | 33.67 | 47.50 | ||||
| Diffuse | 46 (22.9) | 16.00 | 25.50 | ||||
| 肿瘤分化程度 | 0.018 | -2.373 | 0.028 | -2.202 | |||
| Poor | 134 (66.7) | 32.14 | 45.70 | ||||
| Moderate and high | 67 (33.3) | 53.00 | 62.33 | ||||
| 脉管浸润 | 0.000 | -4.224 | 0.000 | -3.815 | |||
| No | 142 (70.6) | 47.00 | 59.80 | ||||
| Yes | 59 (29.4) | 15.83 | 27.00 | ||||
| 神经侵犯 | 0.000 | -3.954 | 0.000 | -3.690 | |||
| No | 150 (74.6) | 45.33 | 58.50 | ||||
| Yes | 51 (25.4) | 16.33 | 26.00 | ||||
| TNM分期 | 0.000 | 2 | 0.000 | 2 | |||
| Ⅰ | 42 (20.9) | 71.00 | 71.00 | ||||
| Ⅱ | 48 (23.9) | 68.00 | 69.00 | ||||
| Ⅲ | 111 (55.2) | 15.00 | 25.00 | ||||
| DBC1 | 0.000 | -8.477 | 0.000 | -8.193 | |||
| Weak-expression | 50 (24.9) | 71.00 | 71.00 | ||||
| Over- expression | 151 (75.1) | 19.00 | 31.00 | ||||
1.1.2 细胞培养: 人胃腺癌细胞株SGC-7901、BGC-823及正常胃黏膜细胞GES-1取自锦州医科大学附属第一医院中心实验室. 细胞培养在含10%胎牛血清(TBD公司)的RPMI 1640培养基(Invitrogen公司)中, 于37 ℃、50 mL/L CO2培养箱中, 间隔2 d更换1次培养基.
1.1.3 主要试剂: DBC1单克隆抗体购自Abcam公司; 苏木素染色液、中性树胶、防脱挂胶玻片、DAB试剂盒、SP免疫组织化学试剂盒购自武汉博士德生物工程有限公司; 光学显微镜购自奥林巴斯(Olympus)公司; 二抗(试剂盒购自中杉金桥公司).
1.2.1 RT-PCR: 荧光RT-PCR检测DBC1在GC组织和细胞中的表达采用TRIzol法提取病理标本和细胞中的总RNA, 并检测RNA的纯度及浓度. 逆转录和PCR反应均严格按照TAKARA公司说明书进行, 以U6作为内参进行相对定量, 每组设3个复孔, 在ROCHE实时定量荧光PCR仪上进行检测. DBC1的上游引物序列: 5'-GCTCGCATCATCCTACTT-3', 下游引物序列: 5'-CAGAGTCCAGATTGTCATAAC-3'; U6的上游引物序列: 5'-TTATGGGTCCTAGCCTGAC-3', 下游引物序列: 5'-CACTATTGCGGGCTGC-3', 采用2-△△Ct法计算DBC1的相对表达量. △Ct = CtDBC1-CtU6.
1.2.2 免疫组织化学: 阴性对照以PBS替代一抗作为阴性对照, 用已知阳性标本作阳性对照, 已知阳性标本的表达情况的定量使用Image J软件进行阳性细胞计数. 烤片30 min, 切片常规脱蜡; 将切片浸于沸腾的柠檬酸缓冲液中用3%过氧化氢甲醇去除内源性酶; 血清封闭, 室温孵育30 min; 加入按1:500稀释的一抗兔抗DBC1多克隆抗体, 4 ℃过夜16 h; 室温孵育45 min; 加入二抗, PBS冲洗3次, 3 min/次; 甩干PBS液, 加羊抗小鼠抗体同辣根过氧化物酶复合物. 室温放置30 min, DAB显色, 苏木素复染、梯度酒精脱水、二甲苯透明、中性树胶封片.
1.2.3 免疫组织化学染色评分: 切片经2名病理科医生显微镜下阅片评分. 染色结果判定采用Remmele和Stegner[13]提出的免疫反应评分(immune response scores, IRS), 是染色强度(staining intensity, SI)和阳性细胞百分比(percentage of positive cells, PP)的乘积, 即IRS = SI×PP. SI可分为4级, 即0级为未见阳性细胞; 1级为弱阳性; 2级为中等阳性; 3级为强阳性. PP可分为5级, 即0级为阴性; 1级≤30%; 2级31%-50%; 3级51%-80%; 4级>80%. 从每一样本的不同区域随即抽取10个视野进行IRS评估, IRS的平均数作为最终值.
统计学处理 应用SPSS21.0软件进行统计学分析. 计量资料数据以mean±SD表示, 肿瘤组与非肿瘤组DBC1表达水平的比较采用配对t检验, 多组间比较采用单因素方差分析和采用Mann-Whitney检验. 计数资料比较采用χ2检验或Fisher确切概率法. 采用Kaplan-Meier法绘制生存曲线, 采用Log-rank检验进行生存分析. 预后因素分析采用COX单因素和多因素分析. P<0.05为差异有统计学意义.
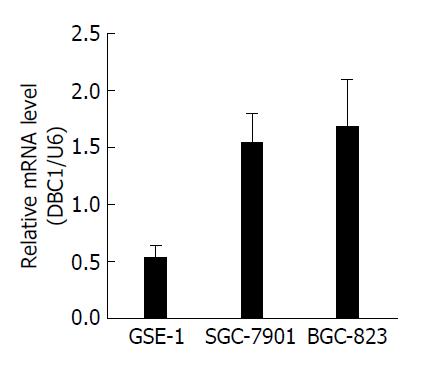
DBC1在人GC细胞株SGC-7901和BGC-823中的表达水平分别为1.53±0.27、1.68±0.41, 比正常胃黏膜细胞GES-1中DBC1的表达水平高(0.53±0.11), 差异有统计学意义(P<0.05, 图1); 而且, 在三株细胞株中, BGC-823中DBC1表达水平最高.
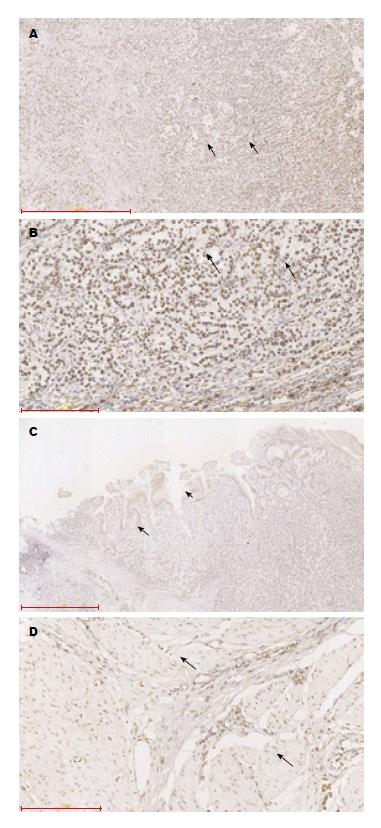
免疫组织化学染色观察DBC1在201例GC和对应的癌旁组织中表达和定位情况. DBC1主要表达于癌组织细胞核和胞浆. 201例癌组织中151例DBC1染色, 阳性率75.12%, 201例癌旁组织中42例染色, 阳性率20.90%. GC组织中DBC1阳性率明显高于癌旁组织, 差异具有统计学差异(P<0.05, 图2).
为了探讨DBC1潜在的临床意义和应用价值, 我们进一步分析了DBC1表达水平与GC临床病理参数间的相关性(DBC1表达从0-12分, 选取中位数4分作为分界标准, 分为高表达和低表达)结果发现(表2), DBC1表达同Bormann分型、肿瘤大小、肿瘤分化程度、Lauren分型、脉管浸润、神经侵犯、TNM分期密切相关(P<0.05), 但DBC1表达水平与年龄、性别、肿瘤部位之间没有明显的统计学意义(P>0.05).
| 临床病理因素 | DBC1表达 n (%) | P值 | χ2值 | |
| 低表达 | 高表达 | |||
| 50 (24.9) | 151 (75.1) | |||
| 年龄(岁) | 0.066 | 3.374 | ||
| <60 | 29 (30.9) | 65 (69.1) | ||
| ≥60 | 21 (19.6) | 86 (80.4) | ||
| 性别 | 0.354 | 0.858 | ||
| 男 | 33 (23.1) | 110 (76.9) | ||
| 女 | 17 (29.3) | 41 (70.7) | ||
| Bormann分型 | 0.000 | 35.333 | ||
| Ⅰ | 11 (73.3) | 4 (26.7) | ||
| Ⅱ | 30 (33.7) | 59 (66.3) | ||
| Ⅲ | 9 (9.6) | 85 (90.4) | ||
| Ⅴ | 0 (0.0) | 3 (100.0) | ||
| 肿瘤大小(cm) | 0.000 | 17.973 | ||
| <5 | 41 (36.3) | 72 (63.7) | ||
| ≥5 | 9 (10.2) | 79 (89.8) | ||
| 肿瘤部位 | 0.131 | 4.061 | ||
| Up | 6 (13.6) | 38 (86.4) | ||
| Middle | 17 (30.4) | 39 (69.6) | ||
| Low | 27 (26.7) | 74 (73.3) | ||
| Lauren分型 | 0.000 | 16.841 | ||
| Intestinal | 38 (35.2) | 70 (64.8) | ||
| Mixed type | 10 (21.3) | 37 (78.7) | ||
| Diffuse | 2 (4.3) | 44 (95.7) | ||
| 肿瘤分化程度 | 0.004 | 8.320 | ||
| Poor | 25 (18.7) | 109 (81.3) | ||
| Moderate and high | 25 (37.3) | 42 (62.7) | ||
| 脉管浸润 | 0.006 | 7.566 | ||
| No | 43 (30.3) | 99 (69.7) | ||
| Yes | 7 (11.9) | 52 (88.1) | ||
| 神经侵犯 | 0.000 | 19.202 | ||
| No | 49 (32.7) | 101 (67.3) | ||
| Yes | 1 (2.0) | 50 (98.0) | ||
| TNM stage | 0.000 | 133.474 | ||
| Ⅰ | 38 (90.5) | 4 (9.5) | ||
| Ⅱ | 12 (25.0) | 36 (75.0) | ||
| Ⅲ | 0 (0) | 111 (100.0) | ||
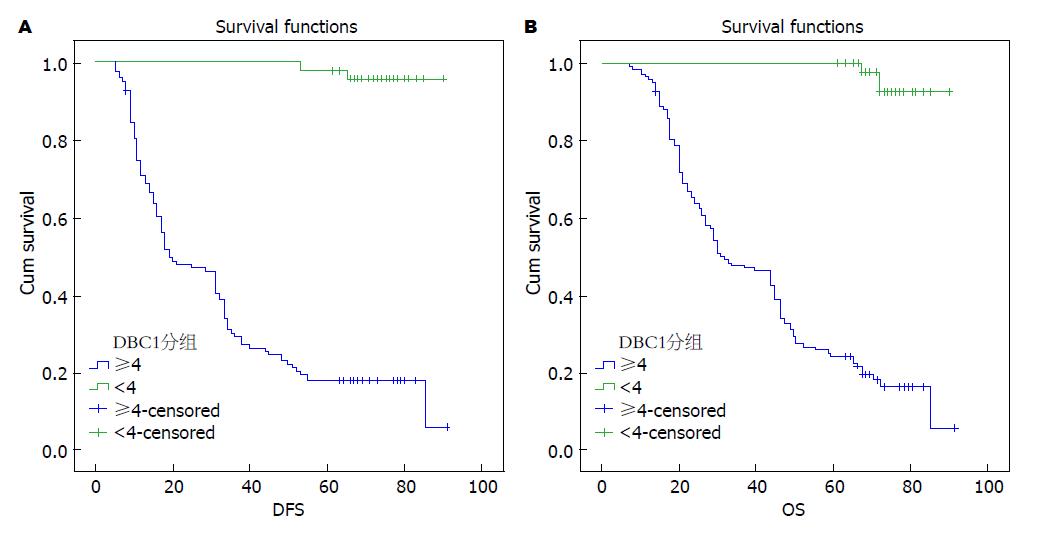
通过回顾病例及电话随访纳入研究的201例患者, 5年后发现已有127例患者死于GC及相关并发症, 5年生存率为36.8%, 中位无病生存时间(disease-free survival, DFS)34 mo, 总生存时间(overall survival, OS)为47 mo; 进一步分析发现DBC1高表达组共151例患者中位DFS为19 mo, OS为31 mo; 低表达组共50例患者中位DFS为71 mo, OS为71 mo. Kaplan-Meier生存曲线提示DBC1表达水平越高, 患者的DFS越短(χ2 = 79.717, P<0.01, 图3A)、OS越短, 差异具有统计学意义(χ2 = 78.745, P<0.01, 图3B). Cox多因素分析发现DBC1表达水平与GC患者DFS、OS密切相关(表3), HR分别为0.694(0.476-1.059), 0.675(0.471-0.981), 差异具有统计学意义(P<0.05), 提示DBC1有可能作为GC的预后判断指标.
| 因素 | DFS | OS | ||||
| P值 | HR | 95%CI | P值 | HR | 95%CI | |
| Bormann分型 | 0.131 | 1.295 | 0.926-1.811 | 0.079 | 1.341 | 0.967-1.861 |
| 肿瘤大小 | 0.420 | .858 | 0.591-1.245 | 0.537 | 0.889 | 0.613-1.290 |
| Lauren分型 | 0.667 | 1.055 | 0.828-1.344 | 0.602 | 1.067 | 0.836-1.363 |
| 肿瘤分化程度 | 0.713 | 1.088 | 0.695-1.701 | 0.895 | 0.970 | 0.618-1.522 |
| 脉管浸润 | 0.041 | 0.676 | 0.464-0.984 | 0.056 | 0.693 | 0.476-1.010 |
| 神经侵犯 | 0.041 | 0.667 | 0.452-0.984 | 0.073 | 0.703 | 0.478-1.034 |
| TNM分期 | 0.000 | 96.114 | 21.829-423.195 | 0.000 | 98.522 | 22.052-440.172 |
| DBC1表达 | 0.049 | 0.694 | 0.476-1.059 | 0.042 | 0.675 | 0.471-0.981 |
近年来, 随着分子生物学的快速发展, 某些基因、分子表达变化不仅能够更为准确地反映肿瘤特性, 而且能够更为准确地反映肿瘤细胞的基因组学及表观遗传学变化, 从而成为肿瘤研究领域热点. DBC1的生理和病理功能目前还知之甚少. 虽然最初报道DBC1可以抑制p53的去乙酰化作用[14,15], 被建议作为一个肿瘤抑制基因, 但随着研究的深入, 是DBC1不是在所有的癌组织中都是缺失的, DNA微阵列数据显示, 乳腺癌组织与正常乳腺组织相比较DBC1是上调[16,17]. DBC1相关机制研究发现DBC1通过影响SIRT1[18,19]、ER等分子的表达、甲基化, 调控NF-κB信号通路[20]参与调控细胞侵袭转移和增殖、凋亡、组蛋白修饰、DNA修复[21]等生理病理过程[7,22-24]. 近来研究提示, CK2α可在转录后水平调节DBC1甲基化调节caspase通路促进肿瘤坏死因子-α诱导细胞凋亡[24,25], DBC1直接结合SIRT1抑制SIRT1的去乙酰化酶活性, 影响SIRT1-p53通路, 促进细胞凋亡[26]; 这些结果提示DBC1在肿瘤的发生发展中起重要作用.
本研究我们发现DBC1在GC中的表达明显高于相应的癌旁组织(75.12% vs 20.90%, P<0.05); 在单因素分析中发现, DBC1的高表达同Bormann分型、肿瘤大小、肿瘤分化程度、Lauren分型、脉管浸润、神经侵犯、TNM分期密切相关, 而这些因素均为GC发生发展中的关键因素, 在指南中均认为同GC的生存期密切相关, 这也从侧面表明, DBC1的高表达同GC死亡的危险因素密切相关. Kaplan-Meier曲线显示, DBC1表达水平越高, 患者的DFS、OS越低, 死亡率越高, 生存时间越短(P<0.05), 这些结果与其他研究者在GC[12,27]、膀胱癌[9,28]、前列腺癌[24]、结肠癌[6,29]、肝癌[8,30]、骨肉瘤等肿瘤研究中获得的结论类似. 多因素分析显示, 肿瘤分化程度、血管浸润、腹膜转移、TNM分期、DBC1为GCDFS和OS的独立危险因素, 与生存密切相关, 对患者总生存期的判断其提示作用.
肿瘤的发生发展、复发转移受多种因子的共同调控, DBC1可能作为一协同因素, 与其他分子共同作用, 这与Cha等[12]的研究有相似之处, 仍需在后续研究中对DBC1的上下游分子调控进行进一步探讨. 在未来研究中我们将采用慢病毒转染、流式细胞术、Transwell、细胞划痕、裸鼠体内转移实验, 探讨DBC1对GC恶性增殖、周期凋亡、侵袭转移等生物学表型的影响. 通过二代测序技术和生物信息学对相关分子机制等方面作进一步深入研究, 寻找DBC1上下游分子靶点, 力争为GC的临床诊治提供潜在靶点和预后分子标志物.
总之, DBC1在GC中呈高表达, DBC1的表达水平与组织学分化程度、TNM分期、OS等密切相关, DBC1可作为GC预后总生存时间的预测指标, 但其在GC发生发展中的作用机制及与肿瘤复发转移的关系仍需进一步研究.
胃癌(gastric cancer, GC)是我国常见的消化系恶性肿瘤, 发病率在我国位居第4位, 死亡率高居第2. 虽然近年来, 围绕GC发生发展的机制研究取得了部分进展, 但应用于临床治疗的药物收效甚微.
寻找影响GC患者生存时间相关的特异性分子靶标, 为GC的分子治疗提供新靶标.
研究乳腺癌缺失基因-1(deleted in breast cancer-1, DBC-1)在GC中的表达水平及潜在的临床意义.
采用RT-PCR方法检测DBC1在胃黏膜细胞(SGC-7901、BGC-823)和GC细胞(SGC-7901、BGC-823)中的表达差异, 利用免疫组织化学染色方法检测DBC1在201例GC及癌旁组织的表达差异, 分析DBC1表达与临床数据的相关性. 本文为国内首次证明DBC1基因在GC中的临床意义.
DBC1在GC细胞中的相对表达量明显高于其在胃黏膜细胞中的表达量, 在GC组织中表达明显高于癌旁组织. DBC1表达水平与Bormann分型、肿瘤大小、肿瘤分化程度、Lauren分型、脉管浸润、神经侵犯、TNM分期密切相关, 但与患者性别、年龄无相关. DBC1表达与GC的无病生存时间、总生存时间密切相关, DBC1表达水平越高, 患者的无病生存时间和总生存时间越短. 本研究的顺利实施为GC分子生物学研究提供新的生物学靶标.
DBC1在GC组织及细胞中高表达, 与GC患者的DFS、OS密切相关, 可能是GC预后的判断指标, 在GC发生发展中起重要作用. 本研究在国内首次对DBC-1与GC的相关性进行报道. 本研究的顺利实施, 为GC的分子生物学研究提供了有价值的新靶标. 为后续的研究及治疗提供新思路.
在作者的后续研究中, 首先, 本研究组将继继续扩大样本量, 对已知研究结论进行进一步验证; 同时, 结合患者血液样本检测, 实施基础向临床的转化; 再次, 我们仍需进一步研究本文中Biomarker在分子调控中的上下游作用关系, 并且进一步探索已获得分子通路的上下游调控机制.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 辽宁省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): D, D
E级 (差): 0
编辑: 闫晋利 电编:杜冉冉
| 1. | Brenner H, Rothenbacher D, Arndt V. Epidemiology of stomach cancer. Methods Mol Biol. 2009;472:467-477. [PubMed] [DOI] |
| 2. | Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017. CA Cancer J Clin. 2017;67:7-30. [PubMed] [DOI] |
| 3. | Hamaguchi M, Meth JL, von Klitzing C, Wei W, Esposito D, Rodgers L, Walsh T, Welcsh P, King MC, Wigler MH. DBC2, a candidate for a tumor suppressor gene involved in breast cancer. Proc Natl Acad Sci USA. 2002;99:13647-13652. [PubMed] [DOI] |
| 4. | Giguère SS, Guise AJ, Jean Beltran PM, Joshi PM, Greco TM, Quach OL, Kong J, Cristea IM. The Proteomic Profile of Deleted in Breast Cancer 1 (DBC1) Interactions Points to a Multifaceted Regulation of Gene Expression. Mol Cell Proteomics. 2016;15:791-809. [PubMed] [DOI] |
| 5. | Kim W, Cheon MG, Kim JE. Mitochondrial CCAR2/DBC1 is required for cell survival against rotenone-induced mitochondrial stress. Biochem Biophys Res Commun. 2017;485:782-789. [PubMed] [DOI] |
| 6. | Yu EJ, Kim SH, Kim HJ, Heo K, Ou CY, Stallcup MR, Kim JH. Positive regulation of β-catenin-PROX1 signaling axis by DBC1 in colon cancer progression. Oncogene. 2016;35:3410-3418. [PubMed] [DOI] |
| 7. | Liu X, Ehmed E, Li B, Dou J, Qiao X, Jiang W, Yang X, Qiao S, Wu Y. Breast cancer metastasis suppressor 1 modulates SIRT1-dependent p53 deacetylation through interacting with DBC1. Am J Cancer Res. 2016;6:1441-1449. [PubMed] |
| 8. | Ha SY, Kim JH, Yang JW, Bae H, Cho HY, Park CK. Expression of DBC1 is associated with poor prognosis in hepatitis virus-related hepatocellular carcinoma. Pathol Res Pract. 2016;212:616-621. [PubMed] [DOI] |
| 9. | Won KY, Cho H, Kim GY, Lim SJ, Bae GE, Lim JU, Sung JY, Park YK, Kim YW, Lee J. High DBC1 (CCAR2) expression in gallbladder carcinoma is associated with favorable clinicopathological factors. Int J Clin Exp Pathol. 2015;8:11440-11445. [PubMed] |
| 10. | Cho D, Park H, Park SH, Kim K, Chung M, Moon W, Kang M, Jang K. The expression of DBC1/CCAR2 is associated with poor prognosis of ovarian carcinoma. J Ovarian Res. 2015;8:2. [PubMed] [DOI] |
| 11. | Noguchi A, Kikuchi K, Zheng H, Takahashi H, Miyagi Y, Aoki I, Takano Y. SIRT1 expression is associated with a poor prognosis, whereas DBC1 is associated with favorable outcomes in gastric cancer. Cancer Med. 2014;3:1553-1561. [PubMed] [DOI] |
| 12. | Cha EJ, Noh SJ, Kwon KS, Kim CY, Park BH, Park HS, Lee H, Chung MJ, Kang MJ, Lee DG. Expression of DBC1 and SIRT1 is associated with poor prognosis of gastric carcinoma. Clin Cancer Res. 2009;15:4453-4459. [PubMed] [DOI] |
| 13. | Remmele W, Stegner HE. Recommendation for uniform definition of an immunoreactive score (IRS) for immunohistochemical estrogen receptor detection (ER-ICA) in breast cancer tissue. Pathologe. 1987;8:138-140. [PubMed] |
| 14. | Lee J, Adelmant G, Marto JA, Lee DH. Dephosphorylation of DBC1 by Protein Phosphatase 4 Is Important for p53-Mediated Cellular Functions. Mol Cells. 2015;38:697-704. [PubMed] [DOI] |
| 15. | Park JH, Lee SW, Yang SW, Yoo HM, Park JM, Seong MW, Ka SH, Oh KH, Jeon YJ, Chung CH. Modification of DBC1 by SUMO2/3 is crucial for p53-mediated apoptosis in response to DNA damage. Nat Commun. 2014;5:5483. [PubMed] [DOI] |
| 16. | Radvanyi L, Singh-Sandhu D, Gallichan S, Lovitt C, Pedyczak A, Mallo G, Gish K, Kwok K, Hanna W, Zubovits J. The gene associated with trichorhinophalangeal syndrome in humans is overexpressed in breast cancer. Proc Natl Acad Sci USA. 2005;102:11005-11010. [PubMed] [DOI] |
| 17. | Kim HJ, Kim SH, Yu EJ, Seo WY, Kim JH. A positive role of DBC1 in PEA3-mediated progression of estrogen receptor-negative breast cancer. Oncogene. 2015;34:4500-4508. [PubMed] [DOI] |
| 18. | Hubbard BP, Loh C, Gomes AP, Li J, Lu Q, Doyle TL, Disch JS, Armour SM, Ellis JL, Vlasuk GP. Carboxamide SIRT1 inhibitors block DBC1 binding via an acetylation-independent mechanism. Cell Cycle. 2013;12:2233-2240. [PubMed] [DOI] |
| 19. | Zheng H, Yang L, Peng L, Izumi V, Koomen J, Seto E, Chen J. hMOF acetylation of DBC1/CCAR2 prevents binding and inhibition of SirT1. Mol Cell Biol. 2013;33:4960-4970. [PubMed] [DOI] |
| 20. | Kong S, Thiruppathi M, Qiu Q, Lin Z, Dong H, Chini EN, Prabhakar BS, Fang D. DBC1 is a suppressor of B cell activation by negatively regulating alternative NF-κB transcriptional activity. J Immunol. 2014;193:5515-5524. [PubMed] [DOI] |
| 21. | Magni M, Ruscica V, Buscemi G, Kim JE, Nachimuthu BT, Fontanella E, Delia D, Zannini L. Chk2 and REGγ-dependent DBC1 regulation in DNA damage induced apoptosis. Nucleic Acids Res. 2014;42:13150-13160. [PubMed] [DOI] |
| 22. | Sathishkumar C, Prabu P, Balakumar M, Lenin R, Prabhu D, Anjana RM, Mohan V, Balasubramanyam M. Augmentation of histone deacetylase 3 (<i>HDAC3</i>) epigenetic signature at the interface of proinflammation and insulin resistance in patients with type 2 diabetes. Clin Epigenetics. 2016;8:125. [PubMed] [DOI] |
| 23. | Qin B, Minter-Dykhouse K, Yu J, Zhang J, Liu T, Zhang H, Lee S, Kim J, Wang L, Lou Z. DBC1 functions as a tumor suppressor by regulating p53 stability. Cell Rep. 2015;10:1324-1334. [PubMed] [DOI] |
| 24. | Bae JS, Park SH, Kim KM, Kwon KS, Kim CY, Lee HK, Park BH, Park HS, Lee H, Moon WS. CK2α phosphorylates DBC1 and is involved in the progression of gastric carcinoma and predicts poor survival of gastric carcinoma patients. Int J Cancer. 2015;136:797-809. [PubMed] [DOI] |
| 25. | Koyama S, Wada-Hiraike O, Nakagawa S, Tanikawa M, Hiraike H, Miyamoto Y, Sone K, Oda K, Fukuhara H, Nakagawa K. Repression of estrogen receptor beta function by putative tumor suppressor DBC1. Biochem Biophys Res Commun. 2010;392:357-362. [PubMed] [DOI] |
| 26. | Zhao W, Kruse JP, Tang Y, Jung SY, Qin J, Gu W. Negative regulation of the deacetylase SIRT1 by DBC1. Nature. 2008;451:587-590. [PubMed] [DOI] |
| 27. | Huan Y, Wu D, Zhou D, Sun B, Li G. DBC1 promotes anoikis resistance of gastric cancer cells by regulating NF-κB activity. Oncol Rep. 2015;34:843-849. [PubMed] [DOI] |
| 28. | Shim UJ, Lee IS, Kang HW, Kim J, Kim WT, Kim IY, Ryu KH, Choi YH, Moon SK, Kim YJ. Decreased DBC1 Expression Is Associated With Poor Prognosis in Patients With Non-Muscle-Invasive Bladder Cancer. Korean J Urol. 2013;54:631-637. [PubMed] [DOI] |
| 29. | Pangon L, Mladenova D, Watkins L, Van Kralingen C, Currey N, Al-Sohaily S, Lecine P, Borg JP, Kohonen-Corish MR. MCC inhibits beta-catenin transcriptional activity by sequestering DBC1 in the cytoplasm. Int J Cancer. 2015;136:55-64. [PubMed] [DOI] |
| 30. | Li C, Liao J, Wu S, Fan J, Peng Z, Wang Z. Overexpression of DBC1, correlated with poor prognosis, is a potential therapeutic target for hepatocellular carcinoma. Biochem Biophys Res Commun. 2017;494:511-517. [PubMed] [DOI] |