修回日期: 2018-08-28
接受日期: 2018-09-07
在线出版日期: 2018-10-08
研究肝脏脂联素信号通路分子在大鼠非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)形成过程不同时期的表达变化.
SD雄性大鼠24只随机分为4组: 正常组N组(6只), 模型组M4组(6只), 模型组M8组(6只), 模型组M12组(6只). 正常组给予普通饲料喂养, NAFLD模型组给予高脂饲料喂养. 分别于第4周末处死M4组大鼠, 第8周末处死M8组大鼠, 第12周末处死N组和M12组大鼠. 采用HE染色法观察各组大鼠肝组织病理学改变; ELISA检测各组大鼠血清脂联素水平; RT-PCR法检测大鼠肝脏AdipoR2、PPARα的mRNA表达; Western blot蛋白印记法检测各组大鼠肝脏AdipoR2、PPARα及磷酸化AMPK蛋白表达.
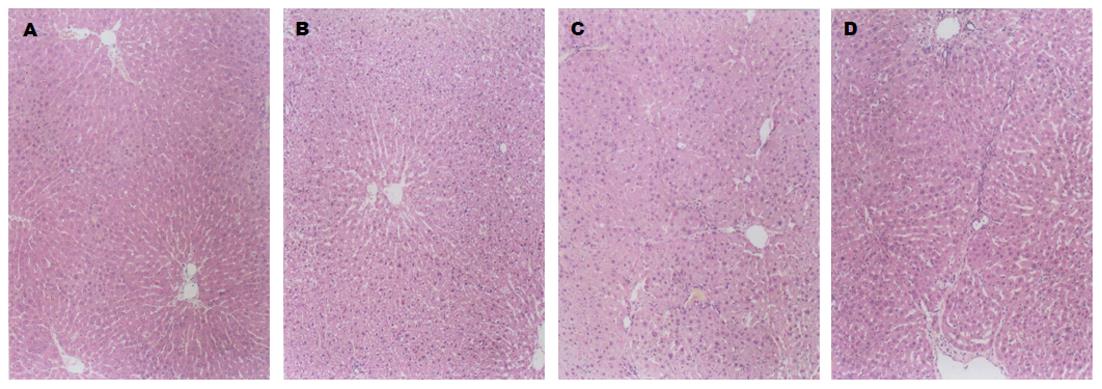
肝脏HE染色显示, 第12周末时模型组大鼠可见肝细胞肿胀明显, 细胞质内可见大量的脂肪空泡, 少量肝细胞发生坏死, 提示造模成功. ELISA法结果表明, 与正常组相比, 模型组大鼠第4周末、第8周末、第12周末血清脂联素水平逐渐降低, 每两组之间比较差异有显著性(P<0.05). RT-PCR法结果表明, 与正常组相比, 模型组大鼠肝脏第4周末、第8周末、第12周末AdipoR2、PPARα的mRNA表达逐渐减弱, 每两组之间比较差异有显著性(P<0.05). Western blot蛋白印记法结果显示, 与正常组相比, 模型组大鼠肝脏AdipoR2、PPARα及磷酸化AMPK蛋白表达在第4周末、第8周末、第12周末逐渐减弱, 每两组之间比较差异有显著性(P<0.05).
脂联素信号通路分子在NAFLD形成过程中表达逐渐减弱. 脂联素信号通路活性逐渐降低可能是NAFLD形成的机制之一.
核心提要: 脂联素信号通路在非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)进展的不同时期如何发挥作用, 目前没有详细的论述. 本文研究在构建NAFLD模型过程的不同时期(第4周末, 8周末, 12周末), 脂联素信号通路分子的动态表达变化, 探讨NAFLD的发病机制.
引文著录: 刘浩, 时昭红. 脂联素信号通路分子在非酒精性脂肪性肝病模型构建不同时期的表达变化. 世界华人消化杂志 2018; 26(28): 1645-1650
Revised: August 28, 2018
Accepted: September 7, 2018
Published online: October 8, 2018
To detect the dynamic expression of adiponectin signaling pathway molecules in a non-alcoholic fatty liver disease (NAFLD) model.
Twenty-four male SD rats were randomly divided into four groups: a normal group (N, n = 6) and three model groups (M4, M8, and M12, n = 6 each). The normal group was given an ordinary diet, and the NAFLD model groups were given a high-fat diet. At the end of the fourth week, rats in group M4 were sacrificed. M8 rats were killed at the end of the eighth week, and rats in groups N and M12 were sacrificed at the end of the twelfth weeks. Tissue samples were collected for histopathological examinations. Serum adiponectin was detected by ELISA. The expression of AdipoR2 mRNA and PPARα mRNA was determined by RT-PCR. Protein expression of AdipoR2, PPARα, and phosphorylated AMPK was examined by Western blot.
HE staining showed that liver cell swelling was obvious at the end of the twelfth weeks, with a large number of fat vacuoles in the cytoplasm and a small number of necrotic liver cells, which suggested that NAFLD was successfully induced. Compared with the normal group, serum adiponectin in the model group rats gradually decreased from week 4 to weeks 8 and 12. Compared with the normal group, the expression of AdipoR2 mRNA and PPARα mRNA in the liver of the model group rats gradually decreased from week 4 to weeks 8 and 12. Compared with the normal group, the protein expression of adiponectin signaling pathway molecules in the liver of the model group rats gradually decreased from week 4 to weeks 8 and 12. There was a significant difference between each two groups (P < 0.05).
The protein expression of adiponectin signaling pathway molecules decreases gradually in the formation process of NAFLD. The activity decrease of the adiponectin signaling pathway is possibly one of the mechanisms contributing to NAFLD.
- Citation: Liu H, Shi ZH. Dynamic expression of adiponectin signaling pathway molecules in a rat model of non-alcoholic fatty liver disease. Shijie Huaren Xiaohua Zazhi 2018; 26(28): 1645-1650
- URL: https://www.wjgnet.com/1009-3079/full/v26/i28/1645.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i28.1645
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)是除外酒精和其他明确的损肝因素所致的, 以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征. 我国NAFLD的发病率呈逐年上升趋势, 严重危害人民身体健康[1]. 脂联素(adiponectin)是一种具有多种生物学效应的细胞因子, 脂联素及其下游信号通路分子参与了多种疾病的脂质代谢[2], 并参与了NAFLD的形成和发展[3]. 但是脂联素信号通路分子在NAFLD进展的不同时期如何发挥作用, 目前仍然没有详细的论述. 本文通过实验大鼠构造NAFLD模型, 研究NAFLD形成过程的不同时期, 脂联素信号通路分子的表达变化, 探讨NAFLD的发病机制, 为NAFLD的防治提供理论基础.
SPF级SD雄性大鼠24只体重180 g±20 g, 购于湖北省实验动物研究中心. 大鼠脂联素双抗夹心ELISA法试剂盒由深圳依诺生物科技有限公司提供. 100 bp DNA Ladder购自华美生物工程公司, 所有引物均由上海生工生物制品公司合成. AdipoR2、PPARα抗体购自美国Santa Cruz公司, 磷酸化AMPK抗体购自美国Cell Signaling Technology公司.
将24只SD雄性大鼠随机分为4组: 正常组N组(6只), 模型组M4组(6只), 模型组M8组(6只), 模型组M12组(6只), 组间暴露无差异. 正常组给予普通饲料喂养, NAFLD模型组给予高脂饲料(普通饲料+2%胆固醇+14%猪油)喂养造模. 模型组分别于第4周末处死M4组大鼠, 第八周末处死M8组大鼠, 第十二周末处死M12组大鼠. 正常组于十二周末全部处死N组大鼠. 同时取各组大鼠的血清和肝脏相同部位的标本储存备用.
ELISA操作方法: 确定检测所需的已包被抗体的酶标板孔数目, 并增加1孔作为TMB空白显色孔, 总数 = 样品数+9. 将浓度梯度标准品(从6000 pg/mL到0)各0.1 mL依次加入一排8孔中. 将大鼠血清稀释10倍, 依次每孔加入0.1 mL. 然后依据说明书进行操作, 显色后用酶标仪在450 nm测定OD值. 将TMB空白显色孔作为对照. 所有的样品和样品的吸光值减去零孔的吸光值后, 在坐标纸上画出曲线, 以吸光值作为纵坐标, 以浓度作为横坐标. 根据样品的吸光值在坐标上找出对应的浓度. 乘以10倍后, 为每个样品的实际值.
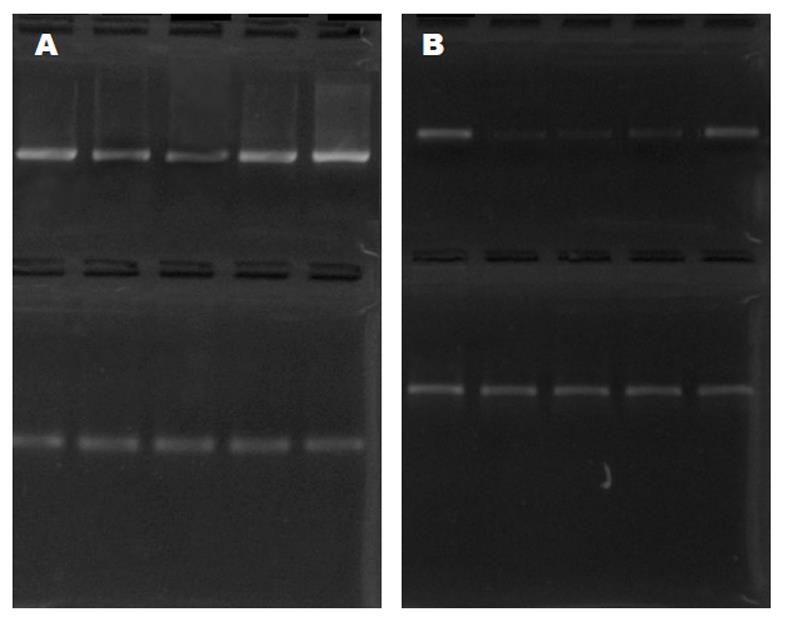
逆转录聚合酶链反应(RT-PCR)操作方法: TRIzol试剂(美国GIBCO公司)一步反向引物法抽提细胞总RNA, 紫外分光光度仪检测其浓度和纯度, 1%琼脂糖变性电泳检验RNA完整性. 取3 μg RNA, 用M-MLV逆转录酶(Promega公司)进行反转录, PCR扩增上述4种基因, 同时扩增β-actin作为内参照. 取6-10 μL扩增产物在1.5%琼脂糖凝胶电泳, 放在紫外投射仪上进行观察和照相.
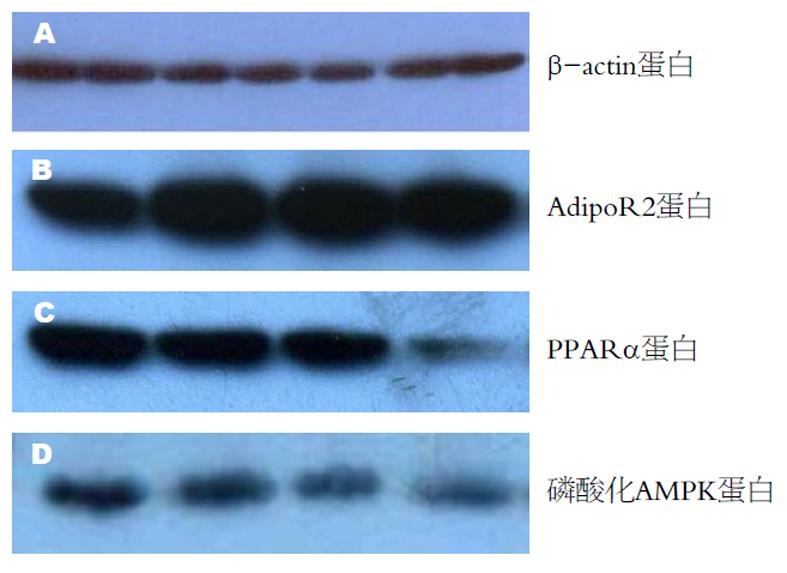
Western blot蛋白印记: 取少量肝脏组织样品, 用机械匀浆器打碎, 溶解在200 μL RIPA裂解液中, 12 000 rpn/min, 30 min, 去掉上层乳白色油脂和管底沉淀, 取上清液作为蛋白溶液样品. 测算蛋白的浓度, 放在-20 ℃保存备用. 配制好10%SDS-聚丙烯酰胺凝胶, 在每孔加入80 μg蛋白, 进行电泳分离. 以β-actin蛋白作为内参照. 把蛋白电转移到硝酸纤维素膜, 放在脱脂奶粉中4 ℃封闭摇动过夜. 在室温下把膜放在一抗中孵育2 h, TBS洗涤, 二抗室温2 h, 加入1 μL显色液, X线下底片曝光, 然后显影和定影, 用计算机的密度扫描对反应条带进行定量分析.
统计学处理 实验结果以mean±SD表示, 各组计量资料分析应用完全随机设计的单因素方差分析, 计数资料采用Ridit检验法. 统计结果用SPSS13.0软件包处理. P<0.05为差异有显著性.
肝脏HE染色显示, 正常组大鼠肝组织肝索结构清晰, 肝细胞以中央静脉为中心呈放射状排列, 肝组织内无脂肪空泡, 未见明显脂滴分布. 模型组大鼠均出现不同程度的弥漫性肝细胞脂肪变性. 第4周末时模型组大鼠肝组织可见散在肝细胞脂肪变性. 第8周末时模型组大鼠可见肝细胞肿胀, 肝组织可见散在片状肝细胞脂肪变性. 第12周末时模型组大鼠可见肝细胞肿胀明显, 呈圆形, 细胞质内可见大量的脂肪空泡, 空泡之间界限模糊. 少量肝细胞发生坏死. 根据肝细胞脂肪变性程度, "-"为0分, "+"为1分, "++"为2分, "+++"为3分, 计算出脂肪变性百分率(图1和表1).
| 分组 | 脂肪变性程度 | 脂肪变性百分率% | |||
| - | + | ++ | +++ | ||
| 正常组 | 6 | 0 | 0 | 0 | 0 |
| 模型组(M4) | 0 | 5 | 1 | 0 | 38.8 |
| 模型组(M8) | 0 | 2 | 4 | 0 | 55.5 |
| 模型组(M12) | 0 | 0 | 1 | 5 | 94.4 |
与正常组相比, 模型组血清脂联素值均示降低. 且随着时间推移, 第4周末、第8周末、第12周末模型组血清脂联素值呈逐渐减弱趋势, 每两组之间比较差异有显著性(P<0.05)(表2).
与正常组相比, 模型组大鼠AdipoR2、PPARα的mRNA表达减弱. 随着造模时间的延长, 模型组第4周末、第8周末、第12周末模型组AdipoR2、PPARα的mRNA表达呈逐渐减弱, 每两组之间比较差异有显著性(P<0.05)(图2和表2).
与正常组相比, 模型组大鼠肝脏AdipoR2、PPARα、磷酸化AMPK蛋白表达减弱. 随着造模时间的延长, 模型组第4周末、第8周末、第12周末大鼠肝脏AdipoR2、PPARα、磷酸化AMPK蛋白表达逐渐减弱, 每两组之间比较差异有显著性(P<0.05)(图3和表3).
NAFLD的病理特征是脂质在肝脏过量沉积, 肝细胞存在大量脂肪变[4]. NAFLD是临床上最常见的主要慢性肝脏疾病之一, 疾病谱包括单纯性脂肪肝以及由其演变的脂肪性肝炎和肝硬化, 缺乏有效治疗药物[5]. NAFLD 的发病机制较为复杂, 至今尚未完全明确, 目前广为接受的是由Donati等[6]和Diehl[7]提出的"二次打击"学说, 其中, "初次打击"与肝脂质代谢紊乱及胰岛素抵抗密切相关, "二次打击"与肝脏炎症坏死及细胞因子、氧化应激以及脂质过氧化密切相关[8,9]. 本实验以脂肪乳灌胃建立的NAFLD模型, 病理切片上提示肝脏脂质沉积增多, 有不同程度的泡状脂肪变性, 符合人类NAFLD的发病机制.
脂联素是一种具有多种生物学效应的细胞因子, 由脂肪细胞分泌, 并在脂肪组织中大量表达[10]. 脂联素通过与其受体结合, 有调节脂质代谢、改善胰岛素抵抗、调节炎症反应、抗氧化应激、抗纤维化等一系列生物活性作用, 具有降血糖、降血脂、抗炎等作用, 参与肥胖、2型糖尿病、动脉粥样硬化等多种疾病的病理生理过程, 同时对预防或延缓NAFLD的发生、发展具有显著效果[11]. 大量研究表明, 脂联素作为一种保护性细胞因子可以抑制肝脏脂肪合成, 促进脂肪氧化分解, 增强周围组织对胰岛素的敏感性, 抑制炎症因子产生,对抗氧化应激和纤维化, 阻止NAFLD的进展[2,12]. Komshilova等[13]通过研究 NAFLD患者血清脂联素水平, 结果表明NAFLD患者血清脂联素水平明显降低, 且与患者NAFLD病情严重程度呈相关性. 本实验研究也表明, 随着实验性大鼠NAFLD的发生发展, 血清脂联素水平在第4周、第8周和第12周末逐渐降低. 因此, 血清脂联素水平降低对NAFLD的预测和诊断均有一定的价值, 可作为NAFLD的一个判断 指标, 为NAFLD的无创性诊断提供一条新的思路和方法.
脂联素通过与细胞膜上的特异性受体结合发挥多种生理作用. 2003年, Kadowaki等[14]应用分子克隆技术确定脂联素受体存在两种异构体, 分别称为脂联素受体1(AdipoR1)和脂联素受体2(AdipoR2), AdipoR1在骨骼肌有丰富表达, 而AdipoR2主要在肝脏表达[15]. 目前一系列研究表明, 脂联素与肝细胞AdipoR2结合后, 主要通过激活过氧化物酶体增殖因子激活受体α(PPARα)途径[12,16], 以及活化AMPK途径[17,18], 引起下游一系列分子的改变, 实现肝细胞糖原异生减少和脂肪酸β氧化增加. PPARα是一类在肝脏大量表达的核转录因子, 通过由相应配体激活, 调节编码肝脏脂肪酸结合蛋白等基因的转录与活化, 从而抑制肝脏对脂肪酸的摄取和代谢, 减少肝脏脂肪沉积[16]. PPARα的激活与脂联素刺激的脂肪酸氧化有关, 而与葡萄糖摄取无关[19]. 高胰岛素血症会使PPARα表达下调或活性受抑, 而引起一系列与脂质代谢有关的蛋白质和酶基因的转录水平降低,进一步加重肝脏脂肪酸沉积,再加之各种细胞因子释放, 从而促进脂肪性肝炎、脂肪性肝纤维化的形成和发展[20]. 因此, 脂联素受体及其信号转导机制在脂联素调控NAFLD的发生过程中发挥关键的作用. 但是这种调控机制在NAFLD形成和发展的不同时期, 是如何发挥作用的, 目前仍然没有详细的论述.
本研究采取体内实验的方法, 以高脂饲料喂养法建立NAFLD大鼠模型, 观察NAFLD形成过程中大鼠血清脂联素的动态变化, 以及脂联素信号通路分子AdipoR2、AMPK、PPARα在大鼠肝脏中不同时期的表达变化. 结果表明, 随着NAFLD的发生发展, 血清脂联素水平在第4周、第8周和第12周末逐渐降低, 肝脏AdipoR2、PPARα、磷酸化AMPK表达在第4周、第8周和第12周末逐渐减弱, 提示了脂联素信号通路活性逐渐降低可能是NAFLD形成的机制之一. 因此, 如能在NAFLD发生的中后期增强脂联素信号通路的活性, 则可能减轻NAFLD引起的肝细胞损伤.
随着近年来饮食习惯和生活方式的改变, 非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)的发病率逐年增高, 目前已经成为我国临床上最常见的慢性肝病之一. 因此NAFLD的防治逐渐成为医学工作者的研究热点.
目前研究发现, 脂联素信号通路在NAFLD的形成过程中发挥着重要的作用. 但是脂联素信号通路分子在NAFLD进展的不同时期如何发挥作用, 目前仍然没有详细的论述.
通过大鼠构建NAFLD模型, 研究脂联素及其下游信号通路分子AdipoR2、PPARα和AMPK在NAFLD形成过程中第4周末、第8周末、第12周末的表达变化, 探讨NAFLD的发病机制, 为寻找新的NAFLD防治方法提供理论依据.
通过ELISA法检测血清脂联素值变化, RT-PCR法检测大鼠肝脏AdipoR2、PPARα的mRNA结果, Western blot蛋白印记法检测肝脏AdipoR2、PPARα和磷酸化AMPK蛋白表达, 并对第4周末、第8周末、第12周末的实验数据进行比较, 研究脂联素信号通路分子在NAFLD形成过程中的动态变化.
随着动物模型大鼠NAFLD的发生发展, 血清脂联素水平在第4周、第8周和第12周末逐渐降低, 肝脏AdipoR2、PPARα、磷酸化AMPK表达在第4周、第8周和第12周末逐渐减弱.
脂联素信号通路活性逐渐降低可能是NAFLD形成的机制之一. 如能在NAFLD发生的中后期增强脂联素信号通路的活性, 则可能减轻NAFLD引起的肝细胞损伤, 对NAFLD起到预防作用.
本课题可更加细致的研究脂联素信号通路分子在NAFLD进展过程中每周的表达变化, 这样得出的实验结果就更为详实可靠. 同时可加入对肝细胞凋亡动态变化的研究, 探讨在NAFLD形成过程中脂联素信号通路与肝细胞凋亡的关系, 进一步探讨NAFLD可能的发生机制.
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): D
E级 (差): E
编辑: 崔丽君 电编:张砚梁
| 1. | 中华医学会肝病学分会脂肪肝和酒精性肝病学组. 非酒精性脂肪性肝病诊疗指南(2010年修订版). 胃肠病学和肝病学杂志. 2010;19:483-487. |
| 2. | Achari AE, Jain SK. Adiponectin, a Therapeutic Target for Obesity, Diabetes, and Endothelial Dysfunction. Int J Mol Sci. 2017;18. [PubMed] [DOI] |
| 3. | Adolph TE, Grander C, Grabherr F, Tilg H. Adipokines and Non-Alcoholic Fatty Liver Disease: Multiple Interactions. Int J Mol Sci. 2017;18. [PubMed] [DOI] |
| 4. | Chalasani N, Younossi Z, Lavine JE, Charlton M, Cusi K, Rinella M, Harrison SA, Brunt EM, Sanyal AJ. The diagnosis and management of nonalcoholic fatty liver disease: Practice guidance from the American Association for the Study of Liver Diseases. Hepatology. 2018;67:328-357. [PubMed] [DOI] |
| 5. | Issa D, Patel V, Sanyal AJ. Future therapy for non-alcoholic fatty liver disease. Liver Int. 2018;38 Suppl 1:56-63. [PubMed] [DOI] |
| 6. | Donati G, Stagni B, Piscaglia F, Venturoli N, Morselli-Labate AM, Rasciti L, Bolondi L. Increased prevalence of fatty liver in arterial hypertensive patients with normal liver enzymes: role of insulin resistance. Gut. 2004;53:1020-1023. [PubMed] |
| 8. | Samuel VT, Shulman GI. Nonalcoholic Fatty Liver Disease as a Nexus of Metabolic and Hepatic Diseases. Cell Metab. 2018;27:22-41. [PubMed] [DOI] |
| 9. | Del Campo JA, Gallego P, Grande L. Role of inflammatory response in liver diseases: Therapeutic strategies. World J Hepatol. 2018;10:1-7. [PubMed] [DOI] |
| 10. | Sharma AX, Holland WL. Adiponectin and its Hydrolase-Activated Receptors. J Nat Sci. 2017;3. [PubMed] |
| 11. | Kadowaki T, Yamauchi T, Kubota N, Hara K, Ueki K, Tobe K. Adiponectin and adiponectin receptors in insulin resistance, diabetes, and the metabolic syndrome. J Clin Invest. 2006;116:1784-1792. [PubMed] [DOI] |
| 12. | Abenavoli L, Milic N, Di Renzo L, Preveden T, Medić-Stojanoska M, De Lorenzo A. Metabolic aspects of adult patients with nonalcoholic fatty liver disease. World J Gastroenterol. 2016;22:7006-7016. [PubMed] [DOI] |
| 13. | Komshilova KA, Troshina EA, Ershova EV, Mazurina NV, Platonova NM. Adiponectin and parameters of glucose and lipid metabolism at different clinical and morphological stages of non-alcoholic fatty liver disease in patients with abdominal obesity. Ter Arkh. 2014;86:27-32. [PubMed] |
| 14. | Kadowaki T, Yamauchi T. Adiponectin and adiponectin receptors. Endocr Rev. 2005;26:439-451. [PubMed] [DOI] |
| 15. | Alzahrani B, Iseli T, Ramezani-Moghadam M, Ho V, Wankell M, Sun EJ, Qiao L, George J, Hebbard LW. The role of AdipoR1 and AdipoR2 in liver fibrosis. Biochim Biophys Acta. 2018;1864:700-708. [PubMed] [DOI] |
| 16. | Doi T. A Novel Selective PPARα Modulator. J Atheroscler Thromb. 2015;22:750-751. [PubMed] [DOI] |
| 17. | Kim SJ, Tang T, Abbott M, Viscarra JA, Wang Y, Sul HS. AMPK Phosphorylates Desnutrin/ATGL and Hormone-Sensitive Lipase To Regulate Lipolysis and Fatty Acid Oxidation within Adipose Tissue. Mol Cell Biol. 2016;36:1961-1976. [PubMed] [DOI] |
| 18. | Liang Z, Li T, Jiang S, Xu J, Di W, Yang Z, Hu W, Yang Y. AMPK: a novel target for treating hepatic fibrosis. Oncotarget. 2017;8:62780-62792. [PubMed] [DOI] |
| 19. | Ishibashi S, Yamashita S, Arai H, Araki E, Yokote K, Suganami H, Fruchart JC, Kodama T; K-877-04 Study Group. Effects of K-877, a novel selective PPARα modulator (SPPARMα), in dyslipidaemic patients: A randomized, double blind, active- and placebo-controlled, phase 2 trial. Atherosclerosis. 2016;249:36-43. [PubMed] [DOI] |