修回日期: 2018-08-18
接受日期: 2018-09-06
在线出版日期: 2018-09-28
研究Wee1抑制剂MK-1775对GBC-SD细胞系胆囊癌干细胞样细胞自我更新的抑制作用.
体外培养GBC-SD细胞系, 在无血清干细胞培养基中加入MK-1775后培养悬浮肿瘤干细胞球; Western-blot检测Wee1的表达, 并分析比较肿瘤干细胞球体积大小和形成率的变化; 建立裸鼠皮下移植瘤模型后MK-17751灌胃2 wk, 2 wk后检测分析移植瘤的重量.
加入MK-1775培养8 d后, GBC-SD 细胞中Wee1表达下调, 同时肿瘤干细胞球大小及形成率均受到抑制; 经MK-17751处理后, 裸鼠皮下移植瘤生长受到抑制.
MK-1775具有抑制GBC-SD细胞系胆囊癌干细胞样细胞自我更新的作用.
核心提要: 原发性胆囊癌早期诊断困难, 恶性程度高, 肿瘤进展快, 预后较差. 目前研究表明肿瘤干细胞是肿瘤发生发展发的根本原因. 本研究通过体外和体内实验观察到MK-1775对胆囊癌干细胞样细胞自我更新具有抑制作用, 有望成为治疗胆囊癌的靶向药物之一.
引文著录: 石程剑, 田锐, 王敏, 赵炎, 秦仁义. Wee1抑制剂MK-1775对GBC-SD细胞系胆囊癌干细胞样细胞自我更新的影响. 世界华人消化杂志 2018; 26(27): 1586-1591
Revised: August 18, 2018
Accepted: September 6, 2018
Published online: September 28, 2018
To assess the inhibitory effect of Wee1 inhibitor MK-1775 on self-renewal of cancer stem like cells in GBC-SD cells.
The GBC-SD cell line was cultured in vitro, and the suspended cancer stem cell spheres were cultured in serum free stem cell culture medium containing MK-1775. The expression of Wee1 was detected by Western blot, and the changes of the sphere size and sphere formation rate were analyzed. After the establishment of a subcutaneously transplanted tumor model in nude mice, MK-17751 was given for 2 wk, and the weight of the transplanted tumors was detected 2 wk later.
After 8 d of culture with MK-1775, the expression of Wee1 in GBC-SD cells was downregulated and the sphere size and sphere formation rate were reduced. After MK-17751 treatment, the growth of subcutaneous xenografts in nude mice was inhibited.
MK-1775 can inhibit the self-renewal of cancer stem like cell in gallbladder cancer GBC-SD cells.
- Citation: Shi CJ, Tian R, Wang M, Zhao Y, Qin RY. Effect of WEE1 inhibitor MK-1775 on self-renewal of gallbladder cancer stem cells. Shijie Huaren Xiaohua Zazhi 2018; 26(27): 1586-1591
- URL: https://www.wjgnet.com/1009-3079/full/v26/i27/1586.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i27.1586
原发性胆囊癌是胆道系统常见的恶性肿瘤, 因其早期诊断困难, 肿瘤进展快, 恶性程度高, 早期易发生转移, 所以其预后较差, 5年生存率5%左右[1,2]. 目前研究表明肿瘤干细胞是肿瘤发生发展、耐药及复发的根本原因[3,4], 而自我更新是肿瘤干细胞的基本特征[5,6], 近来研究表明阻断肿瘤干细胞的自我更新是肿瘤靶向治疗的有效途径之一[7,8]. Wee1抑制剂MK-1775在多种肿瘤的研究中具有抑制肿瘤的作用[9,10], 而其与肿瘤干细胞的相关性研究则较少有报道. 本文旨在考察MK-1775对胆囊癌干细胞自我更新的影响.
MK-1775(MCE中国), Wee1抗体(Santa Cruz), DMEM/F12(1:1)培养基(Gibco); B27添加剂(Gibco); 人表皮生长因子(EGF, Pe-proTech);人碱性成纤维生长因子(bFGF, Pepro-Tech); L-谷氨酰胺(Sigma); 特级胎牛血清(Hy-clone); 人胆囊癌细胞系GBC-SD购自上海中国科学院研究所; 实验动物由鼠来宝(武汉)生物科技有限公司提供.
1.2.1 细胞培养: 人胆囊癌GBC-SD细胞系用含100 mL/L胎牛血清(Gibco)、100 U/mL青霉素和100 U/mL链霉素的DMEM/F12培养基(Gibco), 在37 ℃、50 mL/L CO2饱和湿度条件下培养, 0.2 g/L胰蛋白酶的消化、传代, 实验选用对数生长期的细胞.
1.2.2 肿瘤干细胞球形成率实验: 取对数生长期的细胞消化后, PBS洗2次, 用无血清培养基悬浮培养, 无血清培养基由DMEM/F12(1:1)、B27(1:50)、EGF(20 μg/L)、bFGF(10 mg/L)、LIF(10 mg/L)和L -谷氨酰胺(2 mmol/L)组成. 用24孔板培养, 每孔种入1000个细胞. 实验组的培养基中加入MK-1775(100 nM). 每天加入0.25 mL无血清培养基, 观察细胞球形成的过程, 拍照并记录. 肿瘤干细胞球形成率计算方式: 计数细胞数≥20个的细胞球, 形成率 = 细胞球数/种入细胞数×100%.
1.2.3 Western-blot: 将肿瘤细胞球消化后用RIPA裂解液(博士德, 中国)提取细胞总蛋白, BCA法(碧云天, 中国)测定蛋白质浓度; 取蛋白质40 μg/孔进行电泳(12% SDS-PAGE胶), 转膜至PVDF膜(Millipore, 德国), 用含5%脱脂奶粉的封闭液室温下封闭反应2 h, 分别加入鼠抗人Wee1单克隆抗体(体积稀释比例为1:500)及鼠抗人APDH单克隆抗体(1:200), 4 ℃反应过夜; TBST洗膜后, 加入辣根过氧化物酶标记的羊抗鼠IgG(1:1000), 室温反应1 h; TBST洗膜后, 用ECL试剂进行显影.
1.2.4 裸鼠皮下抑制瘤生长抑制实验: 将GBC-SD细胞消化吹散制成单细胞悬液, 用不含血清的PBS洗2次后, PBS重悬, 按1×106数量级分别注入裸鼠右腹部皮下, 观察移植瘤形成时间及生长速度的情况. 自肉眼可观察到移植瘤形成后, 给予MK-1775灌胃(80 mg/kg), 隔日一次, 持续两周, 治疗结束后继续观察2 wk, 处死、解剖裸鼠取出肿瘤, 测量肿瘤的重量.
1.2.5 免疫组化: 将裸鼠皮下移植瘤甲醛固定, 制成切片行HE染色, 部分行脱蜡、水化及抗原修复后, 按照说明书应用免疫组织化学SP法检测Wee1的表达.
统计学处理 采用SPSS20.0软件对实验的结果数据进行统计分析. 计量资料以mean±SD表示, 使用单因素方差分析进行多组均数比较, 使用LSD分析进行两两比较. 适当的时候使用双侧t检验. P<0.05表示差异有统计学意义.
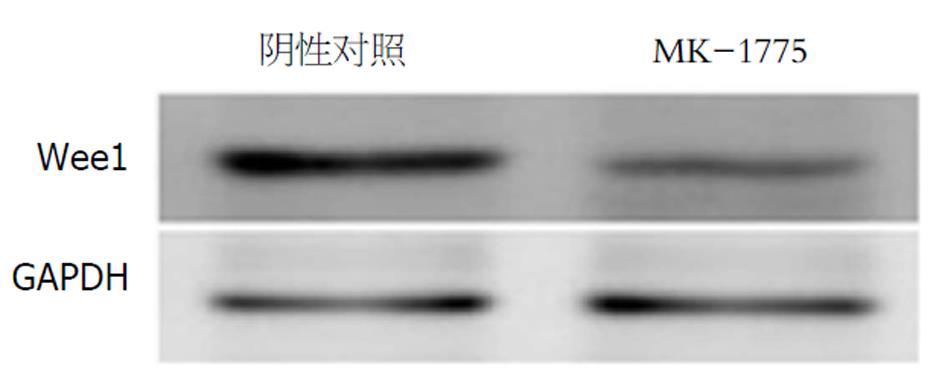
将GBC-SD细胞用不含血清的干细胞培养基培养8 d形成悬浮肿瘤干细胞球后, 使用Western Blot检测Wee1的表达情况, 结果显示(图1), 实验组细胞Wee1的表达明显下调, 表明MK-1775抑制了Wee1的表达.
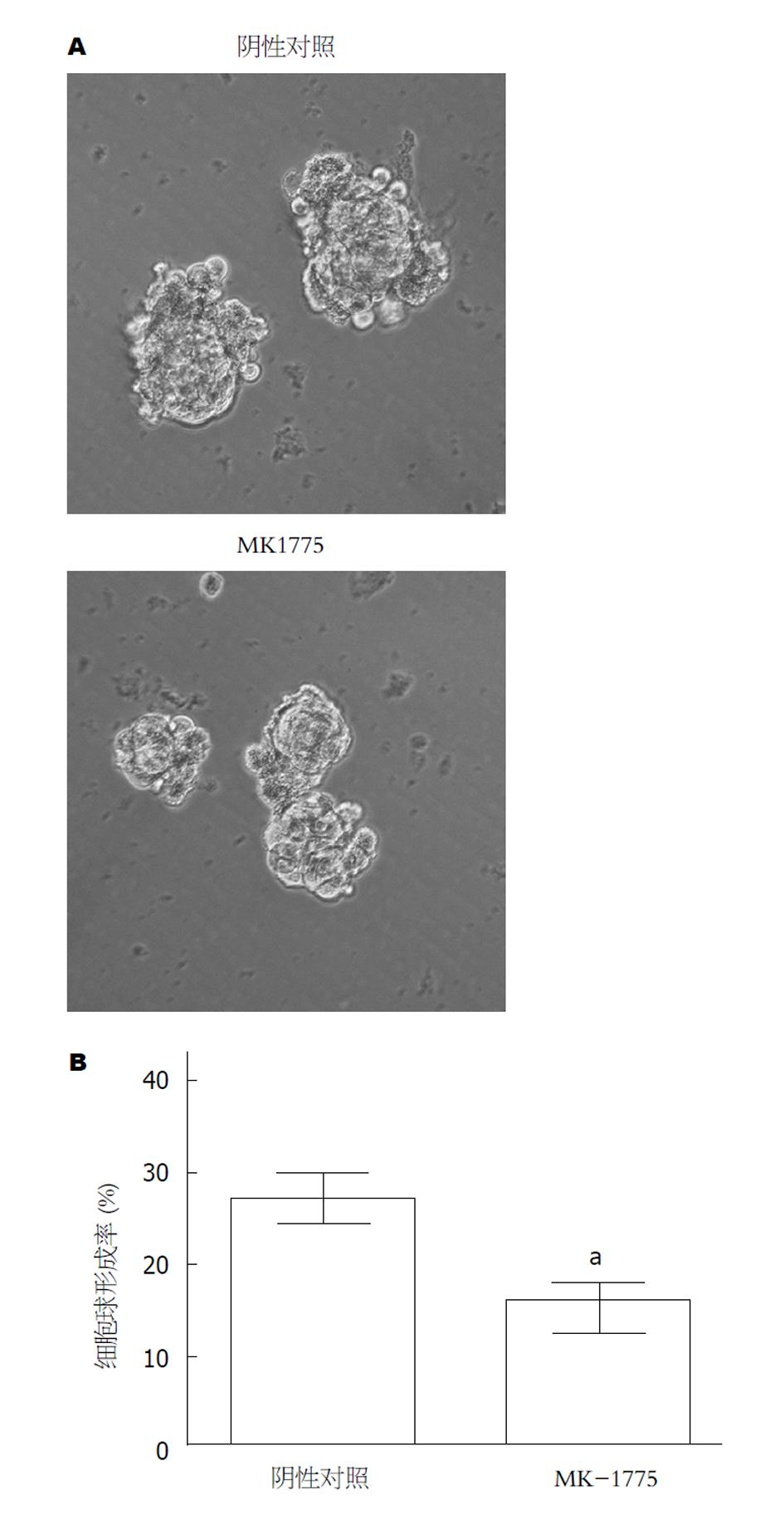
GBC-SD细胞在不含血清的干细胞培养基培养8 d, 观察悬浮肿瘤干细胞球形成的情况, 结果显示(图2), 加入MK-1775组肿瘤干细胞球形成率明显低于对照组, 且肿瘤干细胞球的体积也明显小于对照组.
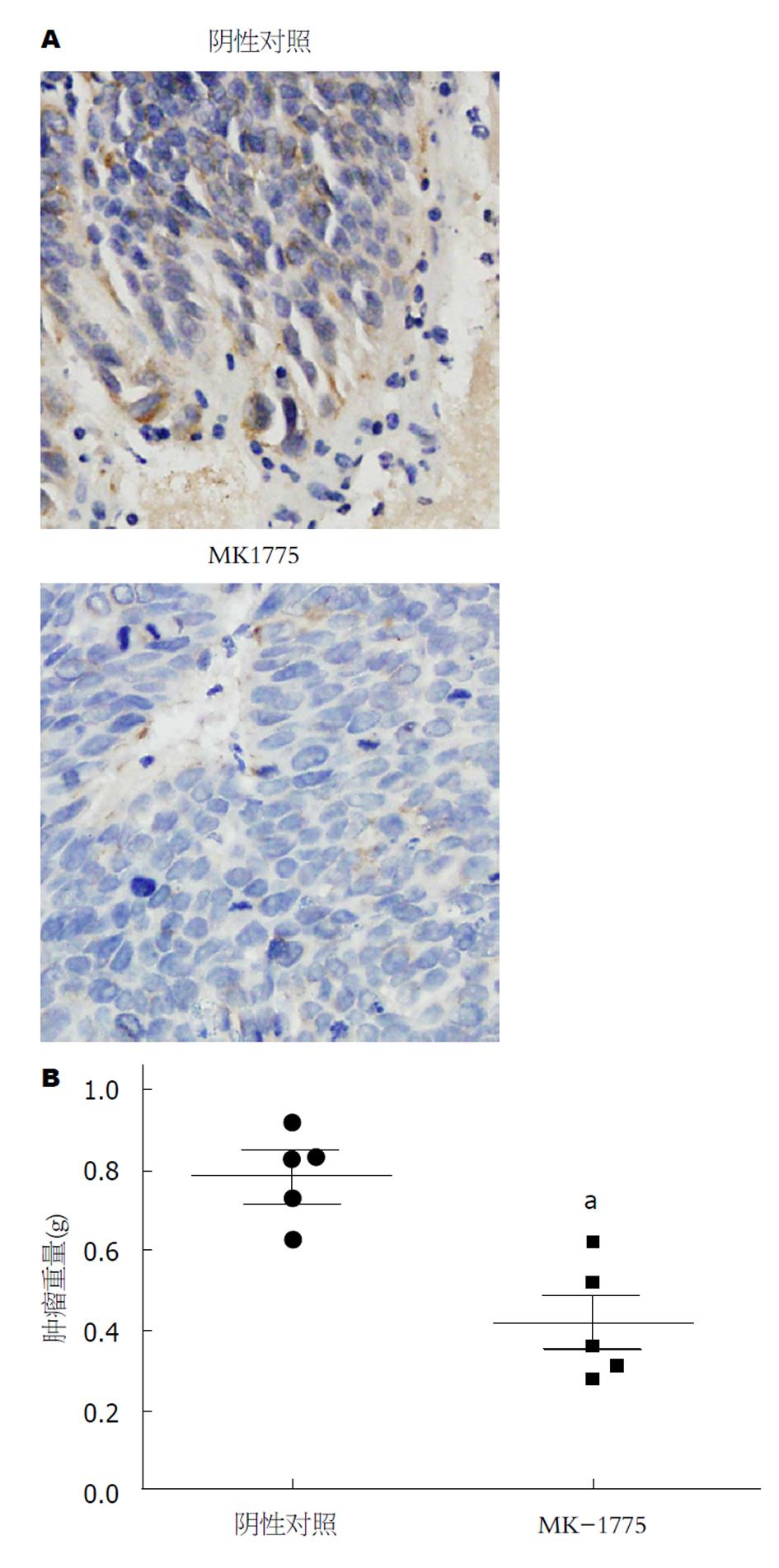
接种GBC-SD细胞2 wk后, 肉眼可见皮下肿瘤形成, 遂开始给予MK-1775灌胃处理, 4 wk后取出肿瘤, 免疫组化结果提示MK-1775在裸鼠体内抑制了GBC-SD来源的皮下肿瘤细胞Wee1的表达; 肿瘤重量对比结果显示, 实验组肿瘤重量明显小于对照组, 表明MK-1775在裸鼠体内抑制了GBC-SD来源的皮下肿瘤的生长(图3).
胆囊癌是胆管系统最常见的恶性肿瘤, 因其难以早期发现, 并极易发生侵袭转移, 确诊时多数患者已处于晚期而丧失了最佳手术时机[1]. 虽然近年来胆囊癌手术切除范围不断扩大, 其总体5年生存率仍徘徊在5%左右[2]. 临床实践表明, 目前的手术治疗方法几乎达到了极限, 放疗和化疗等综合治疗仍是有望提高患者生存率的重要手段, 但遗憾的是,胆囊癌对目前的各种化疗药物都不敏感. 近年来的研究表明, 肿瘤的发生、发展和转移与肿瘤干细胞相关, 这一小群细胞具有自我更新、耐受放化疗及高致瘤性等特性, 是导致治疗后肿瘤复发的原因[3]. 自我更新是肿瘤干细胞的基本特征, 近来研究表明阻断肿瘤干细胞的自我更新是肿瘤靶向治疗的有效途径之一[11-13]. 在我们前期的研究中, 我们证实了胆囊癌部分细胞在干细胞培养环境下可以形成肿瘤细胞球, 这些细胞具有肿瘤干细胞的特征, 包括自我更新、分化潜能及高致瘤性[14,15], 对其自我更新的干预有望为胆囊癌的靶向治疗提供线索.
Wee1属于丝/苏氨酸蛋白激酶家族, 其可以通过抑制CDC2的活性来抑制细胞进行有丝分裂, 调节细胞周期进展[16]. 越来越多的研究表明人Wee1在维持癌细胞生存方面具有非常重要的作用, 是一个理想的癌细胞治疗靶点. 有研究表明在Wee1在结直肠癌[17]、胶质瘤[18]、骨肉瘤[19,20]、神经母细胞瘤[21]、卵巢癌[22]、乳腺癌细胞[23]中, 表达增加并且与肿瘤的恶性在卵巢癌[24]、非小细胞肺癌[25]和头颈部肿瘤细胞[26]中, 单一Wee1抑制剂MK-1775就可以抑制肿瘤; 此外, 在非小细胞肺癌[27]、头颈部肿瘤[28]及乳腺癌[29]细胞中, MK-1775可增强抗肿瘤药物的治疗效果, 而MK-1775对肿瘤干细胞的作用及机制目前尚未见报道. Wee1在细胞周期G2检测点的功能发挥中起着重要的作用, 保证DNA损伤的修复或者促进不可逆受损和修复失败时细胞凋亡[30]. 肿瘤细胞经放化疗DNA损伤后在G2期被修复是肿瘤耐放化疗的重要原因, 因此通过抑制Wee1活性影响G2检测点的功能, 进而阻碍肿瘤干细胞DNA的修复有望成为抑制肿瘤干细胞的机制之一. 我们使用MK-1775在胆囊癌GBC-SD细胞中抑制Wee1功能后, 观察到其中肿瘤干细胞样细胞的自我更新被抑制, 进一步动物体内研究显示, MK-1775通过抑制Wee1功能抑制了肿瘤的生长. 我们的研究表明, MK-1775抑制胆囊癌干细胞样细胞的自我更新, 可能和其损伤的DNA得不到足够的修复而引起, 但其具体机制需进一步探索.
总之, 本文的实验研究结果证明, MK-1775具有抑制源自GBC-SD细胞系肿瘤干细胞样细胞自我更新能力及其形成的肿瘤生长的作用, 从而彰显了MK-1775 可能作为一种靶向胆囊癌干细胞治疗人胆囊癌候选药物的潜能.
原发性胆囊癌是胆道系统常见的恶性肿瘤, 因其早期诊断困难, 肿瘤进展快, 预后较差. 目前研究表明肿瘤干细胞是肿瘤发生发展、耐药及复发的根本原因, 近来研究表明阻断肿瘤干细胞的自我更新是肿瘤靶向治疗的有效途径之一.
Wee1抑制剂MK-1775在多种肿瘤的研究中具有抑制肿瘤的作用, 而其与肿瘤干细胞的相关性研究则较少有报道. 本研究拟考察MK-1775对胆囊癌干细胞自我更新的影响.
研究Wee1抑制剂MK-1775对GBC-SD细胞系胆囊癌干细胞样细胞自我更新的抑制作用.
通过体外实验检测MK-1775对胆囊癌悬浮肿瘤干细胞球形成的影响, 并进一步建立裸鼠皮下移植瘤模型后MK-17751治疗, 观察对移植瘤生长的影响.
加入MK-1775后, GBC-SD细胞肿瘤干细胞球大小及形成率均受到抑制; 经MK-17751处理后, 裸鼠皮下移植瘤生长受到抑制.
MK-1775具有抑制GBC-SD细胞系胆囊癌干细胞样细胞自我更新的作用.
进一步探索MK-1775对胆囊癌耐药和侵袭的影响, 并进行临床前实验, 有望成为治疗胆囊癌的靶向药物之一.
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Randi G, Malvezzi M, Levi F, Ferlay J, Negri E, Franceschi S, La Vecchia C. Epidemiology of biliary tract cancers: an update. Ann Oncol. 2009;20:146-159. [PubMed] [DOI] |
| 2. | Koshiol J, Bellolio E, Vivallo C, Cook P, Roa JC, McGee EE, Losada H, Van Dyke AL, Van De Wyngard V, Prado R. Distribution of dysplasia and cancer in the gallbladder: an analysis from a high cancer-risk population. Hum Pathol. 2018;. [PubMed] [DOI] |
| 3. | Lin PC, Hsieh HY, Chu PC, Chen CS. Therapeutic Opportunities of Targeting Histone Deacetylase Isoforms to Eradicate Cancer Stem Cells. Int J Mol Sci. 2018;19:1939. [PubMed] [DOI] |
| 4. | Chan MM, Chen R, Fong D. Targeting cancer stem cells with dietary phytochemical - Repositioned drug combinations. Cancer Lett. 2018;433:53-64. [PubMed] [DOI] |
| 5. | Chu J, Li Y, Fan X, Ma J, Li J, Lu G, Zhang Y, Huang Y, Li W, Huang X. MiR-4319 Suppress the Malignancy of Triple-Negative Breast Cancer by Regulating Self-Renewal and Tumorigenesis of Stem Cells. Cell Physiol Biochem. 2018;48:593-604. [PubMed] [DOI] |
| 6. | Pei S, Minhajuddin M, Adane B, Khan N, Stevens BM, Mack SC, Lai S, Rich JN, Inguva A, Shannon KM. AMPK/FIS1-Mediated Mitophagy Is Required for Self-Renewal of Human AML Stem Cells. Cell Stem Cell. 2018;23:86-100.e6. [PubMed] [DOI] |
| 7. | Huang G, Jiang H, Lin Y, Xia W, Luo Y, Wu Y, Cai W, Zhou X, Jiang X. LncGPR107 drives the self-renewal of liver tumor initiating cells and liver tumorigenesis through GPR107-dependent manner. J Exp Clin Cancer Res. 2018;37:121. [PubMed] [DOI] |
| 8. | Wang T, Fahrmann JF, Lee H, Li YJ, Tripathi SC, Yue C, Zhang C, Lifshitz V, Song J, Yuan Y. JAK/STAT3-Regulated Fatty Acid β-Oxidation Is Critical for Breast Cancer Stem Cell Self-Renewal and Chemoresistance. Cell Metab. 2018;27:1357. [PubMed] [DOI] |
| 9. | Chen G, Zhang B, Xu H, Sun Y, Shi Y, Luo Y, Jia H, Wang F. Suppression of Sirt1 sensitizes lung cancer cells to WEE1 inhibitor MK-1775-induced DNA damage and apoptosis. Oncogene. 2017;36:6863-6872. [PubMed] [DOI] |
| 10. | Do K, Wilsker D, Ji J, Zlott J, Freshwater T, Kinders RJ, Collins J, Chen AP, Doroshow JH, Kummar S. Phase I Study of Single-Agent AZD1775 (MK-1775), a Wee1 Kinase Inhibitor, in Patients With Refractory Solid Tumors. J Clin Oncol. 2015;33:3409-3415. [PubMed] [DOI] |
| 11. | Paquet-Fifield S, Koh SL, Cheng L, Beyit LM, Shembrey C, Mølck C, Behrenbruch C, Papin M, Gironella M, Guelfi S. Tight Junction Protein Claudin-2 Promotes Self-Renewal of Human Colorectal Cancer Stem-like Cells. Cancer Res. 2018;78:2925-2938. [PubMed] [DOI] |
| 12. | Hu J, Guo X, Yang L. Morin inhibits proliferation and self-renewal of CD133+ melanoma cells by upregulating miR-216a. J Pharmacol Sci. 2018;136:114-120. [PubMed] [DOI] |
| 13. | Thiagarajan PS, Sinyuk M, Turaga SM, Mulkearns-Hubert EE, Hale JS, Rao V, Demelash A, Saygin C, China A, Alban TJ. Cx26 drives self-renewal in triple-negative breast cancer via interaction with NANOG and focal adhesion kinase. Nat Commun. 2018;9:578. [PubMed] [DOI] |
| 14. | Shi CJ, Gao J, Wang M, Wang X, Tian R, Zhu F, Shen M, Qin RY. CD133(+) gallbladder carcinoma cells exhibit self-renewal ability and tumorigenicity. World J Gastroenterol. 2011;17:2965-2971. [PubMed] [DOI] |
| 16. | Olsen BB, Kreutzer JN, Watanabe N, Holm T, Guerra B. Mapping of the interaction sites between Wee1 kinase and the regulatory beta-subunit of protein kinase CK2. Int J Oncol. 2010;36:1175-1182. [PubMed] |
| 17. | Egeland EV, Flatmark K, Nesland JM, Flørenes VA, Mælandsmo GM, Boye K. Expression and clinical significance of Wee1 in colorectal cancer. Tumour Biol. 2016;37:12133-12140. [PubMed] [DOI] |
| 18. | Music D, Dahlrot RH, Hermansen SK, Hjelmborg J, de Stricker K, Hansen S, Kristensen BW. Expression and prognostic value of the WEE1 kinase in gliomas. J Neurooncol. 2016;127:381-389. [PubMed] [DOI] |
| 19. | PosthumaDeBoer J, Würdinger T, Graat HC, van Beusechem VW, Helder MN, van Royen BJ, Kaspers GJ. WEE1 inhibition sensitizes osteosarcoma to radiotherapy. BMC Cancer. 2011;11:156. [PubMed] [DOI] |
| 20. | Beck H, Nähse-Kumpf V, Larsen MS, O'Hanlon KA, Patzke S, Holmberg C, Mejlvang J, Groth A, Nielsen O, Syljuåsen RG. Cyclin-dependent kinase suppression by WEE1 kinase protects the genome through control of replication initiation and nucleotide consumption. Mol Cell Biol. 2012;32:4226-4236. [PubMed] [DOI] |
| 21. | Creevey L, Ryan J, Harvey H, Bray IM, Meehan M, Khan AR, Stallings RL. MicroRNA-497 increases apoptosis in MYCN amplified neuroblastoma cells by targeting the key cell cycle regulator WEE1. Mol Cancer. 2013;12:23. [PubMed] [DOI] |
| 22. | Slipicevic A, Holth A, Hellesylt E, Tropé CG, Davidson B, Flørenes VA. Wee1 is a novel independent prognostic marker of poor survival in post-chemotherapy ovarian carcinoma effusions. Gynecol Oncol. 2014;135:118-124. [PubMed] [DOI] |
| 23. | Murrow LM, Garimella SV, Jones TL, Caplen NJ, Lipkowitz S. Identification of WEE1 as a potential molecular target in cancer cells by RNAi screening of the human tyrosine kinome. Breast Cancer Res Treat. 2010;122:347-357. [PubMed] [DOI] |
| 24. | Zhang M, Dominguez D, Chen S, Fan J, Qin L, Long A, Li X, Zhang Y, Shi H, Zhang B. WEE1 inhibition by MK1775 as a single-agent therapy inhibits ovarian cancer viability. Oncol Lett. 2017;14:3580-3586. [PubMed] [DOI] |
| 25. | Richer AL, Cala JM, O'Brien K, Carson VM, Inge LJ, Whitsett TG. WEE1 Kinase Inhibitor AZD1775 Has Preclinical Efficacy in LKB1-Deficient Non-Small Cell Lung Cancer. Cancer Res. 2017;77:4663-4672. [PubMed] [DOI] |
| 26. | Laurent E, Mockel J, Van Sande J, Graff I, Dumont JE. Dual activation by thyrotropin of the phospholipase C and cyclic AMP cascades in human thyroid. Mol Cell Endocrinol. 1987;52:273-278. [PubMed] [DOI] |
| 27. | McElhinny AS, Warner CM. Detection of major histocompatibility complex class I antigens on the surface of a single murine blastocyst by immuno-PCR. Biotechniques. 1997;23:660-662. [PubMed] [DOI] |
| 28. | Friedman J, Morisada M, Sun L, Moore EC, Padget M, Hodge JW, Schlom J, Gameiro SR, Allen CT. Inhibition of WEE1 kinase and cell cycle checkpoint activation sensitizes head and neck cancers to natural killer cell therapies. J Immunother Cancer. 2018;6:59. [PubMed] [DOI] |
| 29. | Lewis CW, Jin Z, Macdonald D, Wei W, Qian XJ, Choi WS, He R, Sun X, Chan G. Prolonged mitotic arrest induced by Wee1 inhibition sensitizes breast cancer cells to paclitaxel. Oncotarget. 2017;8:73705-73722. [PubMed] [DOI] |