修回日期: 2018-07-09
接受日期: 2018-07-15
在线出版日期: 2018-08-28
原发性肝癌(hepatocellular carcinoma, HCC)是我国常见的恶性肿瘤, HCC合并门静脉高压症在临床实践中是经常遇到的难题. HCC合并门静脉高压症患者主要死亡原因之一是食管胃底静脉曲张破裂出血. 如何同时处理HCC及门静脉高压依然是肝脏外科医师关注的焦点之一. 本文就HCC合并门静脉高压症的诊治概况进行简要述评.
核心提要: 肝癌(hepatocellular carcinoma, HCC)合并门静脉高压症临床多见, HCC合并门静脉高压症患者主要死亡原因之一是食管胃底静脉曲张破裂出血. 术前需充分评估HCC的可根治切除性, 又要兼顾处理门静脉高压症, 个体化治疗是治疗HCC合并门静脉高压症应遵循的原则.
引文著录: 王卫东. 肝癌合并门静脉高压症的诊治现状. 世界华人消化杂志 2018; 26(24): 1429-1433
Revised: July 9, 2018
Accepted: July 15, 2018
Published online: August 28, 2018
Hepatocellular carcinoma (HCC) is a common malignant tumor in China. HCC complicated with portal hypertension is a common problem in clinical practice. Bleeding from esophagogastric varices is a major cause of death in patients with HCC complicated with portal hypertension. How to treat HCC and portal hypertension simultaneously remains one of the challenges for liver surgeons. This article briefly reviews the current status of treatment of HCC with portal hypertension.
- Citation: Wang WD. Diagnosis and treatment of hepatocellular carcinoma with portal hypertension. Shijie Huaren Xiaohua Zazhi 2018; 26(24): 1429-1433
- URL: https://www.wjgnet.com/1009-3079/full/v26/i24/1429.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i24.1429
原发性肝癌(hepatocellular carcinoma, HCC)是全球第5位常见肿瘤, 死亡率高居第3位[1]. 我国是HCC高发地区, HCC患者数约占全球总数的55%[2], 其中, 85%-95%的HCC患者由肝硬化逐渐演变而来[3]. 在中国HCC患者中, 合并不同程度的门静脉高压症患者占15%-20%[4]. HCC合并门静脉高压症的患者由于病情复杂, 手术风险高, 既往被认为不适合行HCC切除术[5]. 二十世纪以来, 随着医学科技的高速发展, 医疗设备的完善, 手术技巧的进步和围手术期管理的提升, 手术治疗HCC合并门静脉高压症已逐渐开展, 并取得一定的疗效, 但总体生存率仍较低. 如何同时处理HCC及门静脉高压依然是肝脏外科医师关注的焦点之一. 本文就HCC合并门静脉高压症的诊治概况进行简要述评.
我国HCC患者多数有肝炎肝硬化基础, HCC合并肝硬化者高达70%-90%[6], 可见HCC合并门静脉高压症的主要病因之一是肝硬化导致的肝组织弥漫性纤维化, 肝小叶内的肝窦被假小叶和再生结节挤压使其变窄或闭塞, 造成门静脉血流受阻, 压力增高. 除此以外, HCC患者中还有其它原因造成门静脉高压: (1)瘤体内动脉门静脉短路: HCC的血供主要来源于肝动脉, 瘤体内存在着大量动静脉短路, 血流由高压力的肝动脉直接注入门静脉系统, 使门静脉压力显著升高; (2)门静脉癌栓: HCC的生物学行为决定癌组织易于侵犯门静脉, 门静脉癌栓的形成可使肝硬化造成的门静脉压力进一步增高; (3)HCC肿瘤直接压迫门静脉使门静脉回流受阻, 导致门静脉高压; (4)肝叶切除或肝动脉栓塞化疗可造成短暂的门静脉压力升高.
临床上直接测量门静脉压力比较困难, 目前常用肝静脉压力梯度(hepatic venous pressure gradient, HVPG)代表门静脉压力, HVPG是肝静脉楔入压与肝静脉自由压之间的差值. HVPG正常范围是3-5 mmHg≥12 mmHg是形成静脉曲张和(或)出血的阈值. 尽管HVPG是目前公认的诊断门静脉高压症的金标准, 但由于其操作有创、技术要求高等因素, 限制其在临床推广应用. 因此, 临床上仍常用Bayraktar等[7]提出的诊断标准: (1)巨脾(超声下脾脏长轴>13 cm); (2)血小板计数<100×109/L和(或)白细胞计数<4.0×109/L(连续监测3次以上); (3)超声显示门脉宽度>13 mm或脾静脉宽度>10 mm; (4)胃镜下食管静脉曲张; (5)存在腹水或胃镜下胃底静脉曲张. 符合以上两者或以上即可确诊为门静脉高压症.
近年来, 门静脉高压症的无创诊断技术备受关注, 基于血清学标志物、瞬时弹性成像、超声、MRI/CT等指标构建的多个无创诊断模型均有较高的敏感性或特异性. 其中瞬时弹性成像是应用FibroScan对肝硬度进行评估, 其诊断门静脉高压症的敏感性和特异性分别为90%和81%[8]. Iranmanesh等[9]利用CT检查肝脏和脾脏体积比, 结合肝周腹水构建的无创HVPG评分, 诊断临床显著性门静脉高压的受试者工作特征曲线下面积达到0.911. Qi等[10]提出了基于CT血管造影和多普勒超声的虚拟门静脉压力梯度, 该指标与门静脉压力梯度高度一致(r = 0.92). 无创诊断技术在诊断门静脉高压症中初露端倪, 其诊断效能仍需大样本的临床研究进一步验证.
HCC患者早期多数无症状, 起病隐匿, 绝大多数患者在就诊时已属于中晚期. 由于肿瘤巨大、肝内多发转移、脉管广泛癌栓等因素导致肿瘤无法切除. 部分患者同时合并门静脉高压症, 全身状况较差, 肝功能Child B级甚至C级, 多不能耐受外科手术. 针对这部分患者, 主要的治疗手段有肝动脉化疗栓塞术、射频消融、瘤体内无水酒精注射术、氩氦刀冷冻治疗等[11]. 对于肿瘤的姑息治疗尽管可获得短期疗效, 但食管胃底静脉破裂出血仍然是这类患者的主要死亡原因, 因此, 针对食管胃底静脉曲张的正确处理直接影响到患者的预后.
对于无法切除的HCC合并门静脉高压症患者, 尤其是合并重度食管胃底静脉曲张者, 主要治疗手段应以内镜下治疗为主, 如内镜下血管套扎术、内镜下硬化剂注射等, 可延长短期生存时间, 但由于HCC的进展, 长期存活率仍不理想. Cheng等[12]对65例中晚期HCC合并门静脉高压症食管静脉曲张出血行EIS, 另外60例患者行药物保守治疗, 结果显示两组的止血率分别为72.5%和56.7%, 而再出血率分别为26.9%和73.5%, 分别有31例和44例在初次出血后2 mo内死亡, 平均生存期为2.39 mo和1.79 mo. 有学者[13]认为: 采用覆膜支架行经颈静脉肝内门体静脉分流术治疗HCC并门静脉高压症可有效降低门静脉压力, 预防再发出血和减少腹水量.
可切除的HCC合并门静脉高压症患者病情通常复杂多样, 部分患者是以消化道出血就诊, 肝功能处于失代偿期, 术前除了评估肿瘤情况外, 更需充分考虑肝脏储备功能以及门静脉高压症的程度, 治疗方案需兼顾HCC和门静脉高压症两个方面, 以选择合理的手术方式, 做到个体化治疗.
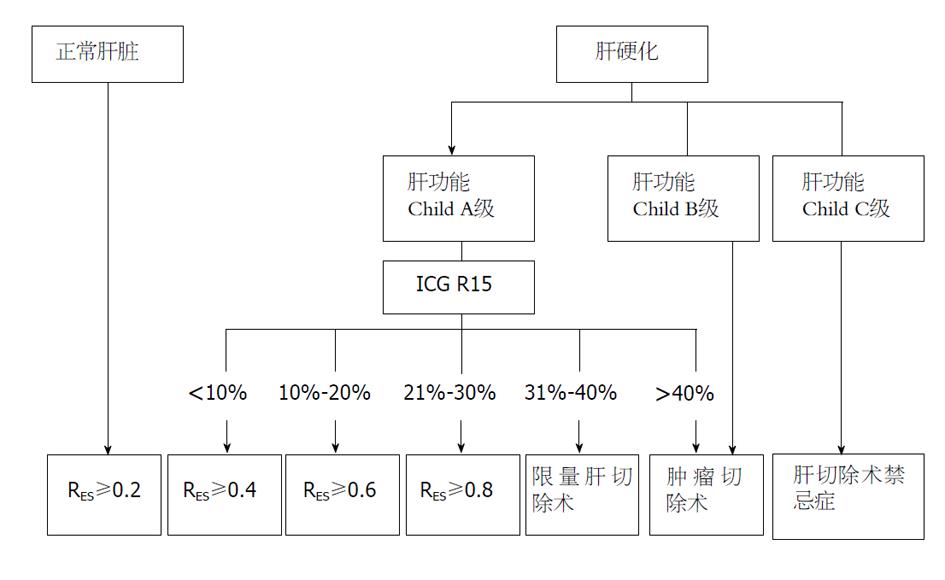
对于可切除HCC合并轻度门静脉高压症未出现严重并发症的患者, 通常优先考虑处理HCC. 由于肝硬化的基础, 尽管肝功能Child A级, HCC切除术应选择不规则性肝切除为宜, 避免半肝甚至以上的大范围切除. 迟天毅等[6]认为手术切除的范围应控制在肝体积的40%以内, 切除范围过大容易导致术后肝功能衰竭和消化道出血等严重并发症的发生. 肝功能Child B级的患者应最大限度保留正常肝组织, 手术应以肿瘤局部切除为主[14]. 近年来, 肝脏储备功能的评估取得一定进展, 除了传统的Child-Pugh分级以外, ICG排泄率和肝体积计算以及三维可视化技术均有一定的优势, 给肝切除范围提供更可靠的依据. 在精准肝切除术专家共识中[15], 认为精准肝切除术的关键环节是判定不同肝病背景的肝脏能耐受的最小剩余功能性肝脏体积. 将Child分级、ICG R15水平、肝实质及脉管病变的影像学检查评估与肝脏体积测算相结合, 采用必需功能性标准化肝体积比(ratio of essential to standard liver volume, RES)来设定肝切除安全限量, 构建出定量化肝切除术决策系统: 正常肝脏RES可为0.2; 合并肝硬化的肝脏, 随Child分级与ICG R15数值上升, RES值次第升高; 肝功能Child C级为肝切除术禁忌证(图1).
腹腔镜肝切除具有创伤小、术后恢复快等优势, 在可切除HCC合并门静脉高压症患者中有一定的优势[16]. 笔者认为, HCC合并门静脉高压症的患者, 多有不同程度的肝硬化, 在腹腔镜肝切除离断肝实质的过程中, 出血一般难以控制, 可应用双极射频 Habib 4X使肝组织凝固坏死以及脉管封闭后再切肝, 采用边凝固边切开的方法, 遇到粗大脉管则用血管夹夹闭后离断, 达到创面渗血减少, 术中出血容易控制, 保障手术安全[17].
对于可切除HCC合并中重度门静脉高压症患者, 如出现食管胃底静脉曲张破裂出血等严重并发症的患者, 笔者认为应先行内镜下止血, 并最大限度调整肝功能后限期行HCC切除术, 如病人术前和术中情况良好, 可考虑同期行断流术.
对于肿瘤直径<2 cm、位置深在的HCC合并门静脉高压症患者, 采用射频消融术治疗HCC可以取得与肝切除相当的疗效, 并且对肝功能及门静脉压力影响较小[18]. 笔者团队曾探讨腹腔镜下冷循环射频消融联合贲门周围血管离断治疗小HCC合并严重门静脉高压症的安全性及可行性, 认为该术式对肝功能损伤小, 手术微创, 术式相对简单, 是一种安全、有效的术式[19].
对于门静脉高压症, 手术目的主要是防止食管胃底静脉曲张破裂出血和改善脾功能亢进. 中华医学会外科学分会肝脏外科学组在2016年针对HCC的治疗方法的选择达成专家共识[20], 其中指出: 对于可切除的HCC合并门静脉高压症患者: (1)有明显脾肿大、脾功能亢进(WBC<3×109/L, 血小板<50×109/L)表现者, 可同时行脾切除术; (2)有明显食管胃底静脉曲张, 特别是发生过食管胃底曲张静脉破裂大出血者, 可考虑同时行贲门周围血管离断术; (3)有严重胃黏膜病变者, 如病人术中情况允许, 应做脾肾分流术或其他类型的选择性门腔分流术.
笔者认为, 腹腔镜下选择性贲门周围血管离断术治疗门静脉高压症具有一定优势[21]. 该术式是在传统贲门周围血管离断术的基础上, 充分利用腹腔镜的放大作用和角度可调, 术中保留胃冠状静脉近端以及食管旁静脉的完整性, 逐一离断胃冠状静脉远端进入胃底以及食管旁静脉进入食管下段的穿支血管. 既离断了造成出血的穿支血管, 同时又保留了人体自身代偿性的合理分流, 适当降低门静脉血流量, 保证合理肝血流灌注, 缓解胃壁的充血状态和预防门奇静脉间的侧支循环的重建, 从而降低再出血率[22]. 笔者结合腹腔镜Habib 4X肝切除的经验, 在10例可切除HCC合并门静脉高压症患者中, 施行腹腔镜Habib 4X HCC切除联合脾切除加选择性贲门周围血管离断术, 所有手术均取得成功, 未中转开腹, 术中出血量平均450 mL, 手术时间平均6.5 h, 无围手术期死亡. 随访2年均未出现上消化道出血, 1例患者出现HCC复发.
对于符合肝移植标准的患者, 施行肝移植无疑是目前最佳治疗方法, 可同时解决HCC和门静脉高压症并且疗效确切. 但由于肝源匮乏, 费用昂贵, 以及等待供体的漫长过程中病情进一步加重, 使肝移植未能广泛应用于临床.
HCC合并门静脉高压症的患者通常肝硬化处于失代偿期, 手术风险极高, 是否同期手术治疗仍存在争议. 传统的开腹手术创伤大、并发症多, 术后发生肝衰竭的风险较大. 既往学者认为[23], 由于HCC合并门静脉高压症患者病情复杂、手术难度大、术后并发症及死亡率高, 门静脉高压症被认为是HCC切除术的相对禁忌证. 近年来, 随着肝脏外科的发展, 术前肝功能的评估日益完善, 以腹腔镜为主的微创技术已趋于成熟, 给HCC合并门静脉高压症的患者带来转机. 有研究[24]指出, Child A级或B级的HCC合并门静脉高压症患者, 行肝切除术的预后跟不合并门静脉高压症的HCC患者相对比无统计学差异, 认为HCC合并门静脉高压症行肝切除术是安全可行的.
相关研究[25]认为: HCC合并肝硬化脾功能亢进的患者施行肝脾联合切除术, 术后不仅促进机体T细胞亚群和Th细胞恢复平衡, 并且使白细胞和血小板计数恢复正常, 同时可以减轻肝脏代谢胆红素的负担, 有利于肝功能的恢复, 一定程度上延缓肝硬化进程, 而且不增加术后并发症发生率. 笔者认为对于可切除的HCC, 合并脾大伴脾功能亢进, 有明显食管胃底静脉曲张, 特别是发生过食管胃底曲张静脉破裂出血者, 如肝脏储备功能良好的患者, 可考虑同期行HCC切除联合脾切除加贲门周围血管离断术. 对于腹腔镜技术经验丰富的肝脏外科医师, 优先选择腹腔镜手术.
HCC合并门静脉高压症施行肝脾联合切除的手术顺序没有统一说法, 王高雄等[26]主张首先结扎脾动脉, 然后处理肝脏肿瘤, 再切除脾脏, 最后行断流术. 而李湘竑等[27]则认为应先切脾后切肝为宜, 主要因为切除脾脏后可改善凝血机制, 而且有利于暴露肝脏肿瘤, 使切肝时渗血减少. 笔者认为应根据具体情况决定手术顺序, 如脾亢严重脾脏明显肿大的患者, 应先结扎脾动脉, 接着切除脾脏, 然后处理肝脏肿瘤, 最后行门奇断流术, 主要原因是结扎脾动脉能缩小脾脏体积, 减少切脾的出血量, 切除脾脏后可以减轻门静脉压力, 使得切肝过程出血容易控制. 由于HCC合并门静脉高压症病情复杂多样, 手术顺序需兼顾局部和全身情况, 值得进一步探讨研究.
HCC合并门静脉高压症在临床多见, 病情相对复杂, 手术风险高, 术前应充分评估HCC的可根治切除性, 又要兼顾处理门静脉高压症. 个体化治疗是治疗HCC合并门静脉高压症应遵循的原则, 根据不同的病例制定不同的治疗方案, 选择最佳的治疗方法改善患者预后. 目前大多数研究报道为小样本和回顾性研究, 缺乏前瞻性的随机对照研究, 今后需采用循证医学的方法, 通过大样本的临床研究来进一步提高HCC合并门静脉高压症的诊治水平.
学科分类: 胃肠病学和肝病学
手稿来源地: 广东省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): E
编辑: 崔丽君 电编:张砚梁
| 1. | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68:7-30. [PubMed] [DOI] |
| 2. | Asia-Pacific Working Party on Prevention of Hepatocellular Carcinoma. Prevention of hepatocellular carcinoma in the Asia-Pacific region: consensus statements. J Gastroenterol Hepatol. 2010;25:657-663. [PubMed] [DOI] |
| 3. | Llovet JM, Bruix J. Novel advancements in the management of hepatocellular carcinoma in 2008. J Hepatol. 2008;48 Suppl 1:S20-S37. [PubMed] [DOI] |
| 4. | Bruix J, Sherman M, Llovet JM, Beaugrand M, Lencioni R, Burroughs AK, Christensen E, Pagliaro L, Colombo M, Rodés J; EASL Panel of Experts on HCC. Clinical management of hepatocellular carcinoma. Conclusions of the Barcelona-2000 EASL conference. European Association for the Study of the Liver. J Hepatol. 2001;35:421-430. [PubMed] |
| 5. | Bruix J, Castells A, Bosch J, Feu F, Fuster J, Garcia-Pagan JC, Visa J, Bru C, Rodés J. Surgical resection of hepatocellular carcinoma in cirrhotic patients: prognostic value of preoperative portal pressure. Gastroenterology. 1996;111:1018-1022. [PubMed] |
| 7. | Llop E, Berzigotti A, Reig M, Erice E, Reverter E, Seijo S, Abraldes JG, Bruix J, Bosch J, García-Pagan JC. Assessment of portal hypertension by transient elastography in patients with compensated cirrhosis and potentially resectable liver tumors. J Hepatol. 2012;56:103-108. [PubMed] [DOI] |
| 8. | Carrión JA, Navasa M, Bosch J, Bruguera M, Gilabert R, Forns X. Transient elastography for diagnosis of advanced fibrosis and portal hypertension in patients with hepatitis C recurrence after liver transplantation. Liver Transpl. 2006;12:1791-1798. [PubMed] [DOI] |
| 9. | Iranmanesh P, Vazquez O, Terraz S, Majno P, Spahr L, Poncet A, Morel P, Mentha G, Toso C. Accurate computed tomography-based portal pressure assessment in patients with hepatocellular carcinoma. J Hepatol. 2014;60:969-974. [PubMed] [DOI] |
| 10. | Qi X, Li Z, Huang J, Zhu Y, Liu H, Zhou F, Liu C, Xiao C, Dong J, Zhao Y. Virtual portal pressure gradient from anatomic CT angiography. Gut. 2015;64:1004-1005. [PubMed] [DOI] |
| 12. | Cheng CY, Chen GH, Chang CS, Tseng CC, Pan HK, Huang CK, Hsieh PF. Sclerotherapy for esophageal variceal bleeding in advanced hepatocellular carcinoma: an 8-year experience in Taiwan. J Gastroenterol. 1994;29:474-478. [PubMed] |
| 14. | Duan YF, Li XD, Sun DL, Chen XM, An Y, Zhu F. A preliminary study on surgery for hepatocellular carcinoma patients with portal hypertension. Am J Surg. 2015;210:129-133. [PubMed] [DOI] |
| 16. | Harada N, Maeda T, Yoshizumi T, Ikeda T, Kayashima H, Ikegami T, Harimoto N, Takaki S, Maehara Y. Laparoscopic Liver Resection Is a Feasible Treatment for Patients with Hepatocellular Carcinoma and Portal Hypertension. Anticancer Res. 2016;36:3489-3497. [PubMed] |
| 17. | 王 卫东, 陈 小伍, 林 杰, 梁 智强, 吴 志强, 冯 剑平, 刘 清波, 何 威, 陈 坚平. 双极射频Habib 4X在完全腹腔镜肝切除术中的应用. 中国微创外科杂志. 2013;14:32-35. [DOI] |
| 18. | Hernandez-Gea V, Turon F, Berzigotti A, Villanueva A. Management of small hepatocellular carcinoma in cirrhosis: focus on portal hypertension. World J Gastroenterol. 2013;19:1193-1199. [PubMed] [DOI] |
| 19. | 王 卫东, 林 杰, 刘 清波. 腹腔镜下冷循环射频消融联合贲门周围血管离断治疗小肝癌合并门脉高压症的临床报道. 消化肿瘤杂志:电子版. 2015;7:200-203. [DOI] |
| 21. | 王 卫东, 陈 小伍, 吴 志强, 梁 智强, 冯 剑平, 刘 清波, 何 威, 陈 坚平, 林 杰. 腹腔镜经胃前、后双入路选择性贲门周围血管离断术. 中华普通外科杂志. 2013;28:889-890. [DOI] |
| 23. | Forner A, Bruix J. East meets the West--portal pressure predicts outcome of surgical resection for hepatocellular carcinoma. Nat Clin Pract Gastroenterol Hepatol. 2009;6:14-15. [PubMed] [DOI] |
| 24. | Jang CW, Kwon HJ, Kong H, Ha H, Han YS, Chun JM, Kim SG, Hwang YJ. Impact of clinically significant portal hypertension on surgical outcomes for hepatocellular carcinoma in patients with compensated liver cirrhosis: a propensity score matching analysis. Ann Hepatobiliary Pancreat Surg. 2016;20:159-166. [PubMed] [DOI] |