修回日期: 2018-06-13
接受日期: 2018-07-08
在线出版日期: 2018-08-18
自噬是细胞依赖溶酶体的一种代谢过程, 通过分解细胞内蛋白质、脂质等成分, 循环再利用分解产物, 使细胞适应不利的生活环境, 是机体维持内环境稳态的重要机制. 肝纤维化是指肝组织内细胞外基质成分过度增生与异常沉积, 导致肝脏结构和功能异常的病理变化, 肝纤维化见于多数不同病因的慢性肝脏疾病中. 本文总结了自噬参与肝纤维化的作用以及与肝纤维化相关的自噬信号通路, 进一步阐述细胞自噬参与肝纤维化的机制.
核心提要: 本文根据自噬在肝纤维化的作用以及现有的关于自噬参与肝纤维化信号通路加以分析, 同时讨论了其他与自噬相关信号通路和自噬泡形成的机制, 还分析了间充质干细胞通过自噬参与肝纤维化进程的可行性.
引文著录: 王鑫焱, 刘文兰. 自噬参与肝纤维化的机制. 世界华人消化杂志 2018; 26(23): 1415-1422
Revised: June 13, 2018
Accepted: July 8, 2018
Published online: August 18, 2018
Autophagy is an evolutionarily conserved lysosome-dependent catabolic process which degrades cell components, including proteins and lipids, in order to recycle substrates to exert optimally and adapt to tough circumstances. It is an important mechanism for the body to maintain the homeostasis of the internal environment. Liver fibrosis refers to the excessive proliferation and abnormal deposition of extracellular matrix components in the liver tissue, resulting in pathological changes in liver structure and function abnormalities, which is seen in chronic liver diseases of many different causes. In this article, we summarizes the role of autophagy in hepatic fibrosis as well as the relevant signaling pathways to reveal the mechanism of autophagy in hepatic fibrosis.
- Citation: Wang XY, Liu WL. Mechanism of autophagy in liver fibrosis. Shijie Huaren Xiaohua Zazhi 2018; 26(23): 1415-1422
- URL: https://www.wjgnet.com/1009-3079/full/v26/i23/1415.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i23.1415
自从1962年Ashford和Porter[1]发现自噬现象以来, 关于自噬的特征和功能的研究越来越受到人们关注. 2016年的诺贝尔医学或生理学奖授予了日本学者大隅良典, 奖励他发现细胞自噬的机制, 这更激发了人们对于自噬探究的热情. 自噬是指细胞内细胞器和蛋白质等在溶酶体被降解及其降解产物被重新利用的过程. 根据底物转运到溶酶体的不同方式, 自噬分为三类: 微自噬、巨自噬和分子伴侣介导的自噬, 通常自噬指的是巨自噬, 本文中提到的也是巨自噬. 更重要的是, 自噬过程在许多疾病的病理过程中发挥重要作用, 包括癌症[2]、感染[3]、神经退行性病变[4]、老化[5]和心血管疾病[6]以及肝纤维化等.
肝纤维化是指肝组织内细胞外基质(extracellular matrix, ECM)成分过度增生与异常沉积, 导致肝脏结构和功能异常的病理变化[7]. 肝纤维化见于多数不同病因的慢性肝脏疾病中如慢性乙型肝炎(简称慢乙肝)、酒精性肝炎、脂肪肝等.如果不积极治疗, 肝纤维化可进一步发展形成肝硬化, 严重影响患者健康和生命[8].
因为自噬是一种调节细胞内环境稳态的重要途径, 所以调节自噬水平可以作为治疗肝纤维化的重要途径.
1962年, Ashford 和Porter发现细胞内有"自己吃自己"的现象[1], 随之提出自噬的概念, 但是很长时间以来没有确切的机制解释[9], 直到20世纪80年代日本科学家大隅良典通过酵母细胞研究得出自噬的部分机理.
细胞自噬依据底物进入溶酶体的方式, 分为三种形式: 微自噬(microautophagy)、巨自噬(macro-autophagy)和分子伴侣介导的自噬(chaperone-mediated autophagy, CMA).
1.1.1 微自噬: 指直接将细胞质的物质吞入溶酶体进行降解的过程[10].
1.1.2 巨自噬: 细胞内异常的蛋白质和受损的细胞器被细胞内双层膜结构(通常指从粗面内质网的无核糖体附着区脱落的双层膜)包裹形成自噬泡, 之后自噬泡与溶酶体融合, 形成自噬溶酶体, 降解其所包裹的内容物, 以实现细胞本身的代谢需要和某些细胞器的更新[11].
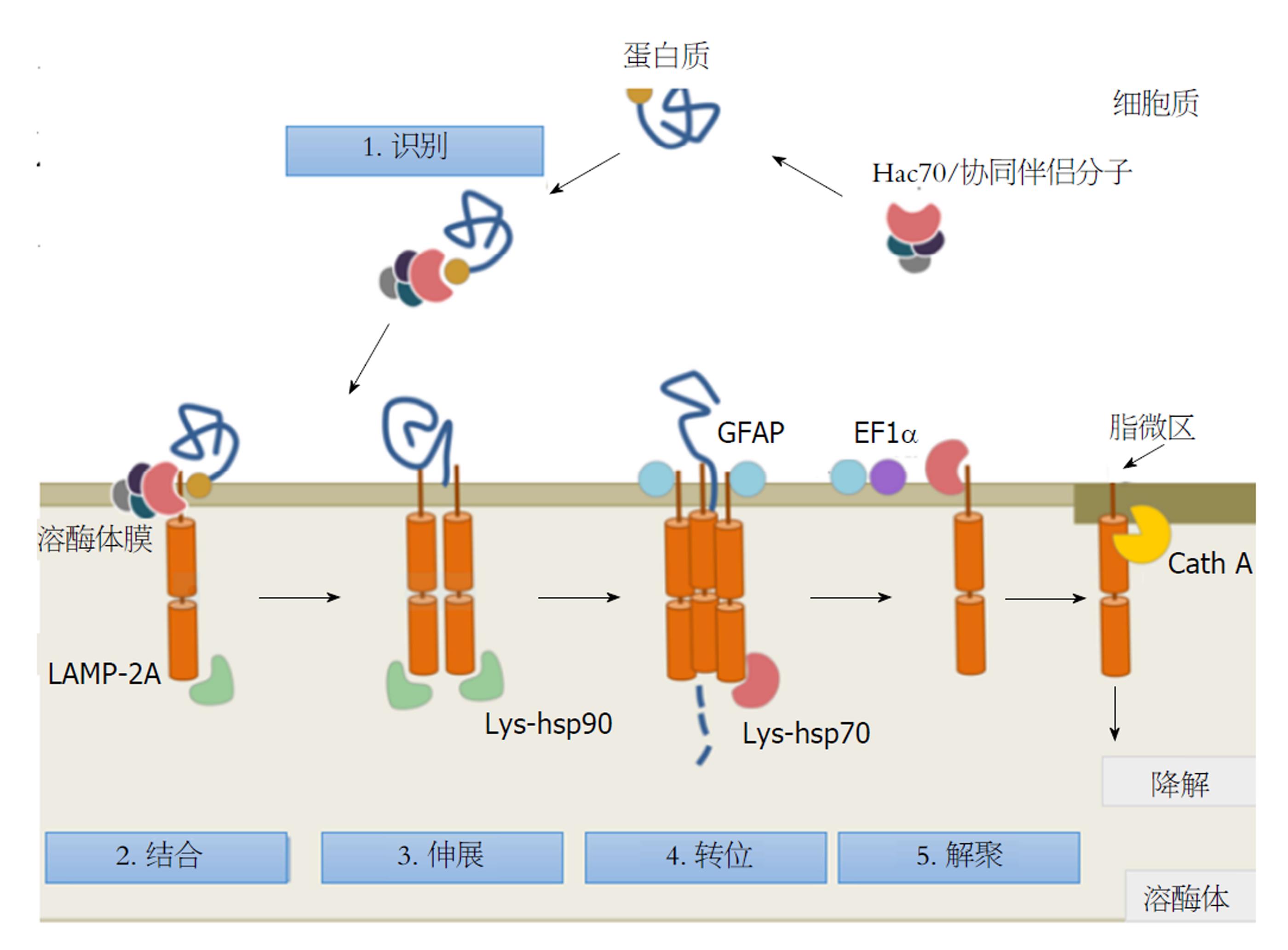
1.1.3 分子伴侣介导的自噬: 指经分子伴侣选择的胞质蛋白靶向运送至溶酶体, 之后在溶酶体膜转位到溶酶体内被降解. 这种细胞自噬的独特之处在于蛋白被分子伴侣选择后降解, 并且不需要其他额外的运输泡, 直接到达溶酶体膜上, 转位到膜内后消化[12](图1).
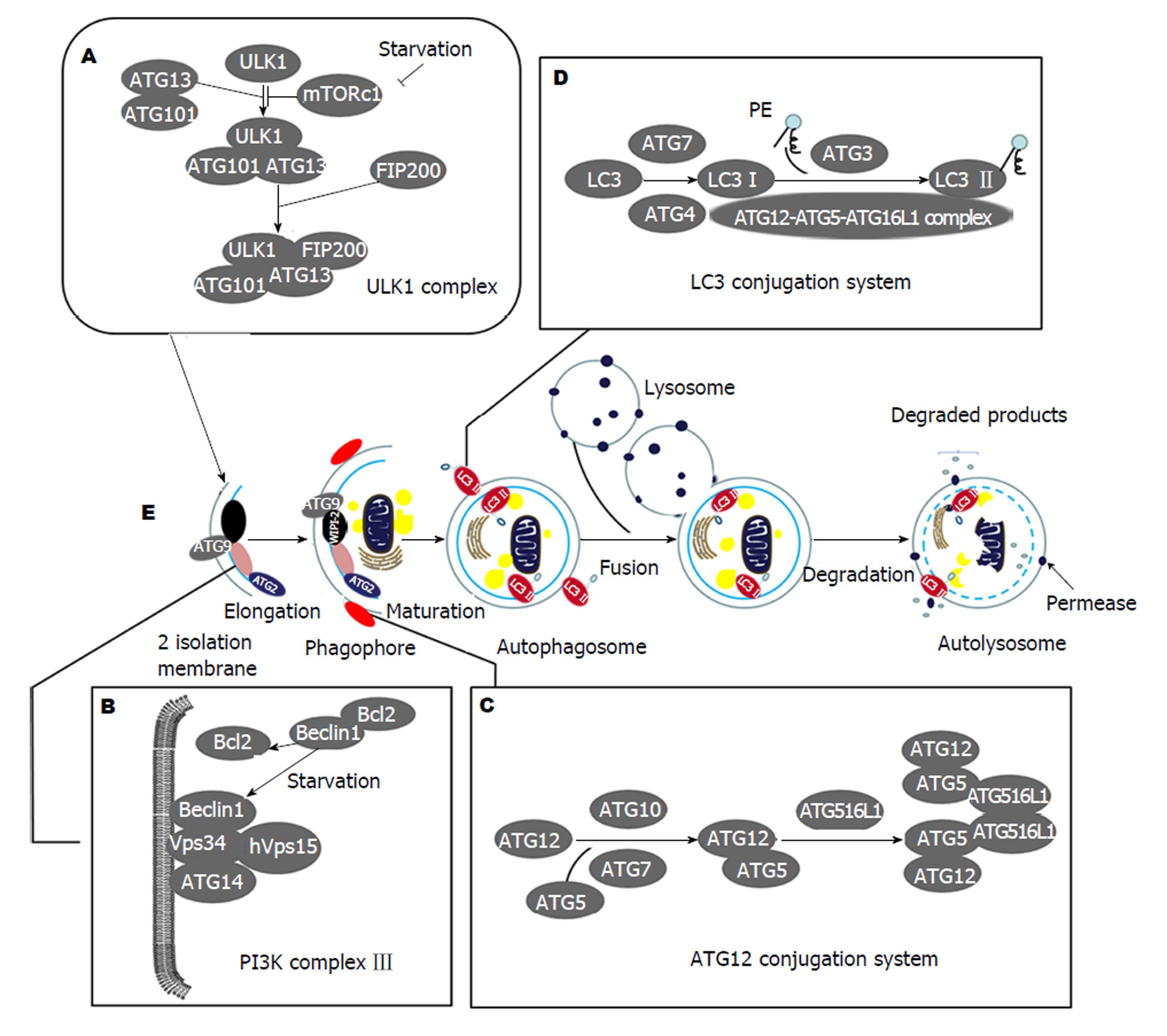
当细胞受到外界条件刺激时, 细胞会启动自噬. 但是自噬的判断一直是一个基础研究的难点, 除了通过电镜观察细胞形态之外, 还可以通过测量自噬泡形成过程中相关成分的变化. 众多的分子中, 参与自噬泡形成的分子至关重要. 近年来随着人们对自噬研究的深入, 自噬泡的形成过程逐渐明晰, 主要涉及四个蛋白质复合体[13](图2), (1)ULK1复合体: 位于自噬泡外膜, 是启动自噬泡形成的第一步. 当ULK与ATG(autophagy essential genes)13、ATG101以及FIP200结合后, 形成四聚体, 启动自噬泡的形成(图2A); (2)P13K复合体Ⅲ: 位于自噬泡内膜, 负责招募ATG蛋白到自噬泡膜, 为自噬泡膜延伸做准备. 但是, Bcl-2和Beclin-1会抑制此过程(图2B); (3)ATG12结合体系: 在ATG10和ATG7催化作用下, ATG10与ATG5结合形成ATG10-ATG5复合体, ATG16起黏合剂作用, 将众多ATG10-ATG5复合体连接在一起, 形成自噬泡上的多聚物, 自噬泡膜不断延伸、扩展(图2C); (4)LC3结合体系: 在ATG7和ATG4作用下, LC3转变为LC3Ⅰ, 在ATG3和ATG10-ATG5-ATG16复合体的作用下, LC3Ⅰ与磷脂酰乙醇胺(phosphatidy lethano-lamine, PE)结合形成LC3Ⅱ附着在自噬泡膜上, 自噬泡成熟. 内外膜上均有LC3Ⅱ存在, 但是当自噬泡与溶酶体结合后, LC3Ⅱ全部转移到自噬泡内膜, 进行内容物的降解(图2D).
自噬作为一把双刃剑, 既可以促进肝纤维化的形成(如通过促进肝星状细胞、各种组织来源的纤维细胞自噬以及自噬相关的上皮间质转化), 又可以抑制肝纤维化进展(促进肝细胞自噬降解相关异常蛋白质、降低TGF-β表达抑制肝星状细胞活化).
静息状态下的肝星状细胞的细胞质中充满脂滴, 脂滴中包含视黄醇、甘油三酯, 占据总脂质成分的70%[14-16]. 在肝星状细胞活化的期间, 脂滴体积减少[17], 当富含脂滴的肝星状细胞活化转变为成肌纤维细胞时, 自噬流量增加. 当抑制其自噬时, 脂滴中甘油三酯含量增加[18], 肝星状细胞活化被抑制. 用自噬抑制剂3MA处理肝星状细胞[19], 或剔除肝星状细胞自噬相关基因Atg5时, 脂滴的数量和体积明显增加. 另外, 在抑制自噬后, 脂肪酸β氧化水平有所降低, 表明脂肪酸合成减弱. 基于这些证据, 推测自噬可能为肝星状细胞活化供能.
除肝星状细胞参与肝纤维化过程外, 其他细胞也参与到肝纤维化的过程中, 包括门管区成纤维细胞、循环系统中的纤维细胞、骨髓来源的纤维细胞以及通过上皮间质转化(epithelial-mesenchymal transition, EMT)参与肝纤维化的肝细胞.
有研究发现, DEDD, 一种新型的肿瘤抑制剂, 通过活化自噬, 促进Snail和Twist的降解(两种在人乳腺癌中调控上皮间质转化的调节剂)[20,21]. 还有研究表明, 饥饿处理HepG2和BEL7402细胞后, 不仅肝癌细胞侵犯能力加强、EMT标记物表达增加, 而且通过TGFβ/Smad3信号途径促进HepG2和BEL7402细胞自噬. 用自噬抑制剂处理, 可以减弱EMT标记物的表达含量[21,22]. 总之, 抑制HepG2和BEL7402细胞的自噬可以减少EMT. 这些证据提示, 自噬可能通过参与肝细胞的上皮间质转化过程参与肝纤维化.
除了肝星状细胞活化之外, 慢性肝细胞损伤也是纤维发生的关键步骤. 已经证明自噬参与多种由异常蛋白聚集导致的肝脏疾病, 例如酒精/非酒精脂肪肝和α-抗胰蛋白酶(alphal-antitrypsin, AT)缺乏性肝疾病. AT缺乏是由于AT基因变异使得翻译出的AT不能正确折叠, 在内质网聚集, 从而诱发内质网应激、肝细胞死亡和肝损伤. 降解异常AT的途径有蛋白酶体和自噬两种途径, 但是前者降解可溶性AT, 后者降解聚合状态下的AT. 因此, 内质网中聚集的AT只能通过自噬途径降解, 减少肝细胞凋亡和肝损伤[23].
有研究首次证明用扁桃体来源的间充质干细胞处理肝纤维化模型小鼠, 间充质干细胞通过促进肝细胞自噬, 减少肝细胞TGF-β表达, 抑制肝星状细胞活化, 最终减弱了CCl4诱导的肝纤维化[24].
TGF-β1/Smads通路参与ECM合成调节的同时, 也参与自噬的调节[25,26].
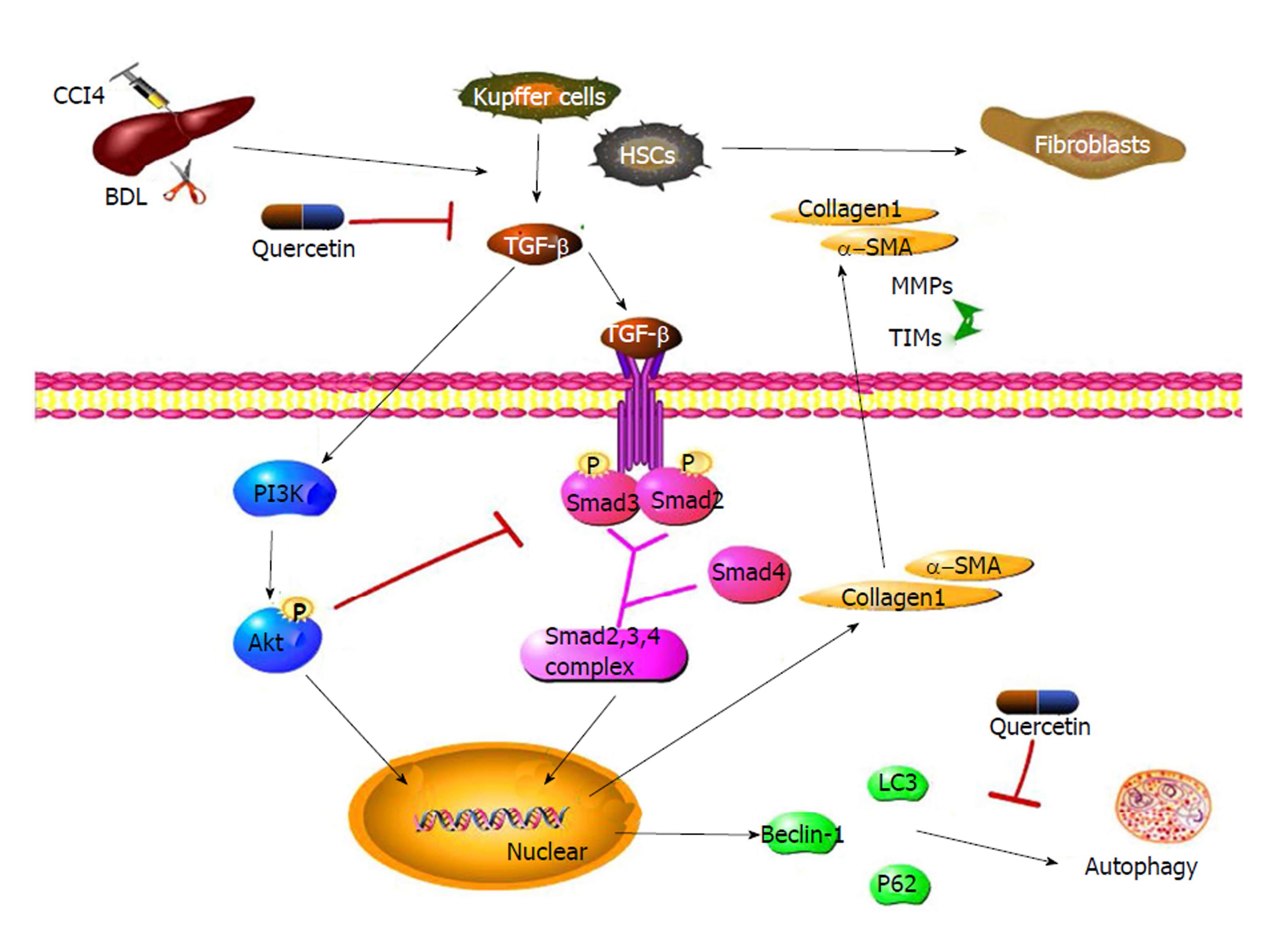
TGF-β1是一种介导纤维化的中间物质, 可以促进肝星状细胞活化、调节细胞生长分化、促进细胞外基质(extracellular matrix, ECM)合成[27,28]. TGF-β1/Smads通路传导如下: (1)TGF-β1肝细胞膜上的TGF-βⅡ型受体 (TβRⅡ)结合, 引发TGF-β1型受体(TβRⅠ)磷酸化; (2)随之Ⅰ型受体磷酸化激活Smad2或Smad3; (3)磷酸化的Smad2和Smad3与Smad4形成三聚体[29,30], 进入细胞核调节目的基因表达. 这些目的基因不仅包括参与肝纤维化形成的基因, 如Ⅰ型胶原蛋白α-SMA, 金属蛋白酶组织抑制剂(matrix metalloproteinases, TIMPs), 金属蛋白酶(matrix metalloproteinases, MMPs), 还包括自噬相关基因Beclin-1[31,32]. 当活化的肝星状细胞分泌TGF-β1后, 经TGF-β1/Smads通路传导促进I型胶原蛋白、α-SMA和TIMP1表达, 抑制MMP2表达, 使TIMP1/MMP2比值升高, 导致ECM大量生成和肝纤维化.
Liu等[7]人证明紫草素通过降低肝纤维化小鼠中TGFb1基因的表达水平和Smad2/3磷酸化水平抑制TGF-β1/Smads通路信号传导, 降低ECM相关基因和Beclin-1基因表达, 减少细胞外基质合成和细胞自噬, 最终缓解肝纤维化.
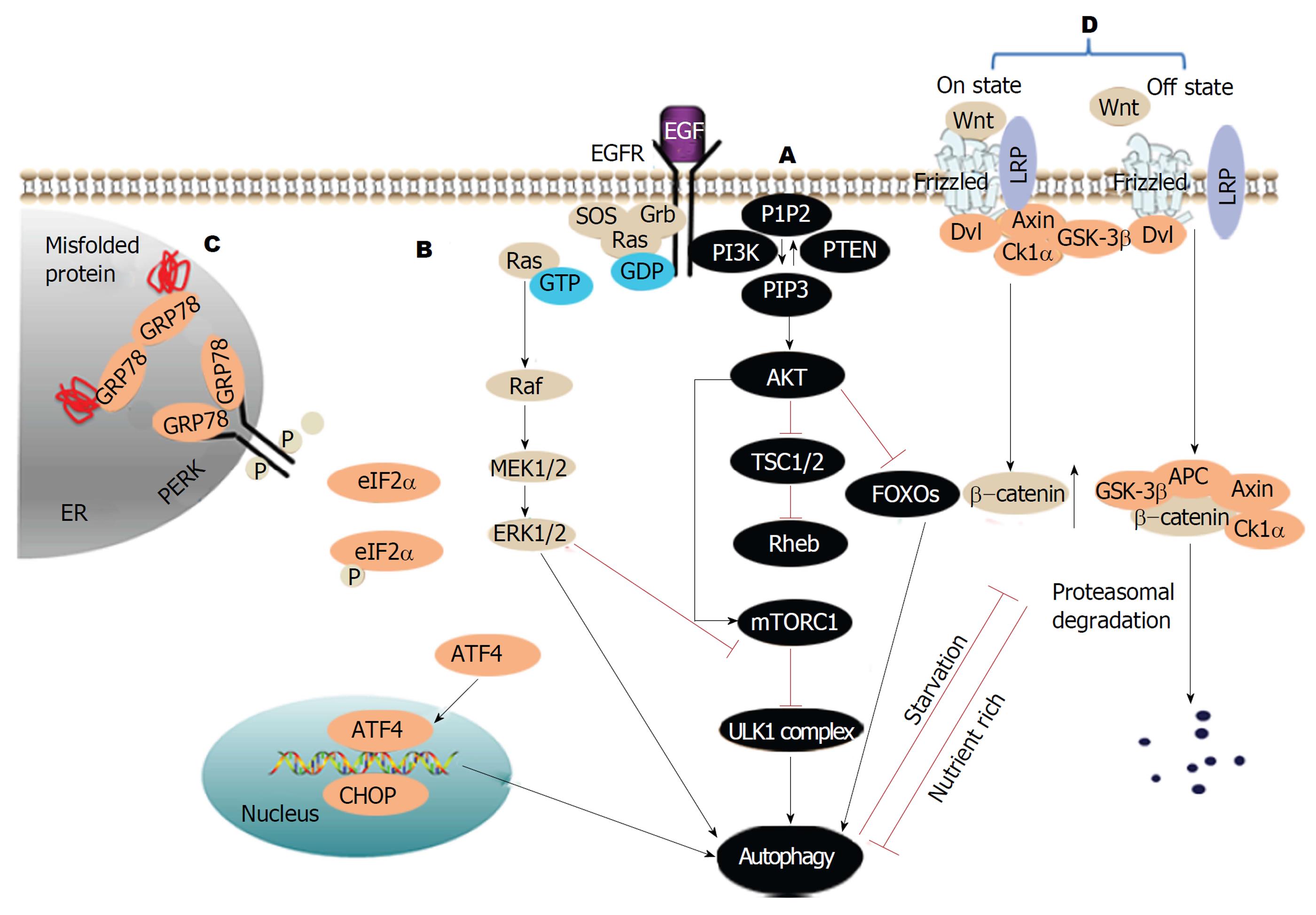
PI3K/AKT/mTOR信号通路, 是调节细胞生长、存活、代谢和凋亡的经典信号通路(图4A). 此通路在多种实体瘤的疾病发展和存活率发挥重要作用, 如肝癌[33]. 多种生长因子可以激活此通路[34-40]. 例如表皮生长因子受体(epidermal growth factor receptor, EGFR)结合表皮生长因子(epidermal growth factor, EGF)后激活PI3K(phosphatidylinositide 3-kinases), 活化的PI3K催化PIP2(phosphatidylinositol biphosphate)经磷酸化转变为PIP3[phosphatidylinositol(3,4,5)-trisphosphate], 并活化AKT丝氨酸苏氨酸激酶(protein kinase B), 磷酸化的AKT随之活化mTORC1, mTORC1抑制ULK1复合体的形成,最终抑制自噬. 同时, 活化的AKT灭活TSC1/TSC2从而活化Rheb. Rheb再活化mTORC1, 抑制自噬. AKT除了直接或间接的激活mTORC1来抑制细胞自噬, 也可以直接调节转录因子FOXOS的活性来抑制自噬.
值得一提的是, 在PI3K/AKT/mTOR信号通路激活的初始阶段, 即PI3K催化PIP2磷酸化转变为PIP3的过程中, 存在一种负性调节物质PTEN(phosphatidylineositol-3,4,5-trispho-sphate3-phosphatase)催化此过程的逆过程. PTEN是一种磷酸酶, 对磷酸化的PIP3有很强的磷酸酶活性, 可以将PIP3去磷酸化转变为PIP2, 进而抑制AKT的活化, 阻断PI3K/AKT/mTOR信号通路的传导, 最终减弱此通路对自噬的抑制作用. 此外, PTEN还具有降低PIP3表达、启动自噬体的形成的功能[41], 进一步促进细胞自噬.
虽然, 目前的没有关于自噬通过PI3K/AKT/mTOR单一信号通路调节细胞自噬参与肝纤维化的研究, 但是Wu等[42]人在研究中指出, 槲皮素(一种黄酮类植物色素, 具有抗炎症、抗肿瘤和抗氧化的作用)通过同时抑制TGFβ/Smad通路和促进PI3K/AKT通路, 抑制肝星状细胞活化, 进而防止肝纤维化的发生(图3). TGFβ作为细胞外信号分子可以通过PI3K/AKT和TGFβ/Smad两种通路调节细胞自噬. 其中TGFβ活化PI3K, 激活PI3K/AKT通路, 抑制细胞自噬, 起负性调节作用; TGFβ活化TGFβ/Smad通路, 促进细胞自噬, 起正性调节作用. 两个通路对于自噬的作用效果相反, 相互作用, 相互制约, 对细胞自噬进行协同调节. 但是两个通路并不是孤立存在的, 二者之间存在广泛交流: AKT阻止Smad复合体形成从而阻止TGFβ/Smad信号传导; 磷酸化的Smad3含量增加抑制AKT和PI3K的活性. 经过药物处理后, 减少了TGFβ的分泌, 同时TGFβ/Smad被抑制, PI3K/AKT通路活性增强, 细胞自噬减弱.
间充质干细胞一种具有自我增殖和多向分化潜能的多功能干细胞, 因为具有自我增殖和多向分化的潜能、来源丰富、低免疫原性、趋化性和归巢的能力、免疫调节和组织修复的功能的特点[51], 在基础研究中用于多种疾病的治疗, 其中包括针对肝纤维化的治疗[52], 而且研究广泛. 既涉及不同组织来源的间充质干细胞[53,54], 也饱含不同类型间充质干细胞的外泌体[55,56]对于肝纤维化的作用, 但是鲜有研究涉及间充质干细胞通过自噬途径参与肝纤维化的进程. 已经有实验证实间充质干细胞的外泌体通过抑制mTOR的磷酸化, 促进肾小管上皮细胞自噬, 抑制炎症反应, 减少细胞凋亡, 从而减弱顺铂肾毒性, 修复急性肾损伤[57]. 除此之外, 间充质干细胞也通过自噬途径参与阿尔兹海默症[58]、脊髓缺血/再灌注损伤[59]、心肌缺血/再灌注损伤[60]. 由此可见, 间充质干细胞通过自噬参与肝纤维化进程是可行的, 可以作为一个新的研究方向.
综上所述, 自噬在肝纤维化中的作用及内在机制研究近几年已取得一些的进展, 调节自噬的相关研究与已经为治疗肝纤维化提供了一些新思路. 但是, 目前对于自噬参与肝纤维化进程的具体机制还不完全清楚. 肝纤维化作为肝病发展的共同通路和关键时期, 逆转肝纤维化是至关重要的. 目前临床上治疗晚期肝病患者以肝移植为主, 如果通过具体的通路调节细胞自噬, 减少肝星状细胞活化增强对肝细胞的保护和再生, 就可以减缓病程甚至逆转肝纤维化, 既可以减少病人手术移植的痛苦, 又可以缓解临床移植器官捐献短缺的现状.
学科分类: 胃肠病学和肝病学
手稿来源地: 北京市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D, D
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Ashford TP, Porter KR. Cytoplasmic components in hepatic cell lysosomes. J Cell Biol. 1962;12:198-202. [PubMed] |
| 2. | Niture S, Ramalinga M, Kedir H, Patacsil D, Niture SS, Li J, Mani H, Suy S, Collins S, Kumar D. TNFAIP8 promotes prostate cancer cell survival by inducing autophagy. Oncotarget. 2018;9:26884-26899. [PubMed] [DOI] |
| 3. | Gong L, Devenish RJ, Prescott M. Autophagy as a macrophage response to bacterial infection. IUBMB Life. 2012;64:740-747. [PubMed] [DOI] |
| 4. | Hara T, Nakamura K, Matsui M, Yamamoto A, Nakahara Y, Suzuki-Migishima R, Yokoyama M, Mishima K, Saito I, Okano H. Suppression of basal autophagy in neural cells causes neurodegenerative disease in mice. Nature. 2006;441:885-889. [PubMed] [DOI] |
| 5. | Yamaguchi O, Otsu K. Role of autophagy in aging. J Cardiovasc Pharmacol. 2012;60:242-247. [PubMed] [DOI] |
| 6. | Hamacher-Brady A, Brady NR, Gottlieb RA. Enhancing macroautophagy protects against ischemia/reperfusion injury in cardiac myocytes. J Biol Chem. 2006;281:29776-29787. [PubMed] [DOI] |
| 7. | Liu T, Xu L, Wang C, Chen K, Xia Y, Li J, Li S, Wu L, Feng J, Xu S. Shikonin alleviates hepatic fibrosis and autophagy via inhibition of TGF-β1/Smads pathway. J Gastroenterol Hepatol. 2018;. [PubMed] [DOI] |
| 8. | Xu B, Lin L, Xu G, Zhuang Y, Guo Q, Liu Y, Wang H, Zhou X, Wu S, Bao S. Long-term lamivudine treatment achieves regression of advanced liver fibrosis/cirrhosis in patients with chronic hepatitis B. J Gastroenterol Hepatol. 2015;30:372-378. [PubMed] [DOI] |
| 10. | Česen MH, Pegan K, Spes A, Turk B. Lysosomal pathways to cell death and their therapeutic applications. Exp Cell Res. 2012;318:1245-1251. [PubMed] [DOI] |
| 11. | Dang S, Xu H, Xu C, Cai W, Li Q, Cheng Y, Jin M, Wang RX, Peng Y, Zhang Y. Autophagy regulates the therapeutic potential of mesenchymal stem cells in experimental autoimmune encephalomyelitis. Autophagy. 2014;10:1301-1315. [PubMed] [DOI] |
| 12. | Kaushik S, Cuervo AM. Chaperone-mediated autophagy: a unique way to enter the lysosome world. Trends Cell Biol. 2012;22:407-417. [PubMed] [DOI] |
| 13. | Liu L, Liao JZ, He XX, Li PY. The role of autophagy in hepatocellular carcinoma: friend or foe. Oncotarget. 2017;8:57707-57722. [PubMed] [DOI] |
| 14. | Hernández-Gea V, Friedman SL. Autophagy fuels tissue fibrogenesis. Autophagy. 2012;8:849-850. [PubMed] [DOI] |
| 15. | Senoo H, Yoshikawa K, Morii M, Miura M, Imai K, Mezaki Y. Hepatic stellate cell (vitamin A-storing cell) and its relative--past, present and future. Cell Biol Int. 2010;34:1247-1272. [PubMed] [DOI] |
| 16. | Yamada M, Blaner WS, Soprano DR, Dixon JL, Kjeldbye HM, Goodman DS. Biochemical characteristics of isolated rat liver stellate cells. Hepatology. 1987;7:1224-1229. [PubMed] |
| 17. | Testerink N, Ajat M, Houweling M, Brouwers JF, Pully VV, van Manen HJ, Otto C, Helms JB, Vaandrager AB. Replacement of retinyl esters by polyunsaturated triacylglycerol species in lipid droplets of hepatic stellate cells during activation. PLoS One. 2012;7:e34945. [PubMed] [DOI] |
| 18. | Thoen LF, Guimarães EL, Dollé L, Mannaerts I, Najimi M, Sokal E, van Grunsven LA. A role for autophagy during hepatic stellate cell activation. J Hepatol. 2011;55:1353-1360. [PubMed] [DOI] |
| 19. | Blommaart EF, Krause U, Schellens JP, Vreeling-Sindelárová H, Meijer AJ. The phosphatidylinositol 3-kinase inhibitors wortmannin and LY294002 inhibit autophagy in isolated rat hepatocytes. Eur J Biochem. 1997;243:240-246. [PubMed] |
| 20. | Lv Q, Hua F, Hu ZW. DEDD, a novel tumor repressor, reverses epithelial-mesenchymal transition by activating selective autophagy. Autophagy. 2012;8:1675-1676. [PubMed] [DOI] |
| 21. | Lv Q, Wang W, Xue J, Hua F, Mu R, Lin H, Yan J, Lv X, Chen X, Hu ZW. DEDD interacts with PI3KC3 to activate autophagy and attenuate epithelial-mesenchymal transition in human breast cancer. Cancer Res. 2012;72:3238-3250. [PubMed] [DOI] |
| 22. | Li J, Yang B, Zhou Q, Wu Y, Shang D, Guo Y, Song Z, Zheng Q, Xiong J. Autophagy promotes hepatocellular carcinoma cell invasion through activation of epithelial-mesenchymal transition. Carcinogenesis. 2013;34:1343-1351. [PubMed] [DOI] |
| 23. | Pastore N, Blomenkamp K, Annunziata F, Piccolo P, Mithbaokar P, Maria Sepe R, Vetrini F, Palmer D, Ng P, Polishchuk E. Gene transfer of master autophagy regulator TFEB results in clearance of toxic protein and correction of hepatic disease in alpha-1-anti-trypsin deficiency. EMBO Mol Med. 2013;5:397-412. [PubMed] [DOI] |
| 24. | Shen M, Chen K, Lu J, Cheng P, Xu L, Dai W, Wang F, He L, Zhang Y, Chengfen W. Protective effect of astaxanthin on liver fibrosis through modulation of TGF-β1 expression and autophagy. Mediators Inflamm. 2014;2014:954502. [PubMed] [DOI] |
| 25. | Li J, Chen K, Li S, Feng J, Liu T, Wang F, Zhang R, Xu S, Zhou Y, Zhou S. Protective effect of fucoidan from Fucus vesiculosus on liver fibrosis via the TGF-β1/Smad pathway-mediated inhibition of extracellular matrix and autophagy. Drug Des Devel Ther. 2016;10:619-630. [PubMed] [DOI] |
| 26. | Park M, Kim YH, Woo SY, Lee HJ, Yu Y, Kim HS, Park YS, Jo I, Park JW, Jung SC. Tonsil-derived mesenchymal stem cells ameliorate CCl4-induced liver fibrosis in mice via autophagy activation. Sci Rep. 2015;5:8616. [PubMed] [DOI] |
| 27. | Yoshida K, Matsuzaki K, Murata M, Yamaguchi T, Suwa K, Okazaki K. Clinico-Pathological Importance of TGF-β/Phospho-Smad Signaling during Human Hepatic Fibrocarcinogenesis. Cancers (Basel). 2018;10. [PubMed] [DOI] |
| 28. | Meng XM, Nikolic-Paterson DJ, Lan HY. TGF-β: the master regulator of fibrosis. Nat Rev Nephrol. 2016;12:325-338. [PubMed] [DOI] |
| 29. | Inagaki Y, Okazaki I. Emerging insights into Transforming growth factor beta Smad signal in hepatic fibrogenesis. Gut. 2007;56:284-292. [PubMed] [DOI] |
| 30. | Derynck R, Zhang YE. Smad-dependent and Smad-independent pathways in TGF-beta family signalling. Nature. 2003;425:577-584. [PubMed] [DOI] |
| 31. | Pan CC, Kumar S, Shah N, Bloodworth JC, Hawinkels LJ, Mythreye K, Hoyt DG, Lee NY. Endoglin Regulation of Smad2 Function Mediates Beclin1 Expression and Endothelial Autophagy. J Biol Chem. 2015;290:14884-14892. [PubMed] [DOI] |
| 32. | Baghy K, Iozzo RV, Kovalszky I. Decorin-TGFβ axis in hepatic fibrosis and cirrhosis. J Histochem Cytochem. 2012;60:262-268. [PubMed] [DOI] |
| 33. | Yeh YC, Tsai JF, Chuang LY, Yeh HW, Tsai JH, Florine DL, Tam JP. Elevation of transforming growth factor alpha and its relationship to the epidermal growth factor and alpha-fetoprotein levels in patients with hepatocellular carcinoma. Cancer Res. 1987;47:896-901. [PubMed] |
| 34. | Chen YL, Law PY, Loh HH. Inhibition of PI3K/Akt signaling: an emerging paradigm for targeted cancer therapy. Curr Med Chem Anticancer Agents. 2005;5:575-589. [PubMed] |
| 35. | Zhou Q, Lui VW, Yeo W. Targeting the PI3K/Akt/mTOR pathway in hepatocellular carcinoma. Future Oncol. 2011;7:1149-1167. [PubMed] [DOI] |
| 36. | Song G, Ouyang G, Bao S. The activation of Akt/PKB signaling pathway and cell survival. J Cell Mol Med. 2005;9:59-71. [PubMed] |
| 37. | Yoneda N, Sato Y, Kitao A, Ikeda H, Sawada-Kitamura S, Miyakoshi M, Harada K, Sasaki M, Matsui O, Nakanuma Y. Epidermal growth factor induces cytokeratin 19 expression accompanied by increased growth abilities in human hepatocellular carcinoma. Lab Invest. 2011;91:262-272. [PubMed] [DOI] |
| 38. | Harada K, Shiota G, Kawasaki H. Transforming growth factor-alpha and epidermal growth factor receptor in chronic liver disease and hepatocellular carcinoma. Liver. 1999;19:318-325. [PubMed] |
| 39. | Ito Y, Takeda T, Higashiyama S, Sakon M, Wakasa KI, Tsujimoto M, Monden M, Matsuura N. Expression of heparin binding epidermal growth factor-like growth factor in hepatocellular carcinoma: an immunohistochemical study. Oncol Rep. 2001;8:903-907. [PubMed] |
| 40. | Tang H, Li RP, Liang P, Zhou YL, Wang GW. miR-125a inhibits the migration and invasion of liver cancer cells via suppression of the PI3K/AKT/mTOR signaling pathway. Oncol Lett. 2015;10:681-686. [PubMed] [DOI] |
| 41. | Psyrri A, Arkadopoulos N, Vassilakopoulou M, Smyrniotis V, Dimitriadis G. Pathways and targets in hepatocellular carcinoma. Expert Rev Anticancer Ther. 2012;12:1347-1357. [PubMed] [DOI] |
| 42. | Wu L, Zhang Q, Mo W, Feng J, Li S, Li J, Liu T, Xu S, Wang W, Lu X. Quercetin prevents hepatic fibrosis by inhibiting hepatic stellate cell activation and reducing autophagy via the TGF-β1/Smads and PI3K/Akt pathways. Sci Rep. 2017;7:9289. [PubMed] [DOI] |
| 43. | Schirripa M, Bergamo F, Cremolini C, Casagrande M, Lonardi S, Aprile G, Yang D, Marmorino F, Pasquini G, Sensi E. BRAF and RAS mutations as prognostic factors in metastatic colorectal cancer patients undergoing liver resection. Br J Cancer. 2015;112:1921-1928. [PubMed] [DOI] |
| 44. | Chen D, Wu X, Zheng J, Dai R, Mo Z, Munir F, Ni X, Shan Y. Autophagy regulates proliferation and biliary differentiation of hepatic oval cells via the MAPK/ERK signaling pathway. Mol Med Rep. 2018;17:2565-2571. [PubMed] [DOI] |
| 45. | Cheng AL, Kang YK, Chen Z, Tsao CJ, Qin S, Kim JS, Luo R, Feng J, Ye S, Yang TS. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double-blind, placebo-controlled trial. Lancet Oncol. 2009;10:25-34. [PubMed] [DOI] |
| 46. | Zhong J, Dong X, Xiu P, Wang F, Liu J, Wei H, Xu Z, Liu F, Li T, Li J. Blocking autophagy enhances meloxicam lethality to hepatocellular carcinoma by promotion of endoplasmic reticulum stress. Cell Prolif. 2015;48:691-704. [PubMed] [DOI] |
| 47. | B'chir W, Maurin AC, Carraro V, Averous J, Jousse C, Muranishi Y, Parry L, Stepien G, Fafournoux P, Bruhat A. The eIF2α/ATF4 pathway is essential for stress-induced autophagy gene expression. Nucleic Acids Res. 2013;41:7683-7699. [PubMed] [DOI] |
| 48. | Rzymski T, Milani M, Singleton DC, Harris AL. Role of ATF4 in regulation of autophagy and resistance to drugs and hypoxia. Cell Cycle. 2009;8:3838-3847. [PubMed] [DOI] |
| 49. | Khramtsov AI, Khramtsova GF, Tretiakova M, Huo D, Olopade OI, Goss KH. Wnt/beta-catenin pathway activation is enriched in basal-like breast cancers and predicts poor outcome. Am J Pathol. 2010;176:2911-2920. [PubMed] [DOI] |
| 50. | Wands JR, Kim M. WNT/β-catenin signaling and hepatocellular carcinoma. Hepatology. 2014;60:452-454. [PubMed] [DOI] |
| 51. | Li X, Yue S, Luo Z. Mesenchymal stem cells in idiopathic pulmonary fibrosis. Oncotarget. 2017;8:102600-102616. [PubMed] [DOI] |
| 52. | Du C, Jiang M, Wei X, Qin J, Xu H, Wang Y, Zhang Y, Zhou D, Xue H, Zheng S. Transplantation of human matrix metalloproteinase-1 gene-modified bone marrow-derived mesenchymal stem cell attenuates CCL4-induced liver fibrosis in rats. Int J Mol Med. 2018;41:3175-3184. [PubMed] [DOI] |
| 53. | Sayyed HG, Osama A, Idriss NK, Sabry D, Abdelrhim AS, Bakry R. Comparison of the therapeutic effectiveness of human CD34 + and rat bone marrow mesenchymal stem cells on improvement of experimental liver fibrosis in Wistar rats. Int J Physiol Pathophysiol Pharmacol. 2016;8:128-139. [PubMed] |
| 54. | Lou G, Yang Y, Liu F, Ye B, Chen Z, Zheng M, Liu Y. MiR-122 modification enhances the therapeutic efficacy of adipose tissue-derived mesenchymal stem cells against liver fibrosis. J Cell Mol Med. 2017;21:2963-2973. [PubMed] [DOI] |
| 55. | Qu Y, Zhang Q, Cai X, Li F, Ma Z, Xu M, Lu L. Exosomes derived from miR-181-5p-modified adipose-derived mesenchymal stem cells prevent liver fibrosis via autophagy activation. J Cell Mol Med. 2017;21:2491-2502. [PubMed] [DOI] |
| 56. | Li T, Yan Y, Wang B, Qian H, Zhang X, Shen L, Wang M, Zhou Y, Zhu W, Li W. Exosomes derived from human umbilical cord mesenchymal stem cells alleviate liver fibrosis. Stem Cells Dev. 2013;22:845-854. [PubMed] [DOI] |
| 57. | Wang B, Jia H, Zhang B, Wang J, Ji C, Zhu X, Yan Y, Yin L, Yu J, Qian H. Pre-incubation with hucMSC-exosomes prevents cisplatin-induced nephrotoxicity by activating autophagy. Stem Cell Res Ther. 2017;8:75. [PubMed] [DOI] |
| 58. | Shin JY, Park HJ, Kim HN, Oh SH, Bae JS, Ha HJ, Lee PH. Mesenchymal stem cells enhance autophagy and increase β-amyloid clearance in Alzheimer disease models. Autophagy. 2014;10:32-44. [PubMed] [DOI] |
| 59. | Yin F, Meng C, Lu R, Li L, Zhang Y, Chen H, Qin Y, Guo L. Bone marrow mesenchymal stem cells repair spinal cord ischemia/reperfusion injury by promoting axonal growth and anti-autophagy. Neural Regen Res. 2014;9:1665-1671. [PubMed] [DOI] |
| 60. | Liu L, Jin X, Hu CF, Li R, Zhou Z, Shen CX. Exosomes Derived from Mesenchymal Stem Cells Rescue Myocardial Ischaemia/Reperfusion Injury by Inducing Cardiomyocyte Autophagy Via AMPK and Akt Pathways. Cell Physiol Biochem. 2017;43:52-68. [PubMed] [DOI] |