修回日期: 2017-12-20
接受日期: 2017-12-24
在线出版日期: 2018-01-18
探讨不同病理特征进展期胃癌(gastric cancer, GC)的超声双重造影特征及其临床应用价值.
选取经病理证实的73例进展期GC患者作为研究对象, 根据不同病理分型将其分为: 黏液癌组(31例)和非黏液癌组(42例, 低未分化癌23例, 中高分化癌19例). 所有患者均于手术前接受超声双重造影检查, 并与术后病理组织结果进行比较.
黏液癌主要表现为层状增强, 非黏液癌主要表现为非层状增强, 两组间增强特征比较差异有统计学意义(P<0.05). 根据层状增强判定黏液癌的灵敏度为77.42%, 特异度为85.71%, 准确度为82.19%. 黏液癌组的峰值强度及增强强度明显低于与非黏液癌组, 差异有统计学意义(P<0.05); 非黏液癌组低未分化癌的峰值强度及增强强度明显高于中高分化癌, 差异有统计学意义(P<0.05).
运用超声双重造影分析进展期GC的增强特征及参数特点, 能初步判定其病理分型及分化程度, 可为临床提供参考.
核心提要: 胃癌(gastric cancer, GC)是较为常见的消化系肿瘤, 准确判定其术前病理特征对临床治疗有着重要意义. 超声造影是一种新兴的超声诊断技术, 能定量分析肿瘤的血流灌注状态. 本研究运用超声双重造影判定进展期GC的病理特征, 并探讨其价值.
引文著录: 马晓棠, 何雪威, 廉华, 王晓娅, 汪文杰, 彭孟龙. 超声双重造影判定进展期胃癌病理特征的应用价值. 世界华人消化杂志 2018; 26(2): 87-92
Revised: December 20, 2017
Accepted: December 24, 2017
Published online: January 18, 2018
To investigate the characteristics and clinical value of double contrast-enhanced ultrasonography (DCUS) in advanced gastric cancer (GC) with different pathological characteristics.
Seventy-three patients with pathologically confirmed advanced GC were included. According to the pathological type, they were divided into a mucinous carcinoma group (31 cases) and a non-mucinous carcinoma group (42 cases, including 23 cases of poorly differentiated and undifferentiated carcinoma and 19 cases of moderately differentiated and well-differentiated carcinoma). All patients received DCUS before surgery, and the DCUS results were compared with pathological results after surgery.
Mucinous carcinoma mainly showed layered enhancement, and non-mucinous carcinoma mainly showed non-layered enhancement. The difference in the enhanced features between the two groups was statistically significant (P < 0.05). The sensitivity, specificity, and accuracy of layered enhancement in diagnosing mucinous carcinoma were 77.42%, 85.71%, and 82.19%, respectively. The peak intensity and enhancement intensity in the mucinous carcinoma group were significantly lower than those in the non-mucinous carcinoma group (P < 0.05). In the non-mucinous carcinoma group, the peak intensity and enhancement intensity of poorly differentiated and undifferentiated carcinoma were significantly higher than those of moderately differentiated and well-differentiated carcinoma (P < 0.05).
The enhanced characteristics and parameter characteristics of advanced GC analyzed by DCUS can preliminarily determine the pathological type and differentiation degree.
- Citation: Ma XT, He XW, Lian H, Wang XY, Wang WJ, Peng ML. Value of double contrast-enhanced ultrasonography in determining pathological features of advanced gastric cancer. Shijie Huaren Xiaohua Zazhi 2018; 26(2): 87-92
- URL: https://www.wjgnet.com/1009-3079/full/v26/i2/87.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i2.87
胃癌(gastric cancer, GC)在我国是一种常见消化系肿瘤, 随着人们生活方式及结构改变, 其发病率逐年增高并趋于年轻化[1]. 不同病理特征的进展期GC具有不同流行病学以及生物学行为特征, 且与治疗方案及预后密切相关[2], 而以往多采用CT、磁共振等影像学方法对进展期GC的病理特征进行研究. 超声双重造影(口服胃窗超声造影结合静脉注射超声造影)具有无创、便捷、安全的优点, 目前关于GC病理特征方面的超声双重造影研究鲜有报道[3]. 本研究运用超声双重造影分析不同病理特征进展期GC的增强特征及参数特点, 以期为临床提供参考.
选取2015-03/2017-10在杭州市中医院接受手术治疗并经病理证实的73例进展期GC患者进行研究, 年龄43-75岁, 平均年龄58.78岁±9.66岁, 男62例, 女11例. 所有患者的GC病灶均为单发且术前均未接受过药物、放疗及化疗等任何治疗, 肿瘤最大径2.80-6.20 cm, 平均最大径4.91 cm±0.80 cm. 所有患者均于术前1 wk内接受超声双重造影检查, 根据不同病理分型分为: 黏液癌组(31例)和非黏液癌组(42例), 黏液癌组中17例黏液腺癌、14例印戒细胞癌; 非黏液癌组中19例中高分化癌(10例管状腺癌、9例乳头状腺癌), 23例低未分化癌(15例低分化腺癌、6例未分化癌、2例鳞癌).
采用Acuson sequoia 512超声诊断仪, 配有2.0-5.0 MHz的4V1探头及CPS成像技术. 心璋牌胃窗超声造影剂(杭州胡庆馀堂), 1包/人(48 g), 按照使用说明书将其调配成均匀浑浊溶液, 约600 mL. 微泡超声造影剂采用声诺维(Bracco公司), 使用前按照使用说明书将5 mL生理盐水注入瓶内, 振荡摇匀备用.
造影前患者禁食时间≥6 h, 同时为减弱胃蠕动可于造影前0.5 h取0.5 mg阿托品进行肌肉注射. 首先运用常规超声观察胃及其周围脏器的情况, 再嘱患者口服准备好的胃窗超声造影剂, 口服过程中应实时观察超声造影剂通过食管下段以及贲门的情况. 口服完毕后通过改变患者体位, 认真观察胃及十二指肠球部各解剖结构情况, 并明确肿瘤位置. 选取肿瘤径线最大切面对超声图像进行优化处理. 局部放大肿瘤区域, 启动cadence造影模式, 将超声图像设置为CA状态, 启动图像自动优化功能, 将MI设定为0.18-0.21, 探头输出功率设定为-20-(-21) dB. 将2.4 mL准备好的超声造影剂经肘静脉进行快速团注后, 同步记时并存储超声动态图像作后续分析.
超声造影完毕, 由两名经验丰富的高年资超声科医师各自分析超声图像, 如意见不同时, 共同讨论以获得一致判定. 观察并记录肿瘤在超声双重造影中的增强特征. 通过ACQ定量分析肿瘤的超声造影参数, 勾画感兴趣区域(严格包络整个肿瘤), 自动获得时间-强度曲线, 测量并记录相关参数: 达峰时间、峰值强度、增强强度.
统计学处理 采用SPSS19.0统计学软件处理数据, 计量资料以mean±SD表示, 组间比较采用独立样本t检验, 计数资料以%表示, 组间比较采用χ2检验. P<0.05为差异有统计学意义.
进展期GC的时间-强度曲线主要表现为"快进快出"的灌注形式, 即造影早期呈快速上升, 造影晚期呈快速下降.
超声造影完毕, 由两名超声科医师分析图像, 仅有4例病灶的增强特征判定存在不同意见, 后经共同讨论获得了一致判定.
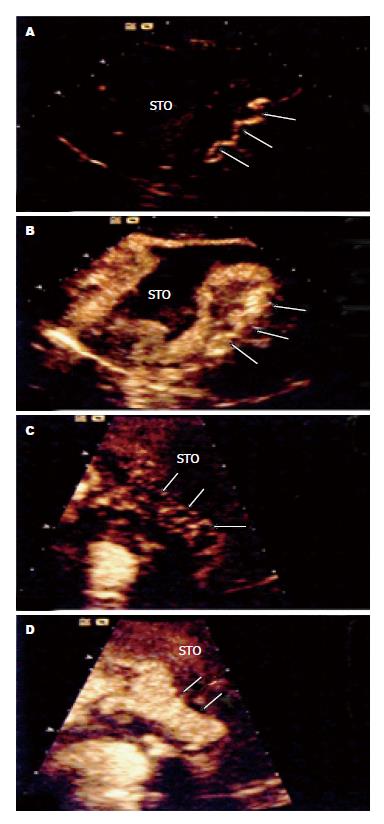
24例黏液癌病灶主要表现为层状增强, 即首先浆膜面或黏膜面出现不连续线样增强, 随后出现层状增强, 持续时间≥3 s, 内层高增强带在起始时较薄逐渐增厚, 中外层低增强带在起始时较厚逐渐变薄, 在低增强带内可见条索状高增强, 常相连于内层高增强带; 2例黏液癌病灶首先表现为弥漫性增强, 随后表现为不均匀性单层增强, 持续时间≥3 s; 5例黏液癌病灶表现为整体均匀性增强为主, 局部可见不规则低增强(图1A, B).
33例非黏液癌病灶主要表现为整体均匀性增强, 即首先内层出现较厚增强带, 随后出现均匀性整体增强, 局部可见形态不规则、散在分布的低增强区; 3例非黏液癌病灶首先黏膜面出现增强, 但高增强带较厚, 随后表现为整体增强; 6例非黏液癌病灶表现为具有较厚内层高增强区(厚度>0.3 cm)的层状增强(图1C, D).
黏液癌组(层状增强24例, 非层状增强7例)的增强特征与非黏液癌组(层状增强6例, 非层状增强36例)比较, 差异有统计学意义(χ2 = 29.367, P = 0.000, P<0.05).
以超声双重造影增强特征中的层状增强判定黏液癌的灵敏度为77.42%, 特异度为85.71%, 准确度为82.19%.
GC是常见的消化系肿瘤, 世界卫生组织将GC的病理分型分为管状腺癌、乳头状腺癌、低分化腺癌、印戒细胞癌和黏液腺癌等[4]. 本研究在该基础上对其按照黏液成分多寡分为黏液癌和非黏液癌. 黏液癌是指在(4×10)低倍视野下, 黏液成分在整体肿瘤组织中占比>30%, 包括黏液腺癌、印戒细胞癌等, 临床上具有恶性程度高, 发生转移早等特点, 故多在晚期才被发现[5]. 非黏液癌包括管状腺癌、乳头状腺癌、低分化腺癌、未分化癌、鳞状细胞癌等, 其生物学行为随分化程度不同, 差异较大, 对应的治疗及预后不尽相同[6]. 因此, 术前准确判定进展期GC的病理分型及分化程度有着重要意义. 国内外已有学者运用CT对GC的术前病理组织学特点进行研究[7-14], 但是目前运用超声双重造影研究GC的病理特征即鲜有报道[15,16].
超声造影剂属于纯血池造影剂, 能反映器官组织的血管化程度及血流灌注状态[17]. 本研究结果中, 经静脉注射超声造影剂后GC病灶均出现明显增强, 黏液癌主要表现为层状增强, 非黏液癌主要表现为非层状增强, 两组间增强特征比较差异有统计学意义, 提示进展期GC的增强模式与其病理组织学类型具有相关性. 而根据"层状增强"判定黏液癌的灵敏度为77.42%, 特异度为85.71%, 准确度为82.19%, 进一步提示超声双重造影有助于初步判定进展期GC的病理组织学类型. 其病理基础如下: (1)黏液癌呈层状增强的原因可能是: 其癌细胞排列紊乱, 分布不规则, 呈分散状或条索状分布[18]; 癌组织内细胞成分较少, 呈浸润生长, 而纤维间质成分较丰富[19]; 大量新生微小血管主要分布在肿瘤病灶表面及周围, 而深部即较少[20]; 黏液癌恶性度高, 生长迅速, 更易发生坏死液化而产生无血流灌注区; (2)部分黏液癌呈非层状增强的原因可能是: 肿瘤内仅含部分印戒细胞癌或黏液腺癌; 肿瘤生长于胃窦部呈浸润性弥漫性生长, 致使局部胃腔狭窄, 前后胃壁过于靠近而发生部分容积效应; (3)非黏液癌呈整体增强的原因可能是: 癌细胞以单团状方式分布[21]; (4)部分非黏液癌呈非整体增强的原因可能是: 癌细胞浸润并散在分布于肌层, 周围反生纤维性反应; 呼吸运动使病灶在检查时发生偏离[22].
大量新生微小血管在肿瘤的发生发展过程中发挥着十分重要的作用, 是肿瘤浸润生长、远处转移的前提条件之一, 肿瘤微血管密度与其病理分化程度有着密切关系, 在分化不良的肿瘤患者中明显升高[23]. 通过超声造影能获得肿瘤的时间-强度曲线, 能直观反映其内部微循环血流灌注状态, 并测量其血流灌注参数, 从而判定肿瘤的病理性质及分型. 本研究结果中, 进展期GC的时间-强度曲线主要表现为"快进快出"的灌注形式, 印证了进展期GC属于富血供肿瘤, 其内部有着大量新生微小血管以及动静脉瘘交通支, 能明显降低血流阻力, 加快造影剂灌注速度. 本研究结果中, 黏液癌组的峰值强度及增强强度明显低于非黏液癌组, 提示进展期GC的血流灌注参数与其病理分型密切相关. 其病理基础可能是, 不同病理分型GC之间, 内部结构成分存在差异, 黏液癌的癌细胞内胞浆含量十分丰富, 而有形成分相对较少, 使其声阻抗差明显减少, 背向散射随之下降[24-26]; 黏液癌恶性程度高, 生长增殖速度较快, 易发生坏死、液化, 导致整体峰值强度和增强强度的测量值下降[27]. 本研究结果中, 非黏液癌组低未分化癌的峰值强度及增强强度明显高于中高分化癌, 提示进展期GC的血流灌注参数与其分化程度存在着相关性, 即分化程度越差所对应的峰值强度及增强强度越高. 通过分析进展期GC的血流灌注参数有助于判定非黏液癌的病理分化程度. 其病理基础可能是, 分化差的进展期GC在其生长、发展及转移过程中势必生成更丰富的微小血管, 并主要以芽状、细索状方式生长, 为癌细胞提供更充足的营养支持, 使其快速增殖转移[28-33].
超声双重造影是一种无创、安全的检查方法, 能观察分析进展期GC的微循环血流灌注情况, 判定其病理分型及分化程度, 可为临床治疗和预后评估提供参考.
胃癌(gastric cancer, GC)在我国具有较高的发病率和死亡率. 超声造影能直观反映肿瘤的血流灌注特点, 并可定量分析其血流灌注参数特征, 进而分析肿瘤的病理特征, 可为GC的临床治疗及预后判定提供有价值的参考.
本研究运用超声双重造影分析不同病理特征进展期GC的增强特征及参数特点, 以期为临床提供参考依据.
探讨不同病理特征进展期GC的超声双重造影特征及其临床应用价值, 为进展期GC的术前病理判定提供参考.
口服胃窗超声造影可以扩张胃腔, 排空气体, 为胃部检查提供透声窗, 而超声造影是一项全新的超声成像技术, 能直观反映并定量分析肿瘤的血流灌注特点.
本篇论文的研究达到了实验目标, 我们发现黏液癌主要表现为层状增强, 非黏液癌主要表现为非层状增强; 根据层状增强判定黏液癌的灵敏度为77.42%, 特异度为85.71%, 准确度为82.19%; 黏液癌的峰值强度及增强强度明显低于与非黏液癌; 非黏液癌中, 低未分化癌的峰值强度及增强强度明显高于中高分化癌. 运用超声双重造影分析进展期GC的增强特征及参数特点, 能初步判定进展期GC的病理分型及分化程度, 可为临床提供参考.
不同病理分型及分化程度的进展期GC具有不同的超声双重造影增强特征及参数特点. 运用超声双重造影能初步判定进展期GC的病理分型及分化程度. 黏液癌主要表现为层状增强, 非黏液癌主要表现为非层状增强; 根据层状增强判定黏液癌的灵敏度为77.42%, 特异度为85.71%, 准确度为82.19%; 黏液癌的峰值强度及增强强度明显低于与非黏液癌; 非黏液癌中, 低未分化癌的峰值强度及增强强度明显高于中高分化癌. 超声双重造影有助于判定进展期GC的病理分型及分化程度. 超声双重造影检查(口服胃窗超声造影结合静脉注射超声造影). 黏液癌主要表现为层状增强, 非黏液癌主要表现为非层状增强; 根据层状增强判定黏液癌的灵敏度为77.42%, 特异度为85.71%, 准确度为82.19%; 黏液癌的峰值强度及增强强度明显低于与非黏液癌; 非黏液癌中, 低未分化癌的峰值强度及增强强度明显高于中高分化癌. 进展期GC是富血供肿瘤. 分化程度越低的GC, 血供越丰富. 运用超声双重造影分析进展期GC的增强特征及参数特点, 能无创简便地初步判定进展期GC的病理分型及分化程度, 为临床提供参考依据.
口服胃窗超声造影可以扩张胃腔, 排空气体, 为胃部检查提供透声窗; 超声造影能直观反映并定量分析肿瘤的血流灌注特点. 运用超声双重造影进一步深入研究进展期GC经治疗前后的病理组织学特征. 超声双重造影与术后病理进行对照研究.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D, D
E级 (差): 0
编辑: 马亚娟 电编:杜冉冉
| 2. | Elimova E, Shiozaki H, Wadhwa R, Sudo K, Chen Q, Estrella JS, Blum MA, Badgwell B, Das P, Song S. Medical management of gastric cancer: a 2014 update. World J Gastroenterol. 2014;20:13637-13647. [PubMed] [DOI] |
| 3. | McCarville MB. Contrast-enhanced sonography in pediatrics. Pediatr Radiol. 2011;41 Suppl 1:S238-S242. [PubMed] [DOI] |
| 4. | 朱 信强, 张 明, 丁 闯, 孔 令永, 陈 焰, 管 文贤. 不同病理类型进展期胃癌的预后因素分析. 中国普外基础与临床杂志. 2017;5:580-586. |
| 7. | Giganti F, Antunes S, Salerno A, Ambrosi A, Marra P, Nicoletti R, Orsenigo E, Chiari D, Albarello L, Staudacher C. Gastric cancer: texture analysis from multidetector computed tomography as a potential preoperative prognostic biomarker. Eur Radiol. 2017;27:1831-1839. [PubMed] [DOI] |
| 8. | Tsurumaru D, Miyasaka M, Muraki T, Nishie A, Asayama Y, Oki E, Oda Y, Honda H. Histopathologic diversity of gastric cancers: Relationship between enhancement pattern on dynamic contrast-enhanced CT and histological type. Eur J Radiol. 2017;97:90-95. [PubMed] [DOI] |
| 9. | Lee SL, Lee HH, Ku YM, Jeon HM. Usefulness of Two-Dimensional Values Measured Using Preoperative Multidetector Computed Tomography in Predicting Lymph Node Metastasis of Gastric Cancer. Ann Surg Oncol. 2015;22 Suppl 3:S786-S793. [PubMed] [DOI] |
| 10. | Cheng J, Wu J, Ye Y, Zhang C, Zhang Y, Wang Y. Extramural venous invasion detected by MDCT as an adverse imaging feature for predicting synchronous metastases in T4 gastric cancer. Acta Radiol. 2017;58:387-393. [PubMed] [DOI] |
| 13. | 王 小平, 沈 明华, 余 旭茗, 余 瑞明, 蔡 建春, 张 海萍. 胃癌16层螺旋CT术前分期与术后病理对比研究. 中国医学计算机成像杂志. 2007;13:435-439. |
| 16. | 娄 迎阁, 李 亚珂, 时 贵阁, 岳 湘竹. 胃肠超声造影诊断胃占位性疾病的临床价值. 中国临床医学影像杂志. 2017;28:594-595. |
| 20. | Schirin-Sokhan R, Winograd R, Roderburg C, Bubenzer J, do Ó NC, Guggenberger D, Hecker H, Trautwein C, Tischendorf JJ. Response evaluation of chemotherapy in metastatic colorectal cancer by contrast enhanced ultrasound. World J Gastroenterol. 2012;18:541-545. [PubMed] [DOI] |
| 21. | 柳 伟, 洪 斌, 王 金金. 超声检查在胃癌诊断中的价值分析. 河南科技大学学报(医学版). 2006;24:218-219. |
| 22. | 李 世岩, 黄 品同, 李 艳萍, 王 亮, 黄 福光, 郑 志强, 王 宗敏. 超声双重造影对进展期胃癌Lauren分型的初步研究. 中华超声影像学杂志. 2008;17:1041-1044. |
| 23. | Tastekin E, Caloglu VY, Durankus NK, Sut N, Turkkan G, Can N, Puyan FO, Caloglu M. Survivin expression, HPV positivity and microvessel density in oropharyngeal carcinomas and relationship with survival time. Arch Med Sci. 2017;13:1467-1473. [PubMed] [DOI] |
| 27. | 沈 理, 汪 晓虹, 王 怡. 我国胃疾病超声诊断的现状与展望. 中华医学超声杂志(电子版). 2016;13:401-405. |
| 28. | 吕 靖芳, 孙 保存, 孙 慧誌, 张 艳辉, 孙 俊英, 赵 秀兰, 古 强, 董 学易, 车 娜. 胃癌不同组织学分型与微血管密度及相关因子的关系. 中国肿瘤临床. 2015;42:737-742. |
| 32. | 涂 毅, 姚 峰, 魏 文, 孙 圣荣. 胃癌中微血管密度及VEGF、NOS表达与肿瘤浸润、转移的相关性. 武汉大学学报(医学版). 2006;27:763-767. |
| 33. | 李 凯, 刘 杰. 胃癌组织中CXCR3表达与微血管形成的关系及其临床意义. 临床与实验病理学杂志. 2016;32:1097-1100. |