修回日期: 2018-05-09
接受日期: 2018-05-19
在线出版日期: 2018-06-28
探讨表面增强拉曼光谱技术(surface-enhanced Raman spectroscopy, SERS)在胃癌(gastric cancer, GC)诊断中的应用价值, 并评估SERS在GC分期中的可行性.
利用InVia+Plus型激光共焦显微拉曼光谱仪检测63例经病理学确诊GC患者, 45例GC前病变患者, 50例健康志愿者的血清, 分析不同血清SERS光谱的特征, 采用单因素方差分析(ANOVA)、独立样本t检验、主成分分析(principal component analysis, PCA)、线性判别分析(linear discriminant analysis, LDA)等统计分析方法进行统计学处理, 利用受试样品工作特征曲线(receiver operating characteristic curve, ROC)评价诊断效能.
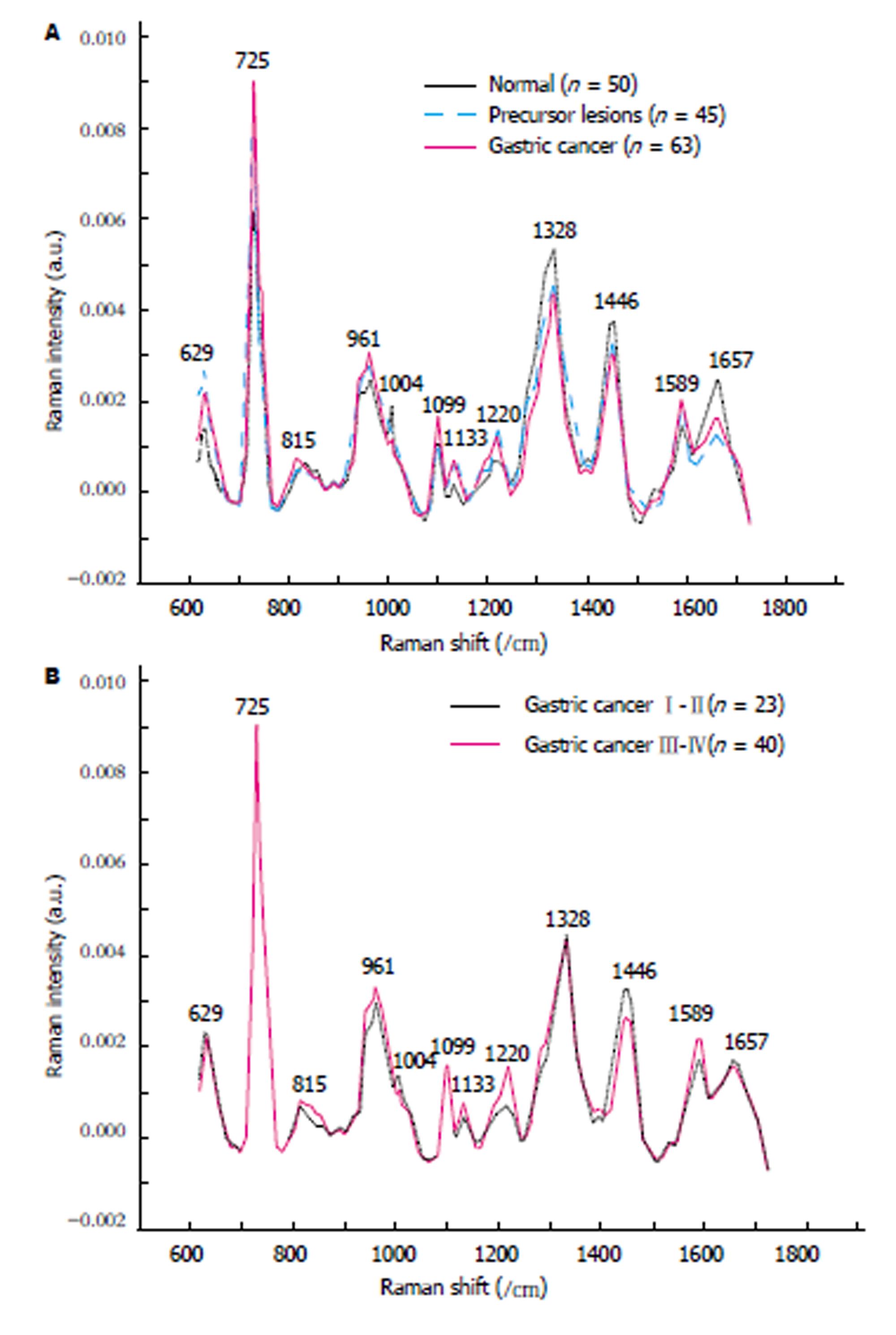
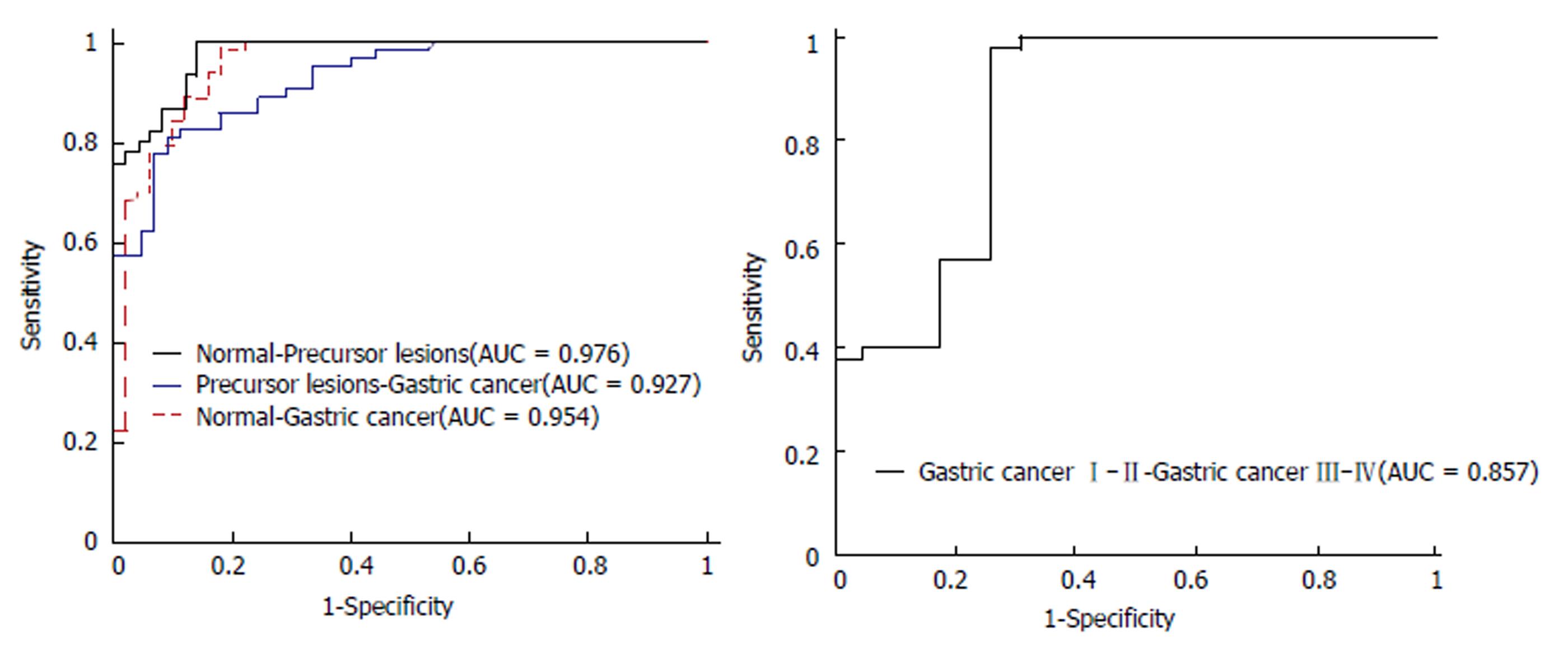
GC、GC前病变、正常组血清的平均SERS光谱存在差异, 在725、1099、1133、1589/cm位移处, GC组血清SERS强度高于正常组; 在1004、1328、1446、1657/cm位移处, GC前病变组和GC组血清SERS强度均弱于正常组. 相比正常组和癌前病变组, GC患者血清在815/cm处有特征峰. 在1133、1446、1589/cm位移处, GC TNM Ⅲ-Ⅳ期患者血清SERS强度明显强于Ⅰ-Ⅱ期; 在1004/cm位移处, Ⅰ-Ⅱ期血清SERS谱峰强度则明显强于Ⅲ-Ⅳ期. 利用PCA-LDA统计方法得到SERS技术诊断GC的灵敏度、特异性和准确率分别为96.8%(61/63), 78%(39/50)和88.5%(100/113); ROC曲线下面积为0.927; SERS技术区分GC TNM Ⅰ-Ⅱ期和Ⅲ-Ⅳ期的灵敏度、特异性和准确率分别为97.5%(39/40), 73.9%(17/23)和88.9%(56/63); ROC曲线下面积为0.857.
基于表面增强拉曼光谱技术对GC、GC前病变及健康人的血清进行检测和分析, 可有效鉴别GC、GC前病变及健康人, 并且能够对不同分期的GC做出有效区分, 有望成为GC的早期诊断、临床决策指导以及预后评估的新方法.
核心提要: 表面增强拉曼光谱(surface-enhanced Raman spectroscopy, SERS)可以在分子水平反映疾病的变化规律, 胃癌(gastric cancer, gc)、癌前病变和正常人之间, 以及不同分期GC之间的SERS光谱存在差异, SERS可有效鉴别GC、GC前病变及健康人, 对于鉴别不同肿瘤分期的GC有一定价值.
引文著录: 刘燕玲, 黄丽韫, 钟会清, 卢敏, 侯雨晴, 毛华. 表面增强拉曼光谱在胃癌诊断和分期中的应用. 世界华人消化杂志 2018; 26(18): 1102-1110
Revised: May 9, 2018
Accepted: May 19, 2018
Published online: June 28, 2018
To investigate the value of surface-enhanced Raman spectroscopy (SERS) in the diagnosis of gastric cancer (GC) as well as its feasibility in distinguishing GC of different TNM stages.
InVia laser confocal microscope-Raman spectrometer was used to examine the sera of patients with pathologically confirmed GC (63 cases), those with gastric precursor lesions (45 cases), and healthy volunteers (50 cases). One-way ANOVA, Student's t test, principal component analysis (PCA), and linear discriminant analysis (LDA) were used to process and analyze the Raman spectral data, and the receiver operating characteristic (ROC) curve analysis was performed to evaluate the diagnostic efficiency.
The average SERS spectra of sera differed significantly among GC patients, patients with precancerous lesions, and healthy volunteers. The intensity of Raman spectra located at 725, 1099, 1133, and 1589/cm was significantly stronger in GC patients than in normal controls, while the intensity of Raman spectra at 1004, 1328, 1446, and 1657/cm was significantly stronger in normal persons. A strong enhancement in the intensity of the peak at approximately 815/cm was observed in the spectra of the serum of GC patients. At the Raman shift of 1133, 1446, and 1589/cm, Raman intensity for serum samples was significantly stronger in GC patients with TNM stage Ⅲ/Ⅳ disease than in those with stage Ⅰ/Ⅱ disease, while the Raman intensity at the Raman shift of 1004/cm was significantly stronger in patients with stage Ⅰ/Ⅱ disease. The sensitivity, specificity, and accuracy of SERS combined with multivariate PCA-LDA in diagnosing GC were 96.8% (61/63), 78% (39/50), and 88.5% (100/113), respectively, and the area under the ROC curve was 0.927. The sensitivity, specificity, and accuracy of SERS combined with multivariate PCA-LDA in distinguishing TNM stage Ⅰ/Ⅱ GC and stage Ⅲ/Ⅳ disease were 97.5% (39/40), 73.9% (17/23), and 88.9% (56/63), respectively, and the area under the ROC curve was 0.857.
Detection and analysis of sera based on SERS can effectively identify patients with GC, those with gastric precancerous lesions, and healthy volunteers. Furthermore, it can effectively distinguish GC of different stages. SERS is expected to become a new method for early diagnosis, clinical decision guidance, and prognosis evaluation of GC.
- Citation: Liu YL, Huang LY, Zhong HQ, Lu M, Hou YQ, Mao H. Application of surface-enhanced Raman spectroscopy in diagnosis and staging of gastric cancer. Shijie Huaren Xiaohua Zazhi 2018; 26(18): 1102-1110
- URL: https://www.wjgnet.com/1009-3079/full/v26/i18/1102.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i18.1102
胃癌(gastric cancer, GC)是严重威胁人们生存的常见消化道恶性肿瘤之一, 也是全球死亡率较高的肿瘤之一. 流行病学资料显示[1], 全球每年大约有90多万新发GC患者, 其中70万以上死于GC相关疾病, 是严重威胁人类生命最主要的恶性肿瘤, 但不同分期GC预后差别很大, 早期发现是GC诊治的关键. 目前GC常用的筛查方法包括便隐血试验、血清学检查、影像学检查、内镜检查及组织活检等, 并以内镜检查结合病理活检为金标准, 但该检查为有创操作, 给患者造成一定痛苦, 不适合人群的普查. 因此, 有必要建立一种无损、客观、准确性高的GC检测方法.
表面增强拉曼光谱(surface-enhanced Raman spectroscopy, SERS)是一种物质成分的分析手段, 可以根据分子的转动及振动能级对应的化学键或官能团来获得分子结构特征和物质成分信息[2,3], 被公认为是研究分子结构和功能的有效方法之一. 相比常规的拉曼光谱, SERS不仅在检测效应上使拉曼信号增强1013-1014倍, 同时能够抑制生物样品荧光背景的干扰[4], 具有灵敏度高、无损、快速、痕量等特点, 近年来已广泛应用于生物医学与疾病诊断的领域[5-9]. 目前GC的SERS研究[10-12]多数集中在GC与正常人的鉴别诊断, 对于GC前病变以及GC分期的研究甚少, 本研究利用SERS技术检测了GC患者、GC前病变患者和健康志愿者的血清, 并结合多元统计分析方法进行对比分析, 探索SERS技术在GC诊断中的应用价值, 同时评估SERS技术在GC分期中的可行性.
1.1.1 纳入及排除标准: (1)GC患者: ①经手术病理确诊; ②样本采集前均未接受外科手术、放化疗等; ③无合并全身其他系统肿瘤; ④无其他胃肠道疾病; ⑤无心、肝、肾等其他器官功能障碍者; (2)GC前病变患者: ①经胃镜病理确诊; ②无恶性肿瘤病史; ③无其他胃肠道疾病; ④无心、肝、肾等其他器官功能障碍者; (3)正常对照组: ①无恶性肿瘤病史; ②无心、肝、肾等其他器官功能障碍者. 本研究符合人体试验伦理学标准, 获得医院伦理委员会的批准. 所有受试者均签署知情同意书, 允许使用其血液样品进行研究.
1.1.2 一般资料: 收集2016-10/2017-10在南方医科大学珠江医院消化内科、普外科、肿瘤科住院的经病理学检查确诊的GC患者共63例, GC前病变组织45例, 健康志愿者50例. 受试者的一般资料见表1. 各组年龄及性别构成比均无统计学差异(P>0.05).
| 分组病理类型 | 性别 | 总例数 | 年龄 (mean ± SD, 岁) | ||
| 男性 | 女性 | ||||
| 正常组 (n = 50) | - | 23 (46) | 27 (54) | 50 (100) | 55.86 ± 10.13 |
| 胃癌前病变(n = 45) | 萎缩性胃炎 | 1 (2.2) | 2 (4.4) | 3 (6.6) | |
| 轻-中度肠上皮化生 | 16 (35.6) | 9 (20) | 25 (55.6) | 57.11 ± 12.63 | |
| 重度肠上皮化生 | 0 | 1 (2.2) | 1 (2.2) | ||
| 胃腺瘤性息肉 | 7 (15.6) | 9 (20) | 16 (35.6) | ||
| 胃癌组(n = 63) | 低分化腺癌 | 25 (39.7) | 17 (27) | 42 (66.7) | 59.87 ± 9.95 |
| 中分化腺癌 | 9 (14.3) | 5 (7.9) | 14 (22.2) | ||
| 高分化腺癌 | 2 (3.2) | 0 | 2 (3.2) | ||
| 印戒细胞癌 | 2 (3.2) | 3 (4.8) | 5 (7.9) | ||
| 胃癌TNM分期(n = 63) | Ⅰ期 | 8 (12.7) | 4 (6.3) | 12 (19) | 59.87 ± 9.95 |
| Ⅱ期 | 5 (7.9) | 6 (9.5) | 11 (17.5) | ||
| Ⅲ期 | 16 (25.4) | 13 (20.6) | 29 (46) | ||
| Ⅳ期 | 9 (14.3) | 2 (3.2) | 11 (17.5) | ||
标本采集及处理: 受试者禁食8 h后, 在次日早晨6-7点抽取空腹静脉血2 mL, 不加入抗凝剂, 经过离心机4000 r/min离心10 min后取上层血清作为样本, 冻存于-80 ℃冰箱待测.
1.1.3 实验装置及参数 实验仪器采用InVia+Plus型激光共焦显微拉曼光谱仪(英国Renishaw公司). 激发光波长为785 nm, 20倍物镜, 每条光谱CCD积分时间为3 s, 累加3次, 取谱区间为600-1800/cm, 50%激光功率, 光谱分辨率为1/cm. 检测前采用520/cm硅片振动峰对仪器进行校准.
1.2.1 SERS基底的制备: 参考Lee和Meisel[13]报道的化学还原法制备银溶胶: 取47.5 mL浓度为0.53 mmol/L的AgNO3溶液, 搅拌状态下缓慢加入600 μL 1%的柠檬酸钠溶液, 继续加热1 h, 均匀搅拌至溶液呈灰绿色后停止加热, 自然冷却至室温, 得到银溶胶.
1.2.2 血清SERS光谱检测: 将待测血清与银纳米溶胶以1:1的比例混合, 并用移液枪使之混合均匀, 在23 ℃环境下静置30 min. 然后取一滴该混合液点至硅片上进行SERS检测. 每个样品测量不同位置的3条光谱, 实验于暗室中进行, 均由同一人操作. 应用WiRE3.4软件包收集数据.
1.2.3 拉曼光谱数据的预处理: 应用Vancouver Raman Algorithm软件[14]对采集的SERS谱线进行平滑以消除噪声以及荧光背景的扣除, 得到血清的SERS信号. 继而在600-1800/cm波数范围对每条谱线进行面积归一化处理, 最后将同一样品不同位置的3条光谱取平均作为一个病例的血清SERS信号.
统计学处理 根据预实验采用公式n = Ψ2(∑(Si2)/K)/[∑(Xi均 - X均)2/(K-1)]计算得出每组观察对象至少12例. 采用SPSS20.0统计软件, 对各组SERS光谱强度值均数比较进行单因素方差分析(ANOVA), 三组间两两比较使用LSD检验, 两独立样本之间的均数比较采用t检验, P<0.05为差异有统计学意义. 在Matlab2016软件中, 采用主成分分析法(principal component analysis, PCA)对数据进行降维, 从多维变量系统中提取出少数具有代表性的综合变量, 从而最大限度地反映原有数据的特征. 进一步使用线性判别分析(linear discriminant analysis, LDA)对数据进行判别分类. 受试者工作特征曲线(receiver operating characteristic curve, ROC)下面积用于评价判别分析结果的诊断效能.
图1显示了GC组、癌前病变组、正常组以及GC TNM Ⅰ-Ⅱ与Ⅲ-Ⅳ期血清面积归一化后的平均SERS光谱. GC组、癌前病变组、正常组血清的平均SERS光谱形态和谱峰大体相似, GC前病变组SERS谱峰强度大致位于正常组和GC组之间, 主要的谱峰位于位移629、725、815、830、961、1004、1099、1133、1220、1328、1446、1589、1657/cm处, 但谱峰强弱存在差异. 这些峰与已有研究报道的GCSERS峰相似[10,12]. 在725、1099、1133、1589/cm位移处, GC组血清SERS强度高于正常组, 差异有统计学意义(P<0.05). 在1004、1328、1446、1657/cm位移处, GC前病变组和GC组血清SERS强度均弱于正常组, 差异有统计学意义(P<0.05); 正常组血清SERS光谱中出现的830/cm谱峰, 在GC前病变组及GC组血清SERS光谱中消失, 并向左偏移至815/cm, 并且GC组该谱峰强度强于癌前病变组及正常组, 三组间两两比较P<0.05, 差异有统计学意义.
GC TNMⅠ-Ⅱ与Ⅲ-Ⅳ期血清的平均SERS光谱形态和拉曼位移基本相似, 差异主要体现在谱峰强度上. 在1133、1446、1589/cm位移处, TNM Ⅲ-Ⅳ期血清SERS谱峰强度明显强于Ⅰ-Ⅱ期, 差异有统计学意义(P<0.05); 在1004/cm位移处, Ⅲ-Ⅳ期血清SERS谱峰强度明显弱于Ⅰ-Ⅱ期, 差异有统计学意义(P<0.05).
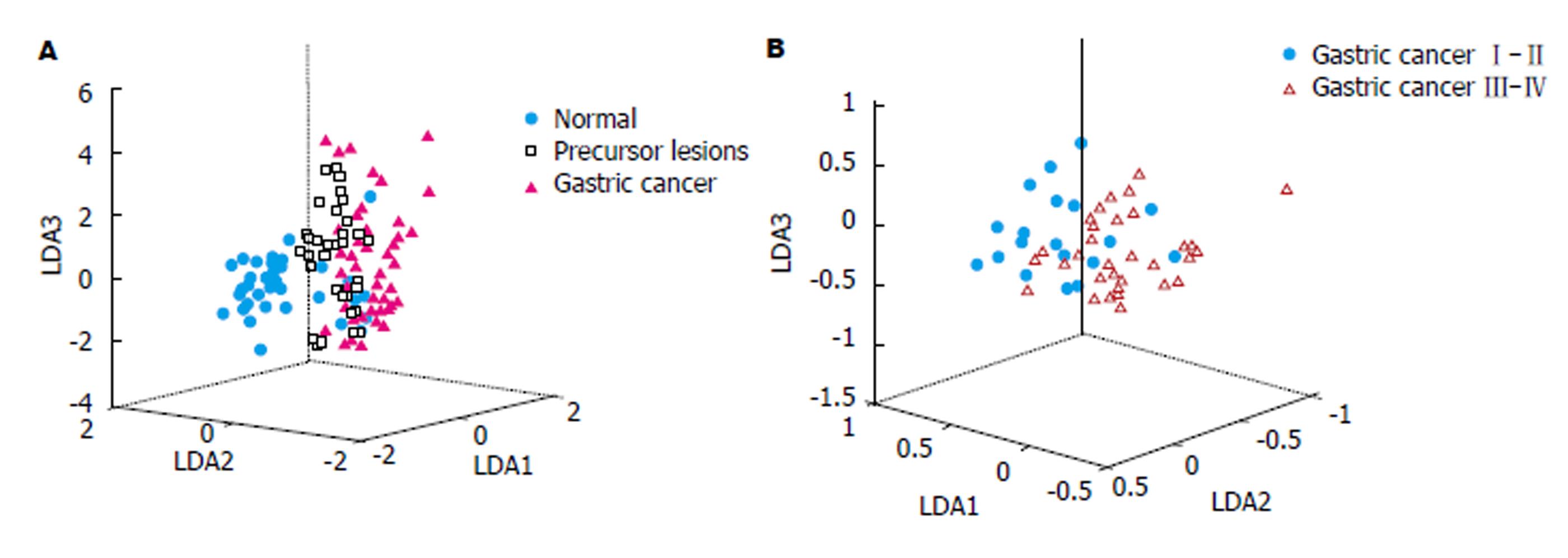
采用PCA分析法对光谱数据进行降维和主成分提取, GC组、癌前病变组、正常组的血清SERS光谱数据前3个主成成分累计贡献率达到82.2%, TNMⅠ-Ⅱ期和Ⅲ-Ⅳ期GC则达到90.4%. 进一步对PCA提取出的主成分进行LDA分析, 建立判别诊断模型, 将LDA产生的线性判别函数绘制散点图(图2), 通过PCA-LDA诊断模型得到: 判别诊断GC前病变的灵敏度、特异性和准确率分别为100%(45/45), 84%(42/50)和91.6%(87/95); 判别诊断GC TNM Ⅰ-Ⅱ期和Ⅲ-Ⅳ期的灵敏度、特异性和准确率分别为97.5%(39/40), 73.9%(17/23)和88.9%(56/63), 见表2.
| 诊断组合 | 预测参数 | |||
| 灵敏度 | 特异性 | 准确性 | AUC | |
| 癌前病变组 vs 正常组 | 45 (45) | 42 (84) | 87 (91.6) | 0.976 |
| 胃癌组 vs 正常组 | 61 (96.8) | 39 (78) | 100 (88.5) | 0.954 |
| 癌前病变组 vs 胃癌组 | 52 (82.5) | 37 (82.2) | 89 (82.4) | 0.927 |
| TNM Ⅲ-Ⅳ期 vs Ⅰ-Ⅱ期 | 39 (97.5) | 17 (73.9) | 56 (88.9) | 0.857 |
对PCA-LDA诊断模型产生的判别得分构建ROC曲线(图3), 以评价模型的诊断效能, 正常组-癌前病变组、癌前病变组-GC组和正常组-GC组ROC曲线下面积分别为0.976, 0.927和0.954.GC TNM Ⅰ-Ⅱ期-Ⅲ-Ⅳ期ROC曲线下面积为0.857.表明运用PCA-LDA统计方法分类诊断的准确性较高, 能有效地鉴别GC患者、癌前病变患者和正常人, 并在GC分期的诊断中具有较高的准确性.
GC的早期诊断和早期治疗对于改善患者的预后, 提高生存率具有重要的意义. 通常早期GC并不引起临床症状和医学影像学的异常, 而在疾病发生发展的过程中, 血清中的蛋白质、核酸、糖类、脂质等生物大分子的含量或构象会随着细胞的坏死和凋亡等生物代谢过程而发生改变, 这些生化改变可以通过SERS检测得以体现, 不同的拉曼位移、谱峰强度及宽度, 可以在分子水平上反映不同病例的化学成分和分子结构的差异. 人体血清SERS谱峰的生物分子归属见表3.
| 拉曼位移(/cm) | 振动模式 | 物质归属 |
| 629 | C-C=O弯曲振动 | 苯丙氨酸 |
| 725 | C-H弯曲振动 | 腺嘌呤, 辅酶A |
| 815 | C-C伸缩振动 | 胶原蛋白 |
| 961 | C-N形变振动 | 核酸 |
| 1004 | C-C环呼吸振动 | 苯丙氨酸 |
| 1099 | PO2对称伸缩 | 鸟嘌呤、磷酸骨架 |
| 1133 | C-N对称伸缩 | D-甘露糖 |
| 1220 | C-C6H5伸缩振动 | 苯丙氨酸, 色氨酸 |
| 1328 | C-H弯曲振动 | 脂质 |
| 1446 | CH2弯曲振动 | 蛋白质、磷脂 |
| 1589 | C=C弯曲振动 | 核酸 |
| 1657 | C=O伸缩振动 | α-螺旋, 酰胺Ⅰ |
有学者利用表面增强拉曼光谱技术对GC患者的血清进行研究, 发现GC血清和正常人血清的SERS谱峰强度存在明显差异, GC血清中归属于核酸的拉曼峰强度较正常人高, 而归属于蛋白质的特征峰强度低于正常人[19]. 本研究的实验结果发现, GC患者、GC前病变患者、正常人血清的平均SERS光谱形态和谱峰大体相似, GC前病变组血清SERS谱峰强度大致位于正常组和GC组之间, 表明各组血清中化学成分的分子结构或含量变化相近, 且癌前病变是正常人向GC转变的一个过渡阶段. 从正常组发展到癌前病变组和GC组, 与核酸相关的血清SERS信号逐渐增强, 主要在725、1099、1133、1589/cm位移处, 表明GC患者血清中核酸的含量高于正常人, 这可能是由于恶性肿瘤细胞无限增殖、转化, 细胞核内核酸或其成分明显增多, 在肿瘤细胞坏死、凋亡的过程中被释放至循环系统, 导致血液中的核酸含量升高, 这种游离态核酸的变化, 有可能成为GC早期诊断的标志物以及预后监测的动态指标[20]. 与文献报道相似[10,21-23], 725/cm谱峰在GC、结直肠癌、鼻咽癌、肝癌等肿瘤中相对正常人增强, 因此被认为是恶性肿瘤诊断的"指纹峰". 在1004、1328、1446、1657/cm位移处, GC前病变组和GC组血清SERS强度均弱于正常组, 这些谱峰分别归属于苯丙氨酸、脂质、蛋白质、酰胺Ⅰ, 说明GC患者血清中蛋白质和脂质等生物大分子明显降低, 这可能与恶性肿瘤细胞生长代谢活跃, 蛋白质、氨基酸、脂类等消耗增快相关. 此外, 我们观察到在正常组中归属于酪氨酸残基的830/cm谱峰, 在GC前病变组及GC组血清SERS光谱中均消失, 并在815/cm位移处出现特征峰, 而且谱带增宽, 此特征峰来自胶原蛋白C-C伸缩振动的贡献. 研究发现[24,25], GC患者血清中Ⅳ型胶原含量高于正常对照组以及GC前病变组, 认为Ⅳ型胶原含量与疾病进展、癌细胞浸润和转移等生物学行为有关, 可作为GC的早期诊断、病情监测以及预后评估的血清标志物. 本研究发现, 归属于胶原蛋白的815/cm谱峰在GC组中强度增大, 与前述研究结果一致. 可见, 该谱峰有可能成为早期诊断GC的特征峰.
不同分期的GC患者预后差异较大, 据研究报道, TNMⅠ、Ⅱ、Ⅲ、Ⅳ期GC患者的5年生存率分别为93.5%, 77.7%, 43.6%和8.8%[26]. GC合理的分期对于治疗方案的选择、疗效判断以及预后评估均具有重要的指导意义[27]. Ito等[28]在胃良性疾病和GC不同病理分期的血清SERS研究中发现, GC血清中归属于肽类的SERS谱峰强度明显强于胃良性疾病, 且进展期(TNM Ⅱ-Ⅳ期)强于早期GC(TNMⅠ期), 提示血清中的肿瘤相关肽含量随着癌症的进展而逐渐增加. 本研究结果显示, GC TNMⅠ-Ⅱ期和Ⅲ-Ⅳ期患者血清SERS光谱存在差异, 在Ⅲ-Ⅳ期血清SERS光谱中, 1133、1446、1589/cm三处谱峰强度明显增高, 表明D-甘露糖、蛋白质、磷脂及核酸等的含量明显多于Ⅰ-Ⅱ期血清, 提示肿瘤的晚期阶段机体处于增殖活跃状态. 在1004/cm谱峰处, Ⅰ-Ⅱ期血清SERS谱峰强度明显强于Ⅲ-Ⅳ期, 反映了该谱峰所对应的生物分子苯丙氨酸随着GC的进展, 含量逐渐减少, 并且在血清SERS光谱上得到了很好的体现, 因此, 1004/cm谱峰可以作为鉴别诊断GCⅠ-Ⅱ期和Ⅲ-Ⅳ期的依据. 由于SERS光谱数据庞大, 通过PCA法可以对多维数据进行降维, 提取用于诊断的有效信息, 并进一步运用LDA分析法, 对不同类型的血清SERS进行判别诊断. 本文对血清SERS光谱构建的PCA-LDA诊断模型, 对于鉴别正常人、GC前病变、GC患者, 以及在不同GC的分期中均得到了较高的灵敏度、特异性和准确率.
本研究利用银溶胶为增强基底, 通过InVia+Plus型激光共焦显微拉曼光谱系统, 检测了GC患者、癌前病变正常人的血清. 研究表明, SERS技术结合PCA-LDA统计分析方法可有效地鉴别正常人、GC前病变以及GC患者的血清标本; 运用SERS技术对不同分期GC血清进行检测, 结合PCA-LDA可以快速、简便地区分出不同分期GC, 该方法具有可行性, 值得进一步研究. 然而, 由于本实验的研究病例数较少, 肿瘤分层尚不精细, 因此存在一定的局限性. 下一步, 我们将扩大样本规模, 对GC患者进行疾病严重程度、甚至不同病理类型的分层研究, 建立GC的SERS光谱数据库, 为SERS技术在疾病的临床应用中提供依据和标准. 总之, 随着对SERS技术的深入研究, 其有望成为临床疾病诊断、决策指导以及预后评估的新方法.
胃癌(gastric cancer, GC)是常见的消化道恶性肿瘤, 其严重威胁着人类的生命健康, 肿瘤分期是GC预后的重要影响因素, 早期发现是GC诊治的关键. 早期GC较隐匿, 现有的检查手段难以对GC做出快速的早期诊断, 且对于肿瘤的分期需依赖术后病理学检查, 方法复杂. 表面增强拉曼光谱技术(surface-enhanced Raman spectroscopy, SERS)是一种物质成分的分析手段, 可以在分子水平揭示疾病发展的物质变化规律, SERS对于细胞、组织、体液等生物样本具有超高的检测灵敏度, 目前已广泛应用于生物医学和疾病诊断领域, 本研究利用SERS技术分析比较了GC血清、癌前病变血清、健康人血清的SERS光谱的差异, 目的在于建立一种无损、客观、准确性高的GC早期诊断和肿瘤分期的方法.
目前国内外对于GC的SERS研究多数集中在GC与正常人的鉴别诊断, 对于GC前病变以及GC分期的研究甚少, 本研究利用SERS技术对GC患者、GC前病变患者和健康志愿者进行鉴别诊断, 并探讨SERS技术在GC分期中的作用. 本研究的关键问题在于制备稳定的增强基底, 建立GC、GC前病变及健康人血清的SERS光谱数据, 同时, 分析不同分期GC的SERS光谱之间的差异, 观察疾病进展过程中, 生物分子含量或结构的变化引起的光谱改变, 从而为拓宽SERS技术在GC的诊断和分期中的应用提供理论依据.
本研究旨在验证一种GC无损诊断的新方法, 通过对比分析不同病例血清的SERS光谱特征, 以寻找能够反映GC早期无创诊断的参考指标, 为GC的早期诊断和快速鉴别肿瘤分期提供科学依据. 本研究结果发现GC、癌前病变患者和正常人血清的SERS光谱存在差异, 而且不同分期的GC血清之间的SERS光谱也有差别, GC血清有强度特异的SERS谱峰, 从而证明SERS技术对于GC的早期诊断和肿瘤分期的鉴别具有可行性, 为SERS技术在消化道肿瘤方面的深入研究奠定了实验基础.
本研究利用银溶胶为增强基底, 通过InVia+Plus型激光共焦显微拉曼光谱系统, 检测了63例GC患者, 45例GC前病变患者, 50例健康人的血清, 获得不同病例血清SERS光谱的数据, 分析不同光谱的特征, 采用单因素方差分析、独立样本t检验、主成分分析、线性判别分析等统计分析方法对光谱数据进行统计学处理, 利用受试样品工作特征曲线评价诊断效能. 本研究创新性地研究了GC TNMⅠ-Ⅱ期和Ⅲ-Ⅳ期的SERS光谱的差异, 评估了SERS技术用于鉴别GC不同分期的可行性. 拉曼光谱数据是一组复杂的多维变量, 在统计分析过程中采用了主成分分析(principal component analysis, PCA)和线性判别分析(linear discriminant analysis, LDA); PCA是一种数学中的降维思想, 从多维变量系统中提取出少数具有代表性的综合变量, 从而最大限度地反映原有数据特征的统计方法. LDA是一种基于特征选择的算法提取判别特征, 利用已知信息对未知的信息进行鉴别、分类的统计方法, 建立PCA-LDA诊断模型对多组样本进行判别分类.
本研究结果发现GC、GC前病变、正常组血清的平均SERS光谱存在差异, 在725、1099、1133、1589/cm位移处, GC组血清SERS强度高于正常组; 在1004、1328、1446、1657/cm位移处, GC前病变组和GC组血清SERS强度均弱于正常组. 相比正常组和癌前病变组, GC患者血清在815/cm处有特征峰. 在1133、1446、1589/cm位移处, GC TNM Ⅲ-Ⅳ期患者血清SERS强度明显强于Ⅰ-Ⅱ期; 在1004、1446、1657/cm位移处, Ⅰ-Ⅱ期血清SERS谱峰强度则明显强于Ⅲ-Ⅳ期Ⅲ-Ⅳ期血清SERS谱峰强度明显弱于Ⅰ-Ⅱ期. 利用PCA-LDA统计方法得到SERS技术诊断GC的灵敏度、特异性和准确率分别为96.8%(61/63), 78%(39/50)和88.5%(100/113); ROC曲线下面积分别为0.927; SERS技术区分GC TNMⅠ-Ⅱ期和Ⅲ-Ⅳ期的灵敏度、特异性和准确率分别为97.5%(39/40), 73.9%(17/23)和88.9%(56/63); ROC曲线下面积为0.857. 本研究结果表明基于表面增强拉曼光谱技术对GC、GC前病变及健康人的血清进行检测和分析, 可有效鉴别GC、GC前病变及健康志愿者人, 并且能够对不同分期的GC做出有效区分, 有望成为GC的早期诊断、临床决策指导以及预后评估的新方法.
本研究证实了GC与癌前病变、健康人血清的SERS光谱存在差异, SERS技术可以在分子水平上对GC做出早期诊断, 并且对于同肿瘤分期的鉴别具有一定价值. 随着SERS技术的发展和推广, 其有望成为临床中GC或其他恶性肿瘤的筛查以及临床决策指导、预后评估的方法.
本研究虽然通过SERS结合多元统计分析法能很好地鉴别GC和癌前病变、正常人血清, 但由于血清成分复杂, 且拉曼峰多数为多种物质的拉曼信号叠加而成, 因此对特征峰对应的生物分子定性及定量仍需进一步研究. 本研究中血清样品量较少, 虽然研究取得初步可喜的结果, 但不能完全排除随机样本可能存在的结果偏倚. 本研究未将其他消化道癌症或其他系统癌症患者血清纳入对比研究, 因此结果存在一定的局限性今后需开展其他肿瘤的血清拉曼光谱对比研究. 下一步, 我们将扩大样本规模, 对GC的肿瘤分期进行更精细的分层, 如根据肿瘤浸润深度(T)、淋巴结转移(N)、远处转移(M)等细化分组, 寻找不同肿瘤不同分期在SERS光谱中的规律, 建立GC的SERS光谱数据库. 同时采集相应的活体组织进行SERS检测, 对比不同生物样本(血清、胃组织等)SERS光谱的异同. 此外, 可进一步针对不同病理类型的GC进行研究, 探讨SERS在GC病理分类中的诊断价值. 对特征峰所对应的生物大分子进行定量分析, 进一步提高研究的准确性. 在本研究的基础上, 对消化系统其他恶性肿瘤的血清进行SERS研究, 分析对比SERS光谱诊断GC以及其他肿瘤的特异性. 完善实验设计, 细化分组, 从不同肿瘤以及不同生物样本着手, 改进检测设备和系统, 制备稳定性能更高的增强基底, 优化统计模型.
学科分类: 胃肠病学和肝病学
手稿来源地: 广东省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:张砚梁
| 2. | Kneipp J, Kneipp H, Kneipp K. SERS--a single-molecule and nanoscale tool for bioanalytics. Chem Soc Rev. 2008;37:1052-1060. [PubMed] [DOI] |
| 3. | Fleischmann M, Hendra PJ, Mcquillan AJ. Raman spectra of pyridine adsorbed at a silver electrode. Chem Phys Lett. 1974;26:163-166. [DOI] |
| 4. | Jenkins CA, Lewis PD, Dunstan PR, Harris DA. Role of Raman spectroscopy and surface enhanced Raman spectroscopy in colorectal cancer. World J Gastrointest Oncol. 2016;8:427-438. [PubMed] [DOI] |
| 5. | Huang X, O'Connor R, Kwizera EA. Gold Nanoparticle Based Platforms for Circulating Cancer Marker Detection. Nanotheranostics. 2017;1:80-102. [PubMed] [DOI] |
| 6. | Chen N, Rong M, Shao X, Zhang H, Liu S, Dong B, Xue W, Wang T, Li T, Pan J. Surface-enhanced Raman spectroscopy of serum accurately detects prostate cancer in patients with prostate-specific antigen levels of 4-10 ng/mL. Int J Nanomedicine. 2017;12:5399-5407. [PubMed] [DOI] |
| 7. | Vargas-Obieta E, Martínez-Espinosa JC, Martínez-Zerega BE, Jave-Suárez LF, Aguilar-Lemarroy A, González-Solís JL. Breast cancer detection based on serum sample surface enhanced Raman spectroscopy. Lasers Med Sci. 2016;31:1317-1324. [PubMed] [DOI] |
| 8. | Li P, Chen C, Deng X, Mao H, Jin S. Drop coating deposition Raman spectroscopy of blood plasma for the detection of colorectal cancer. J Biomed Opt. 2015;20:037004. [PubMed] [DOI] |
| 9. | Mert S, Özbek E, Ötünçtemur A, Çulha M. Kidney tumor staging using surface-enhanced Raman scattering. J Biomed Opt. 2015;20:047002. [PubMed] [DOI] |
| 10. | Feng S, Chen R, Lin J, Pan J, Wu Y, Li Y, Chen J, Zeng H. Gastric cancer detection based on blood plasma surface-enhanced Raman spectroscopy excited by polarized laser light. Biosens Bioelectron. 2011;26:3167-3174. [PubMed] [DOI] |
| 11. | Feng S, Pan J, Wu Y, Lin D, Chen Y, Xi G, Lin J, Chen R. Study on gastric cancer blood plasma based on surface-enhanced Raman spectroscopy combined with multivariate analysis. Sci China Life Sci. 2011;54:828-834. [PubMed] [DOI] |
| 12. | Wei Y, Zhu Y, Wang M. Surface-enhanced Raman spectroscopy of gastric cancer serum with gold nanoparticles/silicon nanowire arrays. Optik. 2016;127:7902-7907. |
| 13. | Lee PC, Meisel D. Adsorption and surface-enhanced Raman of dyes on silver and gold sols. J Phy Chem. 1982;86:3391-3395. |
| 14. | Leonbejarano M, Dorantesmendez G, Ramirezelias M, Mendez MO, Alba A, Rodriguezleyva I. Fluorescence background removal method for biological raman spectroscopy based on empirical mode decomposition. Conf Proc IEEE Eng Med Biol Soc. 2016;3610-3613. [PubMed] [DOI] |
| 15. | Li X, Yang T, Li S, Jin L, Wang D, Guan D, Ding J. Noninvasive liver diseases detection based on serum surface enhanced Raman spectroscopy and statistical analysis. Opt Express. 2015;23:18361-18372. [PubMed] [DOI] |
| 17. | Luo S, Chen C, Mao H, Jin S. Discrimination of premalignant lesions and cancer tissues from normal gastric tissues using Raman spectroscopy. J Biomed Opt. 2013;18:67004. [PubMed] [DOI] |
| 18. | Chen Y, Chen G, Zheng X, He C, Feng S, Chen Y, Lin X, Chen R, Zeng H. Discrimination of gastric cancer from normal by serum RNA based on surface-enhanced Raman spectroscopy (SERS) and multivariate analysis. Med Phys. 2012;39:5664-5668. [PubMed] [DOI] |
| 20. | Kim K, Shin DG, Park MK, Baik SH, Kim TH, Kim S, Lee S. Circulating cell-free DNA as a promising biomarker in patients with gastric cancer: diagnostic validity and significant reduction of cfDNA after surgical resection. Ann Surg Treat Res. 2014;86:136-142. [PubMed] [DOI] |
| 21. | Feng S, Wang W, Tai IT, Chen G, Chen R, Zeng H. Label-free surface-enhanced Raman spectroscopy for detection of colorectal cancer and precursor lesions using blood plasma. Biomed Opt Express. 2015;6:3494-3502. [PubMed] [DOI] |
| 22. | Lin D, Pan J, Huang H, Chen G, Qiu S, Shi H, Chen W, Yu Y, Feng S, Chen R. Label-free blood plasma test based on surface-enhanced Raman scattering for tumor stages detection in nasopharyngeal cancer. Sci Rep. 2014;4:4751. [PubMed] [DOI] |
| 23. | Shao L, Zhang A, Rong Z, Wang C, Jia X, Zhang K, Xiao R, Wang S. Fast and non-invasive serum detection technology based on surface-enhanced Raman spectroscopy and multivariate statistical analysis for liver disease. Nanomedicine. 2018;14:451-459. [PubMed] [DOI] |
| 25. | Ruan HL, Hong RT, Xie HJ, Hu NZ, Xu JM, Zhang W. Significance of elevated levels of collagen type IV and hyaluronic acid in gastric juice and serum in gastric cancer and precancerous lesion. Dig Dis Sci. 2011;56:2001-2008. [PubMed] [DOI] |
| 26. | Kim SG, Seo HS, Lee HH, Song KY, Park CH. Comparison of the Differences in Survival Rates between the 7th and 8th Editions of the AJCC TNM Staging System for Gastric Adenocarcinoma: a Single-Institution Study of 5,507 Patients in Korea. J Gastric Cancer. 2017;17:212-219. [PubMed] [DOI] |
| 28. | Ito H, Inoue H, Hasegawa K, Hasegawa Y, Shimizu T, Kimura S, Onimaru M, Ikeda H, Kudo SE. Use of surface-enhanced Raman scattering for detection of cancer-related serum-constituents in gastrointestinal cancer patients. Nanomedicine. 2014;10:599-608. [PubMed] [DOI] |