修回日期: 2018-05-27
接受日期: 2018-06-02
在线出版日期: 2018-06-18
探讨基质金属蛋白酶-9(matrix metalloproteinases-9, MMP9)、富含半胱氨酸的酸性分泌蛋白(secreted protein acidic and rich in cysteine, SPARC)在原发性肝癌病情和预后评估中的价值.
选取2012-04/2014-04在宁海县中医医院进行手术的54例原发性肝癌患者作为研究组, 其中25例癌旁肝组织作为对照组, 利用免疫组织化学染色法检测两组研究对象中MMP9、SPARC的表达, 分析原发性肝癌组织和癌旁肝组织中MMP9、SPARC表达的差异, 并分析其表达与临床病理特征和预后的关系.
MMP9、SPARC在肝癌组织中表达的强阳性率和评分均显著高于癌旁肝组织(P<0.05). MMP9的表达在原发性肝癌组织不同T分期、N分期、AJCC分期和分化程度的表达中具有统计学差异(P<0.05). SPARC的表达在原发性肝癌组织不同T分期、N分期、AJCC分期和肿瘤分化程度的表达中具有统计学差异(P<0.05). 单因素分析结果显示, MMP9、SPARC强阳性表达及T分期、N分期、AJCC分期均是影响肝癌患者总生存期(overall survival, OS)和无病生存期(disease-free survival, DFS)的独立预后因素(P<0.05). 多因素分析结果显示, MMP9、SPARC强阳性表达是肝癌患者OS和DFS的预后因素(P<0.05).
MMP9、SPARC在肝癌组织中表达明显较高, 且在不同T分期、N分期、AJCC分期和肿瘤分化程度的肝癌组织中具有差异. MMP9、SPARC强阳性表达是影响肝癌患者OS和DFS的预后因素, 可能为肝癌严重程度和预后评估提供帮助.
核心提要: 原发性肝癌是全球高发的恶性肿瘤, 然而, 目前缺乏敏感的病情严重程度和预后判断指标. 本研究旨在探索基质金属蛋白酶-9、富含半胱氨酸的酸性分泌蛋白在原发性肝癌病情严重程度和预后判断中的作用, 为肝癌患者病情和预后评估提供帮助.
引文著录: 杨建村. 基质金属蛋白酶-9、富含半胱氨酸的酸性分泌蛋白检测在原发性肝癌严重程度和预后评估中的价值分析. 世界华人消化杂志 2018; 26(17): 1036-1043
Revised: May 27, 2018
Accepted: June 2, 2018
Published online: June 18, 2018
To analyze the value of matrix metalloproteinase-9 (MMP9) and secreted protein acidic and rich in cysteine (SPARC) in evaluating disease condition and prognosis of primary liver cancer.
Fifty-four patients with primary liver cancer who underwent surgery at Ninghai Traditional Chinese Medicine Hospital from April 2012 to April 2014 were selected as a study group, and 25 tumor adjacent liver tissues were selected as a control group. The expression of MMP9 and SPARC in liver cancer and tumor adjacent liver tissues was detected by immunohistochemical staining. The difference in MMP9 and SPARC expression between primary liver cancer tissues and tumor adjacent liver tissues was analyzed, and the relationship between MMP9 and SPARC expression and clinicopathologic features and prognosis was also explored.
The strong positive rates and scores of MMP9 and SPARC expression in liver cancer tissues were significantly higher than those in tumor adjacent liver tissues (P < 0.05). MMP9 and SPARC expression was significantly correlated with T stage, N stage, AJCC stage, and tumor differentiation in liver cancer tissues (P < 0.05). Univariate analysis showed that strong MMP9 and SPARC expression, T stage, N stage, and AJCC stage were independent risk factors for overall survival (OS) and disease-free survival (DFS) in patients with liver cancer (P < 0.05). Multifactor analysis showed that strong MMP9 and SPARC expression were risk factors for OS and DFS in patients with liver cancer (P < 0.05).
The expression of MMP9 and SPARC in primary liver cancer tissues is significantly high, and is significantly correlated with T stage, N stage, AJCC stage, and tumor differentiation. Strong MMP9 and SPARC expression are risk factors for OS and DFS in liver cancer, which may provide help for the evaluation of disease condition and prognosis of primary liver cancer.
- Citation: Yang JC. Value of matrix metalloproteinase-9 and secreted protein acidic and rich in cysteine in evaluation of severity and prognosis of primary liver cancer. Shijie Huaren Xiaohua Zazhi 2018; 26(17): 1036-1043
- URL: https://www.wjgnet.com/1009-3079/full/v26/i17/1036.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i17.1036
原发性肝癌是全球范围内消化系统高发的恶性肿瘤, 是男性第五常见的恶性肿瘤、女性第九常见的恶性肿瘤, 全球每年约有50万-100万例新发肝癌[1]. 在我国, 肝癌发病率位居第四位, 死亡率位居第三位[2], 严重威胁着人们的健康. 肝癌患者首选肝切除或肝移植治疗, 然而, 大部分肝癌患者就诊时已属晚期, 仅有9%-27%的患者可进行手术治疗, 肝源的缺乏也极大的限制了肝移植的可行性[3,4]. 肿瘤的生长、浸润、转移是患者死亡的重要原因[5-7]. 基质金属蛋白酶-9(matrix metalloproteinases-9, MMP9)是一种重要的基质金属蛋白酶, 可以降解细胞外基质和基质膜成分[8,9]. 富含半胱氨酸的酸性分泌蛋白(secreted protein acidic and rich in cysteine, SPARC)是一种钙结合糖蛋白, 属于基质细胞蛋白家族, 在肿瘤细胞中能够抑制细胞粘附、促进肿瘤细胞增殖、侵袭和转移等[10-12]. 建立肝癌复发预测模型, 有利于为肝癌患者病情和预后评估提供帮助, 并为术后辅助治疗提供决策基础. 本研究将探索MMP9和SPARC在原发性肝癌病情和预后评估中的价值, 并为术后辅助治疗提供理论帮助. 现报道如下.
在2012-04/2014-04, 收集于宁海县中医医院普外科进行肝癌切除术的54例原发性肝癌患者术后组织标本作为研究组, 其中25例癌旁肝组织(均距离肿瘤边缘大于2 cm的组织)标本作为对照组. 所有组织病理类型均经两位具有10年以上工作经历的病理科专家确诊. 原发性肝癌患者中肝细胞癌24例, 胆管细胞癌24例, 混合型肝细胞-胆管细胞癌6例. 其中研究组男36例, 女18例, 年龄42-74岁, 平均年龄61.54岁±10.69岁. 对照组男17例, 女8例, 年龄40-72岁, 平均年龄60.83岁±10.21岁. 两组一般资料匹配良好(P>0.05), 具有可比性.
纳入和排除标准. 纳入标准: (1)肿瘤的原发部位为肝脏且均为R0切除; (2)正常肝组织经病理切片证实; (3)临床病理信息和随访信息完整; (4)术前未接受过放疗、化疗、射频消融治疗等其他治疗方式. 排除标准: (1)非原发性肝癌; (2)失访者.
利用免疫组织化学染色(immohistochemistry, IHC)检测MMP9和SPARC在原发性肝癌组织中的表达: (1)切片首先置于60 ℃烘箱2 h脱蜡; (2)脱蜡和水化: 将组织芯片依次经二甲苯、二甲苯、100%乙醇、100%乙醇、95%乙醇、85%乙醇、75%乙醇分别15 min、15 min、7 min、7 min、5 min、5 min、5 min 进行脱蜡和水化, 然后置于蒸馏水中浸泡5 min; (3)抗原修复: 将1L柠檬酸钠缓冲液(pH6.0)置于不锈钢高压锅中加热煮沸; 将切片转移到切片架上, 浸泡于煮沸的柠檬酸钠缓冲液中4 min; 随后打开高压锅锅盖, 冷却至室温. (4)使用PBS 在摇床上洗涤3次, 每次5 min; (5)封闭: 采用3%过氧化氢溶液在室温、避光的条件下封闭组织芯片10 min; 然后用PBS在摇床上洗涤3次, 每次5 min; (6)一抗孵育: 按一定比例稀释抗体, 滴加足量的抗MMP9(1:1000, Abcam, 美国)、抗SPARC(1:1000, Abcam, 美国)抗体于切片上, 置于湿盒中4 ℃孵育过夜; (7)取出湿盒, 复温30 min, 然后用PBS 在摇床上洗涤3 次, 每次5 min; (8)二抗孵育: 配制抗兔的二抗, 滴加足量的于切片上, 室温下孵育1 h. 然后用PBS 在摇床上洗涤3 次, 每次5 min; (9)DAB显色: 滴加DAB溶液于组织芯片上, 镜下观察染色程度, 采用蒸馏水终止染色; (10)苏木素复染5 min, 蒸馏水冲洗5 min; (11)盐酸乙醇分化3 s, 流水返蓝20 min; (12)脱水、封片: 将组织芯片依次经75%乙醇、95%乙醇、100%乙醇、二甲苯、二甲苯分别5 min、5 min、5 min、15 min、15 min 进行脱水; 风干后用中性树胶封片, 然后置于显微镜下观察.
IHC染色结果由两位具有10 年以上工作经历的病理科专家进行判定, 依据染色强度以及染色范围进行评分. 染色强度评分标准: 无染色为0分, 淡黄色为1分, 棕黄色为2分, 棕褐色为3分. 染色范围评分标准: 0%-10%, 0分; 10%-25%, 1分; 26%-50%, 2分; 51%-75%, 3分; 76%-100%, 4分. 最终得分为染色强度和染色范围得分的乘积, 0-3分为阴性, 4-6分为弱阳性, 8-12分为强阳性.
比较MMP9、SPARC在肝癌组织和癌旁肝组织中的表达, 分析MMP9、SPARC的表达与肝癌患者临床病理特征的关系, 分析MMP9、SPARC的表达对肝癌患者总生存期(overall survival, OS)和无病生存期(disease-free survival, DFS)的影响.
统计学处理 使用SPSS20.0统计软件对本研究数据进行分析, 计量资料表示方法为mean±SD, 采用t检验; 计数资料以百分率表示, 采用χ2检验. 采用Kaplan-Meier法和COX回归分析进行生存分析, Log-rank检验两者差异性. 当P<0.05时差异有统计学意义.
MMP9、SPARC在肝癌组织中强阳性表达率为55.56%、57.41%, 均显著高于癌旁肝组织中强阳性表达率, 差异有统计学意义, P<0.05. MMP9、SPARC在肝癌组织中表达的评分均显著高于癌旁肝组织中表达的评分, 差异有统计学意义, P<0.05(表1).
| 组织 | n | MMP9 | SPARC | ||
| 强阳性 | 评分 (mean±SD) | 强阳性 | 评分 (mean±SD) | ||
| 肝癌 | 54 | 30 (55.56) | 7.74 ± 3.79 | 31 (57.41) | 7.35 ± 3.37 |
| 癌旁 | 25 | 5 (20.00) | 3.02 ± 2.54 | 4 (16.00) | 2.92 ± 2.24 |
| t/χ2 | 8.76 | 6.52 | 11.87 | 6.91 | |
| P | 0.003 | <0.001 | 0.0006 | <0.001 | |
MMP9的表达在不同T分期、N分期、AJCC分期和分化程度的肝癌组织中具有统计学差异, P<0.05. SPARC的表达在不同T分期、N分期、AJCC分期和肿瘤分化程度的肝癌组织中具有统计学差异, P<0.05(表2和表3).
| 参数 | n | MMP9表达 | χ2 | P | ||
| 阴性 | 弱阳性 | 强阳性 | ||||
| 年龄 | ||||||
| <65 | 24 | 3 | 7 | 14 | 0.73 | 0.63 |
| ≥65 | 30 | 6 | 7 | 17 | ||
| 性别 | ||||||
| 男 | 38 | 5 | 7 | 26 | 2.859 | 0.239 |
| 女 | 16 | 4 | 5 | 7 | ||
| T分期 | ||||||
| T2+T3 | 26 | 5 | 10 | 11 | 9.597 | 0.008 |
| T4 | 28 | 4 | 2 | 22 | ||
| N分期 | ||||||
| N0 | 23 | 1 | 12 | 10 | 12.460 | 0.002 |
| N1 | 31 | 4 | 3 | 24 | ||
| AJCC分期 | ||||||
| Ⅰ+Ⅱ | 17 | 4 | 6 | 7 | 6.61 | 0.037 |
| Ⅲ+Ⅳ | 37 | 5 | 4 | 28 | ||
| 分化 | ||||||
| 高分化 | 3 | 3 | 0 | 0 | 9.356 | 0.003 |
| 中低分化 | 51 | 6 | 13 | 32 | ||
| 肿瘤大小 | ||||||
| ≤3 cm | 23 | 4 | 2 | 17 | 4.774 | 0.092 |
| >3 cm | 31 | 5 | 10 | 16 | ||
| 参数 | n | SPARC表达 | χ2 | P | ||
| 阴性 | 弱阳性 | 强阳性 | ||||
| 年龄 | 5.78 | 0.055 | ||||
| <65 | 24 | 3 | 3 | 18 | ||
| ≥65 | 30 | 6 | 11 | 13 | ||
| 性别 | 0.071 | 0.965 | ||||
| 男 | 38 | 6 | 10 | 22 | ||
| 女 | 16 | 3 | 4 | 9 | ||
| T分期 | 10.400 | 0.006 | ||||
| T2+T3 | 26 | 8 | 8 | 10 | ||
| T4 | 28 | 1 | 6 | 21 | ||
| N分期 | 10.157 | 0.006 | ||||
| N0 | 23 | 8 | 5 | 10 | ||
| N1 | 31 | 1 | 9 | 21 | ||
| AJCC分期 | 10.015 | 0.004 | ||||
| Ⅰ+Ⅱ | 17 | 8 | 3 | 6 | ||
| Ⅲ+Ⅳ | 37 | 3 | 9 | 25 | ||
| 分化 | 13.248 | 0.001 | ||||
| 高分化 | 22 | 7 | 9 | 6 | ||
| 中低分化 | 32 | 2 | 6 | 24 | ||
| 肿瘤大小 | 0.279 | 0.870 | ||||
| ≤3 cm | 23 | 5 | 5 | 13 | ||
| >3 cm | 31 | 5 | 7 | 19 | ||
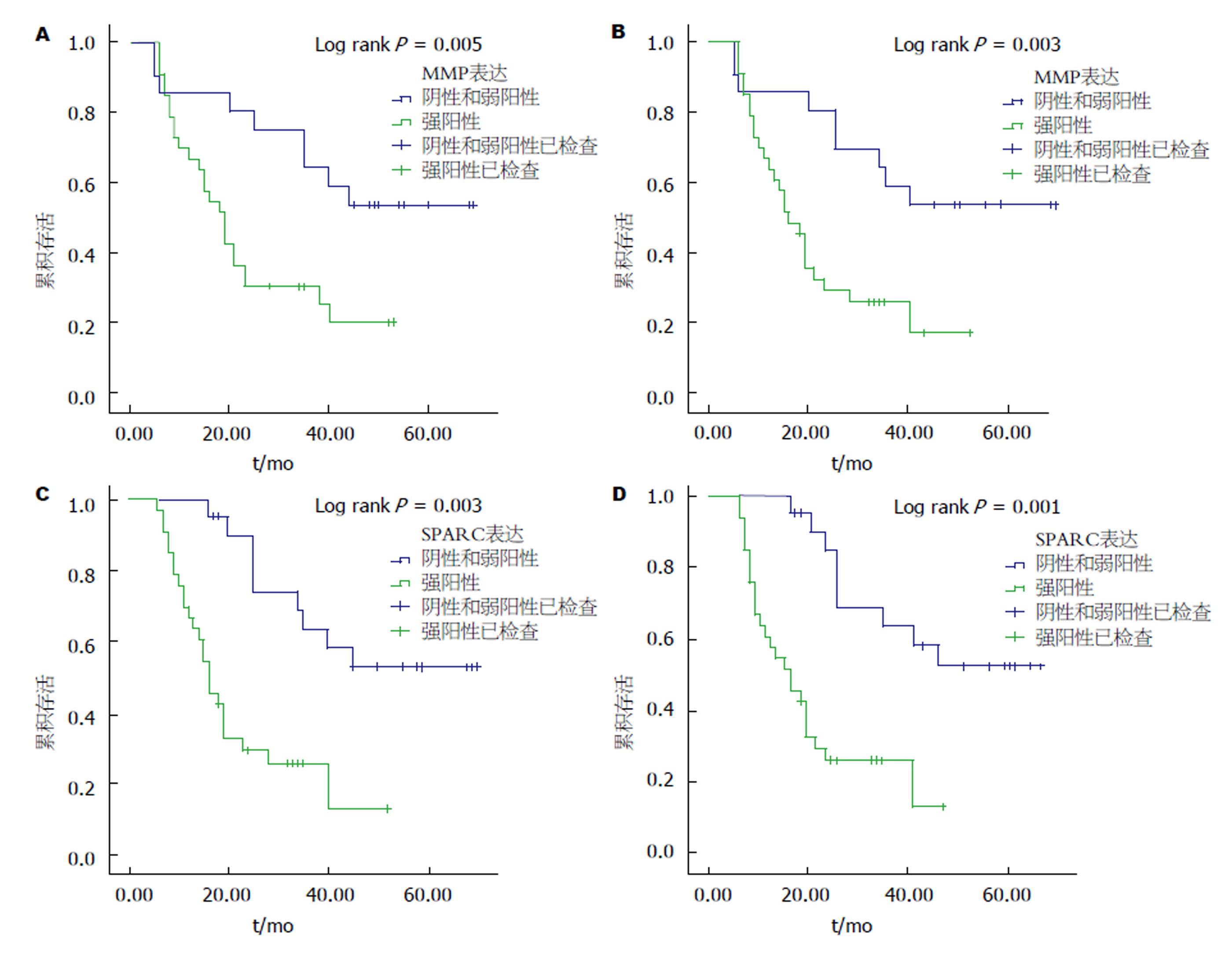
单因素分析结果显示, MMP9、SPARC表达强阳性及高T分期、N分期、AJCC分期均是影响肝癌患者OS和DFS的独立预后因素, P<0.05. 多因素分析结果显示, MMP9、SPARC表达强阳性是影响肝癌患者OS和DFS的预后因素, P<0.05. 如图1、表4所示.
| 参数 | n | OS | DFS | ||||||
| 单因素分析 | 多因素分析 | 单因素分析 | 多因素分析 | ||||||
| χ2 | P | HR (95%CI) | P | χ2 | P | HR (95%CI) | P | ||
| 年龄 | 1.899 | 0.168 | 1.130 | 0.288 | |||||
| <65 | 24 | ||||||||
| ≥65 | 30 | ||||||||
| 性别 | 0.039 | 0.844 | 0.000 | 0.984 | |||||
| 男 | 38 | ||||||||
| 女 | 16 | ||||||||
| T分期 | 10.011 | 0.002 | 1.943 (0.709-5.327) | 0.197 | 9.298 | 0.002 | 1.609 (0.633-4.089) | 0.318 | |
| T2+T3 | 26 | ||||||||
| T4 | 28 | ||||||||
| N分期 | 7.655 | 0.006 | 1.176 (0.462-2.998) | 0.734 | 8.500 | 0.004 | 1.088 (0.434-2.727) | 0.857 | |
| N0 | 23 | ||||||||
| N1 | 31 | ||||||||
| AJCC分期 | 9.714 | 0.002 | 1.658 (0.382-7.196) | 0.500 | 11.367 | 0.001 | 1.976 (0.491-7.945) | 0.338 | |
| Ⅰ+Ⅱ | 17 | ||||||||
| Ⅲ+Ⅳ | 37 | ||||||||
| 分化 | 0.360 | 0.548 | 0.409 | 0.522 | |||||
| 高分化 | 3 | ||||||||
| 中低分化 | 51 | ||||||||
| 肿瘤大小 | 3.337 | 0.068 | 1.032 | 0.310 | |||||
| ≤3 cm | 23 | ||||||||
| >3 cm | 31 | ||||||||
| MMP9表达 | 7.720 | 0.005 | 3.826 (0.893-4.594) | 0.041 | 8.073 | 0.003 | 4.120 (0.855-3.876) | 0.038 | |
| 阴性或弱阳性 | 21 | ||||||||
| 强阳性 | 33 | ||||||||
| SPARC表达 | 8.90 | 0.003 | 4.026 (0.893-4.594) | 0.039 | 9.70 | 0.001 | 4.820 (0.855-3.876) | 0.030 | |
| 阴性或弱阳性 | 21 | ||||||||
| 强阳性 | 33 | ||||||||
原发性肝癌是常见的消化系统恶性肿瘤之一, 发病率高, 预后差, 5年生存率仅5%左右[13,14]. 肝癌的侵袭和转移是预后差及患者死亡的主要原因. 在肿瘤的侵袭和转移过程中, 细胞外基质和基质膜的降解是关键的一步, 癌细胞突破细胞基质和基质膜, 浸润周围组织、转移入血管, 从而实现肿瘤的转移[15-18]. 目前, 有大量研究表明MMP9、SPARC与细胞外基质和基质膜的降解有关. 本研究将以MMP9、SPARC建立肝癌复发预测模型, 为肝癌患者病情和预后评估提供帮助, 并为术后辅助治疗提供决策基础.
本研究发现, MMP9在肝癌组织中表达明显较高, 强阳性率显著高于癌旁肝组织, 且MMP9表达在不同T分期、N分期、AJCC分期和肿瘤分化程度的肝癌组织中具有差异. 以上结果提示MMP9在肝癌中发挥促癌作用, 肝癌组织中表达明显较高可为肝癌的诊断提供帮助; MMP9表达在不同T分期、N分期、AJCC分期和肿瘤分化程度的肝癌组织中具有差异, 提示MMP9可能促进肿瘤侵袭、转移, 有助于病情的判断. 进一步的单因素和多因素生存分析发现, MMP9表达强阳性是影响肝癌患者OS和DFS的预后因素, 为肝癌预后的判断提供参考. 基质金属蛋白酶是一类钙离子依赖的蛋白水解酶, 能够降解细胞外基质, MMP9是其重要的组分, 能够通过多种作用在肿瘤的侵袭和转移中发挥作用, 如破坏肿瘤细胞侵袭的组织学屏障, 调节肿瘤细胞和基质的黏附, 激活血浆纤维蛋白原和层粘连蛋白-5的活性, 促进生长因子分泌等, 从而降解细胞外基质和基质膜成分, 促进肿瘤血管生成, 加速肿瘤血管生长、侵袭和转移[19-22]. 仵志远等[23]研究发现, MMP9在肝癌组织中表达明显较高, 且与肿瘤微血管形成有关, 促进肝癌侵袭和转移. 此外, 黄东等[24]研究表明, MMP9在肝癌组织中表达明显较高, 可以作为肝癌, 尤其是早期肝癌的诊断指标. 上述研究结果与本实验结果相似, 进一步证实了MMP9在肝癌进展中的作用.
本研究还发现, SPARC在肝癌组织中表达强阳性率和评分均显著高于正常肝组织, 且SPARC表达在不同T分期、N分期、AJCC分期和肿瘤分化程度的肝癌组织中具有差异. 上述结果表明SPARC在肝癌组织中表达明显较高, 可能促进肿瘤侵袭、转移, 从而为肝癌的诊断和病情判断提供帮助. 进一步的单因素和多因素生存分析发现, SPARC表达强阳性是影响肝癌患者OS和DFS的预后因素, 可能为肝癌预后的判断提供参考. SPARC是一种具有多种功能的钙结合糖蛋白, 具有以下作用: 抗粘附, 促进肿瘤细胞和瘤体分离; 改变基质成分, 促进基底膜溶解和内皮细胞移动; 刺激血管生成和细胞生长; 从而促进肿瘤细胞侵袭和转移[25-28]. 江冬莲等[29]研究发现, SPARC在结直肠癌组织中表达明显较高, 且与肿瘤分化、转移呈正相关, 提示SPARC在肿瘤的侵袭转移中发挥作用. Le等[30]研究表达, SPARC在肝癌组织中显著高表达, 与肿瘤T分期、N分期和TNM分期呈正相关, 能够促进肿瘤细胞侵袭和转移.
总之, MMP9和SPARC在肝癌组织中表达均明显较高, 且在不同T分期、N分期、AJCC分期和肿瘤分化程度的肝癌组织中具有差异, 是影响肝癌患者OS和DFS的预后因素, 可辅助建立肝癌复发预测模型, 为肝癌患者病情和预后评估提供帮助, 并为术后辅助治疗提供决策基础.
原发性肝癌在我国发病率高, 大部分患者就诊时已属于晚期, 患者预后差, 寻找原发性肝癌早期诊断、病情严重程度、预后评估的分子标志具有重大意义. 已有学者发现基质金属蛋白酶-9(matrix metalloproteinases-9, MMP9)、富含半胱氨酸的酸性分泌蛋白(secreted protein acidic and rich in cysteine, SPARC)在原发性肝癌患者中表达明显升高, 但MMP9、SPARC在原发性肝癌早期诊断、病情严重程度、预后评估中的作用尚不清楚.
本研究采用原发性肝癌和癌旁正常肝组织进行免疫组化检测MMP9、SPARC的表达, 并分析其表达与患者病情严重程度和预后的关系, 旨在为临床判断提供客观参考.
本研究通过检测发性肝癌和癌旁正常肝组织中MMP9、SPARC的表达, 并分析其表达与患者病情严重程度和预后的关系, 为临床判断提供客观参考.
本研究选取于我院进行肝癌切除术的54例原发性肝癌患者术后组织标本作为研究组, 其中25例癌旁肝组织(均距离肿瘤边缘大于2 cm的组织)标本作为对照组. 经两位具有10年以上工作经历的病理科专家确诊病理分级, 并采用免疫组化方法检测MM9、SPARC的表达, 分析其表达与患者病情严重程度和预后的关系. 本研究的独特之处在于从临床标本着手研究MM9、SPARC的表达与患者病情严重程度和预后的关系.
MMP9、SPARC强阳性表达是肝癌患者总生存期(overall survival, OS)和无病生存期(disease-free survival, DFS)的预后因素(P<0.05).
本研究检测了原发性肝癌和癌旁组织中MMP9、SPARC的表达并分析其表达与患者病情严重程度和预后的关系, 这是此前业内学者所未曾涉及到的; 通过本研究结论, 证实了MMP9、SPARC在肝癌组织中表达明显较高, 且在不同T分期、N分期、AJCC分期和肿瘤分化程度的肝癌组织中具有差异. MMP9、SPARC强阳性表达是影响肝癌患者OS和DFS的预后因素, 可能为肝癌严重程度和预后评估提供帮助.
本研究得出了MMP9、SPARC在不同T分期、N分期、AJCC分期和肿瘤分化程度的肝癌组织中具有差异, 且其强阳性表达是影响肝癌患者OS和DFS的预后因素, 可能为肝癌严重程度和预后评估提供帮助的结果, 但是该研究结果应用于临床还有一段不短的路要走, 还需要更多的临床实验进一步完善此结果.
感谢我院普外科各位老师对我的帮助, 感谢病理科2位专家对免疫组化染色评分的判定!
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D
E级 (差): E
编辑: 崔丽君 电编:张砚梁
| 1. | Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65:87-108. [PubMed] [DOI] |
| 2. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 3. | Cho YK. Comparison of seven staging systems in cirrhotic patients with hepatocellular carcinoma in a cohort of patients who underwent radiofrequency ablation with complete response. Am J Gastroenterol. 2008;103:1835-6; author reply 1836-7. [PubMed] [DOI] |
| 4. | Kim YS, Rhim H, Cho OK, Koh BH, Kim Y. Intrahepatic recurrence after percutaneous radiofrequency ablation of hepatocellular carcinoma: analysis of the pattern and risk factors. Eur J Radiol. 2006;59:432-441. [PubMed] [DOI] |
| 7. | 刘 毅, 王 进, 陈 雨信, 徐 克森, 李 海林. 基质金属蛋白酶-9在小鼠肝脏部分缺血再灌注并肝细胞癌门静脉转移模型中的表达及临床意义. 中华肝胆外科杂志. 2014;20:810-815. [DOI] |
| 10. | 韩 玮, 徐 旋旋, 何 大伟, 曹 方, 丁 厚中. SPARCL1基因对肝癌 SMMC-7721细胞增殖与凋亡的影响. 江苏大学学报(医学版). 2016;4. [DOI] |
| 13. | Maluccio M, Covey A. Recent progress in understanding, diagnosing, and treating hepatocellular carcinoma. CA Cancer J Clin. 2012;62:394-399. [PubMed] [DOI] |
| 14. | Yang JD, Roberts LR. Hepatocellular carcinoma: A global view. Nat Rev Gastroenterol Hepatol. 2010;7:448-458. [PubMed] [DOI] |
| 17. | 曹 宽, 鲍 仲明, 周 新宇, 贾 广宇, 张 斌, 温 泉, 王 人颢. 乙型肝炎病毒X蛋白对肝癌细胞侵袭与迁移能力的作用及机制. 中华消化外科杂志. 2017;16:177-182. [DOI] |
| 18. | 李 聪, 邢 秀亚, 张 巍, 李 京华, 王 璇, 张 洪海, 杨 耿侠, 生 守鹏, 孙 玉. 肝癌中星形细胞上调基因1作用于microRNA-885-5p/基质金属蛋白酶9信号通路促进肝癌转移的机制研究. 中华消化外科杂志. 2016;15:161-167. [DOI] |