修回日期: 2018-05-02
接受日期: 2018-05-09
在线出版日期: 2018-06-08
探讨端粒酶逆转录酶(telomerase reverse transcriptase, TERT)mRNA在胃癌及癌前病变组织中的表达情况, 及胃癌组织中TERT表达与临床病理特征和预后的相关性.
收集2011-09/2016-10期间在佳木斯大学附属第一医院治疗的胃癌患者102例、癌前病变患者32例、慢性非萎缩性胃炎30例, 实时定量PCR检测组织中TERT mRNA的表达, 并分析胃癌组织中TERT表达与临床病理特征和预后的相关性.
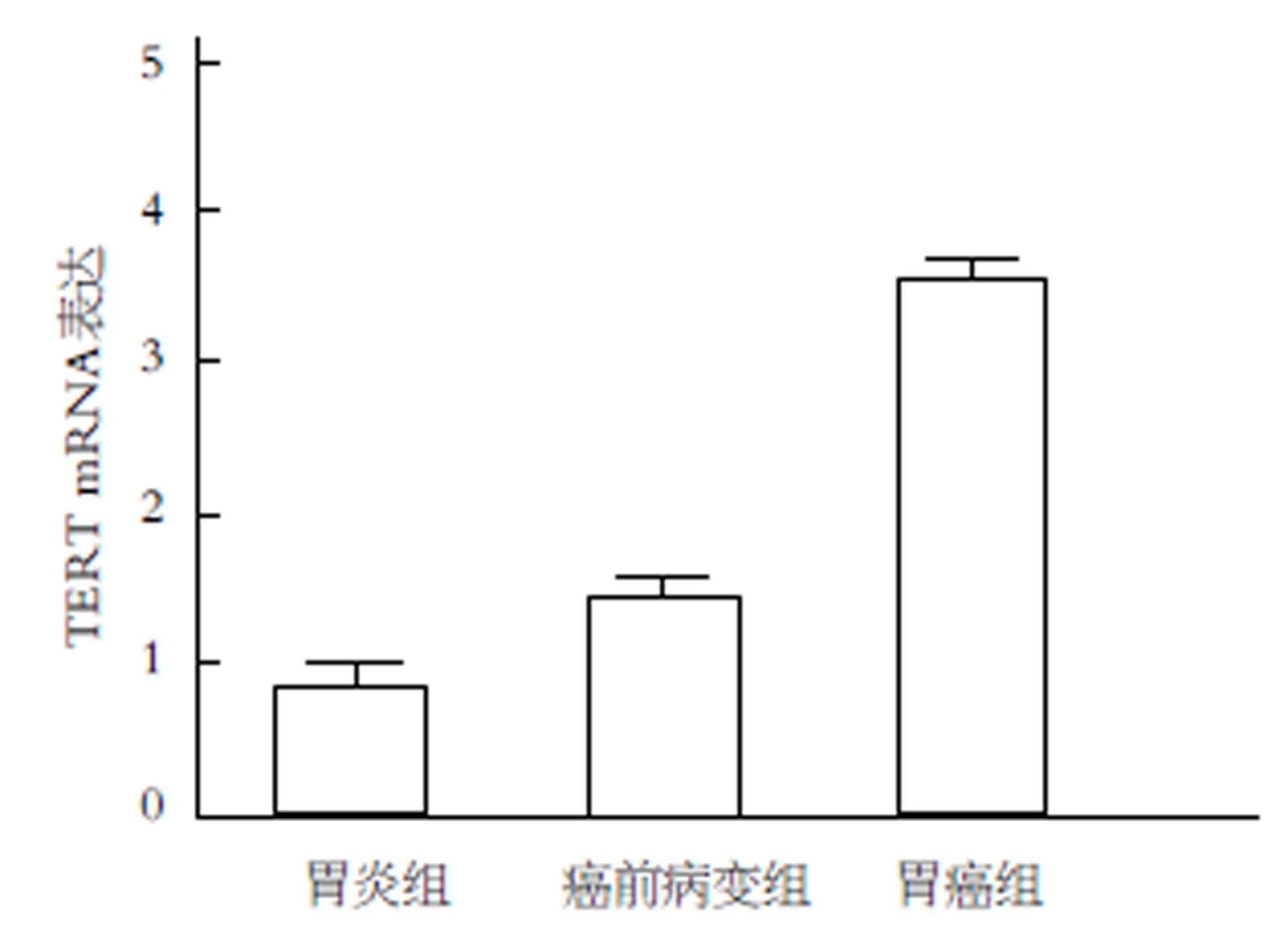
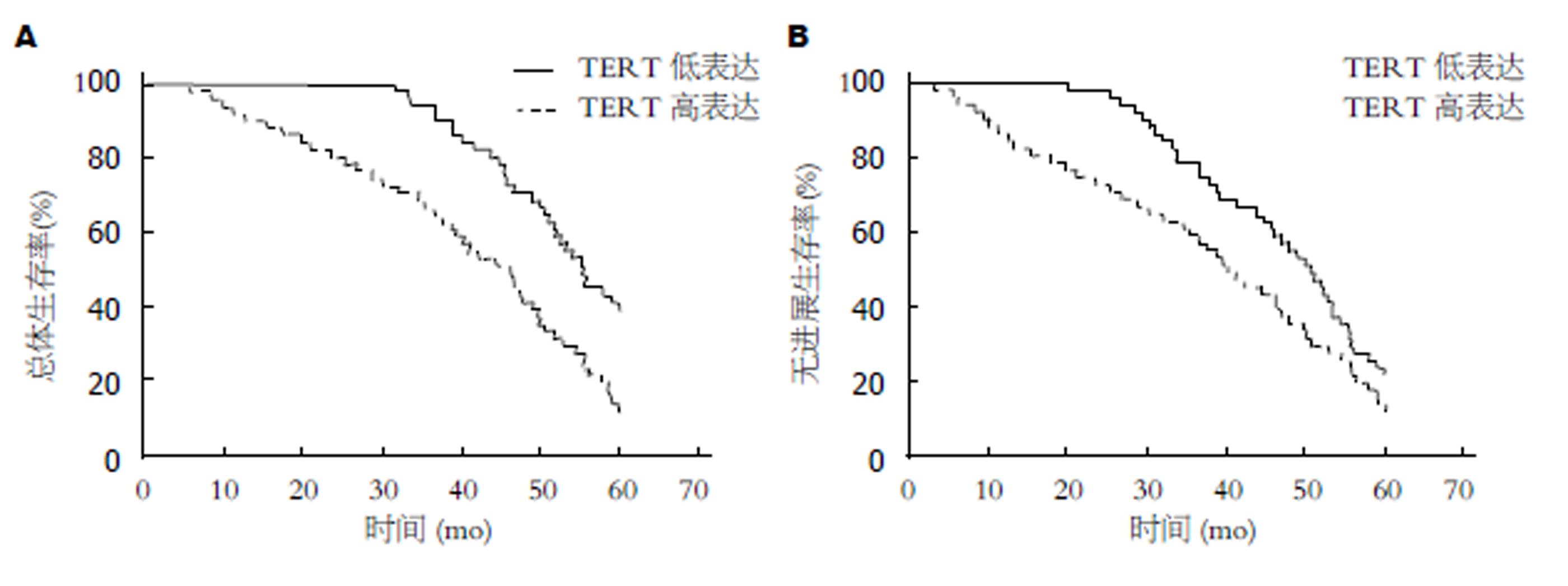
胃癌和癌前病变组织中TERT表达明显高于胃炎组织, 差异有统计学意义(P<0.05). 而且胃癌组织TERT表达与浸润深度、TNM分期、血管侵袭和淋巴结转移显著相关等临床病理特征显著相关(P<0.05). TERT高表达的胃癌患者的总体生存率显著低于TERT低表达的患者(HR = 0.420, 95%CI: 0.264-0.668, P<0.001), 而且TERT高表达的胃癌患者的无进展生存率也显著低于TERT低表达的患者(HR = 0.649, 95%CI: 0.421-0.999, P = 0.049). Cox多因素生存分析表明, TERT表达是胃癌总体生存的独立预后因子.
胃癌和癌前病变组织中TERT高表达, 且TERT高表达与胃癌患者的临床病理特征和预后显著相关, 可能为胃癌患者的诊断和治疗提供新的指标.
核心提要: 端粒酶逆转录酶(telomerase reverse transcri-ptase, TERT)是一种与端粒活性相关的核糖蛋白酶复合物. 胃癌和癌前病变组织中TERT高表达, 且TERT高表达与胃癌患者的临床病理特征和预后显著相关, 可能为胃癌患者的诊断和治疗提供新的指标.
引文著录: 国麟祺, 陈颖, 滕欣丽, 夏伟滨, 徐剑, 曲义坤. TERT在胃癌发生发展中的表达变化及其与临床特征的相关性. 世界华人消化杂志 2018; 26(16): 979-985
Revised: May 2, 2018
Accepted: May 9, 2018
Published online: June 8, 2018
To investigate the expression of telomerase reverse transcriptase (TERT) mRNA in gastric cancer and precancerous lesions, and to analyze the relationship between TERT expression and clinicopathologic features and prognosis in gastric cancer.
From September 2011 to October 2016, 102 patients with gastric cancer, 32 patients with precancerous lesions, and 30 patients with chronic non-atrophic gastritis were treated at the First Affiliated Hospital of Jiamus University. The expression of TERT mRNA in tissues was detected by real-time quantitative PCR, and the correlation of expression of TERT with clinicopathologic features and prognosis in gastric cancer was analyzed.
The expression of TERT in gastric cancer and precancerous lesions was significantly higher than that in chronic non-atrophic gastritis (P < 0.05). TERT expression was significantly correlated with the depth of invasion, TNM stage, vascular invasion, and lymph node metastasis (P < 0.05). The overall survival rate of gastric cancer patients with high expression of TERT was significantly lower than that of patients with low expression of TERT (HR = 0.420, 95%CI: 0.264-0.668, P < 0.001). The progression-free survival rate of gastric cancer patients with high expression of TERT was also significantly lower than that of patients with low TERT expression (HR = 0.649, 95%CI: 0.421-0.999, P = 0.049). Cox multivariate survival analysis showed that TERT expression was an independent prognostic factor for overall survival in gastric cancer.
TERT is highly expressed in gastric cancer and precancerous lesions, and high expression of TERT is significantly associated with the clinicopathologic features and prognosis of gastric cancer patients.
- Citation: Guo LQ, Chen Y, Teng XL, Xia WB, Xu J, Qu YK. TERT expression in gastric carcinogenesis: Correlation with clinical features. Shijie Huaren Xiaohua Zazhi 2018; 26(16): 979-985
- URL: https://www.wjgnet.com/1009-3079/full/v26/i16/979.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i16.979
胃癌是我国常见的消化道恶性肿瘤, 其发生发展受到多基因和多因素的影响[1,2]. 临床上早期胃癌仅有一些非特异性的消化道症状, 故胃癌的早期发现和诊断比较困难[3,4]. 胃癌的发生发展通常需要多年的逐步演变, 因此研究胃癌和癌前病变组织中基因表达的变化情况, 有利于为胃癌的诊断和治疗提供依据[5,6]. 端粒酶逆转录酶(telomerase reverse transcriptase, TERT)是一种核糖蛋白酶复合物, 与端粒酶的生物活性有关, 通常表达于干细胞和肿瘤细胞中[7,8]. 本研究探讨了TERT mRNA在胃癌及癌前病变组织中的表达情况, 及胃癌组织中TERT表达与临床病理特征和预后的相关性, 旨在为TERT在胃癌诊断和治疗中的应用提供依据.
收集2011-09/2016-10期间在佳木斯大学附属第一医院进行过治疗的102例胃癌患者、32例癌前病变患者、30例慢性非萎缩性胃炎的新鲜组织. 所有纳入本研究的患者手术前均未接受过放化疗, 临床资料完整, 收集到的组织均由2名以上经验丰富的病理科医师明确诊断. 本研究收集患者组织样本的所有步骤均经医院伦理学委员会审议通过, 与患者签订知情同意书. 纳入标准: (1)经影像学或组织病理学检查确诊为胃癌、癌前病变(包括慢性萎缩性胃炎伴肠化生、轻度或重度不典型增生)和慢性非萎缩性胃炎的患者; (2)身体状况能耐受肿瘤切除手术及化疗的胃癌患者. 排除标准: (1)有严重心血管、肝脏或肾脏疾病的患者; (2)合并有其他类型恶性肿瘤或原发肿瘤灶不明确的患者. 纳入本研究的胃癌组患者, 其中男69例, 女33例; 年龄43-80岁, 平均年龄59.65岁±6.05岁; 淋巴结转移50例, 淋巴结未转移52例; T1+T2期57例, T3+T4期55例; 高分化和中分化57例, 低分化45例. 癌前病变组患者, 其中男19例, 女13例; 年龄30-78岁, 平均年龄57.21岁±5.77岁; 慢性萎缩性胃炎伴肠化生15例, 轻度不典型增生8例, 重度不典型增生9例. 胃炎(慢性非萎缩性胃炎)组患者, 其中男17例, 女13例; 年龄34-77岁, 平均年龄55.62岁±5.12岁. 三组患者的年龄、性别等一般资料对比无统计学差异(P>0.05), 具有可比性.
实时荧光定量PCR检测胃癌组织中TERT表达. 所有收集到的新鲜组织样本立即用生理盐水清洗, 随后保存于液氮中. 按照总RNA提取试剂盒(天根生化科技有限公司)的说明书提取组织的总RNA. 使用SYBR@ Premix ExTaq@Ⅱ试剂盒(宝生物工程有限公司)和实时荧光定量PCR仪(ABI 7900HT Real-Time PCR System 7900, 美国应用生物系统公司)检测Ct值, 相对表达量结果以2-△△CT形式表示, 以β-actin为内参基因. 正、反向引物见表1.
| 基因 | 5′ to 3′ | 5′ to 3′ |
| TERT | AAG TTCCTGCACTGGCTGAT | CACGACGTAGTCCATGTTCA |
| β-actin | AAGATCATTGCTCCTCCTGA | CTCGTCATACTCCTGCTTGCT |
比较胃癌、癌前病变患者、慢性非萎缩性胃炎组织中TERT mRNA表达. 将TERT mRNA表达水平位于前50%的患者分在TERT高表达组, 另外TERT mRNA表达水平位于后50%的患者分在TERT低表达组, 并分析TERT表达与病理分级、淋巴结转移、TNM分期等临床病理特征的相关性. 出院后利用门诊复查、电话和病历系统信息采集等多种方式对患者进行定期随访, 记录患者的生存情况. 随访时间截至2017-12-31. 手术至死亡或随访终止日期为总体生存期, 并绘制总体生存曲线分析TERT表达与胃癌总体生存期的关系.
统计学处理 采用SPSS 19.0进行数据分析, 计量资料采用均值±标准差表示, 单因素方差分析比较组间差异; 计数资料采用n(%)的形式表示, χ2检验比较组间差异. 应用Kaplan-Meier法绘制总体生存曲线, 并采用Log rank检验计算风险比(HR)及其95%置信区间和P值; 多变量Cox回归模型用于分析预后影响因素的HR和独立性. 所有检验均采用双侧假设检验, α = 0.05, 当P<0.05时认为差异具有统计学意义。
胃癌和癌前病变组织中TERT mRNA表达显著高于胃炎组织, 而且胃癌组织中TERT mRNA表达也显著高于癌前病变组织, 以上差异具有统计学意义(P<0.05)(图1).
相关性分析结果显示, TERT表达与胃癌患者浸润深度、TNM分期、血管侵袭和淋巴结转移显著相关, 有统计学意义(P<0.05)(表2).
| 病理参数 | TERT低表达 (n = 51) | TERT高表达 (n = 51) | χ2 | P |
| 性别 | ||||
| 男 | 36 | 33 | 0.403 | 0.525 |
| 女 | 15 | 18 | ||
| 年龄(岁) | ||||
| ≤60 | 30 | 33 | 0.374 | 0.541 |
| >60 | 21 | 18 | ||
| 浸润深度 | ||||
| T1+T2 | 29 | 18 | 4.775 | 0.029 |
| T3+T4 | 22 | 33 | ||
| TNM分期 | ||||
| Ⅰ+Ⅱ | 31 | 16 | 8.878 | 0.003 |
| Ⅲ+Ⅳ | 20 | 35 | ||
| 肿瘤大小 | ||||
| ≤5 cm | 25 | 20 | 0.994 | 0.319 |
| >5 cm | 26 | 31 | ||
| 血管侵袭 | ||||
| 是 | 19 | 30 | 4.752 | 0.029 |
| 否 | 32 | 21 | ||
| 淋巴结转移 | ||||
| 是 | 18 | 32 | 7.689 | 0.006 |
| 否 | 33 | 19 | ||
| 分化程度 | ||||
| 高分化/中分化 | 30 | 27 | 0.358 | 0.550 |
| 低分化 | 21 | 24 |
TERT高表达的胃癌患者的总体生存率显著低于TERT低表达的患者(HR = 0.420, 95%CI: 0.264-0.668, P<0.001), 而且TERT高表达的胃癌患者的无进展生存率也显著低于TERT低表达的患者(HR = 0.649, 95%CI: 0.421-0.999, P = 0.049)(图2). 将胃癌患者的临床病理特征进行单因素生存分析, 结果TNM分期、淋巴结转移和TERT表达均与总体生存率显著相关. 进一步将进行Cox多因素生存分析表明, TERT表达是胃癌总体生存的独立预后因子(表3).
| 临床病理特征 | 单因素分析 | 多因素分析 | ||
| HR (95%CI) | P | HR (95%CI) | P | |
| 年龄 (≤60 vs >60) | 0.792 (0.503-1.262) | 0.323 | 0.923 (0.622-1.692) | 0.695 |
| 性别 (男 vs 女) | 0.917 (0.586-1.422) | 0.681 | 1.117 (0.552-1.592) | 0.985 |
| 肿瘤大小 (≤5 cm vs >5 cm) | 1.248 (0.811-1.892) | 0.232 | 0.851 (0.547-1.333) | 0.487 |
| 浸润深度 (T1-T2 vs T3-T4) | 0.986 (0.632-1.533) | 0.931 | 1.442 (0.816-2.292) | 0.125 |
| 分化程度 (高中分化 vs 低分化) | 0.844 (0.553-1.291) | 0.437 | 1.037 (0.646-1.662) | 0.892 |
| 血管侵袭 (是 vs 否) | 0.985 (0.633-1.531) | 0.936 | 1.447 (0.856-2.412) | 0.174 |
| 淋巴结转移 (是 vs 否) | 0.533 (0.265-1.119) | 0.009 | 1.615 (0.736-3.558) | 0.239 |
| TNM分期 (Ⅰ-Ⅱ vs Ⅲ-Ⅳ) | 3.135 (1.941-5.045) | <0.001 | 1.883 (1.116-3.189) | 0.018 |
| TERT表达 (低表达 vs 高表达) | 4.517 (2.696-7.552) | <0.001 | 3.367 (1.846-6.122) | <0.001 |
由于缺乏特异性的早期诊断指标, 80%以上的胃癌确诊时已经处于中晚期[9,10]. 肠上皮化生和不典型增生等癌前病变是胃癌发生发展的重要阶段, 也是对胃癌发生进行干预的最佳阶段[11,12]. 因此, 研究能在癌前病变或胃癌早期阶段对患者进行准确诊断的生物学指标是提高患者预后的关键.
TERT是端粒酶的催化亚基, 对于端粒酶生物学作用的发挥至关重要[13,14]. 高达90%的人恶性肿瘤细胞为端粒酶阳性, 而正常组织细胞(生殖细胞、造血干细胞、某些淋巴细胞除外)则呈阴性, 表明端粒酶可能调节异常分化的细胞的分裂增殖和永生化[15,16]. 本研究结果显示胃癌和癌前病变组织中TERT mRNA表达显著高于胃炎组织, 而且胃癌组织中TERT mRNA表达也显著高于癌前病变组织, 以上结果提示在胃癌和癌前病变组织中TERT异常表达, 可能参与胃癌的发生发展相关. TERT是限制端粒酶活性的成分之一, 可能通过调节端粒酶活性参与肿瘤的进展[17,18]. Wu等[19]研究表明TERT在胃癌组织中高表达, 且与胃癌患者转移和侵袭的临床特征显著相关. 戚红霞等发现在肿瘤的早期阶段就能检测到TERT表达, 且随着恶性程度的增加, 其表达量亦增加[20].
文献报道DNA肿瘤病毒、抑癌基因等均可通过与TERT相互作用参与肿瘤细胞的恶性转化过程[21-23]. 猿病毒蛋白和癌基因H-ras与TERT上的位点结合后, 能阻断细胞内调节途径, 使组织细胞恶变[24]. 临床研究发现胃癌患者的临床分期、淋巴结转移和血管侵袭等临床病理特征与远端转移和不良预后密切相关[25,26]. 本研究结果显示胃癌组织中TERT表达与胃癌的浸润深度、TNM分期、血管侵袭和淋巴结转移显著相关, 表明TERT可能通过调节胃癌的恶性行为促进肿瘤的侵袭转移. 研究发现癌细胞中TERT mRNA表达水平和端粒酶活性有显著的相关性, 并证明TERT表达对癌细胞中的端粒酶活性可能是必需的, 在肿瘤形成中起重要的作用[27,28]. 本研究对102例胃癌组织中TERT表达对患者预后影响的分析显示, TERT高表达的胃癌患者的总体生存率和无进展生存率均显著低于TERT低表达的患者, 以上结果表明胃癌组织中TERT高表达可能是转移和预后不良的风险因素. 将胃癌患者临床病理特征进行单因素和多因素COX分析的结果显示, TERT是胃癌总体生存率的独立预后因子, 可能作为胃癌的早期诊断和治疗的生物标志物. TERT在多种人胃癌细胞中高表达, 且沉默TERT可以促进胃癌细胞凋亡[24]. 临床研究表明TERT在肿瘤组织的表达与患者外周血中T淋巴细胞亚群的变化显著相关, 提示TERT可能通过调节患者的免疫功能促进肿瘤的进展[29,30]. TERT可能通过多种机制参与胃癌的发生发展, 检测组织中TERT的表达可能代替端粒酶活性用于胃癌的临床诊断.
总之, 胃癌和癌前病变组织中TERT高表达, 且TERT高表达与胃癌患者的临床病理特征和预后显著相关, 是胃癌患者总体生存率的独立预后因子, 可能为胃癌患者的诊断和治疗提供新的指标.
胃癌是我国常见的消化道恶性肿瘤, 研究胃癌和癌前病变组织中基因表达的变化情况有利于为胃癌的诊断和治疗提供依据. 端粒酶逆转录酶(telomerase reverse transcriptase, TERT)是一种与端粒酶生物活性相关的核糖蛋白酶复合物, 常表达于肿瘤细胞. 研究TERT在胃癌和癌前病变组织中的表达可能为胃癌的早期诊断提供新的指标.
探讨TERT mRNA在胃癌及癌前病变组织中的表达情况, 及胃癌组织中TERT表达与临床病理特征和预后的相关性, 为TERT在胃癌诊断和治疗中的应用提供依据.
本文研究了TERT mRNA在胃癌及癌前病变组织中的表达情况, 并分析胃癌组织中TERT表达与临床病理特征和预后的相关性, 表明胃癌组织中TERT表达是胃癌患者总体生存率的独立预后因子, 可能为胃癌的早期诊断提供新的指标.
本研究采用实时定量PCR检测胃癌和癌前病变组织中TERT mRNA的表达, 并分析胃癌组织中TERT表达与临床病理特征和预后的相关性.
本研究结果表明TERT在胃癌和癌前病变组织中高表达, 且TERT高表达与胃癌患者的临床病理特征和预后显著相关, 可能为胃癌患者的诊断和治疗提供新的指标.
本研究证实胃癌和癌前病变组织中TERT高表达, 且TERT高表达与胃癌患者的临床病理特征和预后显著相关, TERT可能作为早期胃癌诊断的新指标.
本研究的样本量偏小, 且胃癌和癌前病变组织中TERT的蛋白表达情况仍需更多实验数据支持, 建议后期对其发挥作用的机制进行更深入的研究.
学科分类: 胃肠病学和肝病学
手稿来源地: 黑龙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
编辑: 马亚娟 电编:张砚梁
| 1. | De Manzoni G, Marrelli D, Baiocchi GL, Morgagni P, Saragoni L, Degiuli M, Donini A, Fumagalli U, Mazzei MA, Pacelli F. The Italian Research Group for Gastric Cancer (GIRCG) guidelines for gastric cancer staging and treatment: 2015. Gastric Cancer. 2017;20:20-30. [PubMed] [DOI] |
| 2. | Park JY, Forman D, Waskito LA, Yamaoka Y, Crabtree JE. Epidemiology of Helicobacter pylori and CagA-Positive Infections and Global Variations in Gastric Cancer. Toxins (Basel). 2018;10. [PubMed] [DOI] |
| 3. | Yang L, Wang J, Li J, Zhang H, Guo S, Yan M, Zhu Z, Lan B, Ding Y, Xu M. Identification of Serum Biomarkers for Gastric Cancer Diagnosis Using a Human Proteome Microarray. Mol Cell Proteomics. 2016;15:614-623. [PubMed] [DOI] |
| 4. | Virgilio E, Giarnieri E, Giovagnoli MR, Montagnini M, Proietti A, D'Urso R, Mercantini P, Valabrega S, Balducci G, Cavallini M. Gastric Cancer Cells in Peritoneal Lavage Fluid: A Systematic Review Comparing Cytological with Molecular Detection for Diagnosis of Peritoneal Metastases and Prediction of Peritoneal Recurrences. Anticancer Res. 2018;38:1255-1262. [PubMed] [DOI] |
| 5. | Jin C, Shi W, Wang F, Shen X, Qi J, Cong H, Yuan J, Shi L, Zhu B, Luo X. Long non-coding RNA HULC as a novel serum biomarker for diagnosis and prognosis prediction of gastric cancer. Oncotarget. 2016;7:51763-51772. [PubMed] [DOI] |
| 6. | Verma R, Sharma PC. Next generation sequencing-based emerging trends in molecular biology of gastric cancer. Am J Cancer Res. 2018;8:207-225. [PubMed] |
| 7. | Aydin M, Sümbül AT, Camuz Hilaloğullari G, Bayram S. Genetic polymorphisms in human telomerase reverse transcriptase (hTERT) gene polymorphisms do not associated with breast cancer in patients in a turkish population: hospital-based case-control study. Cell Mol Biol (Noisy-le-grand). 2018;64:108-115. [PubMed] [DOI] |
| 8. | Pestana A, Vinagre J, Sobrinho-Simões M, Soares P. TERT biology and function in cancer: beyond immortalisation. J Mol Endocrinol. 2017;58:R129-R146. [PubMed] [DOI] |
| 9. | Smyth EC, Verheij M, Allum W, Cunningham D, Cervantes A, Arnold D; ESMO Guidelines Committee. Gastric cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2016;27:v38-v49. [PubMed] [DOI] |
| 10. | Sitarz R, Skierucha M, Mielko J, Offerhaus GJA, Maciejewski R, Polkowski WP. Gastric cancer: epidemiology, prevention, classification, and treatment. Cancer Manag Res. 2018;10:239-248. [PubMed] [DOI] |
| 11. | Van Cutsem E, Sagaert X, Topal B, Haustermans K, Prenen H. Gastric cancer. Lancet. 2016;388:2654-2664. [PubMed] [DOI] |
| 12. | Virgilio E, Balducci G, Mercantini P, Giarnieri E, Giovagnoli MR, Montagnini M, Proietti A, D'Urso R, Cavallini M. Laparoscopic Intragastric Surgery for Treating Early Gastric Cancer. Anticancer Res. 2018;38:1911-1916. [PubMed] [DOI] |
| 13. | Tang B, Xie R, Qin Y, Xiao YF, Yong X, Zheng L, Dong H, Yang SM. Human telomerase reverse transcriptase (hTERT) promotes gastric cancer invasion through cooperating with c-Myc to upregulate heparanase expression. Oncotarget. 2016;7:11364-11379. [PubMed] [DOI] |
| 14. | Liu R, Bishop J, Zhu G, Zhang T, Ladenson PW, Xing M. Mortality Risk Stratification by Combining BRAF V600E and TERT Promoter Mutations in Papillary Thyroid Cancer: Genetic Duet of BRAF and TERT Promoter Mutations in Thyroid Cancer Mortality. JAMA Oncol. 2016;. [PubMed] [DOI] |
| 15. | Liu T, Yuan X, Xu D. Cancer-Specific Telomerase Reverse Transcriptase (TERT) Promoter Mutations: Biological and Clinical Implications. Genes (Basel). 2016;7. [PubMed] [DOI] |
| 16. | McFarlane M, Brettschneider J, Gelsthorpe A, James S, Snead D, Gopalakrishnan K, Mehenna H, Jankowski J, Arasaradnam R, Nwokolo C. An assessment of candidate genes to assist prognosis in gastric cancer. J Gastrointest Oncol. 2018;In press. |
| 17. | Leão R, Apolónio JD, Lee D, Figueiredo A, Tabori U, Castelo-Branco P. Mechanisms of human telomerase reverse transcriptase (hTERT) regulation: clinical impacts in cancer. J Biomed Sci. 2018;25:22. [PubMed] [DOI] |
| 18. | Liu R, Xing M. TERT promoter mutations in thyroid cancer. Endocr Relat Cancer. 2016;23:R143-R155. [PubMed] [DOI] |
| 19. | Wu Y, Li G, He D, Yang F, He G, He L, Zhang H, Deng Y, Fan M, Shen L. Telomerase reverse transcriptase methylation predicts lymph node metastasis and prognosis in patients with gastric cancer. Onco Targets Ther. 2016;9:279-286. [PubMed] [DOI] |
| 20. | 戚 红霞, 潘 晓燕. CD133、β-catenin和hTERT在胃癌及癌前病变中的表达及相关性研究. 胃肠病学和肝病学杂志. 2017;26:981-985. |
| 21. | Liu L, Liu C, Fotouhi O, Fan Y, Wang K, Xia C, Shi B, Zhang G, Wang K, Kong F. TERT Promoter Hypermethylation in Gastrointestinal Cancer: A Potential Stool Biomarker. Oncologist. 2017;22:1178-1188. [PubMed] [DOI] |
| 22. | Kim W, Ludlow AT, Min J, Robin JD, Stadler G, Mender I, Lai TP, Zhang N, Wright WE, Shay JW. Regulation of the Human Telomerase Gene TERT by Telomere Position Effect-Over Long Distances (TPE-OLD): Implications for Aging and Cancer. PLoS Biol. 2016;14:e2000016. [PubMed] [DOI] |
| 23. | Liu R, Zhang T, Zhu G, Xing M. Regulation of mutant TERT by BRAF V600E/MAP kinase pathway through FOS/GABP in human cancer. Nat Commun. 2018;9:579. [PubMed] [DOI] |
| 24. | La SH, Kim SJ, Kang HG, Lee HW, Chun KH. Ablation of human telomerase reverse transcriptase (hTERT) induces cellular senescence in gastric cancer through a galectin-3 dependent mechanism. Oncotarget. 2016;7:57117-57130. [PubMed] [DOI] |
| 25. | Puneet , Kazmi HR, Kumari S, Tiwari S, Khanna A, Narayan G. Epigenetic Mechanisms and Events in Gastric Cancer-Emerging Novel Biomarkers. Pathol Oncol Res. 2018; Epub ahead of print. [PubMed] [DOI] |
| 26. | Kankeu Fonkoua L, Yee NS. Molecular Characterization of Gastric Carcinoma: Therapeutic Implications for Biomarkers and Targets. Biomedicines. 2018;6. [PubMed] [DOI] |
| 27. | Wang XH, Liu MN, Sun X, Xu CH, Liu J, Chen J, Xu RL, Li BX. TGF-β1 pathway affects the protein expression of many signaling pathways, markers of liver cancer stem cells, cytokeratins, and TERT in liver cancer HepG2 cells. Tumour Biol. 2016;37:3675-3681. [PubMed] [DOI] |
| 28. | Bell RJ, Rube HT, Xavier-Magalhães A, Costa BM, Mancini A, Song JS, Costello JF. Understanding TERT Promoter Mutations: A Common Path to Immortality. Mol Cancer Res. 2016;14:315-323. [PubMed] [DOI] |
| 29. | Cheng YB, Guo LP, Yao P, Ning XY, Aerken G, Fang DC. Telomerase and hTERT: can they serve as markers for gastric cancer diagnosis? World J Gastroenterol. 2014;20:6615-6619. [PubMed] [DOI] |