修回日期: 2018-04-11
接受日期: 2018-04-25
在线出版日期: 2018-05-18
溃疡性结肠炎(ulcerative colitis, UC)是严重影响人类健康的一种炎症性肠道疾病, 研究发现丁酸的添加有助于缓解UC. 已有研究表明丁酸可能通过促进组蛋白乙酰化或者激活G蛋白偶联受体(G protein-coupled receptors, GPRs)进而激活下游的信号途径抑制炎症基因表达. 本文结合近年来的研究进展发现丁酸抑制UC的主要机制是, 首先丁酸可以激活GPRs, 进而激活其下游的信号通路, 影响炎症因子表达, 对免疫细胞的分化和迁移产生影响; 其次丁酸也可以激活过氧化物酶体增殖物激活受体, 促进紧密连接蛋白表达, 保证肠道的屏障功能; 丁酸也可以抑制NF-κB信号通路激活, 抑制炎症因子表达, 促进T细胞凋亡, 促进肠道抗菌肽的分泌. 本文结合近年来的研究进展, 综述了丁酸抑制溃疡性结肠炎的主要机制以及丁酸在治疗溃疡性结肠炎方面的应用, 为丁酸在溃疡性结肠炎治疗中的机制研究方面提供参考.
核心提要: 研究发现丁酸可以抑制溃疡性结肠炎, 但对其机制并不清楚, 本文结合近年来的研究进展, 发现其主要原因是, 首先丁酸可以激活G蛋白偶联受体, 此外可以激活过氧化物酶体增殖物激活受体, 另外它也具有促进组蛋白乙酰化的作用.
引文著录: 冉舒文, 慕春龙, 朱伟云. 丁酸抑制溃疡性结肠炎分子机制的研究进展. 世界华人消化杂志 2018; 26(14): 856-861
Revised: April 11, 2018
Accepted: April 25, 2018
Published online: May 18, 2018
Ulcerative colitis (UC) is a kind of inflammatory bowel disease that damages health seriously, and it is reported that butyrate could be used to treat UC. The underlying mechanism is that butyrate can activate G protein-coupled receptors to influence the downstream signaling pathways, thereby inhibiting the expression of cytokines and the differentiation and migration of immune cells. Besides, butyrate can activate peroxisome proliferator-activated receptor gamma, thus decreasing cell permeability and protecting the integrity of the intestinal mucosa. Butyrate can also inhibit the nuclear factor-kappa B signaling pathway, inhibiting the expression of cytokines, accelerating the apoptosis of T cells, and promoting the secretion of human defense peptides. Based on the recent research, we review the underlying mechanisms by which butyrate relieves UC to provide evidence for the clinical application of butyrate.
- Citation: Ran SW, Mu CL, Zhu WY. Mechanisms for butyrate to inhibit ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2018; 26(14): 856-861
- URL: https://www.wjgnet.com/1009-3079/full/v26/i14/856.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i14.856
溃疡性结肠炎(ulcerative colitis, UC)是临床上一种高发病率的肠道炎症, 其临床症状复杂, 在发病前期患者会发生腹泻、腹痛, 随着病情的加重, 病人出现便血、食欲减退、体重下降等症状[1]. UC的发病机制复杂模糊, 目前没有统一的定论, 但是微生物的改变和UC的发生有密切的关系.
未被胃和前肠分解的碳水化合物到达结肠后, 经微生物发酵生成短链脂肪酸(short-chain fatty acids, SCFA), 丁酸是其中的一种, 它可以作为肠上皮细胞的能源物质, 对于肠道pH稳定、肠道菌群平衡、肠道电解质的稳定等都具有重要意义. 此外, 研究发现丁酸能够缓解UC, 作为机体的信号分子, 丁酸可以识别G蛋白偶联受体(G protein-coupled receptors, GPRs)和过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors gamma, PPARγ), 激活下游的信号通路, 影响炎症因子和趋化因子表达; 另外, 丁酸作为组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor, HDACI)可以抑制NF-κB信号通路, 抑制炎症因子表达、促进T细胞凋亡、促进抗菌肽分泌, 从而保护肠道黏膜, 维持肠道上皮完整. 本文综述了丁酸抑制UC的主要机制以及目前丁酸在缓解UC方面的应用.
GPR是一类庞大的膜受体家族, 能够识别不同的配体, 通过不同的信号通路, 介导不同的生理功能. 短链脂肪酸(short-chain fatty acids, SCFA)也可以作为GPR的配体, 其受体主要包括GPR43、GPR41和GPR109A. Kobayashi等[2]发现SCFA激活人肾皮质上皮细胞的GPR43和GPR41后, 抑制了单核细胞趋化蛋白(monocyte chemotactic protein 1, MCP-1)的表达, 从而抑制肾脏炎症的发生, GPR109A也能够被SCFA激活[3]. 丁酸与这些GPR结合以后, 能激活丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路、磷脂酶C信号通路从而影响炎症因子表达和免疫细胞的趋化和增殖.
炎症因子的过量表达是引起UC的一个重要因素, 丁酸激活GPR后一方面抑制了促炎因子的表达, 另一方面促进了抑炎因子的表达, 从而达到缓解炎症的效果. Cox等[4]发现丁酸可以通过GPR43抑制LPS刺激下的人单核细胞产生白介素1(interleukin, IL-1)、肿瘤坏死因子a(tumor necrosis factor α, TNF-α), 干扰素γ(interferon-γ, IFN-γ), 且随着丁酸浓度的增加, 对炎症因子的抑制作用越强. 敲除小鼠的GPR109A基因导致炎症反应加重, 而丁酸的添加会导致IL-6的表达量下降, 促进IL-18的表达, 同时促进了Treg细胞的增殖[5]. PGE2作为免疫抑制剂, 可以抑制IL-1β、TNF-α等表达, 同时抑制Th1细胞的产生[6]. 丁酸能够通过激活GPR43诱导PGE2的产生, 缓解LPS导致的炎症反应[4]. 结肠上皮细胞表达的IL-18能够抑制机体的过度炎症反应, 是抑制结肠炎和结肠癌发生的有效因子, 丁酸激活GPR109A后促进了IL-18的表达[5]. 丁酸通过激活GPR调节炎症相关因子的表达对于抑制过度炎症反应至关重要, 而GPR也将成为治疗UC的一个靶点.
病原体入侵机体后, 炎性细胞在各种黏附分子和趋化因子作用下, 从血液迁移到炎症部位清除抗原, 但是白细胞的过度激活和招募是引发炎症反应的一个重要因素[7]. 丁酸激活炎性细胞表面受体GPR会影响趋化分子、黏附分子的表达进而对白细胞的迁移产生影响. Vinolo等[8]用丁酸的前体药物三丁酸甘油酯饲喂小鼠, 然后给小鼠腹腔注射1%的糖原溶液, 结果发现相比对照组小鼠, 试验组小鼠腹腔炎症因子TNF-α、一氧化氮(nitric oxide, NO)以及嗜中性粒细胞趋化因子CINC-2α的表达量显著下降, 向腹腔迁移的白细胞数量显著减少. LPS会诱导人树突状细胞产生大量的趋化因子如CXCL9、CXCL10等, 用丁酸处理后, 人树突状细胞中这些趋化因子的表达量均显著下降[9]. MCP-1是机体重要的趋化因子, 口服丁酸可以降低脂肪组织中MCP-1的表达量[3]. 虽然丁酸可以通过抑制趋化因子的表达抑制白细胞迁移, 缓解炎症反应, 但是有体外试验表明丁酸可以直接诱导巨噬细胞趋化[10], 发挥促炎作用, 而出现这种矛盾的原因可能是不同的细胞会对SCFA做出不同的反应. 丁酸通过影响炎性细胞的招募抑制炎症也是丁酸发挥抑炎作用的重要途径.
T细胞作为一种重要的免疫细胞, 对于调节免疫反应意义重大, 丁酸也会影响T细胞的增殖和分化, 会增加抑炎的调节性T细胞(regulatory cells, Tregs)数量, 抑制促炎的Th1细胞(T helper cell 1, Th1)和Th17细胞(T helper cell 17, Th17)分化. 丁酸处理人树突状细胞后, 用LPS诱导炎症状态, 结果发现炎症因子IL-6、IL-12B的表达被抑制, 而IL-12B是IL-12和IL-23重要的组成部分, 这两种炎症因子能够分别诱导Th1细胞的增殖和Th17细胞的扩散, 因此作者认为丁酸通过影响T细胞的增殖和分化, 提高机体的抗炎性能[9]. 丁酸诱导Treg细胞的增殖可能是通过促进Foxp3启动子的乙酰化而实现的[11]. 也就是说丁酸激活GPR以后, 可能会通过下游的信号通路促进Foxp3启动子的乙酰化, 促进抑炎的Treg细胞的增殖, 但是也有可能是丁酸直接作为组蛋白去乙酰化酶抑制剂发挥这种作用.
PPARγ是Ⅱ型核受体超家族的成员之一, 在上皮细胞、单核细胞、树突状细胞等多种细胞中均检测到了这种受体的表达. PPARγ被激活后会影响细胞增殖, 降低细胞通透性, 其作用机制是PPARγ被激活以后, 会与另一种受体9-顺式-视黄醇X受体形成二聚体, 继而进入核内与特定基因即过氧化物酶体增殖物反应元件结合, 影响相关基因的转录[12]. Kinoshita等[13]用丁酸和PPARγ的配体同时处理HT-29细胞, 结果发现这两种物质都能诱导细胞增殖, 促进紧密连接蛋白表达、抑制促炎因子表达, 因此推测丁酸也是PPARγ的配体, 通过激活PPARγ信号途径, 降低细胞通透性. 此外PPARγ被激活以后可以和p65在核内结合形成复合物, 从而抑制NF-κB信号通路产生炎症因子[14]. 综上我们可以推测丁酸激活PPARγ以后, 一方面促进上皮细胞细胞分化, 增加紧密连接蛋白的表达量, 降低细胞通透性, 维持肠道黏膜的完整; 另一方面可能通过与NF-κB分子结合形成复合物, 抑制NF-κB信号通路, 降低促炎因子的含量.
组蛋白的乙酰化会促进特异基因的表达上调, 而去乙酰化会抑制基因表达[15]. 机体内的两种酶乙酰化酶(histone acetyltransferase, HAT)和组蛋白去乙酰化酶(histone deacetylase, HDAC)维持机体的乙酰化水平平衡, 调控机体的基因表达稳定. 丁酸作为HDACI可以通过影响特异基因的乙酰化水平, 影响炎症因子和抗菌肽的表达.
大部分炎症因子是通过NF-κB信号通路产生的, 一般情况下细胞中的NF-κB分子是没有活性的, 因为其抑制性蛋白(inhibitor kappaB, IκB)与其结合抑制了它的活性[16], 阻止NF-κB信号途径激活. 当相应的TLR被激活以后, IκB被降解, NF-κB分子由失活状态转变为活性状态, 进入细胞核, 和其相应的靶基因结合, 促进炎症相关基因的表达[17]. Aguila 比较了丁酸处理的细胞和正常细胞, 发现丁酸的处理会降低细胞核中p65的含量[18]. Lee等[19]发现口服丁酸钠会抑制LPS诱导的IκB的磷酸化, 抑制NF-κB分子与DNA的结合, 同时促进组蛋白的乙酰化, 进而抑制促炎因子表达, 缓解炎症. T细胞的大量增殖是过度炎症发生的一个重要标志, Zimmerman等[20]发现丁酸通过促进Fas蛋白的乙酰化促进T细胞凋亡, 缓解结肠炎症, Ogawa等[21]用丁酸处理人肝癌细胞发现了同样的现象. 丁酸抑制NF-κB信号途径和促进T细胞凋亡是其能够治疗UC的重要特性.
宿主防御肽(human defense peptide, HDPs)是在机体发生炎症或感染时黏膜表面分泌的具有清除病菌和调节免疫作用的一种小分子肽, 是天然免疫的重要效应分子, 主要包括两种类型: 防御素和抗菌肽. 丁酸会促进HDP的产生. Xiong等[22]发现丁酸通过抑制HDAC的活性上调HDP的表达, 从而提高了细胞的抗菌能力, 促进病原菌的清除, 抑制促炎因子IL-6、TNF-α、IL-12的产生, 缓解大肠杆菌所导致的细胞炎症反应. 但是值得注意的是用另外一种HDACI-TST处理猪的肾脏细胞结果发现并不能诱导HDP的表达[23], 这就说明除了具有促进乙酰化的作用, 丁酸可能还有其他的特性才能诱导HDP的表达. Dou等[23]发现丁酸除了促进组蛋白的乙酰化外, 它还可以抑制NF-κB信号通路和MAPK信号通路, 促进HDP的表达, 前边讲的都是抑制NF-κB, 这里是激活, 怎么激活. Wang等[24] 也发现丁酸可以激活Caco-2细胞的环磷腺苷(cyclic adenosine monophosphate, cAMP)-环磷腺苷酸依赖的蛋白-cAMP反应原件结合信号途径. 这就说明丁酸可能激活NF-κB和MAPK信号通路提高相关基因的乙酰化水平从而促进HDP的表达.
目前通过丁酸抑制肠道炎症的方法一方面是改变日粮结构, 例如通过增加粗纤维含量间接增加肠道中SCFA的含量; 另一方面就是直接用丁酸做灌肠剂或者口服. 丁酸, 增加日粮粗纤维的含量能够促进肠道SCFA生成, 为肠道上皮细胞提供能量. 此外, SCFA的肝脏代谢产物谷氨酰胺和乙酸乙酰乙酯也具有供能效应, 促进紧密连接蛋白表达, 维持肠黏膜完整[25], 阻止病原菌入侵. SCFA的生成也改变了肠道环境, 降低肠道的pH值, 有利于肠道益生菌的定植, 维持肠道菌群稳态. 研究发现, 给健康小鼠和DSS诱导发生结肠炎的小鼠饲喂富含黄酮类物质和碳水化合物的蔓越莓豆日粮, 结果健康小鼠体内SCFA含量上升, 肠道紧密连接蛋白表达量增加, 肠道黏膜屏障功能增强, 肠道微生物发生改变; 而结肠炎小鼠体内炎症因子含量下降, 结肠组织评分下降, 炎症状态得以改善[26]. 用菊粉饲喂结肠炎小鼠, 发现小鼠结肠和盲肠组织中的促炎因子IL-6和IL-8的表达量显著下降, NF-κB信号通路被抑制, 肠道菌群发生改变[27]. 用高纤维含量的日粮饲喂患有结肠息肉的小鼠, 发现小鼠肠道菌群中产SCFA类细菌含量提高, 肠道中的SCFA含量也随之提高, 息肉症状显著缓解[28]. UC患者每天食用燕麦麸做的面包, 在第14 wk时, 病人体内的丁酸浓度显著上升, 肠道损伤逐渐恢复[29]. 以上结果说明通过增加日粮粗纤维间接提高肠道内丁酸的含量是缓解UC的一种潜在有效方法, 但是以哪种方式、以多少剂量添加能够最有效的抑制UC还需要进行大量的试验研究.
丁酸灌肠剂也是在临床治疗中一直被尝试的方法, 但是疗效不一, 有时疗效显著, 有时仅能轻微缓解疾病, 有时却无效. Luceri等[30]给实施肠造口术的病人使用丁酸钠灌肠剂, 结果发现丁酸会缓解肠道黏膜萎缩, 保证肠黏膜的完整, 缓解患者的炎症反应. 但是此前的研究发现, 给正处于恢复期, 氧化应激和炎症反应均不是特别强烈的患者使用丁酸灌肠剂, 仅能起到轻微的缓解作用[31]. Steinhart等[32]给左结肠UC患者每天使用60 mL 80 mmol/L的丁酸钠灌肠剂, 发现疾病并未得到治疗. Hamer等[33]做的临床试验也发现丁酸灌肠剂并不会影响肠道黏膜黏蛋白2以及三叶肽因子3的表达, 对UC的治疗无效. 引起这种差异的原因可能是丁酸的使用剂量、使用时间在各个研究中并不统一, 疾病的状态也不一样, 可能丁酸对于严重的UC, 治疗效果更加明显. 此前的观点认为丁酸在胃和十二指肠就被大量吸收不能到达结肠发挥作用, 因此口服丁酸并不能抑制炎症. 但是Vieira等[25]给DSS诱导发生结肠炎的小鼠口服丁酸以后, 发现丁酸能够到达结肠, 并且通过抑制免疫细胞的激活缓解黏膜病变, 进一步缓解炎症损伤. Ferreira等[34]也发现了类似的现象, 他给5氟尿嘧啶诱发结肠炎的小鼠口服丁酸, 发现患病小鼠体内肠道通透性降低、炎症得以缓解. 此外, 丁酸的衍生物丁酰胺也能够显著抑制促炎因子的生成, 提高紧密连接蛋白表达, 维持肠道黏膜完整[35]. 以上结果说明丁酸不仅可以直接使用作为治疗UC的药物, 而且它的衍生物也是一种潜在的治疗药物, 但是具体的使用方法还需要做大量的研究工作.
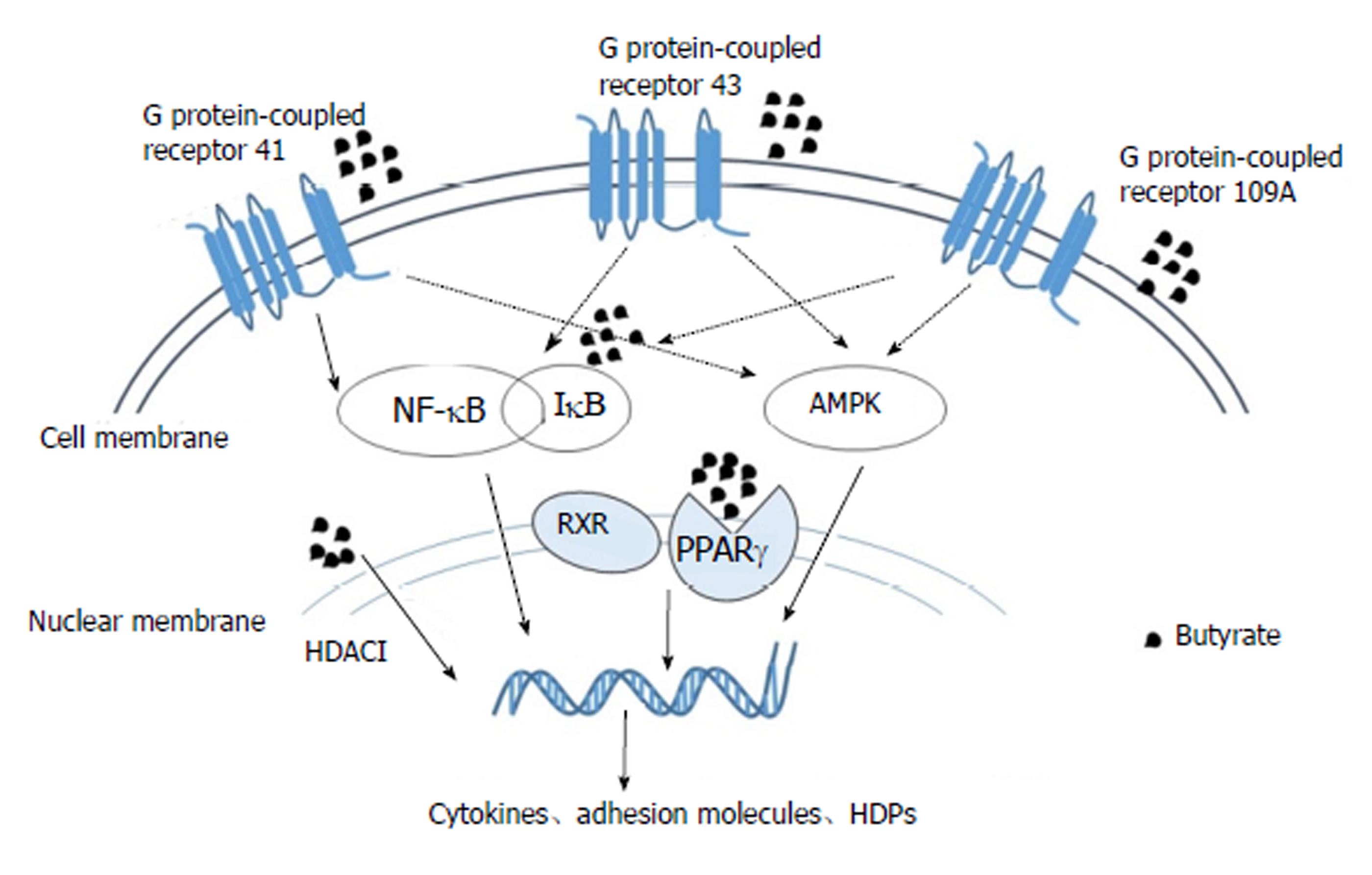
综合以上得出结论, 丁酸主要通过三个方面抑制UC: 一是丁酸作为机体的信号分子, 可以识别膜受体GPR41、GPR43、GPR109A, 进而激活下游的信号通路, 影响炎症因子和趋化因子表达, 增加Treg细胞增殖, 抑制Th1细胞和Th17细胞分化; 二是丁酸可以激活核受体PPARγ, 抑制NF-κB信号通路, 促进紧密连接蛋白表达, 保持肠上皮完整. 三是丁酸作为HDACI, 通过促进组蛋白乙酰化, 抑制炎症基因表达, 促进T细胞凋亡, 促进抗菌肽分泌(如图1). 目前丁酸在抑制UC方面的应用主要是两种形式, 一种是通过增加日粮粗纤维间接增加肠道的丁酸含量, 另一种是直接给机体口服丁酸制剂或者使用丁酸灌肠剂, 就目前的情况来看可能增加日粮粗纤维的方式和口服丁酸制剂的方式更容易被接受.
值得注意的是丁酸抑制UC的机制复杂模糊, 多条途径相互交错, 而目前的研究大部分都注重于机制某一方面或者某一途径的研究, 能够全面考虑丁酸抑制结肠炎分子机制方面的研究还比较少, 以后还需要大量的研究对目前已经得到的结论进行验证, 同时也需要能够全面考虑丁酸抑制UC分子机制各个方面的试验设计. 至于丁酸在UC方面的具体应用, 还需要做大量的试验确定具体的应用形式以及用量, 同时也应该考虑疾病的程度以及动物模型和临床应用之间的差异.
学科分类: 胃肠病学和肝病学
手稿来源地: 江苏省
同行评议报告分类
A级 (优秀): A
B级 (非常好): B, B, B, B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:张砚梁
| 1. | Head KA, Jurenka JS. Inflammatory bowel disease Part 1: ulcerative colitis-pathophysiology and conventional and alternative treatment options. Altern Med Rev. 2003;8:247-283. [PubMed] |
| 2. | Kobayashi M, Mikami D, Kimura H, Kamiyama K, Morikawa Y, Yokoi S, Kasuno K, Takahashi N, Taniguchi T, Iwano M. Short-chain fatty acids, GPR41 and GPR43 ligands, inhibit TNF-α-induced MCP-1 expression by modulating p38 and JNK signaling pathways in human renal cortical epithelial cells. Biochem Biophys Res Commun. 2017;486:499-505. [PubMed] [DOI] |
| 3. | Vinolo MA, Rodrigues HG, Nachbar RT, Curi R. Regulation of inflammation by short chain fatty acids. Nutrients. 2011;3:858-876. [PubMed] [DOI] |
| 4. | Cox MA, Jackson J, Stanton M, Rojas-Triana A, Bober L, Laverty M, Yang X, Zhu F, Liu J, Wang S. Short-chain fatty acids act as antiinflammatory mediators by regulating prostaglandin E(2) and cytokines. World J Gastroenterol. 2009;15:5549-5557. [PubMed] [DOI] |
| 5. | Singh N, Gurav A, Sivaprakasam S, Brady E, Padia R, Shi H, Thangaraju M, Prasad PD, Manicassamy S, Munn DH. Activation of Gpr109a, receptor for niacin and the commensal metabolite butyrate, suppresses colonic inflammation and carcinogenesis. Immunity. 2014;40:128-139. [PubMed] [DOI] |
| 6. | Sakata D, Yao C, Narumiya S. Prostaglandin E2, an immunoactivator. J Pharmacol Sci. 2010;112:1-5. [PubMed] [DOI] |
| 7. | Sina C, Gavrilova O, Förster M, Till A, Derer S, Hildebrand F, Raabe B, Chalaris A, Scheller J, Rehmann A. G protein-coupled receptor 43 is essential for neutrophil recruitment during intestinal inflammation. J Immunol. 2009;183:7514-7522. [PubMed] [DOI] |
| 8. | Vinolo MA, Rodrigues HG, Hatanaka E, Sato FT, Sampaio SC, Curi R. Suppressive effect of short-chain fatty acids on production of proinflammatory mediators by neutrophils. J Nutr Biochem. 2011;22:849-855. [PubMed] [DOI] |
| 9. | Nastasi C, Candela M, Bonefeld CM, Geisler C, Hansen M, Krejsgaard T, Biagi E, Andersen MH, Brigidi P, Ødum N. The effect of short-chain fatty acids on human monocyte-derived dendritic cells. Sci Rep. 2015;5:16148. [PubMed] [DOI] |
| 10. | Vinolo MA, Ferguson GJ, Kulkarni S, Damoulakis G, Anderson K, Bohlooly-Y M, Stephens L, Hawkins PT, Curi R. SCFAs induce mouse neutrophil chemotaxis through the GPR43 receptor. PLoS One. 2011;6:e21205. [PubMed] [DOI] |
| 11. | Furusawa Y, Obata Y, Fukuda S, Endo TA, Nakato G, Takahashi D, Nakanishi Y, Uetake C, Kato K, Kato T. Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells. Nature. 2013;504:446-450. [PubMed] [DOI] |
| 12. | Adams M, Reginato MJ, Shao D, Lazar MA, Chatterjee VK. Transcriptional activation by peroxisome proliferator-activated receptor gamma is inhibited by phosphorylation at a consensus mitogen-activated protein kinase site. J Biol Chem. 1997;272:5128-5132. [PubMed] [DOI] |
| 13. | Kinoshita M, Suzuki Y, Saito Y. Butyrate reduces colonic paracellular permeability by enhancing PPARγ activation. Biochem Biophys Res Commun. 2002;293:827-831. [PubMed] [DOI] |
| 14. | Annese V, Rogai F, Settesoldi A, Bagnoli S. PPARγ in Inflammatory Bowel Disease. PPAR Res. 2012;2012:620839. [PubMed] [DOI] |
| 15. | de Ruijter AJ, van Gennip AH, Caron HN, Kemp S, van Kuilenburg AB. Histone deacetylases (HDACs): characterization of the classical HDAC family. Biochem J. 2003;370:737-749. [PubMed] [DOI] |
| 16. | Tan Y, Zou KF, Qian W, Chen S, Hou XH. Expression and implication of toll-like receptors TLR2, TLR4 and TLR9 in colonic mucosa of patients with ulcerative colitis. J Huazhong Univ Sci Technolog Med Sci. 2014;34:785-790. [PubMed] [DOI] |
| 17. | May MJ, Ghosh S. Signal transduction through NF-κB. Immunol Today. 1998;19:80-88. [PubMed] [DOI] |
| 18. | Aguilar EC, Leonel AJ, Teixeira LG, Silva AR, Silva JF, Pelaez JM, Capettini LS, Lemos VS, Santos RA, Alvarez-Leite JI. Butyrate impairs atherogenesis by reducing plaque inflammation and vulnerability and decreasing NFκB activation. Nutr Metab Cardiovasc Dis. 2014;24:606-613. [PubMed] [DOI] |
| 19. | Lee C, Kim BG, Kim JH, Chun J, Im JP, Kim JS. Sodium butyrate inhibits the NF-kappa B signaling pathway and histone deacetylation, and attenuates experimental colitis in an IL-10 independent manner. Int Immunopharmacol. 2017;51:47-56. [PubMed] [DOI] |
| 20. | Ogawa K, Yasumura S, Atarashi Y, Minemura M, Miyazaki T, Iwamoto M, Higuchi K, Watanabe A. Sodium butyrate enhances Fas-mediated apoptosis of human hepatoma cells. J Hepatol. 2004;40:278-284. [PubMed] [DOI] |
| 21. | Zimmerman MA, Singh N, Martin PM, Thangaraju M, Ganapathy V, Waller JL, Shi H, Robertson KD, Munn DH, Liu K. Butyrate suppresses colonic inflammation through HDAC1-dependent Fas upregulation and Fas-mediated apoptosis of T cells. Am J Physiol Gastrointest Liver Physiol. 2012;302:G1405-G1415. [PubMed] [DOI] |
| 22. | Xiong H, Guo B, Gan Z, Song D, Lu Z, Yi H, Wu Y, Wang Y, Du H. Butyrate upregulates endogenous host defense peptides to enhance disease resistance in piglets via histone deacetylase inhibition. Sci Rep. 2016;6:27070. [PubMed] [DOI] |
| 23. | Dou X, Han J, Song W, Dong N, Xu X, Zhang W, Shan A. Sodium butyrate improves porcine host defense peptide expression and relieves the inflammatory response upon Toll-like receptor 2 activation and histone deacetylase inhibition in porcine kidney cells. Oncotarget. 2017;8:26532-26551. [PubMed] [DOI] |
| 24. | Wang A, Si H, Liu D, Jiang H. Butyrate activates the cAMP-protein kinase A-cAMP response element-binding protein signaling pathway in Caco-2 cells. J Nutr. 2012;142:1-6. [PubMed] [DOI] |
| 25. | Vieira EL, Leonel AJ, Sad AP, Beltrão NR, Costa TF, Ferreira TM, Gomes-Santos AC, Faria AM, Peluzio MC, Cara DC. Oral administration of sodium butyrate attenuates inflammation and mucosal lesion in experimental acute ulcerative colitis. J Nutr Biochem. 2012;23:430-436. [PubMed] [DOI] |
| 26. | Monk JM, Lepp D, Zhang CP, Wu W, Zarepoor L, Lu JT, Pauls KP, Tsao R, Wood GA, Robinson LE. Diets enriched with cranberry beans alter the microbiota and mitigate colitis severity and associated inflammation. J Nutr Biochem. 2016;28:129-139. [PubMed] [DOI] |
| 27. | Hijova E, Soltesova A, Salaj R, Kuzma J, Strojny L, Bomba A. Use of the prebiotic inulin in the prevention of adverse signs of acute colitis. Acta Vet-Beograd. 2015;65:339-347. [DOI] |
| 28. | Bishehsari F, Engen PA, Preite NZ, Tuncil YE, Naqib A, Shaikh M, Rossi M, Wilber S, Green SJ, Hamaker BR. Dietary fiber treatment corrects the composition of gut microbiota, promotes SCFA production, and suppresses colon carcinogenesis. Genes (Basel. ). 2018;9. [PubMed] [DOI] |
| 29. | Hallert C, Björck I, Nyman M, Pousette A, Grännö C, Svensson H. Increasing fecal butyrate in ulcerative colitis patients by diet: controlled pilot study. Inflamm Bowel Dis. 2003;9:116-121. [PubMed] [DOI] |
| 30. | Luceri C, Femia AP, Fazi M, Di Martino C, Zolfanelli F, Dolara P, Tonelli F. Effect of butyrate enemas on gene expression profiles and endoscopic/histopathological scores of diverted colorectal mucosa: A randomized trial. Dig Liver Dis. 2016;48:27-33. [PubMed] [DOI] |
| 31. | Hamer HM, Jonkers DM, Vanhoutvin SA, Troost FJ, Rijkers G, de Bruïne A, Bast A, Venema K, Brummer RJ. Effect of butyrate enemas on inflammation and antioxidant status in the colonic mucosa of patients with ulcerative colitis in remission. Clin Nutr. 2010;29:738-744. [PubMed] [DOI] |
| 32. | Steinhart AH, Hiruki T, Brzezinski A, Baker JP. Treatment of left-sided ulcerative colitis with butyrate enemas: a controlled trial. Aliment Pharmacol Ther. 1996;10:729-736. [PubMed] [DOI] |
| 33. | Hamer HM, Jonkers DM, Renes IB, Vanhoutvin SA, Kodde A, Troost FJ, Venema K, Brummer RJ. Butyrate enemas do not affect human colonic MUC2 and TFF3 expression. Eur J Gastroenterol Hepatol. 2010;22:1134-1140. [PubMed] [DOI] |
| 34. | Ferreira TM, Leonel AJ, Melo MA, Santos RR, Cara DC, Cardoso VN, Correia MI, Alvarez-Leite JI. Oral supplementation of butyrate reduces mucositis and intestinal permeability associated with 5-Fluorouracil administration. Lipids. 2012;47:669-678. [PubMed] [DOI] |
| 35. | Simeoli R, Mattace Raso G, Pirozzi C, Lama A, Santoro A, Russo R, Montero-Melendez T, Berni Canani R, Calignano A, Perretti M. An orally administered butyrate-releasing derivative reduces neutrophil recruitment and inflammation in dextran sulphate sodium-induced murine colitis. Br J Pharmacol. 2017;174:1484-1496. [PubMed] [DOI] |