修回日期: 2018-04-19
接受日期: 2018-04-25
在线出版日期: 2018-05-18
评估玻连蛋白(vitronectin, VTN), ɑ-1-B糖蛋白(alpha 1 B glycoprotein, A1BG), 抗凝血酶Ⅲ(antithrombin-Ⅲ, AT-Ⅲ), 甲胎蛋白(alpha fetoprotein, AFP)对肝细胞癌(hepatocellular carcinoma, HCC)的诊断价值, 筛选最佳检测组合.
利用ELISA方法检测160例HCC患者, 70例慢性乙肝肝炎(chronic hepatitis B, CH)患者, 70例乙肝肝硬化(Liver cirrhosis, LC)患者和50例健康对照(health comparison, HC)人员的血清VTN, A1BG, AT-Ⅲ浓度, 电化学发光方法检测AFP浓度, 分别比较玻连蛋白(VTN), A1BG, AT-Ⅲ, AFP在HCC组, LC组, CH组, HC组中变化情况; 应用ROC曲线分析血清AFP, HRG, A1BG和AT-Ⅲ单项及联合检测HCC的敏感度和特异度; 并以肝病状态(HCC组, 非HCC组)为应变量, 血清AFP, A1BG和AT-Ⅲ测定结果为自变量, 建立HCC诊断综合预测模型.
血清AFP, VTN, A1BG和AT-Ⅲ水平在HCC组, LC组, CH组和HC组之间差异具有统计学意义(F = 1498.93, 51.68, 84.00, 115.34, P<0.05). 1. HCC组和其他组相比, VTN水平差异无统计学意义(F = 1.31), 作为筛查指标相对效能较差. 2. 单独检测时, AFP, HRG, A1BG和AT-Ⅲ曲线下面积(AUC)为0.878, 0.579, 0.712, 0.801, VTN的AUC效能最低, 无诊断价值, 综合预测模型AUC为0.923, 与 AFP, A1BG和AT-Ⅲ比较, 差异均有统计学意义(P<0.05). 3. AFP, A1BG和AT-Ⅲ单独诊断HCC的敏感性分别为70.00%, 64.37%和61.25%, 特异性分别为91.05%, 74.74%和83.68%, AUC分别为0.878, 0.712, 0.801. 综合预测模型的敏感性和特异性为 85.00%和88.42%, AUC为 0.923, 与单独诊断比较, 差异均有统计学意义(P<0.05). 其预测HCC概率P = 1/[1+exp(0.152-0.035 AFP-0.006 A1BG+ 0.021 AT-Ⅲ)], 且具有较好的诊断效能.
AFP, A1BG, AT-Ⅲ联合检测效果优于AFP单独检测, 能够提高肝癌早期诊断率.
核心提要: 前期研究发现ɑ-1-B糖蛋白(alpha 1 B glycoprotein, A1BG), 抗凝血酶Ⅲ(antithrombin-Ⅲ, AT-Ⅲ),玻连蛋白(vitronectin, VTN)与肝细胞癌(hepatocellular carcinoma, HCC)的发病机制密切相关. 本文应用logistic回归和受试者工作特征曲线探讨A1BG, AT-Ⅲ, VTN, 甲胎蛋白对HCC的诊断价值, 为HCC的临床诊断提供新的思路.
引文著录: 范志娟, 刘爽, 张磊, 田亚琼, 刘树业. Logistic回归和ROC曲线分析血清玻连蛋白, ɑ-1-B糖蛋白, 抗凝血酶Ⅲ, 甲胎蛋白在肝细胞癌早期诊断中的价值. 世界华人消化杂志 2018; 26(14): 842-848
Revised: April 19, 2018
Accepted: April 25, 2018
Published online: May 18, 2018
To evaluate the value of combined detection of serum vitronectin (VTN), alpha-1-B glycoprotein (A1BG), antithrombin-Ⅲ (AT-Ⅲ), and alpha fetoprotein (AFP) for early diagnosis of hepatocellular carcinoma (HCC).
ELISA was used to detect the concentrations of serum VTN, A1BG, and AT-Ⅲ in 160 patients with HCC, 70 patients with chronic hepatitis B (CHB), 70 patients with liver cirrhosis (LC), and 50 healthy controls (HC), and electrochemical luminescence was used to detect serum concentration of AFP. The changes of VTN, A1BG, AT-Ⅲ, histidine-rich glycoprotein (HRG), and AFP in different groups of subjects were compared. The sensitivity and specificity of HRG, A1BG, AFP, and AT-Ⅲ, alone or in different combinations, in the diagnosis of HCC were determined by receiver operating characteristic (ROC) curve analysis. Serum AFP, A1BG, and AT-Ⅲ were then used as independent variables to establish a comprehensive prediction model for HCC.
The levels of serum AFP, VTN, A1BG, and AT-Ⅲ were significantly different in the four groups (F = 1498.93, 51.68, 84.00, 115.34, P < 0.05). There was no significant difference in the level of VTN between the HCC group and other groups (F = 1.31), and its performance as a screening index was poor. The areas under the ROC curves (AUCs) of AFP, HRG, A1BG, and AT-Ⅲ were 0.878, 0.579, 0.712, and 0.801, respectively. The AUC of VTN was the lowest, suggesting that it has no diagnostic value. The AUC of the comprehensive prediction model was 0.923, which was significantly higher than those of A1BG and AT-Ⅲ (P < 0.05). The sensitivities of AFP, A1BG, and AT-Ⅲ for the diagnosis of HCC were 70.00%, 64.37%, and 61.25%, respectively, the specificities were 91.05%, 74.74%, and 83.68%, respectively, and the AUCs were 0.878, 0.712 and 0.801, respectively. The sensitivity and specificity of the integrated prediction model were 85.00% and 88.42%, respectively. The AUC was 0.923, which was significantly different from the single diagnosis (P < 0.05). The predictive equation was P = 1/[1+exp (0.152-0.035 AFP-0.006 A1BG + 0.021 AT-Ⅲ)], which had a good diagnostic performance.
Combined detection of serum AFP, A1BG, and AT-Ⅲ can improve the early diagnosis of HCC.
- Citation: Fan ZJ, Liu S, Zhang L, Tian YQ, Liu SY. Value of combined detection of serum vitronectin, alpha-1-B glycoprotein, antithrombin-Ⅲ, and alpha fetoprotein for diagnosis of early hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2018; 26(14): 842-848
- URL: https://www.wjgnet.com/1009-3079/full/v26/i14/842.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i14.842
原发性肝细胞癌(hepatocellular carcinoma, HCC)是发病率和死亡率都较高的一种疾病, 且发病率仍有增高的趋势[1-3]. 我国每年HCC病例中新增病例和死亡病例均近40万例[4], 发病率排名第四, 每10万人的发病数可达29人, 死亡率高居第二, 每10万人的死亡人数达到26人[5]. 早期诊断HCC是提高患者生存率最根本的方法. 目前肝癌的病理学诊断是金标准, 但其创伤性给患者带来很大的痛苦, 不能作为常规诊断方法. 临床用于肝癌筛查的金标准是甲胎蛋白(alpha fetoprotein, AFP), 但AFP对原发性肝癌诊断的灵敏度和阳性预测值都不高, 单一检测AFP会有30%-40%的肝癌患者被漏检, 其检测效能根本无法满足现实中对初发肝癌准确诊断的要求[6,7]. 有研究[8,9]显示ɑ-1-B糖蛋白(alpha 1 B glycoprotein, A1BG); 抗凝血酶Ⅲ(Antithrombin-Ⅲ, AT-Ⅲ), 等2种血清蛋白标志物全部由肝脏合成, 与HCC的发病机制密切相关. 朱伟等[10]和梁晓芸等[11]发现玻连蛋白(vitronectin, VTN)有助于肝癌细胞株SMMC7721的增殖及迁移, 提示VTN在肝癌发生过程中可能具有促进肿瘤细胞生长, 增殖和迁移, 抑制化学物诱导凋亡的生物学作用. 本研究拟通过ELISA方法检测VTN, A1BG, AT-Ⅲ, AFP等4种蛋白标志物在乙肝肝癌患者, 乙肝肝硬化患者, 乙肝肝炎患者和正常对照组血清中的表达水平, 进而应用Logistic回归和受试者ROC曲线探讨VTN, A1BG, AT-Ⅲ, AFP对HCC的诊断价值, 为HCC的临床诊断提供新的思路.
随机收集2015-01/2017-01就诊于天津市第三中心医院肝胆外科及消化内科患者250例. 其中, HCC患者160例; 乙肝肝硬化(liver cirrhosis, LC)者70例; 慢性乙肝肝炎(chronic hepatitis B, CH)患者70例; 并收集健康对照(health comparison, HC)50例作为对照组. 性别及年龄分布见表1.
| 项目 | HCC组 (n = 160) | LC组 (n = 70) | CH组 (n = 70) | HC组 (n = 50) |
| 性别 (男/女) | 17/15 | 18/17 | 16/19 | 13/12 |
| 年龄 | 58.68 ± 7.50 | 60.33 ± 7.21 | 57.79 ± 6.35 | 58.60 ± 7.35 |
| 总蛋白 (g/L) | 76.91 ± 7.80 | 74.17 ± 4.98a | 74.18 ± 4.32a | 74.93 ± 5.21 |
| 白蛋白 (g/L) | 39.91 ± 6.22 | 43.76 ± 4.52a | 42.47 ± 5.14 | 41.61 ± 6.41 |
| 谷丙转氨酶 (U/L) | 43.91 ± 6.69 | 44.21 ± 3.00 | 44.60 ± 2.99 | 45.05 ± 4.27 |
| 谷草转氨酶 (U/L) | 36.78 ± 6.10 | 36.53 ± 4.62c | 38.33 ± 7.76 | 46.79 ± 12.34ae |
| r-谷氨酰转肽酶 (U/L) | 81.32 ± 10.58 | 78.89 ± 9.10 | 80.48 ± 9.30 | 79.14 ± 8.98 |
肝病诊断标准和肿瘤诊断标准符合2000年中华医学会传染病与寄生虫病学分会, 肝病学分会联合修订的"病毒性肝炎防治方案"中病毒性肝炎诊断标准及中华人民共和国卫生部2011 年制定的《原发性肝癌诊疗规范》中的肝癌诊断标准. 健康组肝肾功能正常, 排除肝炎, 肝硬化, 并排除胃肠道肿瘤, 胆胰, 生殖系统及其他系统恶性肿瘤患者.
1.2.1 试剂与仪器: 玻连蛋白(VTN), A1BG, AT-Ⅲ测定采用酶联免疫吸附试验, 试剂分别由武汉华美生物(CUSABIO BIOTHCH CO., LTD)提供. 检测均严格按试剂盒说明书操作. 血清AFP测定采用罗氏Cobas601及其配套试剂(电化学发光免疫法), 参考区间为0 -20 ng/mL.
1.2.2 样本留取及保存: 所有研究对象于清晨空腹采集静脉血3 mL于促凝管中, 3000 r/min离心30 min, 取血清于冻存管中分装保存, 置于-80 ℃冷冻冰箱低温保存备用.
统计学处理 应用SPSS 21.0 软件对数据进行分析, 采用K-S检验几组数据的正态性, AFP, A1BG和AT-Ⅲ水平均为非正态分布的计量资料, 采用M(P25-P75)表示, 各组间差异的显著性用非参数Kruskal-Wallis H检验, 再通过U检验进行两两比较; VTN水平呈正态分布, 用mean±SD示, 多组间比较采用单因素方差分析, 两两比较用LSD法. 使用Binary Logistic进行逐步Logistic回归分析产生各个体预测概率的新变量PRE. 以新变量PRE作为检验变量, 诊断结果为状态变量, 做ROC曲线分析, 计算曲线下面积.
应用IBM SPSS Statistics 21对实验各组样本的一般临床资料(所涉及基本资料均源于LIS系统查询)进行统计学分析, 结果显示患者年龄(F = 1.54, P = 0.20), 性别(χ2 = 0.18, P = 0.67), 均无统计学差异, 证明该实验中所设置的各组别具有可比性. 与LC组相比, HCC组的总蛋白升高(P<0.05)而白蛋白降低(P<0.05); 与CH组相比, LC组的谷草转氨酶降低(P<0.05), 与HC组相比, CH组与HC组呈递减趋势. 表明白蛋白, 总蛋白, 谷草转氨酶三项在各组中存在差异但差异没有特异性 (见表1).
血清AFP, VTN, A1BG和AT-Ⅲ水平在HCC组, 肝硬化组, 慢性乙型肝炎组和健康对照组之间差异具有统计学意义(F = 1498.93, 51.68, 84.00, 115.34, P均<0.001). HCC组与LC组相比, AFP, A1BG和AT-Ⅲ水平差异具有统计学意义(Z = -9.25, -5.20, -5.70, P均<0.05), VTN水平差异无统计学意义(F = 1.10); 乙肝HCC组与慢性乙型肝炎组相比, AFP, A1BG和AT-Ⅲ水平差异具有统计学意义(Z = -8.23, -2.40, -6.76, P均<0.001), VTN水平差异也有统计学意义(F = 1.10, P = 0.007); 乙肝HCC组和非HCC组相比, AFP, A1BG和AT-Ⅲ水平差异具有统计学意义(Z = -12.19, -6.84, -9.71, P均<0.001), VTN水平差异无统计学意义(F = 1.31, P = 0.60). 由此得出初步结论, 作为筛查指标, AFP, A1BG和AT-Ⅲ比较合适, VTN相对效能较差. (见表2).
| 分组 | AFP1 (ng/mL) | VTN2 (μg/mL) | A1BGa (μg/mL) | AT-Ⅲa (μg/mL) |
| 乙肝HCC组 | 57.80 (10.03-347.20) | 354.30±104.96 | 688.06 (559.12-846.10) | 202.51 (177.26-234.22) |
| 乙肝肝硬化组 | 2.93 (2.07-5.54)a | 344.28±75.89 | 570.84 (532.55-616.25)a | 233.66 (217.22-248.58)a |
| 慢乙肝组 | 3.24 (2.19-6.28)a | 400.84±123.15a | 625.41 (524.50-739.93)a | 264.16 (213.55-336.05)a |
| 健康对照组 | 3.27 (2.92-6.22)a | 281.29±46.34 | 483.13 (446.68-542.05)a | 274.99 (255.47-298.33)a |
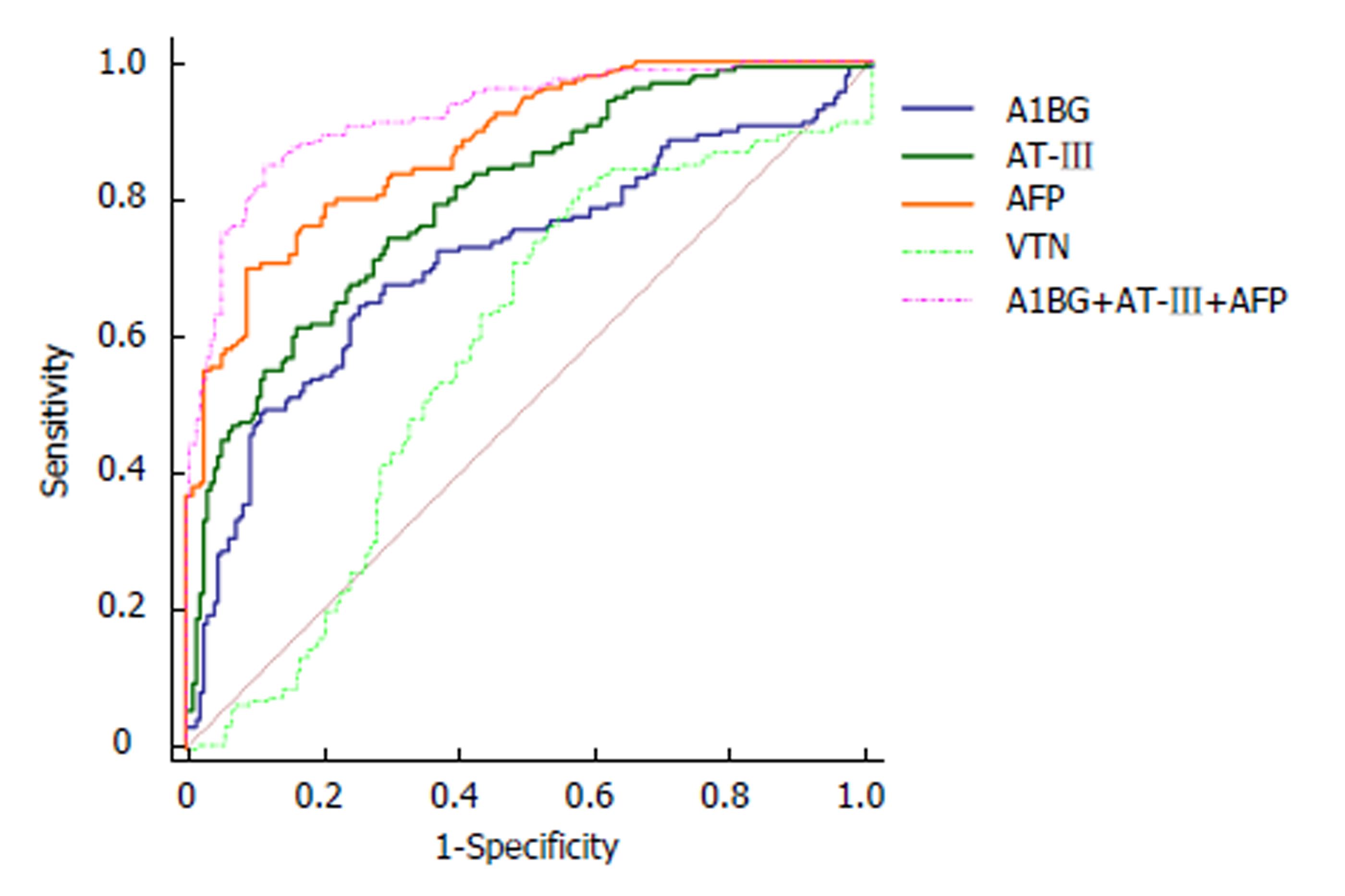
单独检测时, AFP, 玻连蛋白(VTN), A1BG和AT-Ⅲ曲线下面积(AUC)为0.878, 0.579, 0.712, 0.801, HRG的AUC效能最低, 无诊断意义. 综合预测模型AUC为0.923, 与 AFP, A1BG和AT-Ⅲ比较, 差异均有统计学意义(P<0.05). 各指标单独检测HCC的ROC曲线见图1. AFP, A1BG和AT-Ⅲ诊断HCC的敏感性分别为70.00%, 64.37%和61.25%, 特异性分别为 91.05%, 74.74%和 83.68%. 综合预测模型的敏感性和特异性为 85.00%和88.42%.
以肝病状态(HCC组, 非HCC组)为应变量, 血清AFP, A1BG和AT-Ⅲ测定结果为自变量, 建立Logistic回归模型. 获得HCC诊断概率预测模型P = 1/[1+exp(0.152-0.035 AFP-0.006 A1BG+0.021 AT-Ⅲ)], 该模型经过似然比检验, 此回归模型具有统计学意义(χ2 = 7.58, P = 0.476). 以预测变量PRE为检验变量, 诊断结果为状态变量, 做AFP, A1BG和AT-Ⅲ三者联合的ROC 曲线分析(如图1), 其AUC为0.923, 高于任何单独检测的AUC, 差异具有统计学意义(Z = 2.58, P = 0.01). 通过ROC 曲线分析确定最佳cut-off值, 并计算对应检测项目的敏感度, 特异度, 阳性预测值与阴性预测值, 见表3.
| 检测项目 | 敏感度 (%) | 特异度 (%) | 阳性预测值 (%) | 阴性预测值 (%) | AUC |
| AFP | 70.00 | 91.05 | 86.8 | 78.3 | 0.878 |
| HRG | 81.25 | 42.63 | 54.4 | 73.0 | 0.579 |
| A1BG | 64.37 | 74.74 | 68.2 | 71.4 | 0.712 |
| AT-Ⅲ | 61.25 | 83.68 | 76.0 | 71.9 | 0.801 |
| AFP, A1BG and AT-Ⅲ1 | 85.00 | 88.42 | 86.1 | 87.5 | 0.923 |
从表3中可以看出, 利用logistic回归分析得出的预测模型的敏感度和特异度都可以达到85%以上, 阳性预测值与阴性预测值也较单独检测的要高, 说明该预测模型具有较好的诊断效能.
肝细胞肝癌最佳的手术时机是早期肝癌, 但早期多无明显的症状, 体征, 发现时多数已为中晚期, 总体5年生存率<5%[12]. AFP是目前诊断HCC最重要的肿瘤标志物, 已被广泛用于HCC的普查, 诊断, 判断治疗效果和预测复发, 然而其敏感性和特异性均不令人满意, 肝硬化结节, 脂肪浸润, 不典型肝脏炎性病灶及罕见的肝脏良性病变等均可发生AFP升高, 且AFP阴性或低滴度阳性肝癌亦无法与肝脏良性病变鉴别[13] . 课题组前期通过收集乙肝肝癌患者, 乙肝肝硬化患者, 慢性乙肝肝炎患者, 健康人等的血清样本, 采用胰蛋白酶酶解后, 以强阳离子交换与反相C18二维一体色谱柱分离并以超高分辨质谱对多肽液进行检测, 鉴定并筛选A1BG, 抗凝血酶Ⅲ(Anti thrombin-Ⅲ, ATⅢ)和AFP等HCC血清分子标志物.
本研究应用logistic逐步回归方法筛选诊断效能较高的联合检测模式, 纳入该预测模型的指标是AFP, A1BG和AT-Ⅲ, 被剔除模型的是VTN.
VTN含有精氨酸-甘氨酸一天冬氨酸肽序列, 是一种膜相关蛋白, 与血管内皮细胞表面avB3整合素族的特异性结合[14,15], 促进血液循环中的单核细胞和内皮细胞的黏附. avB3广泛表达于多种不同组织来源的恶性肿瘤细胞和血管内皮细胞的表面, 能与基质金属蛋白酶相互作用, 分解纤连蛋白, 对恶性肿瘤的发生发展, 新血管生成和侵袭转移等恶性生物学行为起促进作用[16-18].
在前期研究中, 课题组发现VTN在HBV相关HCC组的水平与HBV肝硬化组, 慢性乙型肝炎组和健康对照组的水平均显著下降. 然而有研究表明, 正常情况下, VTN表达于门静脉系统和中央静脉内皮下的基质中, 在血浆/血清中含量在200 -400 μg/mL[19], 而一旦出现肝细胞癌, 细胞外基质的主要组成便转化为VTN[20], 尤其高表达于窦状隙样脉管周围[21]. 本研究结果与这一研究结论相悖, 通过观察纳入研究的实验对象, 在肝细胞肝癌组存在个别患者的肝功能指标均较差, 其血清VTN含量异常低于其他患者, 甚至是健康人群. 因此考虑部分患者体内存在某种因素导致VTN表达受阻, 具体原因将会在后续研究中进一步研究分析. 在本研究中, 单独检测VTN诊断HCC的敏感度为81.25%, 而特异度仅为42.63%, AUC也仅仅0.579, 无法满足筛查试验的要求, 且通过logistic逐步回归模型建立时也将其剔除, 因此不将其列为筛选指标.
血浆中存在的一种单链糖蛋白AT-Ⅲ归属丝氨酸蛋白酶抑制剂超家族[22], 是一个循环血浆蛋白, 人体关键的生理性抗凝血酶, 凝血功能的主要调节器. 绝大部分AT-Ⅲ在肝脏中生成, 只有小部分在内皮细胞中合成, 当肝癌发生时, 人体肝细胞和内皮细胞均有不同程度的损伤, 脏损伤程度越重, AT-Ⅲ活性越低, 因此, AT-Ⅲ有利于肝脏疾病的诊断与治疗及判断肝脏损伤程度[23-25]. Bechmann等[17]研究发现抗因子 Xa活性与肝脏疾病的严重性呈负相关, 和AT-Ⅲ水平呈正相关, 抗凝血酶本身与肝脏疾病严重程度呈负相关. Saray等[26]通过对慢性病毒性肝炎, 早期肝硬化, 代偿性肝硬化以及失代偿性肝硬化患者的蛋白组学研究发现, AT-Ⅲ水平在代偿性肝硬化和失代偿性肝硬化组中下降, AT-Ⅲ和蛋白C与慢性肝脏疾病严重程度的相关系数分别为r = -0.931, r = 0.789(P均<0.01). 本研究中单独检测AT-Ⅲ用于诊断HCC时, 其敏感性为61.25%, 特异性为83.68%, AUC低于AFP单独诊断HCC, 阳性预测值与阴性预测值都稍低于AFP, 因此AT-Ⅲ单独检测的效能仍不足以满足临床需求.
A1BG在HCC组和肝硬化组都较健康对照组表达增高. A1BG最早由Ishioka等[27]人于1986年在血浆中分离得到, 后陆续有研究学者对其进行探索, 和免疫球蛋白超家族的同源性分析结果为31%, 分子组成中包含IG2结构域4个, 故推测其为归属为免疫球蛋白超家族, 也是参与肝细胞再生的一种糖蛋白. 目前还没有相关研究证实A1BG的表达水平与肝癌的内在关联. 本研究中HCC患者的A1BG水平显著高于对照组, 但其单独诊断HCC的诊断效能不高, 与其他指标联合检测能够提高诊断效能.
AFP是经典肝癌标志物, 目前依然是临床筛查肝癌的金标准. 与多项标志物联合检测肝癌[28-31]. 在本研究中, AFP cut-off值的敏感性70.00%, 特异性91.05%, 其敏感性不能满足临床需求. 应用logistic回归获得的预测模型诊断HCC时, 敏感性显著提高. 故此, AFP, A1BG, AT-Ⅲ联合检测效果优于AFP单独检测, 能够提高肝癌早期诊断率.
诸多癌症之中, 肝癌尤其凶险, 其发病率和病死率均较高, 分别居世界第五位和第二位. 肝细胞肝癌最佳的手术时机是早期肝癌, 但早期多无明显的症状, 体征, 发现时多数已为中晚期, 总体5年生存率<5%. 病理活检是肝癌诊断的金标准, 但其为有创操作, 且有诸多禁忌症. 甲胎蛋白(alpha fetoprotein, AFP)是目前诊断肝细胞癌(hepatocellular carcinoma, HCC) 最重要的肿瘤标志物, 然而其敏感性和特异性均不令人满意.
旨在寻求一种无创, 敏感性和特异性都较高的诊断早期肝癌的方法, 辅助临床提高对早期肝癌的诊断率, 从而提高肝癌患者的生存率.
评估玻连蛋白(vitronectin, VTN), ɑ-1-B糖蛋白(alpha 1 B glycoprotein , A1BG), 抗凝血酶Ⅲ(antithrombin-Ⅲ, AT-Ⅲ), AFP对HCC的诊断价值, 筛选并获得最佳检测组合.
应用电化学发光免疫法检测参与实验人群血清AFP水平, 通过酶联免疫吸附试验测定参与实验人群血清VTN, A1BG, AT-Ⅲ水平. 然后应用ROC曲线分析血清AFP, HRG, A1BG和AT-Ⅲ单项及联合检测HCC的敏感度和特异度并以肝病状态(HCC组, 非HCC组)为应变量, 血清AFP, A1BG和AT-Ⅲ测定结果为自变量, 建立HCC诊断综合预测模型.
血清AFP, VTN, A1BG和AT-Ⅲ水平在HCC组, LC组, CH组和HC组之间差异具有统计学意义, 通过logistic逐步回归方法将AFP, AT-Ⅲ, A1BG三个指标纳入了得出的诊断初发肝癌的概率预测模型中, 最终得出P = 1/[1+exp(0.152-0.035 AFP-0.006 A1BG+0.021 AT-Ⅲ)], 该模型经过似然比检验, 此回归模型具有统计学意义(χ2 = 7.58, P = 0.476). 通过ROC曲线计算出此概率预测模型AUC为 0.923, 与 AFP, A1BG和AT-Ⅲ单独检测的AUC比较, 差异均有统计学意义(P<0.05). 概率预测模型的敏感性和特异性为85.00%和88.42%.
实验得出诊断初发肝癌的概率预测模型P = 1/[1+exp(0.152-0.035 AFP-0.006 A1BG+0.021 AT-Ⅲ)], 该模型经过似然比检验, 此回归模型具有统计学意义(χ2 = 7.58, P = 0.476). 本研究利用Logistic逐步回归筛选出可以纳入概率预测模型的检测指标, 并利用该概率预测模型对初发肝癌进行联合检测, 提高诊断效能. 本研究创新性应用统计学知识, 做到优化的组合检测, 有效提高指标组合检测的诊断效能. 本研究结果有望对临床难以发现的初发肝癌做出及时诊断, 提高肝癌患者的生存质量.
考虑纳入更多便于精准医疗的检测指标, 以实现对初发肝癌的早起诊断, 方便临床予以及时治疗, 提高肝癌患者的生存率.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 崔丽君 电编:张砚梁
| 1. | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68:7-30. [PubMed] [DOI] |
| 2. | Mazzanti R, Gramantieri L, Bolondi L. Hepatocellular carcinoma: epidemiology and clinical aspects. Mol Aspects Med. 2008;29:130-143. [PubMed] [DOI] |
| 3. | Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65:87-108. [PubMed] [DOI] |
| 4. | Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, Parkin DM, Forman D, Bray F. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015;136:E359-E386. [PubMed] [DOI] |
| 5. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 6. | Toyoda H, Kumada T, Tada T, Sone Y, Kaneoka Y, Maeda A. Tumor Markers for Hepatocellular Carcinoma: Simple and Significant Predictors of Outcome in Patients with HCC. Liver Cancer. 2015;4:126-136. [PubMed] [DOI] |
| 7. | 万 豪光, 徐 浩, 顾 玉明, 王 慧, 许 伟, 祖 茂衡, 王 勇, 宗 迎迎. GP73和AFP单项与联合诊断对原发性肝癌诊断应用的Meta分析. 中华检验医学杂志. 2014;37:378-382. [DOI] |
| 10. | 朱 伟, 刘 颖芝, 李 文学, 陈 建玲, 李 军涛, 杨 光宇, 吴 锦银, 梁 晓芸. 玻连蛋白对肝癌细胞株凋亡的抑制效应及可能的机制. 毒理学杂志. 2014;28:180-184. [DOI] |
| 12. | Bruix J, Llovet JM. Major achievements in hepatocellular carcinoma. Lancet. 2009;373:614-616. [PubMed] [DOI] |
| 13. | 安 松林, 肖 汀, 冯 林, 郭 宏林, 荣 维淇, 王 黎明, 吴 凡, 冯 莉, 吴 健雄. 甲胎蛋白阴性与甲胎蛋白阳性肝细胞癌基因表达谱差异研究. 中华普通外科杂志. 2016;31:411-414. [DOI] |
| 14. | Paradis V, Degos F, Dargère D, Pham N, Belghiti J, Degott C, Janeau JL, Bezeaud A, Delforge D, Cubizolles M. Identification of a new marker of hepatocellular carcinoma by serum protein profiling of patients with chronic liver diseases. Hepatology. 2005;41:40-47. [PubMed] [DOI] |
| 17. | Rathinam R, Alahari SK. Important role of integrins in the cancer biology. Cancer Metastasis Rev. 2010;29:223-237. [PubMed] [DOI] |
| 18. | Jiao Y, Feng X, Zhan Y, Wang R, Zheng S, Liu W, Zeng X. Matrix metalloproteinase-2 promotes αvβ3 integrin-mediated adhesion and migration of human melanoma cells by cleaving fibronectin. PLoS One. 2012;7:e41591. [PubMed] [DOI] |
| 19. | Bittorf SV, Williams EC, Mosher DF. Alteration of vitronectin. Characterization of changes induced by treatment with urea. J Biol Chem. 1993;268:24838-24846. [PubMed] |
| 20. | Jaskiewicz K, Chasen MR, Robson SC. Differential expression of extracellular matrix proteins and integrins in hepatocellular carcinoma and chronic liver disease. Anticancer Res. 1993;13:2229-2237. [PubMed] |
| 21. | Roemisch J, Gray E, Hoffmann JN, Wiedermann CJ. Antithrombin: a new look at the actions of a serine protease inhibitor. Blood Coagul Fibrinolysis. 2002;13:657-670. [PubMed] |
| 22. | Bechmann LP, Sichau M, Wichert M, Gerken G, Kröger K, Hilgard P. Low-molecular-weight heparin in patients with advanced cirrhosis. Liver Int. 2011;31:75-82. [PubMed] [DOI] |
| 26. | Saray A, Mesihovic R, Vanis N. Clinical significance of haemostatic tests in chronic liver disease. Medical Archives. 2012;66:231. |