修回日期: 2018-04-02
接受日期: 2018-04-25
在线出版日期: 2018-05-18
检测结肠腺癌中真核翻译起始因子3h(eukaryotic translation initiation factor 3 h , EIF3h)、基质金属蛋白酶-10(matrix metallopeptidase 10, MMP-10)和MMP-11的表达, 分析其相关性.
选择110例经病理医师确诊的结肠腺癌作为观察组, 选择43例结肠黏膜高级别上皮内瘤变组织作为对照组1, 选择43例结肠黏膜低级别上皮内瘤变组织作为对照组2, 选择43例非肿瘤性结肠黏膜组织作为对照组3. 应用免疫组化法检测四组中EIF3h和MMP-10、MMP-11蛋白的表达.
四组中EIF3h、MMP-10和MMP-11的表达差别有统计学意义, 观察组中三种蛋白的表达与淋巴结转移相关, EIF3H的表达与肿瘤最大径、分化程度、增殖指数及TNM分期相关, MMP-10、MMP-11与脉管累犯相关. 三者均与性别、年龄和炎细胞浸润程度无关. 观察组中MMP-10和MMP-11呈正相关.
结肠腺癌中三者高表达是促进肿瘤形成和进展的重要因素之一, MMP-10和MMP-11之间可能具有协同正向作用. EIF3h可能与预后有关.
核心提要: 真核翻译起始因子3h(eukaryotic translation initiation factor 3 h , EIF3h)在结肠腺癌中高表达, 在细胞水平主要表达到细胞浆中, 其高表达在结肠腺癌病变形成过程中具有促进作用, 在肿瘤进展中的作用更明显, EIF3H与基质金属蛋白酶-10(matrix metallopeptidase 10, MMP-10)、MMP-11具有协同正向作用, 认为三种蛋白异常表达具有重要意义, 且EIF3h与预后有关.
引文著录: 沈渊, 沈瑛, 刘江, 施杰民, 丁建. EIF3h、MMP-10和MMP-11在结肠腺癌中的表达及意义. 世界华人消化杂志 2018; 26(14): 834-841
Revised: April 2, 2018
Accepted: April 25, 2018
Published online: May 18, 2018
To detect the expression of eukaryotic translation initiation factor 3h (EIF3h), matrix metallopeptidase 10 (MMP-10), and matrix metallopeptidase 11 (MMP-11) in colonic adenocarcinoma and to analyze their clinical significance.
One hundred and ten colonic adenocarcinoma tissues, 43 high-grade colorectal intraepithelial neoplasia tissues, 43 low-grade colorectal intraepithelial neoplasia tissues, and 43 normal colonic mucosal tissues were collected. The expression of EIF3h, MMP-10, and MMP-11 in the above tissues was detected by immunohistochemistry.
The expression of EIF3h, MMP-10, and MMP-11 differed significantly among the four groups. Expression of EIF3h, MMP-10, and MMP-11 was correlated with lymph node metastasis. Expression of EIF3h was correlated with tumor size, differentiation, proliferation index, and TNM stage. Expression of MMP-10 and MMP-11 was correlated with vascular invasion. There was a positive correlation between MMP-10 and MMP-11 expression in colonic adenocarcinoma.
High expression and synergy of EIF3h, MMP-10, and MMP-11 can promote tumor formation and progression in colonic adenocarcinoma. EIF3h may be associated with the prognosis of colonic adenocarcinoma.
- Citation: Shen Y, Shen Y, Liu J, Shi JM, Ding J. Significance of expression of EIF3h, MMP-10 and MMP-11 in colonic adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2018; 26(14): 834-841
- URL: https://www.wjgnet.com/1009-3079/full/v26/i14/834.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i14.834
结肠腺癌临床常见, 主要发生于中老年人. 来源于结肠黏膜的上皮异型增生, 继发恶变浸润生长. 肿瘤细胞形成时分化程度不同, 其对组织的浸润程度和侵袭能力也不同, 在此过程中均伴随着肿瘤细胞活跃的增殖过程. 与癌变相关的基因与蛋白能促进肿瘤的形成. 真核翻译起始因子(eukaryotic translation initiation factor, EIF)能调控肿瘤的形成, 并对细胞恶性转化有重要的促进作用. 近年研究显示家族中的相关成员与肿瘤的转移相关[1]. EIF3h可以使Met复合物稳定地结合到40S核糖体亚基上, 并有助于保存这个复合物在60S核糖体亚单位之上, 与EIF3h的功能有相似性. 当外源性刺激或有丝分裂信号刺激细胞时, mTOR结合EIF3h复合物, 此种作用可以引起细胞的异型增生, 同时能诱导肿瘤进展. EIF3h的磷酸化可能与细胞的运动相关, 尤其是肿瘤细胞的迁移. 基质金属蛋白酶家族(matrix metallopeptidases, MMPs)是与肿瘤迁移相关的蛋白质, 在肿瘤进展时肿瘤细胞分泌增多, 能破坏基底膜、Ⅳ型胶原等成分. MMP-10和MMP-11是MMPs家族中的重要成员, 可以降解细胞外基质, 并破坏基底膜, 降解肿瘤转移的屏障, 促进肿瘤细胞的迁移[2,3]. 本实验对结肠腺癌中EIF3h、MMP-10和MMP-11的表达特征进行观察, 分析其意义.
收集2014-01/2017-12在湖州市中心医院确诊为结肠腺癌, 并行根治术的患者110例作为观察组, 年龄38-87岁, 平均年龄58.1岁±10.7岁, 其中男57例, 女53例. 纳入标准: (1)符合WHO中结直肠腺癌中的标准及分型; (2)首次发病, 且术前未进行放、化疗. 排除标准: (1)林奇综合征; (2)有肠道手术史; (3)伴有其它器官恶性肿瘤. 收集43例结肠黏膜高级别上皮内瘤变组织作为对照组1, 年龄35-84岁, 平均年龄53.2岁±9.6岁, 其中男22例, 女21例. 收集43例结肠黏膜低级别上皮内瘤变组织作为对照组2, 年龄34-82岁, 平均年龄56.7岁±9.6岁, 其中男23例, 女20例. 选择43例非肿瘤性结肠黏膜组织作为对照组3(均为观察组中的标本, 距肿物边缘大于5 cm的癌旁组织), 年龄39-82岁, 平均年龄55.6岁±9.5岁, 其中男23例, 女20例. 四组的一般临床特征比较, 无明显差别(P>0.05).
1.2.1 EIF3h、MMP-10和MMP-11检测方法: EIF3h、MMP-10和MMP-11的试剂均购自武汉博士德生物公司, 均为浓缩液. 三者的检测均应用免疫组化SP法完成. 先进行预实验, 选择EIF3h(1:150)、MMP-10(1:200)和MMP-11(1:200)的显色最理想的浓度进行实验. 样本的检测基于石蜡切片, 切取4 μm的切片, 三种蛋白的检测应用免疫组化二步法, 具体步骤: (1)二甲苯脱蜡10 min×2次; (2)梯度酒精洗(100%、90%、80%、70%)各1 min; (3)蒸馏水洗片刻; (4)3%H2O2去除内源性酶, 室温10 min; (5)蒸馏水3 min×2次; (6)高压抗原修复; (7)蒸馏水洗3 min×2次; (8)PBS洗3 min×2次; (9)一抗孵育放于湿盒中, 4 ℃过夜; 加一抗放于湿盒中, 4度过夜; (10)PBS洗3min×2次; (11)加一抗孵育30 min 37 ℃; (12)PBS洗3 min×2次; (13)DAB显色 (棕褐色), 镜下控制; (14)自来水冲洗5 min; (15)苏木素复染, 水洗; 梯度酒精 (70%、80%、90%、100%)脱水; (16)切片风干后中性树胶封片. DAB显色. 全程做好质控.
1.2.2 EIF3h、MMP-10和MMP-11结果的判读: 以上皮细胞胞浆中观察到淡黄-棕黄色为阳性反应细胞, 均选择热点区进行观察并评价. 按着色强度和着色百分率进行综合评分. 着色强度: 无着色为0分; 弱着色为1分, 中等程度着色为2分, 强着色为3分. 选择上皮细胞分布区且染色较为明显的区域进行计数, 共选择5个高倍 (400倍)显微镜下的视野, 取平均值, 以<5%为0分, 5%-25%为1分, 以26%-50%为2分, 以>50%为3分. 二者相加, 分值范围是0-6分, 以≤2分为阴性, 以>2分为阳性.
统计学处理 应用SAS6.12完成, χ2检验、t检验、线性相关分析和生存分析, 以P<0.05为有统计学差别.
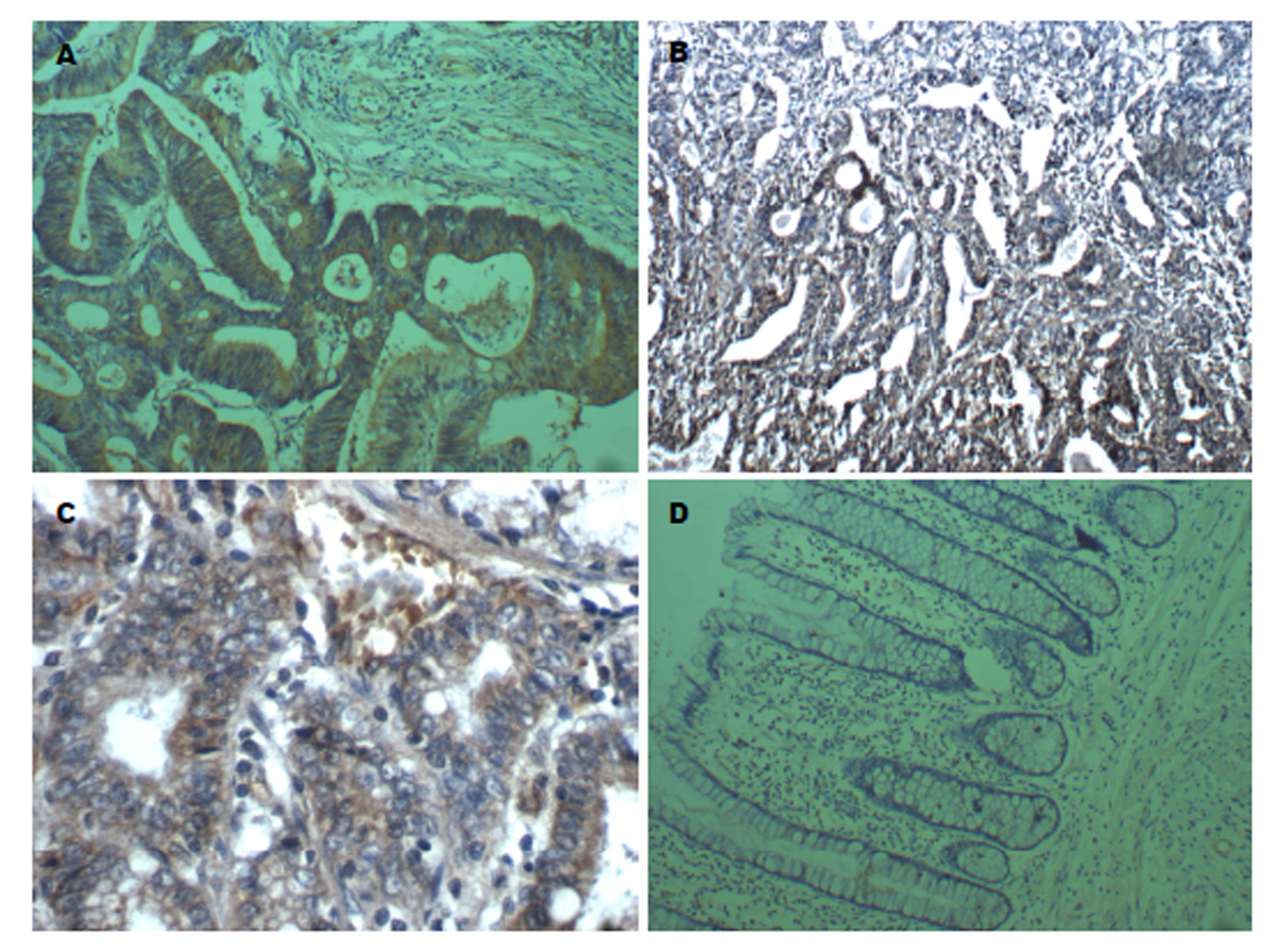
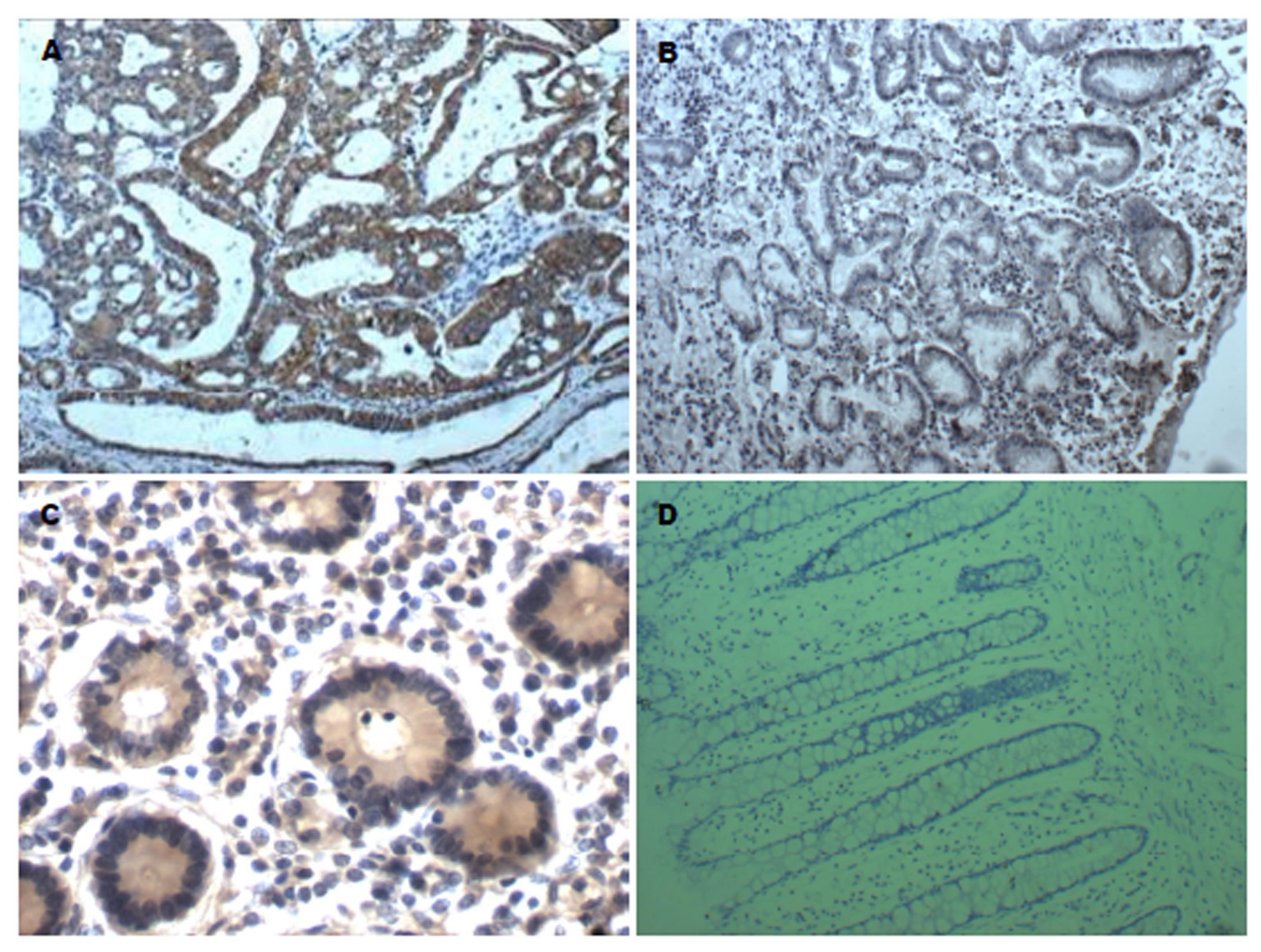
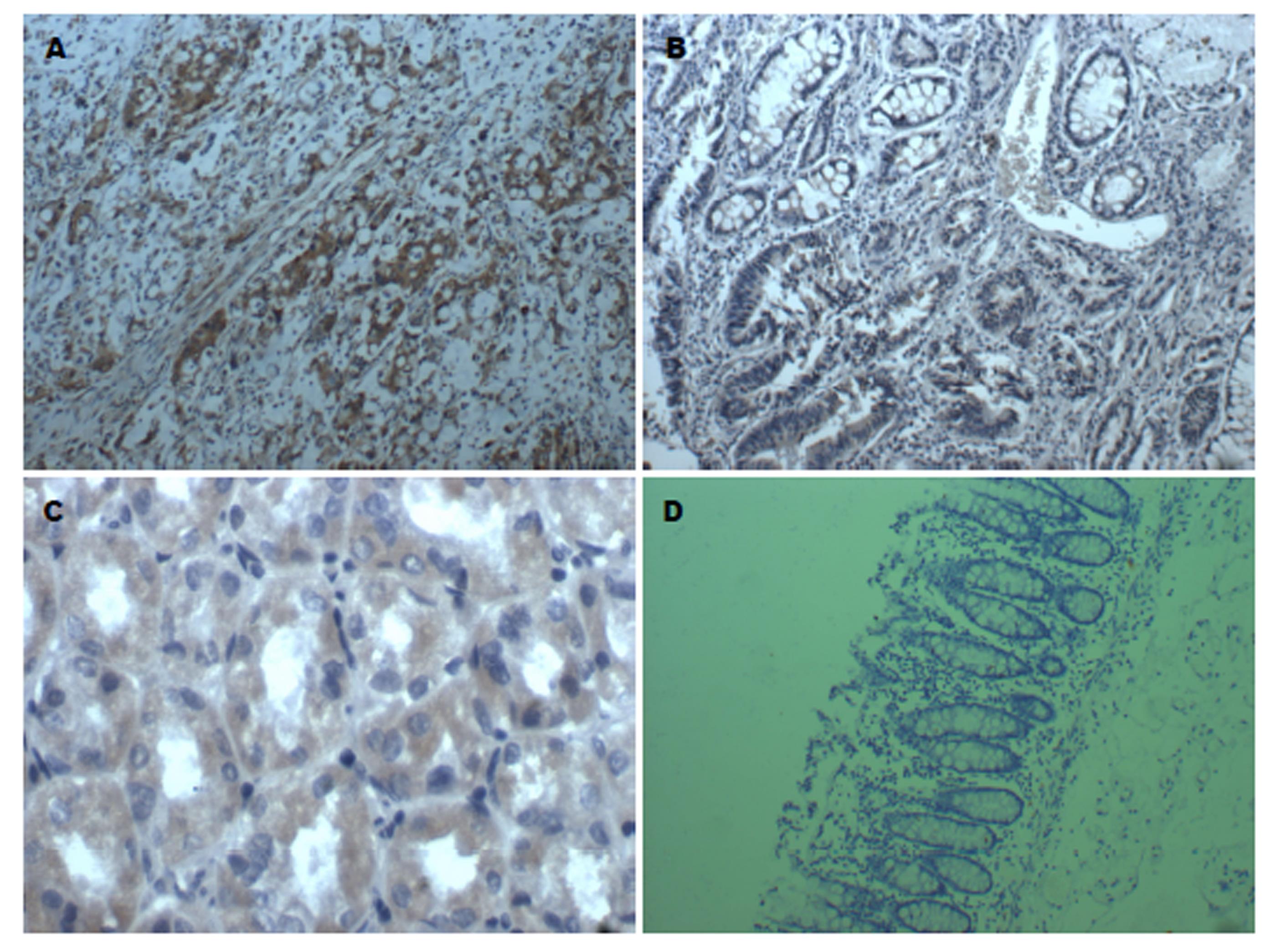
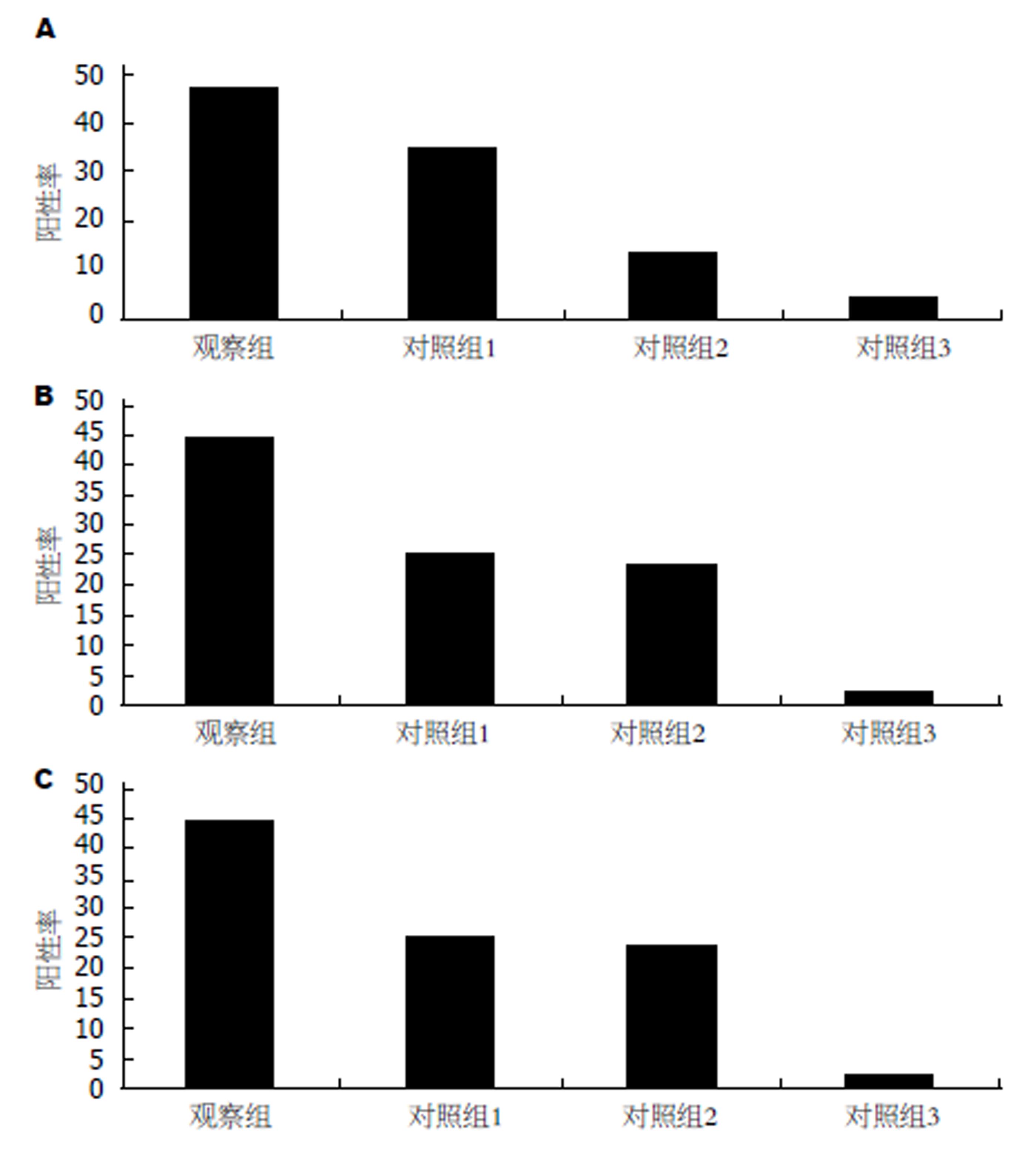
四组中EIF3h、MMP-10和MMP-11的差别有统计学意义, 即对照组3、对照组2、对照组1和观察组中三者蛋白的表达有增高趋势(表1), EIF3h的表达见图1, MMP-10的表达见图2, MMP-11的表达见图3, 柱形图见图4.
| 分组 | n | EIF3h | χ2 | P | MMP-10 | χ2 | P | MMP-11 | χ2 | P | |||
| + | - | + | - | + | - | ||||||||
| 观察组 | 110 | 52 (47.3) | 58 (52.7) | 14.581 | 0.000 | 49 (44.5) | 61 (55.5) | 25.048 | 0.000 | 57 (51.8) | 53 (48.2) | 12.025 | 0.001 |
| 对照组1 | 43 | 15 (34.9) | 28 (65.1) | 11 (25.6) | 32 (74.4) | 9 (20.9) | 34 (79.1) | ||||||
| 对照组2 | 43 | 6 (14.0) | 37 (86.0) | 10 (23.3) | 33 (76.7) | 8 (18.6) | 35 (81.4) | ||||||
| 对照组3 | 43 | 2 (4.7) | 41 (95.3) | 1 (2.3) | 42 (97.7) | 3 (7.0) | 40 (93.0) | ||||||
观察组中三种蛋白的表达均与淋巴结转移相关, EIF3h的表达与肿瘤最大径、分化程度、增殖指数和TNM分期相关, MMP-10、MMP-11与脉管累犯相关. 三者均与性别、年龄和炎细胞浸润程度无关(表2).
| 临床特征 | n | EIF3h | χ2 | P | MMP-10 | χ2 | P | MMP-11 | χ2 | P | |||
| + | - | + | - | + | - | ||||||||
| 淋巴结转移 | |||||||||||||
| 无 | 76 | 28 (36.8) | 48 (63.2) | 10.733 | 0.001 | 28 (36.8) | 48 (63.2) | 5.907 | 0.015 | 34 (44.7) | 42 (55.3) | 4.938 | 0.026 |
| 有 | 34 | 24 (70.6) | 10 (29.4) | 21 (61.8) | 13 (38.2) | 23 (67.6) | 11 (32.4) | ||||||
| 分化程度 | |||||||||||||
| 高-中 | 84 | 32 (38.1) | 52 (61.9) | 12.009 | 0.001 | 39 (46.4) | 45 (53.6) | 0.510 | 0.475 | 45 (53.6) | 39 (46.4) | 0.438 | 0.508 |
| 低 | 26 | 20 (76.9) | 6 (23.1) | 10 (38.5) | 16 (61.5) | 12 (46.2) | 14 (53.8) | ||||||
| 最大径 | |||||||||||||
| <5 cm | 43 | 10 (23.3) | 33 (76.7) | 16.337 | 0.000 | 19 (44.2) | 24 (55.8) | 0.004 | 0.952 | 27 (62.8) | 16 (37.2) | 3.404 | 0.065 |
| ≥5 cm | 67 | 42 (62.7) | 25 (37.3) | 30 (44.8) | 37 (55.2) | 30 (44.8) | 37 (55.2) | ||||||
| 脉管侵犯 | |||||||||||||
| 无 | 88 | 42 (47.7) | 46 (52.3) | 0.036 | 0.849 | 34 (38.6) | 54 (61.4) | 9.219 | 0.013 | 41 (46.6) | 47 (53.4) | 4.815 | 0.028 |
| 有 | 22 | 10 (45.5) | 12 (54.5) | 15 (68.2) | 7 (31.8) | 16 (72.7) | 6 (27.3) | ||||||
| 性别 | |||||||||||||
| 男 | 57 | 22 (38.6) | 35 (61.4) | 3.573 | 0.059 | 26 (45.6) | 31 (54.4) | 0.055 | 0.815 | 29 (50.9) | 28 (49.1) | 0.042 | 0.838 |
| 女 | 53 | 30 (56.6) | 23 (43.4) | 23 (43.4) | 30 (56.6) | 28 (52.8) | 25 (47.2) | ||||||
| 年龄 | |||||||||||||
| <60 | 40 | 22 (55.0) | 18 (45.0) | 1.506 | 0.220 | 14 (35.0) | 26 (65.0) | 2.319 | 0.128 | 25 (62.5) | 15 (37.5) | 2.873 | 0.090 |
| ≥60 | 70 | 30 (42.9) | 40 (57.1) | 35 (50.0) | 35 (50.0) | 32 (45.7) | 38 (54.3) | ||||||
| 炎细胞浸润 | |||||||||||||
| 轻 | 64 | 27 (42.2) | 37 (57.8) | 1.588 | 0.208 | 29 (45.3) | 35 (54.7) | 0.036 | 0.849 | 36 (56.3) | 28 (43.8) | 1.204 | 0.273 |
| 重 | 46 | 25 (54.3) | 21 (45.7) | 20 (43.5) | 26 (56.5) | 21 (45.7) | 25 (54.3) | ||||||
| 增殖指数 | |||||||||||||
| <50% | 43 | 14 (32.6) | 29 (7.4) | 6.491 | 0.011 | 19 (44.2) | 24 (55.8) | 0.004 | 0.952 | 25 (58.1) | 18 (41.9) | 1.130 | 0.288 |
| ≥50% | 67 | 38 (57.4) | 29 (42.6) | 30 (44.8) | 37 (55.2) | 32 (47.8) | 35 (52.2) | ||||||
| TNM分期 | |||||||||||||
| Ⅰ+Ⅱ期 | 81 | 32 (39.5) | 49 (60.5) | 7.435 | 0.006 | 33 (40.7) | 48 (59.3) | 1.800 | 0.180 | 40 (49.4) | 41 (50.6) | 0.730 | 0.393 |
| Ⅲ+Ⅳ期 | 29 | 20 (69.0) | 9 (31.0) | 16 (55.2) | 13 (44.8) | 17 (58.6) | 12 (41.4) | ||||||
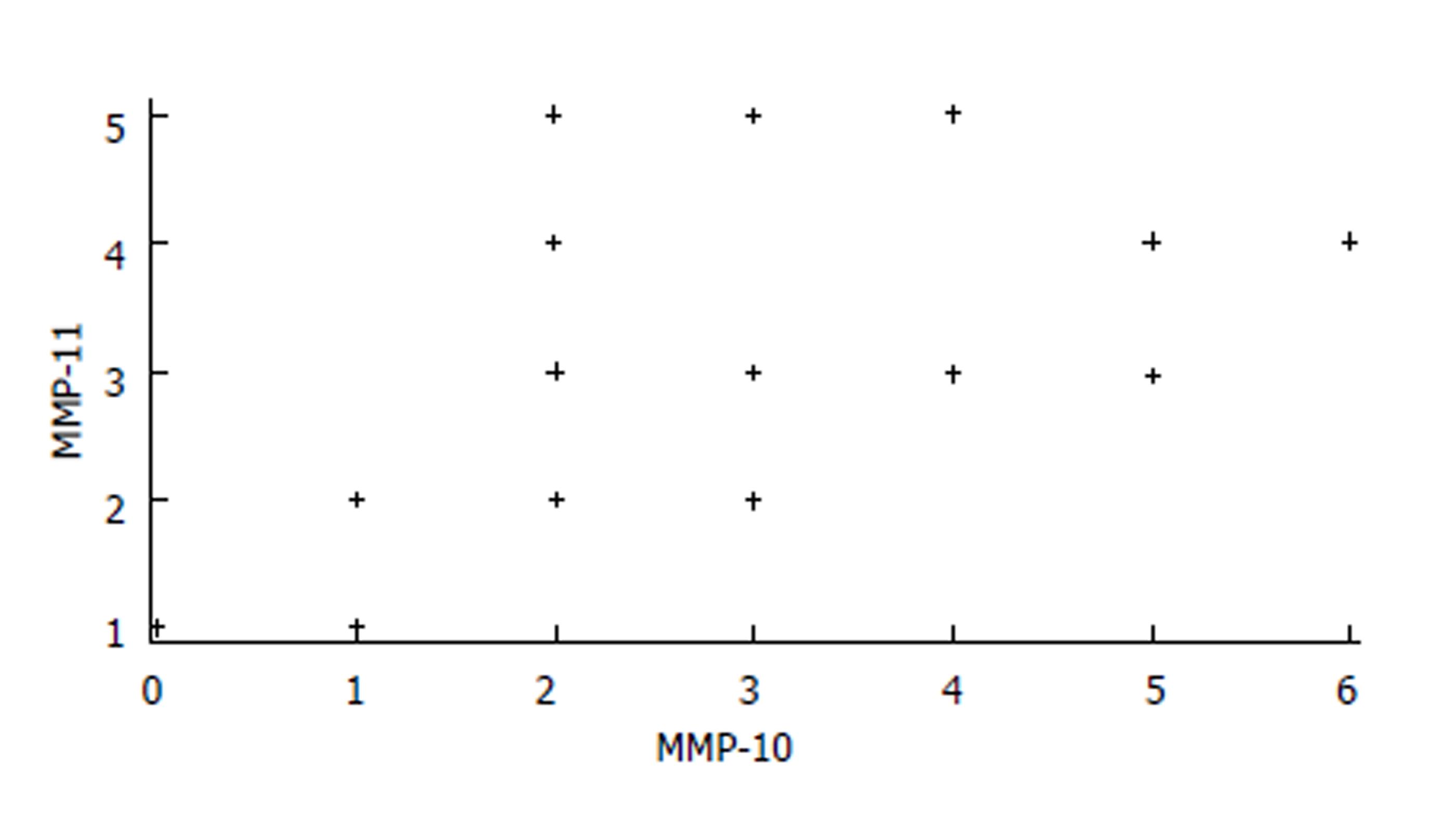
对观察组中三种蛋白的表达进行线性相关分析, 结果显示MMP-10和MMP-11 (r = 0.47, P = 0.0451)呈正相关性. 其余指标间未见明显相关性(P>0.05, 图5).
结肠腺癌表现为腺上皮的异型增生及肌层浸润, 异型增生与分化有明显关联, 与细胞的形态关系密切, 肌层浸润与间质直接相关. 在肿瘤性病变过程中常伴有基因和蛋白表达的失调. 近年认为在上皮性肿瘤形成中特定的时段需要特殊蛋白参与, 如在细胞的翻译初始过程中, 40S核糖体与mRNA结合要特殊蛋白辅助后才具有特殊功能, 这种特殊蛋白包括EIF3h、EIF3f等[4]. EIF3h可以使Met相关产物嵌合在40S核糖体的大亚基上, 其位置在60S核糖体结构域的上方, 在有丝分裂信号刺激后, EIF3h与mTOR形成复合物, 抑制蛋白的磷酸化, 增强S6K1的活性, 并引起细胞分裂, 细胞增殖活性明显, 肿瘤生长加速. 近年也有研究关注EIF3h在肿瘤迁移中的作用, 认为EIF3h对肿瘤转移相关蛋白调节作用明显, 上皮-间质转化能促进肿瘤的迁移[5]. MMP-10和MMP-11是MMPs家族中的重要成员, 可以引起肿瘤间质中的基质成份和基底膜溶解[6,7], 使肿瘤细胞迁移的屏障破坏, 细胞运动能力提高[8,9]. MMP-10也称为间质溶解素2, 与MMP-3的同源性最强, 在慢性损伤和肿瘤侵袭中发挥作用[10,11]. Miyata等[12]认为MMP-10与肾细胞的预后有关, 其调节作用可能与MMP-10对CXCR4/SDF-1轴的调控作用有关[13]. MMP-11还可以作用于丝氨酸蛋白酶抑制因子a1蛋白酶抑制因子, 可以被弗林蛋白酶激活, 参与组织的生理、病理改造过程[14,15]. Peruzzi等[16]认为MMP-11可以参与肿瘤进展的作用, 其对间质的溶解及调控作用可能是肿瘤免疫治疗的靶点.
本研究结果显示结肠黏膜组织、低级别上皮内瘤变、高级别上皮内瘤变和腺癌中EIF3h、MMP-10和MMP-11表达有增高趋势, 提示三者是促进病变形成的重要因素. EIF3h诱导肿瘤形成与其对增殖的调控有关, 主要与TCP-1结合到EIF3h结构域上并折叠有关, 这时其对细胞核的功能有明显促进作用. EIF3h受翻译后其修饰的分子质量大小可能有一定变化, 对腺癌的调控更多是通过PEAK1实现的, 引起细胞间黏附、细胞运动、增殖及上皮间质转化发生改变, 此种作用也能引起肿瘤细胞周围环境出现改变, 基质中的相关成份也对细胞转化有促进作用[17]. MMP-10和MMP-11具有癌基因样的作用, 其与家族中其它成员不一样[18,19], 可能与MMP-10和MMP-11均可受AJUBA的调控作用有关[20]. MMP-10和MMP-11降解a1抗胰蛋白酶或IGFBP-1, 能被多数MT-MMPs在细胞内激活, 并具有活性的形式[21,22]. 多数MMPs以无活性的酶原形式分泌到细胞外后被激活, 二者的底物和活化方式区别于家族其它成员[23]. MMP-10和MMP-11表现为抗凋亡、促进增殖及组织再塑形的作用. 近年研究显示IGF-1活化后可以激活MMP-11的表达[24]. 结果观察组中三种蛋白的表达与淋巴结转移相关, 提示EIF3h、MMP-10和MMP-11是淋巴结转移的促进蛋白. 结果显示EIF3h的表达与肿瘤最大径和增殖指数相关, 提示EIF3h可以促进肿瘤细胞的繁殖, 肿瘤细胞数量增加, 肿瘤生长加速, 肿瘤体积增大. EIF3h的表达与分化程度相关, 提示EIF3h参与到肿瘤细胞分化的动态转变的过程中, 使肿瘤细胞形成的核酸发生变化. 由于分化是细胞由幼稚到成熟的动态变化过程, 也提示EIF3h高表达时能阻止肿瘤细胞向成熟分化, 即EIF3h高表达时, 肿瘤细胞停滞于幼稚的不同阶段, 细胞相对原始, 细胞的形态异型明显, 增殖程度高并具有多向分化的潜能. EIF3h的表达与TNM分期相关, 由于TNM分期是与预后直接相关的指标, 因此EIF3h高表达是肿瘤进展的重要因素, 同时检测EIF3h的表达可能与患者的预后有关, 即EIF3h可能是独立的预后指标. 结果显示MMP-10、MMP-11与脉管累犯相关, 提示二者能促进肿瘤的脉管浸润, 对肿瘤细胞离开原发灶形成转移提供了重要支持. 实验未发现三者与炎细胞浸润程度的关系, 提示三者与肿瘤周围的炎性环境改变无关. 肿瘤在生长过程中形成间质反应, 其主要表现是间质的纤维化和炎细胞浸润, 炎细胞浸润无特殊性, 但是不同级别肿瘤形成时浸润程度不同. 这可能是受炎性相关介质调控的, 而EIF3h、MMP-10和MMP-11均不具有炎性调控的作用. 本实验结果显示MMP-10和MMP-11呈正相关, 提示二者在肿瘤进展中的作用更趋于一致的协同性, 也与二者的结构同源, 功能相近有关. MMP-10和MMP-11均具有血管生成的促进作用, 可以诱导肿瘤间质中CD31阳性的血管新生, 为肿瘤旺炽生长提供营养支持, 同时也为肿瘤细胞播散提供血管通路[25]. EIF3h在上皮间质转化中也有作用, 主要与上皮间质转化时RhoA和Rac1的活化有关[26]. 也有研究认为EIF3h可能通过激活MMPs起作用, 消除内源性EIF3h并通过减少MMP-2的表达来抑制肿瘤血管生成[27]. EIF3h对微管蛋白组装过程可能具有一定的作用, 调节肿瘤细胞的稳定. 此种作用的机制与EIF3h具有核苷二磷酸激酶的特征有关, 微管的聚合程度不足, 细胞不能形成正常的形态, 对诱发转移有一定作用[28].
总之, 结肠腺癌中三者高表达是促进肿瘤形成和进展的重要因素之一, MMP-10和MMP-11之间可能具有协同正向作用. EIF3h可能是独立的预后指标.
结肠腺癌中蛋白表达是临床研究的热点, 目前关于真核翻译起始因子3h(eukaryotic translation initiation factor 3h , EIF3h)在结肠腺癌中的研究较少, 其与基质金属蛋白酶-10(matrix metallopeptidase 10, MMP-10)和MMP-11表达的关系尚未见报道.
针对EIF3h、MMP-10和MMP-11在肿瘤中表达的差别, 本实验探讨三者与结肠腺癌的关系.
结肠腺癌中EIF3h、MMP-10和MMP-11的表达特征、不同临床病理特征中的关系及相关性.
前瞻性研究和对照研究. 主要实验方法为免疫组化检测方法.
研究达到预期目标, 主要发现了结肠腺癌中EIF3h、MMP-10和MMP-11高表达, 明确了肿瘤中三种蛋白的表达与淋巴结转移相关, EIF3H的表达与肿瘤最大径、分化程度、增殖指数及TNM分期相关, MMP-10、MMP-11与脉管累犯相关; 发现了MMP-10和MMP-11呈正相关.
结肠腺癌中三者高表达是促进肿瘤形成和进展的重要因素之一, MMP-10和MMP-11之间可能具有协同正向作用. EIF3h可能是独立的预后指标, 可能对临床有重要意义.
未来可以应用PCR方法检测结肠腺癌中EIF3h、MMP-10和MMP-11mRNA的表达, 在更深层次探讨三者的关系及临床意义.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:张砚梁
| 1. | Schepetilnikov M, Dimitrova M, Mancera-Martínez E, Geldreich A, Keller M, Ryabova LA. TOR and S6K1 promote translation reinitiation of uORF-containing mRNAs via phosphorylation of eIF3h. EMBO J. 2013;32:1087-1102. [PubMed] [DOI] |
| 2. | García-Irigoyen O, Latasa MU, Carotti S, Uriarte I, Elizalde M, Urtasun R, Vespasiani-Gentilucci U, Morini S, Benito P, Ladero JM. Matrix metalloproteinase 10 contributes to hepatocarcinogenesis in a novel crosstalk with the stromal derived factor 1/C-X-C chemokine receptor 4 axis. Hepatology. 2015;62:166-178. [PubMed] [DOI] |
| 3. | Lin CW, Yang SF, Chuang CY, Lin HP, Hsin CH. Association of matrix metalloproteinase-11 polymorphisms with susceptibility and clinicopathologic characteristics for oral squamous cell carcinoma. Head Neck. 2015;37:1425-1431. [PubMed] [DOI] |
| 4. | Ray A, Bandyopadhyay A, Matsumoto T, Deng H, Maitra U. Fission yeast translation initiation factor 3 subunit eIF3h is not essential for global translation initiation, but deletion of eif3h+ affects spore formation. Yeast. 2008;25:809-823. [PubMed] [DOI] |
| 5. | Choudhuri A, Evans T, Maitra U. Non-core subunit eIF3h of translation initiation factor eIF3 regulates zebrafish embryonic development. Dev Dyn. 2010;239:1632-1644. [PubMed] [DOI] |
| 6. | Du X, Lin BC, Wang QR, Li H, Ingalla E, Tien J, Rooney I, Ashkenazi A, Penuel E, Qing J. MMP-1 and Pro-MMP-10 as potential urinary pharmacodynamic biomarkers of FGFR3-targeted therapy in patients with bladder cancer. Clin Cancer Res. 2014;20:6324-6335. [PubMed] [DOI] |
| 7. | Wu D, Li M, Wang L, Zhou Y, Zhou J, Pan H, Qu P. microRNA145 inhibits cell proliferation, migration and invasion by targeting matrix metallopeptidase-11 in renal cell carcinoma. Mol Med Rep. 2014;10:393-398. [PubMed] [DOI] |
| 8. | Li WM, Wei YC, Huang CN, Ke HL, Li CC, Yeh HC, Chang LL, Huang CH, Li CF, Wu WJ. Matrix metalloproteinase-11 as a marker of metastasis and predictor of poor survival in urothelial carcinomas. J Surg Oncol. 2016;113:700-707. [PubMed] [DOI] |
| 9. | Fernandez-Gomez JM, Eiro N, García-Rodríguez JJ, Quintás-Blanco A, Gonzalez-Ruiz de León C, Perez de Haro ML, Vizoso-Piñero F. Metalloproteinase 11, potential marker and molecular target in advanced and castration-resistant prostate cancer. Culture study of peritumoral fibroblasts. Actas Urol Esp. 2017;41:376-382. [PubMed] [DOI] |
| 10. | Gill JH, Kirwan IG, Seargent JM, Martin SW, Tijani S, Anikin VA, Mearns AJ, Bibby MC, Anthoney A, Loadman PM. MMP-10 is overexpressed, proteolytically active, and a potential target for therapeutic intervention in human lung carcinomas. Neoplasia. 2004;6:777-785. [PubMed] [DOI] |
| 11. | Suomela S, Koljonen V, Skoog T, Kukko H, Böhling T, Saarialho-Kere U. Expression of MMP-10, MMP-21, MMP-26, and MMP-28 in Merkel cell carcinoma. Virchows Arch. 2009;455:495-503. [PubMed] [DOI] |
| 12. | Miyata Y, Iwata T, Maruta S, Kanda S, Nishikido M, Koga S, Kanetake H. Expression of matrix metalloproteinase-10 in renal cell carcinoma and its prognostic role. Eur Urol. 2007;52:791-797. [PubMed] [DOI] |
| 13. | Zhang X, Zhu S, Luo G, Zheng L, Wei J, Zhu J, Mu Q, Xu N. Expression of MMP-10 in lung cancer. Anticancer Res. 2007;27:2791-2795. [PubMed] |
| 14. | Périgny M, Bairati I, Harvey I, Beauchemin M, Harel F, Plante M, Têtu B. Role of immunohistochemical overexpression of matrix metalloproteinases MMP-2 and MMP-11 in the prognosis of death by ovarian cancer. Am J Clin Pathol. 2008;129:226-231. [PubMed] [DOI] |
| 15. | Cheng CW, Yu JC, Wang HW, Huang CS, Shieh JC, Fu YP, Chang CW, Wu PE, Shen CY. The clinical implications of MMP-11 and CK-20 expression in human breast cancer. Clin Chim Acta. 2010;411:234-241. [PubMed] [DOI] |
| 16. | Peruzzi D, Mori F, Conforti A, Lazzaro D, De Rinaldis E, Ciliberto G, La Monica N, Aurisicchio L. MMP11: a novel target antigen for cancer immunotherapy. Clin Cancer Res. 2009;15:4104-4113. [PubMed] [DOI] |
| 18. | Greco M, Arcidiacono B, Chiefari E, Vitagliano T, Ciriaco AG, Brunetti FS, Cuda G, Brunetti A. HMGA1 and MMP-11 Are Overexpressed in Human Non-melanoma Skin Cancer. Anticancer Res. 2018;38:771-778. [PubMed] [DOI] |
| 19. | de Vega RG, Sanchez MLF, Eiro N, Vizoso FJ, Sperling M, Karst U, Medel AS. Multimodal laser ablation/desorption imaging analysis of Zn and MMP-11 in breast tissues. Anal Bioanal Chem. 2018;410:913-922. [PubMed] [DOI] |
| 20. | Han J, Choi YL, Kim H, Choi JY, Lee SK, Lee JE, Choi JS, Park S, Choi JS, Kim YD. MMP11 and CD2 as novel prognostic factors in hormone receptor-negative, HER2-positive breast cancer. Breast Cancer Res Treat. 2017;164:41-56. [PubMed] [DOI] |
| 21. | Rahat B, Sharma R, Bagga R, Hamid A, Kaur J. Imbalance between matrix metalloproteinases and their tissue inhibitors in preeclampsia and gestational trophoblastic diseases. Reproduction. 2016;152:11-22. [PubMed] [DOI] |
| 24. | Yonemori M, Seki N, Yoshino H, Matsushita R, Miyamoto K, Nakagawa M, Enokida H. Dual tumor-suppressors miR-139-5p and miR-139-3p targeting matrix metalloprotease 11 in bladder cancer. Cancer Sci. 2016;107:1233-1242. [PubMed] [DOI] |
| 25. | Takeuchi T, Adachi Y, Nagayama T, Furihata M. Matrix metalloproteinase-11 overexpressed in lobular carcinoma cells of the breast promotes anoikis resistance. Virchows Arch. 2011;459:291-297. [PubMed] [DOI] |
| 26. | 吴 继华, 张 建中, 崔 彦, 冯 凯, 周 金莲, 景 青萍, 尚 乐, 丁 华野. EIF3h在结直肠癌组织中的表达及临床病理意义. 第三军医大学学报. 2013;35:2582-2585. |
| 28. | 孙 树军, 刘 清明, 田 军, 周 建明, 张 爱玲. 声门上型喉鳞状细胞癌组织vegf、mmp-2、eif4e的表达及临床意义. 中国耳鼻咽喉颅底外科杂志. 2013;5:332-336. |