修回日期: 2018-03-20
接受日期: 2018-03-28
在线出版日期: 2018-04-08
肥大细胞(mast cells, MCs)的发育源于骨髓CD34+前体细胞, 肠道中MCs被激活后,可以释放多种生物活性介质, 包括组胺、5-HT、类胰蛋白酶等. MCs因其独特的成熟特性和分泌颗粒的多样性在肠道固有和适应性免疫中均起到了至关重要的作用. 多项研究表明, MCs与肠道的多种疾病密切相关, 尤其以炎症性肠病、肠易激惹综合征和肠道过敏性疾病受到广泛关注. 因此, 肠道中MCs的功能及其作用机制在治疗临床相关疾病中的作用不可小觑.
核心提要: 肥大细胞(mast cells, MCs)是人体肠道中重要的免疫细胞. 本文对于MCs的分化和形态学, 分泌介质, 以及肠道中MCs功能, 尤其是MCs在肠道固有免疫, 适应性免疫, 免疫耐受和在肠道疾病中作用的研究进展引起广泛关注.
引文著录: 王雪, 郝贵亮, 高琛琛, 王跃秀, 刘玥宏, 仇志强, 李利生, 徐敬东. 肠道卫士肥大细胞及其功能研究进展. 世界华人消化杂志 2018; 26(10): 601-608
Revised: March 20, 2018
Accepted: March 28, 2018
Published online: April 8, 2018
Mast cells develop from the CD34+ precursor cells in bone marrow, are activated in the gut, and can release a variety of bioactive mediators, including histamine, 5-hydroxytryptamine, and tryptase. They play a crucial role in intestinal innate and adaptive immunity because of their diverse secretory granules and unique mature characteristics. Many studies have shown that a variety of intestinal diseases have close relationship with mast cells, especially inflammatory bowel disease, irritable bowel syndrome, and intestinal allergic diseases, which has attracted extensive attention. In this paper, we review the function and mechanism of intestinal mast cells and their role in the treatment of related clinical diseases.
- Citation: Wang X, Hao GL, Gao CC, Wang YX, Liu YH, Qiu ZQ, Li LS, Xu JD. Intestinal mast cells and their function. Shijie Huaren Xiaohua Zazhi 2018; 26(10): 601-608
- URL: https://www.wjgnet.com/1009-3079/full/v26/i10/601.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i10.601
肥大细胞(mast cells, MCs)是人体主要的免疫细胞, 发育源于骨髓CD34+前体细胞, 广泛的分布在组织中, 并且主要存在于宿主与外界相交的通道, 也就是病原体的潜在入口或者与有害物质的交界处, 例如皮肤、呼吸道黏膜或者胃肠道[1]. 这种分布特点就使它成为造血-免疫系统中首先与环境中的变应原及病原体相互作用的细胞群. MCs首先在1878年由Paul Ehrlich描述, 主要被看做过敏反应的效应细胞, 特别是在过敏反应的早期和急性阶段[2]. MCs在IgE介导的过敏反应中起到了非常重要的作用, 如哮喘、食物过敏等. MCs是由异质性的细胞群组成, 它们可以分泌许多种不同的生物活性产物, 从而影响多种生理过程[3-7]. 越来越多的证据表明, MCs的成熟, 表型, 功能是其所处的微环境对其影响的结果, 而且所处的微环境对其通过释放一系列生物活性介质而特异性的识别和应答不同的刺激有显著的影响[2]. 众所周知, 肠道是人体最大的免疫器官, 人类每天摄入食物中含有大量病原微生物, 肠道的机械、生物、化学、免疫屏障等是抵御这些微生物的关卡, 而肠道免疫屏障又是尤其的重要.肠道免疫屏障包括肠上皮细胞(intestinal epithelial cell, iEC)及肠道内的黏膜免疫相关淋巴组织(gut associated lymph oid tissue, GALT)组成. 胃肠道中含有的大量MC在神经-免疫-内分泌网络调节中起到了关键性作用, 并参与人体多种生理和病理功能调节. 本文就肠道中MCs形态特点, 分泌介质, 机制及其在肠道中的功能予以综述.
MCs源于骨髓CD34+前体细胞, 造血组织来源的细胞一般在被释放到血液之前就在骨髓中分化和成熟, 而MCs并非如此, MCs是以未成熟的前体细胞形式经血流到外周组织, 并且在外周组织中完成分化[8]. 在血液中只标记出一种同骨髓中MCs前体细胞(mast cell precursor cells, MCcp)一样的只能够被MCs抗体mAb BGD6结合的细胞,这种细胞即MCcp, 而这些前体细胞可以在外周组织中继续增殖与分化[9]. 这种特殊的成熟机制可能赋予了MCs根据所处环境不同而特异性分化以及合成分泌不同介质的特性.
上世纪六十年代, 瑞典科学家Enerback根据细胞的大小,分布位置和染色特性确定了大鼠[10]和小鼠[11,12]胃肠道中MCs的两种亚型,这两种亚型分别是黏膜MCs(mucous mast cells, MMCs)和结缔组织MCs(connective tissue mast cells, CTMCs). 组织化学染色方法上的区别[13,14]可以证明CTMCs和MMCs分泌颗粒中分别包含了不同的基本物质, 即CTMC的分泌颗粒[13]中含有大量肝素而MMCs[14]的分泌颗粒中主要包含了硫酸软骨素和黏多糖. 在胃肠道,经典的CTMCs广泛分布于黏膜下层,浆膜层和肠系膜. 而MMCs则分布在固有层,且数量十分稀少. 人类成熟MCs根据所含酶的不同分为两种亚型: 类胰蛋白酶/糜酶(tryptase/chymotrypsin mast cell, MCT/C)亚型的颗粒中含有类胰蛋白酶, 糜酶和羧肽酶, 而MCT亚型的颗粒中只含有类胰蛋白酶[10,11]. MCT亚型MCs主要存在于肠道和肺的黏膜层, 而MCT/C亚型主要存在于皮肤和淋巴结,也存在于肺和肠道的黏膜下层[12,15], 这两种类型的MCs在肠道的作用不同引起了广泛关注[11].
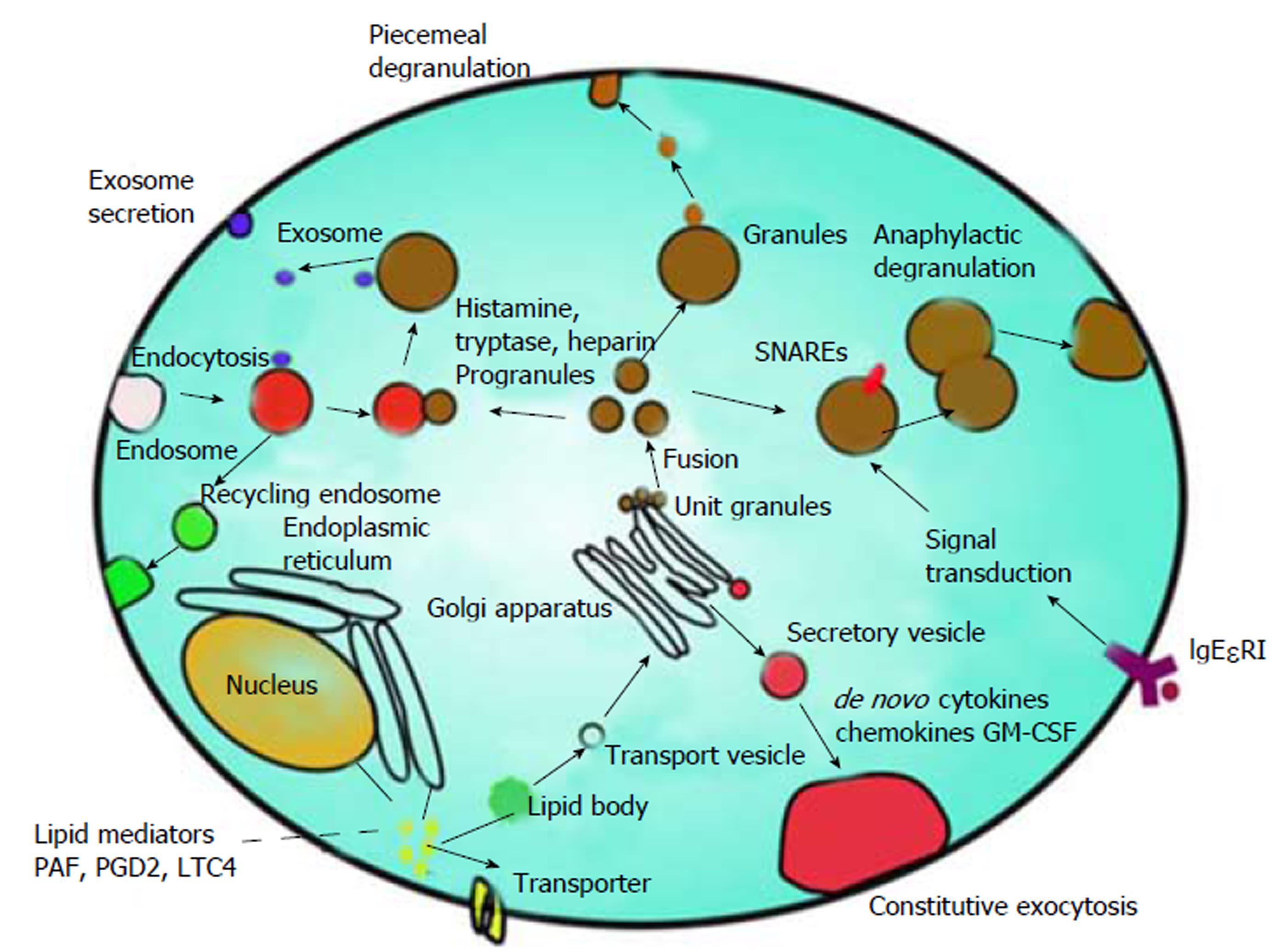
MC的激活可以释放三类不同的介质: (1)储存在MCs胞质颗粒中的介质; (2)来源于细胞膜脂的脂质介质; (3)转录激活后新合成的介质, 并且这种介质的调节依赖于刺激和受体的类型[16]. MCs所分泌的介质包括生命所必需的胺类, 包括组织胺, 5-羟色胺[16]; 几种丝氨酸蛋白酶,包括类胰蛋白酶-α, -βⅠ, -βⅡ, -βⅢ, -γ[蛋白酶丝氨酸S1家族(PRSS)[17]]-θ, 糜酶-1, 组织蛋白酶G, 颗粒酶B, 和羧肽酶A3[17]; 溶酶体酶(b-葡萄糖醛酸酶, b-氨基己糖苷酶, 芳香基硫酸酯酶, 还有一些细胞因子如TNF, bFGF, IL-4和SCF[18]; 蛋白聚糖(肝素,硫酸软骨素)等多种生物活性物质. 这些物质参与多种机体功能的调节(如图1所示).
人体的胃肠道是机体与外界环境最早也是最频繁接触的部位之一, 不可避免的成为了体内免疫系统和病原微生物相互作用的主要部位. 肠道黏膜屏障包括机械屏障、免疫屏障、生物屏障、化学屏障等. 而消化道是机体独立的免疫器官,免疫功能异常可能与肠道疾病的发生有关. MCs在肠道中"策略性"的分布反映了这种细胞在抵御环境危险因素时提供了防御的特殊防线的作用, 以及通过分泌不同的介质调节局部和系统的炎症反应, 在固有以及适应性免疫应答中的重要角色.
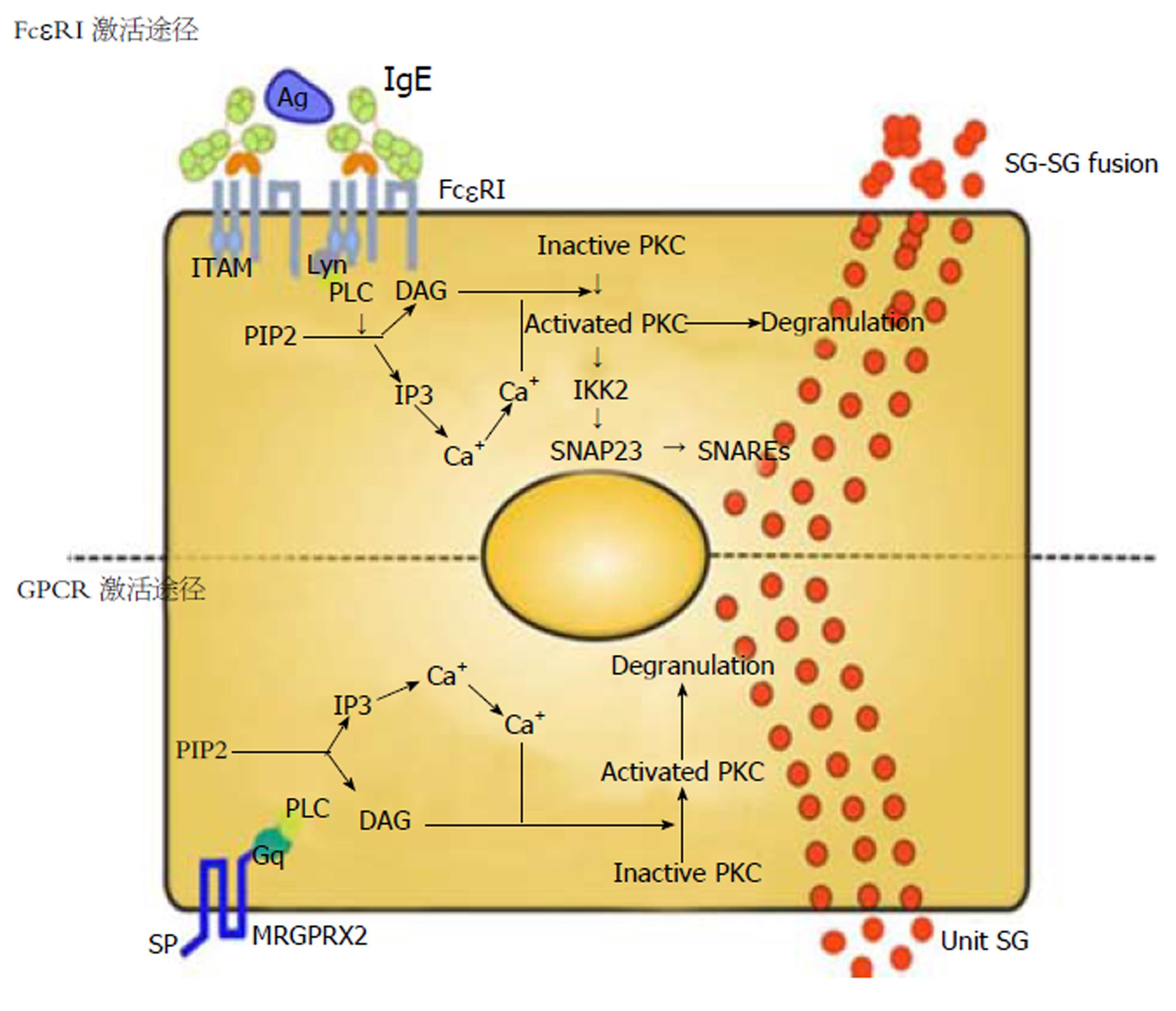
肠MMCs表面有模式识别受体(pattern recognition receptor, PRR), 其中主要包括Toll样受体(TLRs), NOD样受体(NOD like receptor, NLRs), RIG-I样受体(RLRs),趋化性受体(chemotaxis receptor, CXCR1, CXCR2), 过敏毒素受体(anaphylaxis receptor, C3aR, C5aR)和高亲和力IgE Fc受体(FcεRI), 能够被病原体表面病原相关PRR、C3a, C5a或FcεRI识别结合而激活或者处于致敏状态. 而这些受体可以大致分为两类, 一类是G蛋白偶联受体, 另一类是高亲和力IgE Fc受体(FcεRI),两类受体都可以介导MCs的脱颗粒, 只不过在脱颗粒的时程和形式有所不同(如图2所示). 肠MMCs被活化后, 释放多种活性炎症介质, 包括组胺、5-羟色胺(5-HT)、类胰蛋白酶等, 这些介质分别在肠道中起到了重要的作用.
3.1.1 组织胺: 组织胺(Histamine,简称组胺)是MCs分泌介质中最早被发现的, MCs脱颗粒释放预形成的介质是在刺激后的早期和快速反应时期, 即可以在刺激后的15-90 s内释放大量的组胺.组胺的增加可以引起扩张血管, 收缩支气管, 增加毛细血管的渗透性, 收缩平滑肌, 这些功能与过敏和炎症反应有着密切的关系. 最近的研究表明组胺在调节树突状细胞(dendritic cell, DC)功能上起到了重要作用[19], MC 产生的组胺可以通过H1、H2受体增加DC MHCⅡ类分子和协同刺激分子的表达促进其发育成熟. 大量的研究证明组胺对胃肠功能, 尤其是对肠道的运动、分泌吸收等有多种调节作用. 组胺可能是调节黏膜屏障功能的重要因素.完整的肠黏膜上皮及细胞间的紧密连接构成了肠黏膜机械屏障, 有学者[20]采用失血感染模型观察组胺对大鼠肠道细菌移位的影响时证明, 一定浓度和作用时间的组胺可显著减少入侵上皮细胞内的大肠埃希菌数. 研究证实[21], 组胺是一种高效的类胰蛋白酶刺激剂, 可诱导人结肠MCs释放类胰蛋白酶, 类胰蛋白酶刺激上皮细胞DNA的合成和增生, 参与上皮修复, 对肠道具有保护作用, 给予小剂量组胺有保护肠黏膜屏障、抑制肠道细菌移位的功能. 组胺能促进肠黏膜厚度的增加, 杯状上皮细胞数目增加, 黏液及黏蛋白分泌增多. 组胺还可以可通过HR1和HR2增强肠壁平滑肌的收缩, 增强肠道平滑肌蠕动, 减少细菌在肠道的停留时间. 组胺的促进蠕动作用对抑制细菌移位有重要意义.
3.1.2 5-羟色胺: 5-羟色胺(5- serotonin, 5-HT)是由MCs分泌的另一种重要的生物胺, 是脑-肠轴的关键递质, 5-HT作为一种神经递质通过启动脑-肠轴调节, 而影响胃肠道运动、胃酸分泌及内脏感觉[22]. 同时, 5-HT作为一种配体与肠壁上相应亚型5-HT3、5-HT4、5-HT7等受体相互作用, 启动多种信号通路, 进而影响胃肠道离子转运, 引发腹痛、腹泻、腹部不适等[23]. 5-HT转运蛋白(5- serotonin transporter protein, SERT)是一种膜传递蛋白,其与5-羟色胺有很高的亲和力, 其主要作用是在数量、时间上对5-羟色胺的神经传递进行精细调控, 大部分5-HT在效应部位发挥生理效应之后迅速被SERT重新摄取而失去其相应功能, 其余由单胺氧化酶分解代谢. 因此, 5-羟色胺转运蛋白在5-羟色胺信号系统中至关重要. Colucci等[24]发现虽然SERT的基因多态性与IBS症状之间缺乏直接证据, 但5-HT转运蛋白基因的L/S和S/S型(SERT基因启动子区5-HTTLPR有3种等位基因片段长短, 分为S、L、XL. 共有5种基因型: S/S、S/L、S/XL、L/L、L/XL.)的确与IBS症状的严重程度明显相关. 因此, 5-HT在IBS的发病中发挥了重要作用, 且SERT则与IBS的严重程度密切相关, 但是目前还缺乏直接证据证明SERT与IBS发病的关系, 但这为临床治疗IBS提供了新的思路.
3.1.3 类胰蛋白酶: 有研究报道MC中含有一定量的胰蛋白酶活性物质, 在1981年Schwartz等进一步纯化这种酶后发现, 它是由MC释放的, 其活性90%以上来自一种酶, 故命名为类胰蛋白酶(Tryptase). Miller等[25]在1989年克隆了第一种类胰蛋白酶cDNA, 其后又有几种类胰蛋白酶被克隆. 目前, 类胰蛋白酶在cDNA和蛋白水平被分为三类: α、β、γ, 其中β含量最高, 而MCs类胰蛋白酶(mast cell tryptase, MCT)是由MCs释放的一种炎症介质. 血清MCT主要为无活性的前体β-类胰蛋白酶(precursor beta tryptase), Pereira等[26]阐明了人β-类胰蛋白酶的晶体结构为指环状的同源四聚体,其晶体由四个单体构成. α-类胰蛋白酶是没有活性的四聚体结构,仅有单体形式. β-类胰蛋白酶和γ-类胰蛋白酶结构相似其水平可以持续稳定地反映体内总的MCs分泌物含量因此常常这为MCs的标记分子. MCs被激活脱颗粒后, 由于组织内相对高的pH值环境及温度, 四聚体结构的β-类胰蛋白酶部分降解为有活性的单体, 这种有活性的单体, 即成熟的β-类胰蛋白酶能够在短时间内快速地加重全身过敏反应[27], 蛋白酶活化受体-2(protease activated receptor-2, PAR-2)广泛分布于iEC、MCs、内皮细胞、肠感觉神经元等.MCT通过激活PAR-2来增加肠上皮的通透性[28], 同时引起PAR-2阳性伤害感受神经元兴奋性增高, 释放P物质和降钙素基因相关肽等兴奋性神经递质, 传递伤害性信息, 导致IBS患者腹痛、腹胀等内脏高敏感性症状发生.
3.2.1 固有免疫和适应性免疫: 作为机体重要的固有免疫细胞之一, MCs参与对细菌、寄生虫、真菌和病毒进行早期和快速的反应[29]. MCs可以通过不同的机制识别病原体, 包括通过MCs膜上病原相关分子模式(pathogen-associated molecular patterns, PAMPs)受体与病原体或者病原体的某一组分直接结合, 通过膜表面免疫球蛋白或补体受体与黏附了抗体或补体的细菌结合, 识别被感染或者受损的细胞的内生肽[30]. Toll样受体1-7和9(TLRs)、NOD样受体(NLRs)、维甲酸诱导基因1受体(Retinoic acid induced gene 1 receptor, RLRs)、和补体受体在固有免疫应答中起到重要的作用[31-33]. MCs的PRR包括TLRs、NLRs、RLRs,MCsTLR4介导的LPS的识别在盲肠结扎和穿孔小鼠中起到了保护性的作用[34], 而且可以增加MCs促炎症细胞因子TNF-a和 IL-6,以及抗炎因子IL-13的释放, 而不引起脱颗粒.在炎症情况下, 补体对于MCs的激活非常重要.而补体成分C3缺乏的小鼠不能够激活补体通路, 该小鼠对于盲肠结扎和穿孔更加敏感,而且腹膜的MCs的脱颗粒, TNF-a的产生, 中性粒细胞的渗透以及细菌的清除能力均降低[35]. 还有一些物质可以激活MCs而不需要特定的受体, 包括细菌毒素和多聚阳离子化合物,比如防御素等[35,36]. MC被病原体激活后, 有两种效应机制: 可迅速以脱颗粒的方式释放组胺和脂性介质, 如白三烯, 也能以非脱颗粒的方式释放大量细胞因子和趋化因子. 而且不同的介质的释放方式不同, 非脱颗粒形式释放的介质与小囊泡有关, 而与大的分泌颗粒(约1 μm)无关[37,38].
由此可见, MC 参与机体抵御外来微生物侵袭过程的一个重要机制: 即在固有免疫应答中, MCs有着储存预先形成的TNF-a的特殊能力[39]. TNF-a可以在几分钟之内被释放. MCs这种释放TNF-a的能力对于启动炎症反应非常重要, 因为TNF-a能够使中性粒细胞快速募集[40], 从而快速启动固有免疫应答.
MC参与机体抵御外来微生物侵袭免疫过程的另一个重要机制: 即在适应性免疫中, MCs可以吞噬和杀死[41,42]结合有补体或者免疫球蛋白的细菌[41]并将吞噬细菌的抗原提呈给T细胞[42]. 体外研究显示, MCs能通过MHCI和 MHCII 复合体加工和提呈抗原[43,44]. MCs及其分泌的介质可以直接调节树突细胞的激活和向感染组织淋巴结转移[45], 从而发挥树突状细胞呈递抗原与启动细胞免疫的作用. 而且MCs可以通过TNF的释放直接激活T淋巴细胞[46]. 它产生的脂质介质可以募集T细胞到淋巴结并诱导抗原特异性CD8+ T细胞的活化和增殖, 使其分泌IL-2和巨噬细胞炎性蛋白. 由此观之, MCs在肠道即刻和早期固有免疫应答中起到了关键作用, 而在启动和调节适应性免疫应答中具有不可替代的作用.
3.2.2 免疫耐受: 消化道作为动物机体接触外界环境中抗原物质最广泛的部位, 正常情况下, 一方面需要对无害的抗原如食物、共生微生物等做出免疫耐受, 即具有免疫活性的细胞接触抗原性物质时所表现的一种无应答状态, 避免由于对无害抗原起反应而浪费免疫资源[47]; 另一方面对病原体产生免疫排斥与清除. 肠道由于缺乏识别某些微生物抗原的受体或肠道细胞表面存在抑制性受体和结构均可使肠道对共生微生物产生天然性免疫耐受. 成熟T细胞或B细胞的活化需要2种或以上的信号进行启动.而当部分信号因子被抑制时, T细胞或B细胞就不能被活化, 从而处于无反应状态, 形成获得性免疫耐受. Man-tovani等[48]的研究表明了IL-4和IL-10可以抑制依赖IFN-依赖的炎性趋化因子CXCL10和CCL5等的产生; 同时, IL-10可以抑制抑制性kB激酶(inhibitory kappa B kinase, IKK)的活性进而抑制NF-ĸF的活化, 间接抑制参与免疫反应的T细胞和B细胞的活化形成免疫耐受. MCs在免疫耐受中所起到的作用还是一个较新的探索领域.有研究显示[49], 相对于MCs在过敏疾病中促进炎症反应的作用, MCs在CD4+CD25+Foxp3+调节性T细胞[T(Reg)]依赖的外周耐受中也起到了重要作用. MCs的生长和激活因子--高水平的IL-9是由调节性T细胞产生. IL-9对于MCs募集到耐受组织并且将其激活的过程具有重要作用. MCs还可以通过IL-10的分泌限制免疫应答的持续时间和应答的强度, 且可以通过IL-10和TGF-β的释放抑制IgE介导的依赖FcεRI途径的细胞脱颗粒, 从而抑制免疫应答[50-52]. 因此MCs在肠道免疫耐受中起到一定作用, 成为肠道免疫研究的新明星靶细胞.
炎症性肠病(inflammatory bowel disease, IBD)是一种原因不明的累及胃肠道的慢性炎症性疾病, 包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩氏病(Crohn's disease, CD). 发病的高峰年龄在15-30岁和60-80岁. IBD的发病机制包括免疫细胞被不明刺激物(微生物、食物成分、细菌或自身抗原)激活而导致细胞因子和炎性介质的释放. Nolte等[53]发现UC患者体内的MC数量明显多于对照组. 而且, 炎症组织中MC的数量明显多于正常组织. Gelbmann等[54]发现, CD患者肠道肌层内MC的数量与对照组相比明显增多, 而且在CD患者早期黏膜病变中, 可发现固有膜、黏膜下层MC数量增多. 甚至于更深层也可见MC, 伴随有黏膜组织的水肿和炎症.可能是由于MCs被激活后可以释放多种介质,也可以释放多种细胞因子. 而无论是介质还是细胞因子在IBD的发病中的作用不容小觑. Gelbmann等[54]用免疫组织化学法发现CD患者有纤维化病变的炎症肠组织中高表达MC所分泌的类胰蛋白酶和糜蛋白酶明显高于正常人和非纤维化肠组织, 由此推测MCs在炎症肠道聚集与CD患者肠道纤维化及狭窄的形成有关. 另外, TNF-α主要是由IBD肠道内MC释放的,而且细菌和抗-IgE抗体都可以大幅度增加MC对其的释放[55]. 这一观点得到了支持[56]而且MCs所分泌的IL-4能诱导TH0细胞向TH2细胞分化, 这种TH2细胞主要分泌IL-4、IL-5、IL-10、IL-13、TGF等TH2型细胞因子, 参与体液免疫应答, 诱导B细胞增殖分化产生抗体, 具有抗胞外病原体感染的免疫作用. 而且IL-4能够抑制TH1细胞的产生, 抑制TH1细胞介导的抗胞内病原体感染的免疫作用. 因此, 探究MC在IBD发病中的作用机制无论对于IBD发生机制的研究还是IBD治疗新方式的探索具有重要的临床价值.
肠易激综合征(irritable bowel syndrome, IBS)的发生发展是多种发病机制间相互联系、共同作用的结果. 肠MMCs被活化后, 释放多种活性炎症介质, 包括组胺、5-羟色胺、类胰蛋白酶等, 这些炎症物质直接影响肠神经信号的传导, 参与并放大胃肠功能及中枢神经系统功能的局部病理生理变化,最终导致胃肠疾病的发生.由此推测MCs在神经-免疫信号调节过程是促进IBS发生发展的重要因素之一. IBS患者胃肠道中大约有70%的肠MMCs与感觉神经末梢有直接联系, 二者之间形成一条功能上相互制约的双向信息传递通路[57,58], 提示MCs在神经调节过程中可能对内脏高敏起到至关重要的作用. Ucmak等[59]研究表明, 许多IBS患者肠道黏膜MCs富集处低度炎症浸润. MCs激活后释放的类胰蛋白酶通过强力激活PAR-2信号转导, 进而增加肠道上皮黏膜通透性, 同时De Lisle等[60]研究表明肠MMCs释放的活性物(histanine、5-HT等)通过与肠黏膜上相应受体结合, 增加肠道上皮黏膜通透性, 同时显著增强平滑肌收缩, 加速肠道蠕动, 松弛肛门内括约肌, 进而影响胃肠道运动使患者出现血便、黏液便、发热、腹痛、里急后重和体重下降. 因此, 肠道MCs及其所释放的介质在IBS发病中起到了重要作用.
肠道过敏反应是一种在婴儿期开始并由肠道黏膜免疫系统介导的过程. 食物过敏可以分为IgE介导食物过敏的和非IgE介导的食物过敏[61], 研究表明, 在过敏反应中IgE介导占据主要地位. 在摄入食物后的几分钟到2 h, 食物中抗原激活肠道黏膜固有层的IgE+浆细胞产生IgE, 随之与MCsFcεRI结合, 固定于MCs表面, 当抗原再次进入人体, MCs脱颗粒释放组织胺, 白三烯等生物活性介质, 使血管通透性增加[62]. 因此, MCs在肠道过敏反应中不可或缺. Benjamin D[63]等学者用一种激动剂通过激活MCs表面的MrgprB2(即一种G蛋白偶联受体MrgprX2的家族成员)受体从而激活MCs, 使MCs脱颗粒释放组织胺等致过敏因子从而诱导过敏反应. 该研究提示[64], 使用MrgprB2特异性阻断剂, 抑制该受体启动的信号转导, 减少过敏反应的发生. 最新研究表明, MCs的DNA甲基化酶-DNMT3A酶可以抑制MCs的激活, 从而避免了MCs诱导的急性和慢性炎性反应. 以上研究均为为治疗MCs诱导的肠道食物过敏开启了新的研究思路.
总之, MCs是肠道固有免疫和获得性免疫的重要成员之一. MCs的分化成熟可以根据其所处的微环境的不同而异, 其所合成分泌的介质或者细胞因子也与其所处的局部环境有关. 肠道中MCs被激活后, 可以释放多种生物活性介质在肠道黏膜屏障、免疫调节、肠道疾病的发生中不可或缺. MCs因其独特的成熟特性和分泌颗粒的多样性在肠道固有和适应性免疫中均起到了重要的作用,而且在免疫耐受中"调节者"的作用. 正是因为肠道中的MCs作用多样, 既可以作为胃肠道的保护细胞, 也可以导致肠道疾病的发生, 因此如何平衡和控制其在肠道中发挥的作用成为目前基础医学研究的热点, 更成为临床医生治疗肠道疾患的一个"明星靶细胞".
学科分类: 胃肠病学和肝病学
手稿来源地: 北京市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:张砚梁
| 1. | Galli SJ, Kalesnikoff J, Grimbaldeston MA, Piliponsky AM, Williams CM, Tsai M. Mast cells as "tunable" effector and immunoregulatory cells: recent advances. Annu Rev Immunol. 2005;23:749-786. [PubMed] [DOI] |
| 2. | Galli SJ, Borregaard N, Wynn TA. Phenotypic and functional plasticity of cells of innate immunity: macrophages, mast cells and neutrophils. Nat Immunol. 2011;12:1035-1044. [PubMed] [DOI] |
| 3. | Groschwitz KR, Wu D, Osterfeld H, Ahrens R, Hogan SP. Chymase-mediated intestinal epithelial permeability is regulated by a protease-activating receptor/matrix metalloproteinase-2-dependent mechanism. Am J Physiol Gastrointest Liver Physiol. 2013;304:G479-G489. [PubMed] [DOI] |
| 4. | Hamilton MJ, Frei SM, Stevens RL. The multifaceted mast cell in inflammatory bowel disease. Inflamm Bowel Dis. 2014;20:2364-2378. [PubMed] [DOI] |
| 5. | Hamilton MJ, Sinnamon MJ, Lyng GD, Glickman JN, Wang X, Xing W, Krilis SA, Blumberg RS, Adachi R, Lee DM. Essential role for mast cell tryptase in acute experimental colitis. Proc Natl Acad Sci USA. 2011;108:290-295. [PubMed] [DOI] |
| 6. | Kurashima Y, Goto Y, Kiyono H. Mucosal innate immune cells regulate both gut homeostasis and intestinal inflammation. Eur J Immunol. 2013;43:3108-3115. [PubMed] [DOI] |
| 7. | Kurashima Y, Kiyono H. New era for mucosal mast cells: their roles in inflammation, allergic immune responses and adjuvant development. Exp Mol Med. 2014;46:e83. [PubMed] [DOI] |
| 8. | Hallgren J, Gurish MF. Pathways of murine mast cell development and trafficking: tracking the roots and routes of the mast cell. Immunol Rev. 2007;217:8-18. [PubMed] [DOI] |
| 9. | Jamur MC, Moreno AN, Mello LF, Souza Júnior DA, Campos MR, Pastor MV, Grodzki AC, Silva DC, Oliver C. Mast cell repopulation of the peritoneal cavity: contribution of mast cell progenitors versus bone marrow derived committed mast cell precursors. BMC Immunol. 2010;11:32. [PubMed] [DOI] |
| 10. | Schwartz LB. Analysis of MC(T) and MC(TC) mast cells in tissue. Methods Mol Biol. 2006;315:53-62. [PubMed] |
| 11. | Pejler G, Rönnberg E, Waern I, Wernersson S. Mast cell proteases: multifaceted regulators of inflammatory disease. Blood. 2010;115:4981-4990. [PubMed] [DOI] |
| 12. | Goldstein SM, Kaempfer CE, Proud D, Schwartz LB, Irani AM, Wintroub BU. Detection and partial characterization of a human mast cell carboxypeptidase. J Immunol. 1987;139:2724-2729. [PubMed] |
| 13. | Meurer SK, Neß M, Weiskirchen S, Kim P, Tag CG, Kauffmann M, Huber M, Weiskirchen R. Isolation of Mature (Peritoneum-Derived) Mast Cells and Immature (Bone Marrow-Derived) Mast Cell Precursors from Mice. PLoS One. 2016;11:e0158104. [PubMed] [DOI] |
| 14. | Pennock JL, Grencis RK. In vivo exit of c-kit+/CD49d(hi)/beta7+ mucosal mast cell precursors from the bone marrow following infection with the intestinal nematode Trichinella spiralis. Blood. 2004;103:2655-2660. [PubMed] [DOI] |
| 15. | Irani AM, Craig SS, DeBlois G, Elson CO, Schechter NM, Schwartz LB. Deficiency of the tryptase-positive, chymase-negative mast cell type in gastrointestinal mucosa of patients with defective T lymphocyte function. J Immunol. 1987;138:4381-4386. [PubMed] |
| 16. | Moon TC, Befus AD, Kulka M. Mast cell mediators: their differential release and the secretory pathways involved. Front Immunol. 2014;5:569. [PubMed] [DOI] |
| 17. | Moon TC, St Laurent CD, Morris KE, Marcet C, Yoshimura T, Sekar Y, Befus AD. Advances in mast cell biology: new understanding of heterogeneity and function. Mucosal Immunol. 2010;3:111-128. [PubMed] [DOI] |
| 18. | Blank U, Madera-Salcedo IK, Danelli L, Claver J, Tiwari N, Sánchez-Miranda E, Vázquez-Victorio G, Ramírez-Valadez KA, Macias-Silva M, González-Espinosa C. Vesicular trafficking and signaling for cytokine and chemokine secretion in mast cells. Front Immunol. 2014;5:453. [PubMed] [DOI] |
| 19. | Simon T, László V, Falus A. Impact of histamine on dendritic cell functions. Cell Biol Int. 2011;35:997-1000. [PubMed] [DOI] |
| 20. | Yao YM, Bahrami S, Leichtfried G, Redl H, Schlag G. Pathogenesis of hemorrhage-induced bacteria/endotoxin translocation in rats. Effects of recombinant bactericidal/permeability-increasing protein. Ann Surg. 1995;221:398-405. [PubMed] |
| 21. | Camilleri M, Oduyebo I, Halawi H. Chemical and molecular factors in irritable bowel syndrome: current knowledge, challenges, and unanswered questions. Am J Physiol Gastrointest Liver Physiol. 2016;311:G777-G784. [PubMed] [DOI] |
| 22. | Yu Y, Wu S, Li J, Wang R, Xie X, Yu X, Pan J, Xu Y, Zheng L. The effect of curcumin on the brain-gut axis in rat model of irritable bowel syndrome: involvement of 5-HT-dependent signaling. Metab Brain Dis. 2015;30:47-55. [PubMed] [DOI] |
| 23. | Tonini M. 5-Hydroxytryptamine effects in the gut: the 3, 4, and 7 receptors. Neurogastroenterol Motil. 2005;17:637-642. [PubMed] [DOI] |
| 24. | Colucci R, Blandizzi C, Bellini M, Ghisu N, Tonini M, Del Tacca M. The genetics of the serotonin transporter and irritable bowel syndrome. Trends Mol Med. 2008;14:295-304. [PubMed] [DOI] |
| 25. | Miller JS, Westin EH, Schwartz LB. Cloning and characterization of complementary DNA for human tryptase. J Clin Invest. 1989;84:1188-1195. [PubMed] [DOI] |
| 26. | Pereira PJ, Bergner A, Macedo-Ribeiro S, Huber R, Matschiner G, Fritz H, Sommerhoff CP, Bode W. Human beta-tryptase is a ring-like tetramer with active sites facing a central pore. Nature. 1998;392:306-311. [PubMed] [DOI] |
| 27. | Caughey GH. Tryptase genetics and anaphylaxis. J Allergy Clin Immunol. 2006;117:1411-1414. [PubMed] [DOI] |
| 28. | Cenac N, Coelho AM, Nguyen C, Compton S, Andrade-Gordon P, MacNaughton WK, Wallace JL, Hollenberg MD, Bunnett NW, Garcia-Villar R. Induction of intestinal inflammation in mouse by activation of proteinase-activated receptor-2. Am J Pathol. 2002;161:1903-1915. [PubMed] [DOI] |
| 29. | Abraham SN, St John AL. Mast cell-orchestrated immunity to pathogens. Nat Rev Immunol. 2010;10:440-452. [PubMed] [DOI] |
| 30. | Hofmann AM, Abraham SN. New roles for mast cells in modulating allergic reactions and immunity against pathogens. Curr Opin Immunol. 2009;21:679-686. [PubMed] [DOI] |
| 31. | Galli SJ, Tsai M. Mast cells in allergy and infection: versatile effector and regulatory cells in innate and adaptive immunity. Eur J Immunol. 2010;40:1843-1851. [PubMed] [DOI] |
| 32. | Metz M, Siebenhaar F, Maurer M. Mast cell functions in the innate skin immune system. Immunobiology. 2008;213:251-260. [PubMed] [DOI] |
| 33. | Graham AC, Hilmer KM, Zickovich JM, Obar JJ. Inflammatory response of mast cells during influenza A virus infection is mediated by active infection and RIG-I signaling. J Immunol. 2013;190:4676-4684. [PubMed] [DOI] |
| 34. | Supajatura V, Ushio H, Nakao A, Okumura K, Ra C, Ogawa H. Protective roles of mast cells against enterobacterial infection are mediated by Toll-like receptor 4. J Immunol. 2001;167:2250-2256. [PubMed] [DOI] |
| 35. | Prodeus AP, Zhou X, Maurer M, Galli SJ, Carroll MC. Impaired mast cell-dependent natural immunity in complement C3-deficient mice. Nature. 1997;390:172-175. [PubMed] [DOI] |
| 36. | Gupta K, Idahosa C, Roy S, Lee D, Subramanian H, Dhingra A, Boesze-Battaglia K, Korostoff J, Ali H. Differential Regulation of Mas-Related G Protein-Coupled Receptor X2-Mediated Mast Cell Degranulation by Antimicrobial Host Defense Peptides and Porphyromonas gingivalis Lipopolysaccharide. Infect Immun. 2017;85. [PubMed] [DOI] |
| 37. | Stassen M, Müller C, Richter C, Neudörfl C, Hültner L, Bhakdi S, Walev I, Schmitt E. The streptococcal exotoxin streptolysin O activates mast cells to produce tumor necrosis factor alpha by p38 mitogen-activated protein kinase- and protein kinase C-dependent pathways. Infect Immun. 2003;71:6171-6177. [PubMed] [DOI] |
| 38. | Theoharides TC, Kempuraj D, Tagen M, Conti P, Kalogeromitros D. Differential release of mast cell mediators and the pathogenesis of inflammation. Immunol Rev. 2007;217:65-78. [PubMed] [DOI] |
| 39. | Malaviya R, Abraham SN. Mast cell modulation of immune responses to bacteria. Immunol Rev. 2001;179:16-24. [PubMed] [DOI] |
| 40. | Gordon JR, Galli SJ. Mast cells as a source of both preformed and immunologically inducible TNF-alpha/cachectin. Nature. 1990;346:274-276. [PubMed] [DOI] |
| 41. | Rdzany RS, Brzezińska-Błaszczyk E. [The mast cells phagocytose bacteria]. Postepy Hig Med Dosw (Online). 2004;58:398-404. [PubMed] |
| 42. | Malaviya R, Ross EA, MacGregor JI, Ikeda T, Little JR, Jakschik BA, Abraham SN. Mast cell phagocytosis of FimH-expressing enterobacteria. J Immunol. 1994;152:1907-1914. [PubMed] |
| 43. | Elieh Ali Komi D, Grauwet K. Role of Mast Cells in Regulation of T Cell Responses in Experimental and Clinical Settings. Clin Rev Allergy Immunol. 2017;7:1-14. [PubMed] [DOI] |
| 44. | Suto H, Nakae S, Kakurai M, Sedgwick JD, Tsai M, Galli SJ. Mast cell-associated TNF promotes dendritic cell migration. J Immunol. 2006;176:4102-4112. [PubMed] [DOI] |
| 45. | Poncet P, Arock M, David B. MHC class II-dependent activation of CD4+ T cell hybridomas by human mast cells through superantigen presentation. J Leukoc Biol. 1999;66:105-112. [PubMed] |
| 46. | Nakae S, Suto H, Kakurai M, Sedgwick JD, Tsai M, Galli SJ. Mast cells enhance T cell activation: Importance of mast cell-derived TNF. Proc Natl Acad Sci USA. 2005;102:6467-6472. [PubMed] [DOI] |
| 47. | Nakae S, Suto H, Iikura M, Kakurai M, Sedgwick JD, Tsai M, Galli SJ. Mast cells enhance T cell activation: importance of mast cell costimulatory molecules and secreted TNF. J Immunol. 2006;176:2238-2248. [PubMed] [DOI] |
| 48. | Zhou F, Zhang GX, Rostami A. Apoptotic cell-treated dendritic cells induce immune tolerance by specifically inhibiting development of CD4⁺ effector memory T cells. Immunol Res. 2016;64:73-81. [PubMed] [DOI] |
| 49. | Lu LF, Lind EF, Gondek DC, Bennett KA, Gleeson MW, Pino-Lagos K, Scott ZA, Coyle AJ, Reed JL, Van Snick J. Mast cells are essential intermediaries in regulatory T-cell tolerance. Nature. 2006;442:997-1002. [PubMed] [DOI] |
| 50. | Mantovani A, Sica A, Sozzani S, Allavena P, Vecchi A, Locati M. The chemokine system in diverse forms of macrophage activation and polarization. Trends Immunol. 2004;25:677-686. [PubMed] [DOI] |
| 51. | Hart PH, Townley SL, Grimbaldeston MA, Khalil Z, Finlay-Jones JJ. Mast cells, neuropeptides, histamine, and prostaglandins in UV-induced systemic immunosuppression. Methods. 2002;28:79-89. [PubMed] [DOI] |
| 52. | Grimbaldeston MA, Nakae S, Kalesnikoff J, Tsai M, Galli SJ. Mast cell-derived interleukin 10 limits skin pathology in contact dermatitis and chronic irradiation with ultraviolet B. Nat Immunol. 2007;8:1095-1104. [PubMed] [DOI] |
| 53. | Rao KN, Brown MA. Mast cells: multifaceted immune cells with diverse roles in health and disease. Ann N Y Acad Sci. 2008;1143:83-104. [PubMed] [DOI] |
| 54. | Nolte H, Spjeldnaes N, Kruse A, Windelborg B. Histamine release from gut mast cells from patients with inflammatory bowel diseases. Gut. 1990;31:791-794. [PubMed] |
| 55. | Jouvin I, Lefevre JH, Creavin B, Pitel S, Chafai N, Tiret E, Beaugerie L, Parc Y; Saint-Antoine IBD Network. Postoperative Morbidity Risks Following Ileocolic Resection for Crohn's Disease Treated With Anti-TNF Alpha Therapy: A Retrospective Study of 360 Patients. Inflamm Bowel Dis. 2018;24:422-432. [PubMed] [DOI] |
| 56. | Ko LN, Pinard J, Merola JF, Patel M. Novel posterior auricular cutaneous reaction after anti-TNF-α infusion in young women with Crohn's disease. JAAD Case Rep. 2017;3:512-514. [PubMed] [DOI] |
| 57. | Rijnierse A, Koster AS, Nijkamp FP, Kraneveld AD. TNF-alpha is crucial for the development of mast cell-dependent colitis in mice. Am J Physiol Gastrointest Liver Physiol. 2006;291:G969-G976. [PubMed] [DOI] |
| 58. | Buhner S, Schemann M. Mast cell-nerve axis with a focus on the human gut. Biochim Biophys Acta. 2012;1822:85-92. [PubMed] [DOI] |
| 59. | Schemann M, Camilleri M. Functions and imaging of mast cell and neural axis of the gut. Gastroenterology. 2013;144:698-704.e4. [PubMed] [DOI] |
| 60. | De Lisle RC, Meldi L, Roach E, Flynn M, Sewell R. Mast cells and gastrointestinal dysmotility in the cystic fibrosis mouse. PLoS One. 2009;4:e4283. [PubMed] [DOI] |
| 61. | Kim EH, Burks W. Immunological basis of food allergy (IgE-mediated, non-IgE-mediated, and tolerance). Chem Immunol Allergy. 2015;101:8-17. [PubMed] [DOI] |
| 62. | Burton OT, Noval Rivas M, Zhou JS, Logsdon SL, Darling AR, Koleoglou KJ, Roers A, Houshyar H, Crackower MA, Chatila TA. Immunoglobulin E signal inhibition during allergen ingestion leads to reversal of established food allergy and induction of regulatory T cells. Immunity. 2014;41:141-151. [PubMed] [DOI] |
| 63. | McNeil BD, Pundir P, Meeker S, Han L, Undem BJ, Kulka M, Dong X. Identification of a mast-cell-specific receptor crucial for pseudo-allergic drug reactions. Nature. 2015;519:237-241. [PubMed] [DOI] |
| 64. | Leoni C, Montagner S, Rinaldi A, Bertoni F, Polletti S, Balestrieri C, Monticelli S. Dnmt3a restrains mast cell inflammatory responses. Proc Natl Acad Sci USA. 2017;114:E1490-E1499. [PubMed] [DOI] |