修回日期: 2017-01-21
接受日期: 2017-02-17
在线出版日期: 2017-03-28
观察转化生长因子-β1(transforming growth factor β1, TGF-β1)中和抗体对2,4,6-三硝基苯磺酸(trinitrobenzene sulfonic acid, TNBS)慢性结肠炎动物模型中小鼠肠道纤维化的影响.
将48只Balb/c小鼠分为正常对照组、TNBS模型组、治疗对照组和TGF-β1抗体组, TNBS 6 wk灌肠造模, TGF-β1抗体组于每次TNBS灌肠后24 h给予TGF-β1抗体灌肠治疗, 光镜下观察结肠组织学变化, RT-PCR检测各组小鼠肠道中Ⅰ、Ⅲ、Ⅴ型胶原蛋白及TGF-β mRNA水平, 免疫组织化学、Western blot检测各组小鼠结肠中TGF-β1水平并分析结果.
(1)HE染色和VG胶原蛋白染色发现, TGF-β1抗体组小鼠未见大量胶原蛋白聚集, 固有肌层明显增厚, 较TNBS模型组、治疗对照组改善; (2)TGF-β1抗体组结肠Ⅰ、Ⅲ、Ⅴ型胶原蛋白及TGF-β mRNA较TNBS模型组及治疗对照组均降低(P<0.05); (3)免疫组织化学、Western blot发现TGF-β1抗体组较TNBS模型组及治疗对照组结肠内TGF-β1均降低(P<0.05).
TGF-β1中和抗体拮抗TGF-β1, 下调小鼠结肠组织中胶原蛋白的表达, 抑制TNBS慢性结肠炎动物模型纤维化.
核心提要: 通过反复的2,4,6-三硝基苯磺酸灌肠构建模拟克罗恩病(Crohn's disease, CD)慢性肠道纤维化的小鼠动物模型, 应用转化生长因子中和抗体灌肠进行干预性治疗, 发现该中和抗体对CD模型小鼠肠道纤维化形成的治疗效应.
引文著录: 戴萌, 金雷, 徐维田, 熊毅敏, 王一鸣, 郑国荣. TGF-β1中和抗体对TNBS慢性结肠炎动物模型纤维化的影响. 世界华人消化杂志 2017; 25(9): 783-791
Revised: January 21, 2017
Accepted: February 17, 2017
Published online: March 28, 2017
To evaluate the effect of transforming growth factor-β1 (TGF-β1) neutralizing antibody on intestinal fibrosis in a mouse model of chronic colitisinduced with trinitrobenzene sulfonic acid (TNBS).
Forty-eight Balb/c mice were randomly divided into a normal control group, a model control group, a treatment control group, and a TGF-β1 antibody group. Chronic colitis and intestinal fibrosis were induced with TNBS/ethanol enema for 6 wk. Mice in the TGF-β1 antibody group and treatment control group were administered with TGF-β1 neutralizing antibody and physiological saline, respectively, at 24 h after the administration of TNBS/ethanol enema. The pathological changes in intestine tissue were detected by HE and VG collage staining. Expression of TGF-β1 and collagen types Ⅰ, Ⅲ, and Ⅴ mRNAs in the colon was detected.
HE and VG collage staining showed that pathologic histology was improved in the TGF-β1 antibody group. The expression of collagen types Ⅰ, Ⅲ, and Ⅴ and TGF-β1 mRNAs decreased significantly in the TGF-β1 antibody group compared with the model control group and the treatment control group (P < 0.05). The protein expression of TGF-β1 also decreased significantly in the TGF-β1 antibody group compared with the model control group and the treatment control group (P < 0.05).
TGF-β1 neutralizing antibody can effectively down-regulate the expression of TGF-β1 and collagen in mice with chronic colitis, and intestinal fibrosis can be abrogated by targeting TGF-β1.
- Citation: Dai M, Jin L, Xu WT, Xiong YM, Wang YM, Zheng GR. Effect of TGF-β1 neutralizing antibody on intestinal fibrosis in a mouse model of chronic colitis induced with trinitrobenzene sulfonic acid. Shijie Huaren Xiaohua Zazhi 2017; 25(9): 783-791
- URL: https://www.wjgnet.com/1009-3079/full/v25/i9/783.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i9.783
克罗恩病(Crohn's disease, CD), 以透壁性炎症为特征, 导致大量异常的细胞外基质(extracellular matrix, ECM)沉淀, 从而引发肠道纤维化性狭窄, 并最终导致肠梗阻[1,2]. 有数据表明, 40%以上病例有程度不等的肠梗阻, 且反复发生, 多数患者在有生之年最终需要手术治疗[3-5]. 动物模型极大地促进了我们对慢性肠道炎症及纤维化性狭窄机制的了解, 2,4,6-三硝基苯磺酸(trinitrobenzene sulfonic acid, TNBS)慢性结肠炎动物模型是目前较为成功的动物模型之一[6]. 转化生长因子-β1(transforming growth factor β1, TGF-β1)是组织器官纤维化中进程中的关键调节因子, 可直接作用成纤维细胞合成大量的ECM产生促纤维化作用, 可被作为纤维化治疗的靶点[7]. 我们的前期研究中通过重复的TNBS灌肠建立了TNBS慢性结肠炎动物模型, 可致小鼠结肠肠壁产生纤维化, 以肠道慢性炎症、肠道大量ECM聚集沉淀为特征, 模拟CD中的疾病特点, 以此为桥梁, 在本研究中采用中和抗体阻断细胞因子拮抗TGF-β1, 研究TGF-β1中和抗体对肠道纤维化的影响.
1.1.1 实验动物与分组: Balb/c小鼠48只, 体质量20-23 g左右, 由武汉大学动物实验中心提供, 许可证号: SCXK(鄂)2008-0004. 实验方案报医院实验动物伦理委员会批准. Balb/c小鼠称质量、编号后, 随机分为正常对照组、TNBS模型组、治疗对照组和TGF-β1抗体组, 常规饲料及自由饮水, 饲养室温度为23 ℃±1.0 ℃, 湿度30%-60%, 中国解放军武汉总医院医学实验中心饲养.
1.1.2 主要试剂和药物: TNBS(购自Sigma公司)5%(W/V)水溶液, 与无水乙醇按比例配成TNBS灌肠剂. TGF-β1多克隆抗体、免疫组织化学试剂盒由Santa Cruz工程有限公司提供. 抗兔IgG多克隆抗体购自SIGMA公司.
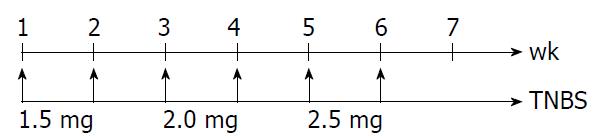
1.2.1 结肠炎模型的建立: 造模前小鼠在动物房饲养1 wk, 按照参考文献[6]方法(图1)采用6 wk TNBS灌肠剂诱导Balb/c小鼠慢性结肠炎模型, TNBS在灌肠剂中的剂量逐渐增加. Balb/c小鼠禁食、不禁饮24 h后, 乙醚麻醉小鼠, 将石蜡油润滑3.5F导管从肛门插入肠道深约5 cm, 正常对照组灌注生理盐水100 μL, TNBS模型组、治疗对照组和TGF-β1中和抗体组每只小鼠灌注TNBS/乙醇溶液100 μL, 之后将小鼠倒置60 s. TNBS灌肠后24 h后, TGF-β1抗体组每只小鼠各自肛门灌浓度为2.0 μg/mL的TGF-β1中和抗体100 μL, 治疗对照组则灌注生理盐水100 μL. 整个实验过程每天记录小鼠的体质量、大便性状等, 于最后一次TNBS灌肠后第7天处死所有存活小鼠, 大体观察小鼠结肠形态并收集小鼠结肠. 各组随机取9只进行结果分析.
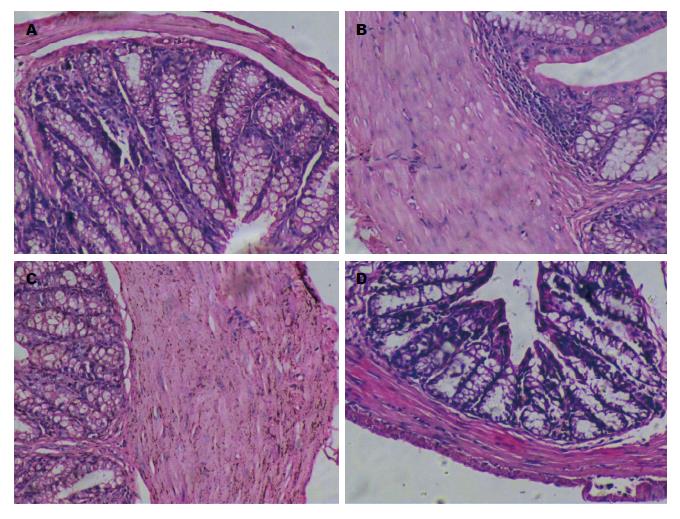
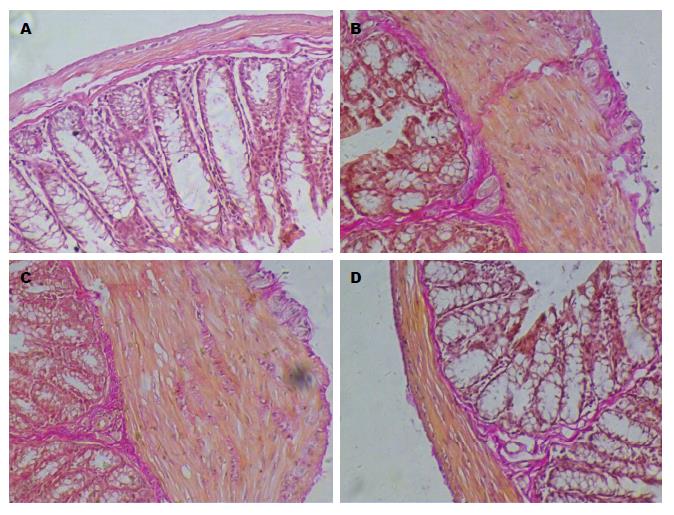
1.2.2 光镜观察小鼠结肠炎症及纤维化: 在距肛门5 cm处取结肠组织, 制备石蜡切片, 行HE染色及VG染色, 以双盲法观察, 光镜观察肠黏膜损伤及纤维化情况, 于光学显微镜下观察全部切片病理组织学改变, 根据根据Powell等[8]制定的半定量标准判断胶原纤维增生程度.
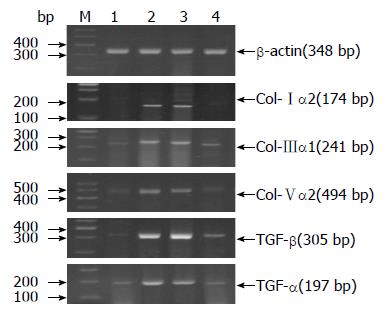
1.2.3 RT-PCR检测结肠组织中Ⅰ、Ⅲ、Ⅴ型胶原蛋白及TGF-β1 mRNA: 按照TRIzol试剂盒说明书提取结肠组织总RNA, 再按RT-PCR试剂盒说明书逆转录得cDNA. 合成的引物序列, 扩增条件及产物如表1, 以β-actin为内参照, PCR反应产物置3%琼脂糖凝胶电泳检测.
| 指标 | 引物 | 产物大小(bp) | 退火温度(℃) | 循环次数 |
| β-actin | 上游引物: 5'-ATGGAATCCTGTGGCATCCATGAAAC-3' | 348 | 55 | 30 |
| 下游引物: 5'-ATAAAACGCAGCTCAGTAACAGTCCG-3' | ||||
| Col-Ⅰα2 | 上游引物: 5'-GGGAGCACCAAGAAGACC-3' | 174 | 45 | 35 |
| 下游引物: 5'-GCTGGAAAGGAAGGGATT-3' | ||||
| Col-Ⅲα1 | 上游引物: 5'-ACCCATTCCTCCCACTCC-3' | 241 | 48 | 30 |
| 下游引物: 5'-CCCACAGCCTTCTACACCT-3' | ||||
| Col-Ⅴα2 | 上游引物: 5'-CTACATTTCCATTTCGCTTA-3' | 494 | 42 | 30 |
| 下游引物: 5'-CCGCACTTGTGATGATTT-3' | ||||
| TGF-β | 上游引物: 5' CCATGACATGAACCGACCCT-3' | 296 | 58 | 30 |
| 下游引物: 5'-CCGGGTTGTGTTGGTTGTAG-3' |
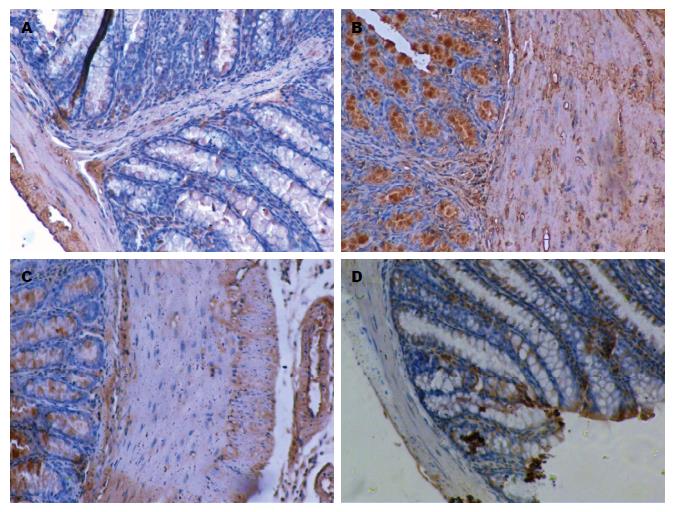
1.2.4 免疫组织化学检测肠道组织中TGF-β1蛋白表达: 免疫组织化学检查, 取出距肛门5 cm小鼠肠黏膜组织2块常规固定、切片, 染色程序严格按试剂说明书操作, 显微镜观察. 每次染色时用试剂公司提供的TGF-β1阳性片作阳性对照, PBS代替第一抗体作为阴性对照. 随机选择5个视野, 取每视野内的平均阳性细胞数作为计数标准, 以mean±SD表示.
1.2.5 Western blot检测肠道组织中TGF-β1蛋白表达: 取结肠组织0.1 g, 按照1:10 (m/V)加入300 μL组织裂解液和3 μL蛋白酶抑制剂, 4 ℃冰浴超声匀浆, 15000 r/min离心10 min, 取上清用BCA蛋白定量试剂盒检测蛋白质浓度. 取相同质量的蛋白经DS-PAGE凝胶电泳, 转膜, 转移后的硝酸纤维素膜分别加入分别加入兔抗小鼠TGF-β1多克隆抗体(1:500)、HRP标记的抗兔IgG(1:1000), 洗膜后显色、曝光, 通过Image tool图像分析软件读取X光片上目的条带的激光光密度扫描值, 结果用与β-actin的比值作为内参照.
统计学处理 用SPSS11统计软件处理, 检测的计量数据采用mean±SD表示, 计量资料的分析方法为方差分析, 对方差分析有意义者再采用LSD法进行两两比较; 计数资料采用相对数进行描述, 对其分析方法为χ2检验或精确概率计算; 以P<0.05为差异有统计学意义.
从第1次TNBS灌肠开始, TNBS模型组、治疗对照组Balb/c小鼠在灌肠后第1天起出现不同程度的稀便、少动、毛发无光泽、身体蜷缩、食量减少、体质量下降, 于第2、3天最为明显; 上述症状于第3周达到顶峰, 但在随后的4-6 wk存活的小鼠症状逐渐改善、恢复体质量, 且再无小鼠死亡. TGF-β1抗体组小鼠在灌肠后第1天出现与上述对照组小鼠相似的情况, 在TGF-β1中和抗体灌肠后则发生变化, 并在此后的每周出现血便、稀便等情况的小鼠减少, 活动性较TNBS模型组、治疗对照组好, 疾病活动指数评分较TNBS模型组、治疗对照组低(P<0.05). 各组小鼠DAI评分如下, 正常对照组为1.38±0.98; TNBS模型组为4.03±1.36; 治疗对照组为3.25±1.58; TGF-β1抗体组为1.01±0.06. 正常对照组小鼠则反应灵活、食量正常、体质量增加. TNBS灌肠后1-3 wk内, 治疗对照组、TNBS模型组3只Balb/c小鼠死亡, TGF-β1抗体组1只小鼠死亡, 此后再无小鼠死亡.
TNBS模型组、治疗对照组小鼠远端5-6 cm左右结肠扭曲变形, 肠壁僵直, 增厚, HE染色及VG染色观察各组小鼠的结肠病理特征(图2, 3), 发现TNBS模型组、治疗对照组小鼠结肠可观察上皮细胞破碎, 杯状细胞减少, 主要位于黏膜及黏膜下层, 结肠固有层炎症细胞浸润, 以慢性炎性细胞淋巴细胞、单核细胞浸润为主, 淋巴滤泡增大、增多等慢性结肠炎的组织学改变, 黏膜下及固有肌层小血管增生, 结肠黏膜下和浆膜层的区域显现出大量胶原蛋白沉淀, 固有肌层明显增厚, 偶可见纤维分隔, 致肠腔狭窄, 病变以远端结肠为主. 而TGF-β1抗体组小鼠肠道炎症已明显改善, 未见肠腔狭窄, 正常对照组小鼠则表现为正常肠壁. TGF-β1抗体组纤维化评分较TNBS模型组、治疗对照组低(P<0.05), 与正常对照组对比无统计学差异P>0.05(表2).
PT-PCR检测发现TGF-β1抗体组、正常对照组小鼠结肠组织Ⅰ、Ⅲ、Ⅴ型胶原蛋白及TGF-β mRNA表达均低于TNBS模型组、治疗对照组(P<0.05), 而TGF-β1抗体组与正常对照组之间无统计学差异(P>0.05, 表3, 图4). 在蛋白水平, 免疫组织化学、Western blot发现TGF-β1抗体组、正常对照组小鼠结肠组织TGF-β1表达均低于TNBS模型组、治疗对照组(P<0.05), 而TGF-β1抗体组与NC组之间无统计学差异(P>0.05, 表4, 图5, 6). 从而说明TGF-β1中和抗体灌肠治疗后可降低TGF-β1表达, 并抑制Ⅰ、Ⅲ、Ⅴ型胶原蛋白的mRNA产生.
急性炎症可导致的致肠道间质细胞活化, 转化为能大量合成ECM的纤维型间质细胞, 但受到正常肠道修复机制的调控, 通过对胶原蛋白转录及翻译的调节措施及对活化的纤维型间质细胞促凋亡作用, 阻止了大量ECM沉淀. 而慢性炎症可致机体对损伤的修复反应过度, 导致大量ECM的异常沉淀, 从而引发肠壁纤维化性狭窄, 并最终导致肠梗阻[9,10]. 克罗恩并便是典型的代表, 其狭窄肠段主要表现为肠壁各层的增厚, 尤以黏膜下层及肌层平滑肌细胞区域为主[11]. 正常肠道中, 主要的胶原蛋白亚型为Ⅰ(70%)、Ⅲ(20%)和Ⅴ(12%), 而在CD狭窄肠段中, 亚型Ⅰ、Ⅲ、Ⅳ、Ⅴ亚型明显增多, 特别是Ⅲ和Ⅴ[12,13]. 大量的胶原蛋白过度沉积, 分隔、延伸至平滑肌细胞之间, 最终导致了肠壁结构破坏及增厚, 产生类似瘢痕收缩式的肠腔狭窄[14,15].
TGF-β家族在哺乳动物细中包括TGF-β1、TGF-β2和TGF-β3 3种形式, TGF-β1在体细胞中所占比例最高(>90%), 活性最强. TGF-β1是一种多效细胞因子, 是组织器官纤维化中进程中的关键调节因子[16-20], 支持这一理论的有利证据是发现CD狭窄肠道中成纤维细胞中的TGF-β1及其受体均过度表达[21,22]. TGF-β1在胶原大量合成时抑制ECM降解酶, 即基质金属蛋白酶(matrix metalloproteinase, MMP)和纤溶酶原蛋白酶的活性, 通过刺激基质金属蛋白酶抑制剂-1的产生而抑制MMP-1和MMP-3的表达[23]. 另外, TGF-β1可直接作用成纤维细胞合成大量的ECM产生促纤维化作用. 大部分研究[24-26]表明抑制TGF-β/Smad信号途径可抑制持续存在的慢性炎症和纤维化. 因此TGF-β1可作为治疗纤维化的靶点, 有研究表明采用细胞因子单克隆抗体拮抗TGF-β1的生物学效应, 同时还能阻止肝星状细胞自分泌TGF-β1, 另外有研究[27]报道, TGF-β1抗体可能通过抑制Ⅰ型胶原蛋白及基质金属蛋白酶抑制因子-1的基因表达, 拮抗了TGF-β1的致肝纤维化作用, 对肝纤维化的逆转起到了一定的治疗作用. Qiu等[28]发现局部注射TGF-β1抗体可抑制移植入裸鼠的增生性疤痕. 因此TGF-β1抗体可成为治疗纤维化的新方向[29,30], 但目前国内外均无文献报道, TGF-β1抗体是否可治疗肠道纤维化.
此次实验中采用TNBS反复灌肠诱导小鼠结肠炎的反复, 这种反复的及扩大的肠道炎症促进间质细胞的激活并产生大量的ECM, 导致肠壁的纤维化的形成. 随后经TGF-β1中和抗体治疗后的TNBS慢性结肠炎模型小鼠, 无论是急性炎症期或慢性炎症期, 症状较模型及治疗对照组小鼠明显减轻, 减少Ⅰ、Ⅲ、Ⅴ型胶原蛋白的mRNA生成, 更为重要的是VG胶原蛋白染色显示, 治疗后小鼠缺少纤维化组织结构和异常胶原质聚集. 这种TGF-β1中和抗体对TNBS慢性结肠炎动物模型小鼠的治疗作用, 考虑与抑制了TGF-β1促进纤维化作用相关. 但TGF-β1中和抗体是否因其广泛的抗纤维化及其他生物学效益从而引发不良反应, 且局部灌肠治疗是否有助于减少不良反应有待下一步在动物试验中继续观察.
总之, 本研究证实了TGF-β1中和抗体能有效抑制TNBS诱导Balb/c小鼠慢性结肠炎动物模型结肠组织中Ⅰ、Ⅲ、Ⅴ型胶原蛋白的mRNA生成, 改善肠壁纤维化. 因此, 具有抗纤维化治疗效.
肠道纤维化性狭窄是克罗恩病(Crohn's disease, CD)患者肠道慢性炎症发展的必然结果, 但目前临床上常用的治疗手段对已形成肠道纤维化均无明显的疗效. 虽然已有以促纤维化因子关键因子转化生长因子-β1(transforming growth factor β1, TGF-β1)为靶点的TGF-β1中和抗体的抗纤维化的治疗研究, 但其对肠道纤维化的影响尚未见报道.
肠纤维化是多种炎性肠病比较棘手的并发症, TGF-β1在此过程中起了关键作用. TGF-β1中和抗体对于纤维化的治疗作用已有文献报道, 但对于肠道纤维化的作用尚未见报道研究, 另是否有致免疫性疾病甚至肿瘤的可能未见研究.
有文献报道发现局部注射TGF-β1抗体可抑制移植入裸鼠的增生性疤痕, 这种局部注射治疗有助于减少全身不良反应.
本文观察TGF-β1中和抗体灌肠对CD模型小鼠肠道纤维化形成的治疗作用, 目前国内外未见文献报道.
此次实验证实TGF-β1中和抗体对于2,4,6-三硝基苯磺酸慢性结肠炎模型小鼠肠道纤维化的治疗作用, 此实验结果有可能为CD患者肠道纤维化的防治提供新的治疗方法.
基质金属蛋白酶(matrix metallopro-teinases, MMPs)为肽链内切酶, 可降解许多重要的细胞外基质蛋白, 如胶原蛋白、层黏连蛋白、纤维连接蛋白等, 其在细胞外基质的代谢调节中起着非常重要的作用, 受许多参与肠壁纤维化的细胞因子和生长因子的同步调控. 相反, 组织金属蛋白酶抑制物可抑制MMPs的活性.
冯百岁, 教授, 郑州大学第五附属医院消化内科; 靖大道, 教授, 主任医师, 上海交通大学附属第一人民医院消化科; 吴巧凤, 副研究员, 成都中医药大学针灸推拿学院
本研究立题较新颖, 课题设计合理, 数据统计分析可信. 此实验结果有可能为CD的临床治疗, 尤其是CD患者肠道纤维化的防治开辟一条新的途径.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
编辑: 马亚娟 电编:李瑞芳
| 1. | Ince MN, Elliott DE. Immunologic and molecular mechanisms in inflammatory bowel disease. Surg Clin North Am. 2007;87:681-696. [PubMed] [DOI] |
| 2. | Thienpont C, Van Assche G. Endoscopic and medical management of fibrostenotic Crohn's disease. Dig Dis. 2014;32 Suppl 1:35-38. [PubMed] [DOI] |
| 3. | Cosnes J, Gower-Rousseau C, Seksik P, Cortot A. Epidemiology and natural history of inflammatory bowel diseases. Gastroenterology. 2011;140:1785-1794. [PubMed] [DOI] |
| 4. | Gearry RB, Richardson AK, Frampton CM, Dodgshun AJ, Barclay ML. Population-based cases control study of inflammatory bowel disease risk factors. J Gastroenterol Hepatol. 2010;25:325-333. [PubMed] [DOI] |
| 5. | Van Assche G, Geboes K, Rutgeerts P. Medical therapy for Crohn's disease strictures. Inflamm Bowel Dis. 2004;10:55-60. [PubMed] [DOI] |
| 6. | Lawrance IC, Wu F, Leite AZ, Willis J, West GA, Fiocchi C, Chakravarti S. A murine model of chronic inflammation-induced intestinal fibrosis down-regulated by antisense NF-kappa B. Gastroenterology. 2003;125:1750-1761. [PubMed] [DOI] |
| 7. | Loeuillard E, Bertrand J, Herranen A, Melchior C, Guérin C, Coëffier M, Aziz M, Déchelotte P, Savoye G, Marion-Letellier R. 2,4,6-trinitrobenzene sulfonic acid-induced chronic colitis with fibrosis and modulation of TGF-β1 signaling. World J Gastroenterol. 2014;20:18207-18215. [PubMed] [DOI] |
| 8. | Powell DW, Mifflin RC, Valentich JD, Crowe SE, Saada JI, West AB. Myofibroblasts. II. Intestinal subepithelial myofibroblasts. Am J Physiol. 1999;277:C183-C201. [PubMed] |
| 9. | Pucilowska JB, Williams KL, Lund PK. Fibrogenesis. IV. Fibrosis and inflammatory bowel disease: cellular mediators and animal models. Am J Physiol Gastrointest Liver Physiol. 2000;279:G653-G659. [PubMed] |
| 10. | Fiocchi C, Lund PK. Themes in fibrosis and gastrointestinal inflammation. Am J Physiol Gastrointest Liver Physiol. 2011;300:G677-G683. [PubMed] [DOI] |
| 11. | Latella G, Di Gregorio J, Flati V, Rieder F, Lawrance IC. Mechanisms of initiation and progression of intestinal fibrosis in IBD. Scand J Gastroenterol. 2015;50:53-65. [PubMed] [DOI] |
| 12. | McCormick BA. Using Salmonella enterica serotype typhimurium to model intestinal fibrosis. Gastroenterology. 2008;134:872-875. [PubMed] [DOI] |
| 13. | Beddy D, Mulsow J, Watson RW, Fitzpatrick JM, O'Connell PR. Expression and regulation of connective tissue growth factor by transforming growth factor beta and tumour necrosis factor alpha in fibroblasts isolated from strictures in patients with Crohn's disease. Br J Surg. 2006;93:1290-1296. [PubMed] [DOI] |
| 14. | Rieder F, Zimmermann EM, Remzi FH, Sandborn WJ. Crohn's disease complicated by strictures: a systematic review. Gut. 2013;62:1072-1084. [PubMed] [DOI] |
| 15. | Grassl GA, Valdez Y, Bergstrom KS, Vallance BA, Finlay BB. Chronic enteric salmonella infection in mice leads to severe and persistent intestinal fibrosis. Gastroenterology. 2008;134:768-780. [PubMed] [DOI] |
| 16. | Deng YL, Xiong XZ, Cheng NS. Organ fibrosis inhibited by blocking transforming growth factor-β signaling via peroxisome proliferator-activated receptor γ agonists. Hepatobiliary Pancreat Dis Int. 2012;11:467-478. [PubMed] [DOI] |
| 17. | Rieder F, Fiocchi C. Mechanisms of tissue remodeling in inflammatory bowel disease. Dig Dis. 2013;31:186-193. [PubMed] [DOI] |
| 18. | Rieder F, Fiocchi C. Intestinal fibrosis in IBD--a dynamic, multifactorial process. Nat Rev Gastroenterol Hepatol. 2009;6:228-235. [PubMed] [DOI] |
| 19. | Sans M, Masamunt MC. [Fibrogenesis and inflammatory bowel disease]. Gastroenterol Hepatol. 2007;30:36-41. [PubMed] [DOI] |
| 20. | Biernacka A, Dobaczewski M, Frangogiannis NG. TGF-β signaling in fibrosis. Growth Factors. 2011;29:196-202. [PubMed] [DOI] |
| 21. | McKaig BC, Hughes K, Tighe PJ, Mahida YR. Differential expression of TGF-beta isoforms by normal and inflammatory bowel disease intestinal myofibroblasts. Am J Physiol Cell Physiol. 2002;282:C172-C182. [PubMed] [DOI] |
| 22. | Lawrance IC, Maxwell L, Doe W. Inflammation location, but not type, determines the increase in TGF-beta1 and IGF-1 expression and collagen deposition in IBD intestine. Inflamm Bowel Dis. 2001;7:16-26. [PubMed] [DOI] |
| 23. | Warnaar N, Hofker HS, Maathuis MH, Niesing J, Bruggink AH, Dijkstra G, Ploeg RJ, Schuurs TA. Matrix metalloproteinases as profibrotic factors in terminal ileum in Crohn's disease. Inflamm Bowel Dis. 2006;12:863-869. [PubMed] [DOI] |
| 24. | Zanninelli G, Vetuschi A, Sferra R, D'Angelo A, Fratticci A, Continenza MA, Chiaramonte M, Gaudio E, Caprilli R, Latella G. Smad3 knock-out mice as a useful model to study intestinal fibrogenesis. World J Gastroenterol. 2006;12:1211-1218. [PubMed] [DOI] |
| 25. | Gauldie J, Bonniaud P, Sime P, Ask K, Kolb M. TGF-beta, Smad3 and the process of progressive fibrosis. Biochem Soc Trans. 2007;35:661-664. [PubMed] [DOI] |
| 26. | Alonso-Merino E, Martín Orozco R, Ruíz-Llorente L, Martínez-Iglesias OA, Velasco-Martín JP, Montero-Pedrazuela A, Fanjul-Rodríguez L, Contreras-Jurado C, Regadera J, Aranda A. Thyroid hormones inhibit TGF-β signaling and attenuate fibrotic responses. Proc Natl Acad Sci USA. 2016;113:E3451-E3460. [PubMed] [DOI] |
| 27. | 李 书香. TGF-β1抗体对肝星状细胞Ⅰ型胶原及TIMP-1基因表达的影响. 石家庄: 河北医科大学 2008; . |
| 28. | Qiu SS, Dotor J, Hontanilla B. Effect of P144® (Anti-TGF-β) in an "In Vivo" Human Hypertrophic Scar Model in Nude Mice. PLoS One. 2015;10:e0144489. [PubMed] [DOI] |
| 29. | Fan X, Zhang Q, Li S, Lv Y, Su H, Jiang H, Hao Z. Attenuation of CCl4-induced hepatic fibrosis in mice by vaccinating against TGF-β1. PLoS One. 2013;8:e82190. [PubMed] [DOI] |
| 30. | Kajdaniuk D, Marek B, Borgiel-Marek H, Kos-Kudła B. Transforming growth factor β1 (TGFβ1) in physiology and pathology. Endokrynol Pol. 2013;64:384-396. [PubMed] [DOI] |