修回日期: 2016-12-12
接受日期: 2016-12-19
在线出版日期: 2017-02-18
评价国产冷冻消融设备在≤5 cm肝细胞肝癌(hepatocellular carcinoma, HCC)消融治疗的安全性及有效性.
对33例直径≤5 cm HCC, 采用国产靶向刀行计算机断层扫描引导下冷冻消融治疗, 评估术中、术后手术相关并发症, 通过影像学复查评价目标病灶消融效果及术后局部复发率.
全部33例(共37个病灶)均成功行冷冻消融治疗, 消融结束时, 消融靶区完全覆盖病灶率为83.78%(31/37), 部分覆盖或消融区域达到病灶边缘率为16.22%(6/37). 术中、术后无严重并发症出现. 平均10.8 mo随访中, 32例存活, 1例失访, 肿瘤病灶局部复发率30.3%(10/33), 治疗效果与进口设备相当.
本研究揭示该国产冷冻消融系统在≤5 cm HCC消融治疗中安全有效, 能有效灭活局部瘤体.
核心提要: 通过使用国产冷冻消融设备对33例(共37个病灶)病灶直径≤5 cm的肝癌患者进行消融治疗, 证明国产冷冻消融设备疗效的可靠性.
引文著录: 刘源, 李曦, 张莉敏, 陈婧, 蔡懿, 林瑶, 耿彩娟, 王科, 王奇奇, 何春水, 钟森. 国产靶向刀在≤5 cm肝细胞肝癌冷冻消融治疗中的应用. 世界华人消化杂志 2017; 25(5): 426-431
Revised: December 12, 2016
Accepted: December 19, 2016
Published online: February 18, 2017
To assess the safety and efficacy of a China-made cryoablation device in the treatment of hepatocellular carcinoma (HCC) smaller than 5 cm.
A total of 33 patients with HCC smaller than 5 cm were treated by cryoablation using a China-made cryoablation device under the guidance of computed tomography. Operation-associated complications within and after procedures were evaluated. The efficacy of target lesions within procedures and local recurrence rate after procedures were evaluated with imaging modalities.
All 37 lesions of the 33 patients were successfully treated with a China-made cryablation device. Upon the finish of procedures, complete ablation was achieved in 83.78% (31/37) of lesions, and partial ablation was achieved in 16.22% (6/37). In a median follow-up period of 10.8 mo, 32 patients remained alive and 1 was lost to follow-up. The rate of local recurrence for target lesions was 30.3% (10/33), which is equal to that achieved with imported devices.
Our findings suggest that the China-made cryoablation device is safe and effective for HCC smaller than 5 cm with the capability of destroying the whole tumor lesion.
- Citation: Liu Y, Li X, Zhang LM, Chen J, Cai Y, Lin Y, Geng CJ, Wang K, Wang QQ, He CS, Zhong S. Safety and efficacy of a China-made cryoablation device in treatment of hepatocellular carcinoma smaller than 5 cm. Shijie Huaren Xiaohua Zazhi 2017; 25(5): 426-431
- URL: https://www.wjgnet.com/1009-3079/full/v25/i5/426.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i5.426
《原发性肝癌诊疗规范(2011版)》中将消融术作为≤5 cm肝癌的常规治疗手段, 冷冻消融术作为其中一种消融技术, 由于具有消融冰球边界清楚、参与激活机体肿瘤免疫功能、不损伤大血管、没有明显疼痛等优点, 在临床中获得广泛应用[1-7]. 国内目前采用的冷冻消融设备主要为美国或以色列进口, 以氩气、氦气作为冷媒[8-14]. 本文主要研究以氩气和氮气为冷媒的国产冷冻消融设备(靶向刀®), 对≤5 cm的肝细胞肝癌(hepatocellular carcinoma, HCC)进行消融治疗的安全性和疗效.
1.1.1 仪器设备: 以氩气和氦气作为冷媒, 采用国产靶向刀®(型号AT-2008-Ⅱ)作为冷冻治疗系统(上海导向), 工作压力8268-10335 Kpa(1200-1500 psi), 配有直径1.6 mm、长度17 cm冷刀, 有4个输出通道. 定位计算机断层扫描(computed tomography, CT)采用西门子16层Emotional多排螺旋CT.
1.1.2 患者资料: 收集2015-10/2016-10接受冷冻消融治疗的瘤体直径≤5 cm的HCC患者资料. 全部33例患者符合HCC诊断标准[15], 其中穿刺活检病理诊断13例, 临床诊断20例. 男21例, 女12例, 年龄41-73岁(中位年龄59岁), 81.8%(27/33)合并乙型肝炎病毒感染. 5例为HCC切除术后或消融术后肝内其他部位复发, 11例TACE术后疗效不佳, 17例为初治患者. 33例患者共37个靶病灶, 直径≤3 cm病灶15个, >3 cm, ≤5 cm病灶22个. 行冷冻治疗前, 11例AFP阴性(≤400 ng/mL); 22例AFP阳性(>400 ng/mL), 肝功能Child-Pugh A、B级者分别为23、10例; 按BCLC分期, A期11例, B期22例. 单发病灶29例, 多发病灶4例. 纳入标准: 单发结节肿瘤直径≤5 cm, 多发结节肿瘤数≤3个且最大直径≤3 cm; 肝功能Child-Pugh分级A级或B级; 无门脉瘤栓或其他部位转移; 有合适的经皮穿刺进针路径. 剔除标准: 患者拒绝冷冻消融治疗, 术前有远处转移; 合并心、肾、脑等严重器质性疾病者, 不能耐受手术. 所有治疗均经患者和家属同意, 并签订知情同意书.
1.2.1 冷冻消融: 分析患者术前影像资料, 根据瘤体部位决定靶区冷冻体积、大概皮肤进针点、穿刺途径及体位(仰卧位或俯卧位). 首先采用5 mm层厚肝脏螺旋CT平扫, 通过术中扫描图像选择并确定进针层面、角度、深度和穿刺点, 按照CT定位线及体表标志线标记体表穿刺点后消毒、铺巾、麻醉, 按预定穿刺途径将一次性靶向刀穿入冷冻靶区(根据瘤体大小及部位决定单刀或多刀), CT扫描显示靶向刀在瘤体内位置满意后, 启动靶向刀, 在氩气及氮气压力8268-10335 Kpa(1200-1500 psi)和100%输出功率条件下, 冷冻靶向区至-140-(-160) ℃, 持续14-16 min, 开启复温模式, 使靶向区复温至30 ℃, 以上作为第1次冷冻循环. 重复上述条件进行第2次冷冻循环后结束消融. 术中每3-8 min行CT平扫, 并结合消融情况在CT工作站行冠状面、矢状面重建, 从各层面监视冰球范围, 若冰球临近膈肌、肠管、胆囊、心包等重要脏器, 则暂停工作, 降低冷媒压力并缩短冷冻时间, 以控制冰球范围避免损伤临近器官(冰球范围超出肿瘤范围5 mm定义为完全消融). 术毕, 撤出靶向刀, 伤口给予纱布覆盖. 术中全程给予心电监护、吸氧, 术后常规保肝、止血、对症、预防感染等治疗.
1.2.2 手术安全性及疗效评价: (1)手术安全性评价: 观察术中、术后疼痛、发热、临近脏器损伤、大出血等情况. 观察有无冷休克和过冷反应出现(冷休克和过冷反应为与冷冻消融相关的特殊并发症, 前者主要表现为多器官功能衰竭、严重凝血障碍、血管内播散凝血等, 后者主要为寒战、发热、心动过速、一过性肌酐升高); (2)疗效评价: 冷冻术后每1-3 mo行增强CT或核磁共振成像检查观察肿瘤大小及密度(信号)变化, 若发现肿瘤消融区域内或边缘出现存活肿瘤则判定为局部复发. 并随访患者生存率.
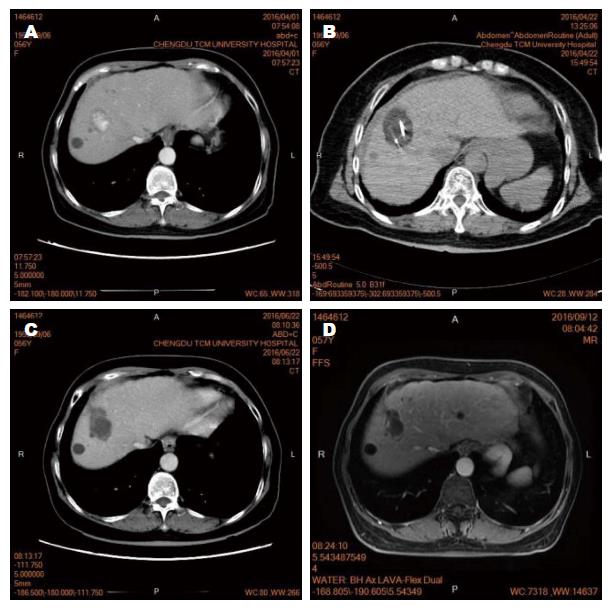
对全部33例(共37个病灶)均进行冷冻消融治疗. 消融术中, CT扫描显示单靶向刀消融区域为形状规则的椭圆形低密度区, 边界清楚(通常单把靶向刀消融范围的长×宽×高约4.5 cm×3.0 cm×3.0 cm, 两把或多把刀联合应用, 实现消融的病灶体积可进一步扩大). 消融结束时, 消融靶区完全覆盖83.78%(31/37)的目标病灶, 实现了完全消融(图1A, B), 靶区部分覆盖16.22%(6/37)的目标病灶或消融区域达到病灶边缘.
术中31例患者未诉疼痛不适, 2例患者术中出现轻微疼痛, 未予以进一步止痛、镇静药物处理. 术中、术后均无冷休克、皮肤冻伤、大出血、胆道损伤、膈肌损伤、胆囊、肠道等空腔脏器穿孔、死亡等严重并发症出现. 术后30.3%(10/33)患者腹部轻微疼痛不适, 未予以处理; 24.2%(8/33)出现酶学指标轻度升高, 幅度<50%; 39.4%(13/33)出现低于38 ℃的低热; 9.1%(3/33)出现反应性的胸水或腹水; 以上次要并发症经对症处理均逐渐恢复. 这些次要并发症经对症处理均逐渐恢复. 1例患者术后3 wk左右出现右侧腹壁肿块伴疼痛, 经穿刺引流出暗红色液性坏死组织后肿块消失. 在平均10.8 mo的随访中, 1例失访, 32例存活(图1C, D), 其中30.3%(10/33)出现肿瘤消融区域局部肿瘤复发, 进一步接受栓塞、靶向药物等抗肿瘤治疗.
冷冻消融相对于射频消融及微波消融来说, 主要优势在于冷冻范围清晰可见, 便于消融区域的把握, 不会对大的动脉、静脉造成损伤. 术中患者几乎无明显疼痛, 不需要额外麻醉, 同时还能刺激机体免疫反应, 激活全身抗肿瘤免疫发挥抗癌作用[12-14], 故冷冻消融技术已成为国内外前列腺癌的首选治疗手段, 在肝癌、肾癌、结、直肠肝转移瘤等治疗领域应用较广[15-25]. 目前国内常用的进口冷冻消融设备主要为美国的CRYO care System(EndoCare, Irvine, CA, United States)和以色列的Cryohit(Galil Medical, Yokneam, Israel), 冷媒为氩气和氦气. 氦气作为冷媒的缺点在于价格昂贵、国内许多地区缺乏氦气供应等原因阻碍了冷冻消融的普及及发展. 本研究中所用国产靶向刀®采用氩气、氮气作为冷媒, 价格便宜, 国内能够得到普遍供应, 克服了上述缺点.
靶向刀采用的冷刀直径约1.6 mm, 单把刀产生的冰球各径线为4.5 cm×3.0 cm×3.0 cm, 同进口设备相当. 单次冷冻循环时间13-16 min, 在肝脏中能够达到-140 ℃低温. 冷刀的直径小于进口产品, 可直接穿刺抵达病灶. 有些进口产品需要18G穿刺针预先穿刺形成通道, 引入超硬导丝及5F血管鞘, 才能够引入冷刀, 操作较为复杂, 创伤较大, 但在20 min循环中, 能够达到-150-(-160) ℃的低温[11,12].
Rong等[13]报道迄今最大病例数量的1组患者中, 没有冷冻相关死亡和冷休克出现, 肿瘤种植、出血、过冷反应、肝脓肿、脓胸等主要并发症发生率2.4%(29/1197), 术后疼痛、发热、少量胸水、穿刺点出血等次要并发症发生率10.6%(128/1197), 过冷反应的发生率在0.6%(7/1197), 经对症处理好转. Wang等[11]报道肝癌冷冻并发症死亡率1.5%, 同手术切除相当[20,21]. Shafir等[25]报道300例接受超声引导下冷冻消融治疗的HCC患者, 严重并发症发生率为6%, 包括冷休克6例, 肝脏出血5例, 胃腔应激性出血4例, 肝脓肿1例, 肠瘘1例, 肝功能衰竭所致死亡2例. 冷休克是冷冻消融的一种罕见并发症, 表现为肾功能衰竭、播散性血管内凝血、成人呼吸窘迫综合征, 发生率与冷冻组织的体积有关, 如果冰球直径>6 cm, 发生率相应增加. 次要并发症包括寒战、发热、肝区疼痛、酶学增高, 通常对症处理即可[24-27]. 在本研究中, 没有冷休克、过冷反应严重并发症出现, 可能因为纳入病例数量有限或没有纳入巨块型肝癌, 产生的冰球直径通常不会太大有关. 1例患者出现腹壁肿块, 或与肿瘤临近腹壁, 消融术中导致壁腹膜、腹壁肌肉损伤, 肿瘤坏死组织液化引流到腹壁组织间隙中有关. 除此之外, 没有膈肌、胆囊、肠管等空腔脏器损伤等严重并发症, 或与CT图像上冰球消融范围清楚可见、消融术中多次CT扫描监控冰球范围有关, 也与及术中适时调整消融冷媒压力及时间, 调整了冰球大小有关, 也有可能与总体例数过少有关. 发热、酶学增高等次要并发症的发生率在9.1%-30.3%之间, 经对症处理即可, 处于可以接受范围.
Rong等[13]报道冷冻术后96.1%(832/866)的患者达到了CR的治疗效果. 1、3、5年生存率为98.6%、80.6%和60.3%; 1、3、5年局部复发率分别为10.7%、22.1%和24.2%, 治疗到首次复发平均时间22.4 mo, 多个肿瘤、瘤体直径>3 cm、同一肿瘤多次消融为局部复发的独立相关因素. 本组患者消融靶区完全覆盖83.78%(31/37)目标病灶, 比例低于上述报道, 主要由于上述研究66.9%病灶直径在0-3 cm, 而本组59.45%(22/37)病灶直径在3.1-5.0 cm之间, 瘤体直径大于上述研究中的瘤体有关. 另外也与本单位消融例数不多, 经验不足有关. 在有限的平均10.8 mo随访期间内, 1例失访, 其余患者全部存活, 生存率96.97%, 与上述研究相当.
杨茂等[10]对90例≤5 cm的肝癌行冷冻消融治疗后的复发因素分析, 发现2年复发率63.3%(57/90), 术前HBV DNA>5 log10 copies/mL、肿瘤最大直径>3 cm、肿瘤邻近大血管是HCC冷冻消融术后早期复发的独立影响因素(P<0.05). 唐裕福等[28]分析436例肝癌微波消融患者资料, 并进一步的多因素Logistic回归分析提示肿瘤大小、肿瘤部位、肿瘤数目, 结合TACE治疗是微波消融术后肿瘤残余的独立影响因素. 本组患者在平均10.9 mo随访中, 30.3%(10/33)发现肿瘤消融区域肿瘤复发或增大, 低于杨茂等[10]报道的2年内复发率63.3%(57/90), 或与本组患者随访时间不足1年有关, 随时间推移, 复发患者会逐渐增多; 本组复发率高于Rong等[13]报道的1年局部复发率10.7%, 或与本组瘤体数量直径在3-5 cm, 相对较大有关, 也可能与将消融边界设定在瘤体外周5 mm有关. Hinshaw等[29]与Li等[30]报道低密度冷冻区边缘温度为0摄氏度, 该区域有肿瘤存活. 边缘内5 mm为-20-(-50) ℃, 仍有可能有肿瘤存活, 因此建议将低密度冷冻区域的边界扩展到瘤体外1 cm. 也有学者提出在原有2个循环的基础上, 再增加1个循环, 以彻底灭活肿瘤[23]. 鉴于以上认识, 我们认为, 对于>3 cm肿瘤, 应多刀消融, 确保消融范围覆盖整个靶区, 同时对于周围没有重要结构的瘤体, 可以考虑在原来的5 mm消融边界的基础上进一步扩大消融范围, 以降低复发的可能, 也可对靶区进行3个低温冷冻循环消融. 但对于膈顶、肝门、肝脏表面的肿瘤, 扩大消融范围, 又带来手术风险的增加. 增加1个冷冻循环, 势必延长手术时间, 也会带来相应风险, 因此需要手术医生权衡利弊. 对于靠近大血管的肿瘤, 应当预估早期复发可能, 结合其他治疗手段, 如125碘粒子或栓塞治疗, 进行早期干预, 同时对于乙型肝炎病毒复制的患者, 应重视抗病毒治疗.
通过样本量不大的研究, 得出国产冷冻消融设备对≤5 cm肝癌安全有效结论, 术中即时消融完全覆盖率、术后并发症发生率、肿瘤病灶短期局部复发率与进口设备相当, 仍有待于进一步大样本、随机对照研究.
目前肝癌的消融治疗在小肝癌治疗领域越来越得到临床医生及患者的接受, 目前肝癌消融方式多为微波和射频, 冷冻消融作为一种新的消融方式, 因其疼痛较轻, 安全性较好, 在介入消融领域越来越得到推广.
消融作为一种能完全达到或部分达到外科肿瘤切除效果的微创方式, 应用越来越广泛. 目前冷冻消融主要用于肝癌及肺癌的小病灶的治疗, 受消融方式的影响, 对血供不同的病灶消融持续时间尚未有一个统一的标准.
冷冻消融作为近两年发展较快的消融方式, 对位置较浅表病灶及靠近大血管的病灶的消融提供了一种更安全有效的方法. 同时相较微波及射频消融, 患者的疼痛感更轻, 术中也更安全.
本文所使用的消融设备的冷媒为氮气及氩气, 相对其他文章所使用的冷媒为氩气及氦气的国外设备, 冷媒更易获得, 成本也更低廉, 适合更多下级医院及偏远地区开展冷冻消融.
本文通过对33例肝癌患者冷冻消融治疗的回顾, 对国产靶向刀在肝癌消融的时间、疗效及并发症的发生几率等做了一个探索性的研究.
消融: 主要指通过物理(化学)方法, 破坏细胞结构及组成成分, 使肿瘤细胞灭活, 从而完全达到或部分达到外科学上肿瘤完全切除效果的一种微创手术方式.
王阁, 教授, 中国人民解放军第三军医大学第三附属医院; 王学梅, 教授, 中国医科大学附属第一医院超声科; 朱争艳, 研究员, 天津市第三中心医院
肝细胞肝癌的微创消融治疗是近几年的研究热点, 本研究主要探讨国产刀的治疗疗效, 立意较好, 使用的技术描述比较详细, 结果比较可靠, 有一定创新性及临床推广价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 四川省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 闫晋利 电编:李瑞芳
| 1. | Littrup PJ, Ahmed A, Aoun HD, Noujaim DL, Harb T, Nakat S, Abdallah K, Adam BA, Venkatramanamoorthy R, Sakr W. CT-guided percutaneous cryotherapy of renal masses. J Vasc Interv Radiol. 2007;18:383-392. [PubMed] [DOI] |
| 2. | Littrup PJ, Freeman-Gibb L, Andea A, White M, Amerikia KC, Bouwman D, Harb T, Sakr W. Cryotherapy for breast fibroadenomas. Radiology. 2005;234:63-72. [PubMed] [DOI] |
| 3. | Ladd AP, Rescorla FJ, Baust JG, Callahan M, Davis M, Grosfeld JL. Cryosurgical effects on growing vessels. Am Surg. 1999;65:677-682. [PubMed] |
| 4. | Sabel MS. Cryo-immunology: a review of the literature and proposed mechanisms for stimulatory versus suppressive immune responses. Cryobiology. 2009;58:1-11. [PubMed] [DOI] |
| 5. | Arciero CA, Sigurdson ER. Liver-directed therapies for patients with primary liver cancer and hepatic metastases. Curr Treat Options Oncol. 2006;7:399-409. [PubMed] [DOI] |
| 8. | Lee DI, McGinnis DE, Feld R, Strup SE. Retroperitoneal laparoscopic cryoablation of small renal tumors: intermediate results. Urology. 2003;61:83-88. [PubMed] [DOI] |
| 11. | Wang CP, Wang H, Qu JH, Lu YY, Bai WL, Dong Z, Gao XD, Rong GH, Zeng Z, Yang YP. Tumour seeding after percutaneous cryoablation for hepatocellular carcinoma. World J Gastroenterol. 2012;18:6587-6596. [PubMed] [DOI] |
| 12. | Zhang JR. A New Challenge on Clinical Oncology: Argon-Helium Targeted Ablation Therapy. Int J Modern Cancer Ther. 2002;25:68-72. |
| 13. | Rong G, Bai W, Dong Z, Wang C, Lu Y, Zeng Z, Qu J, Lou M, Wang H, Gao X. Long-term outcomes of percutaneous cryoablation for patients with hepatocellular carcinoma within Milan criteria. PLoS One. 2015;10:e0123065. [PubMed] [DOI] |
| 15. | Bruix J, Sherman M, Llovet JM, Beaugrand M, Lencioni R, Burroughs AK, Christensen E, Pagliaro L, Colombo M, Rodés J. Clinical management of hepatocellular carcinoma. Conclusions of the Barcelona-2000 EASL conference. European Association for the Study of the Liver. J Hepatol. 2001;35:421-430. [PubMed] [DOI] |
| 16. | Tang A, Valasek MA, Sirlin CB. Update on the Liver Imaging Reporting and Data System: What the Pathologist Needs to Know. Adv Anat Pathol. 2015;22:314-322. [PubMed] [DOI] |
| 18. | Cohen JK, Miller RJ, Ahmed S, Lotz MJ, Baust J. Ten-year biochemical disease control for patients with prostate cancer treated with cryosurgery as primary therapy. Urology. 2008;71:515-518. [PubMed] [DOI] |
| 20. | Seifert JK, Junginger T. Cryotherapy for liver tumors: current status, perspectives, clinical results, and review of literature. Technol Cancer Res Treat. 2004;3:151-163. [PubMed] [DOI] |
| 21. | Tanagho YS, Roytman TM, Bhayani SB, Kim EH, Benway BM, Gardner MW, Figenshau RS. Laparoscopic cryoablation of renal masses: single-center long-term experience. Urology. 2012;80:307-314. [PubMed] [DOI] |
| 22. | Ng KM, Chua TC, Saxena A, Zhao J, Chu F, Morris DL. Two decades of experience with hepatic cryotherapy for advanced colorectal metastases. Ann Surg Oncol. 2012;19:1276-1283. [PubMed] [DOI] |
| 23. | Yang Y, Wang C, Lu Y, Bai W, An L, Qu J, Gao X, Chen Y, Zhou L, Wu Y. Outcomes of ultrasound-guided percutaneous argon-helium cryoablation of hepatocellular carcinoma. J Hepatobiliary Pancreat Sci. 2012;19:674-684. [PubMed] [DOI] |
| 25. | Shafir M, Shapiro R, Sung M, Warner R, Sicular A, Klipfel A. Cryoablation of unresectable malignant liver tumors. Am J Surg. 1996;171:27-31. [PubMed] [DOI] |
| 26. | Niu LZ, Li JL, Xu KC. Percutaneous Cryoablation for Liver Cancer. J Clin Transl Hepatol. 2014;2:182-188. [PubMed] [DOI] |
| 27. | Lerusse J, Dubois P. Study of a case of cervical pregnancy. Rev Med Liege. 1977;32:748-751. [PubMed] |
| 28. | 唐 裕福, 张 怡冰, 罗 斌, 王 学范, 林 琳, 姜 晓峰, 梁 健. 肿瘤残余在肝癌微波消融治疗后出现的原因及防治. 世界华人消化杂志. 2011;19:1075-1080. [DOI] |
| 29. | Hinshaw JL, Lubner MG, Ziemlewicz TJ, Lee FT, Brace CL. Percutaneous tumor ablation tools: microwave, radiofrequency, or cryoablation--what should you use and why? Radiographics. 2014;34:1344-1362. [PubMed] [DOI] |
| 30. | Li J, Chen J, Zhou L, Zeng J, Yao F, Wu B, Fang G, Deng C, Chen Z, Leng Y. Comparison of dual- and triple-freeze protocols for hepatic cryoablation in a Tibet pig model. Cryobiology. 2012;65:68-71. [PubMed] [DOI] |