修回日期: 2016-12-06
接受日期: 2016-12-12
在线出版日期: 2017-02-08
胃癌是世界范围内最常见的肿瘤之一, 其死亡率在全球所有肿瘤中居第3位. 因此, 探究胃癌的发病及演变机制, 为治疗胃癌提供理论依据尤为必要. 过去数十年中, 肿瘤干细胞的学说的提出与发展大大深化了人们对胃癌的认识. 肿瘤干细胞是一类具有自我更新能力并能产生异质性肿瘤细胞的细胞, 胃癌干细胞(gastric cancer stem cell, GCSC)在发生进展过程中都会伴随干细胞相关信号通路的异常, 随着研究的深入, 特别是针对GCSC及相关信号通路的研究取得了一定的成果, 为阐明和治疗胃癌提供新的理论基础和实验依据. 本文就干细胞相关的几条信号通路对GCSC影响与机制和靶向抑制信号通路关键靶点的治疗进行了综述.
核心提要: 靶向胃癌干细胞(gastric cancer stem cells, GCSC)相关信号通路及关键靶点的药物的出现, 以及近来数个临床试验的开展, 为提高胃癌诊疗水平, 改善胃癌患者的生存率带来了新的曙光. 本文从综述GCSC内相关信号通路的异常改变入手, 对上市或处于研发阶段的干细胞靶向药物作一综述, 为今后的肿瘤干细胞信号通路及靶向治疗研究提供基础.
引文著录: 高云鹤, 马连港, 蔡爱珍, 郗洪庆, 陈凛. 胃癌肿瘤干细胞相关信号通路及靶向治疗研究进展. 世界华人消化杂志 2017; 25(4): 351-357
Revised: December 6, 2016
Accepted: December 12, 2016
Published online: February 8, 2017
Gastric cancer is still one of the most common malignant neoplasms worldwide and the third leading cause of cancer-related death. Therefore, it is of great significance to clarify the mechanism of gastric cancer oncogenesis. In the past decades, the theory of cancer stem cell has enhanced our knowledge of gastric cancer. Cancer stem cells are defined as cells within a tumor that possess the capacity to self-renew and to cause the heterogeneous lineages of cancer cells that comprise the tumor. The dysregulation of certain signal pathways occurs during tumor formation. Recently, the research on gastric cancer stem cells (GCSCs) and related signal pathways has provided a new theoretical basis for clarifying the mechanism of gastric cancer and treating this malignancy. This review will discuss the role of related signal pathways in GCSCs and therapies targeting the key molecules of these pathways.
- Citation: Gao YH, Ma LG, Cai AZ, Xi HQ, Chen L. Gastric cancer stem cells: Signal pathways and targeted therapies. Shijie Huaren Xiaohua Zazhi 2017; 25(4): 351-357
- URL: https://www.wjgnet.com/1009-3079/full/v25/i4/351.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i4.351
目前认为胃癌干细胞(gastric cancer stem cells, GCSC)的起源主要有2种可能[1]: (1)正常的胃黏膜干细胞经过突变产生"干性"重激活产生[2,3]; (2)骨髓间充质干细胞易位到胃黏膜位置, 由于炎症因素刺激导致微环境改变和基因变化, 进而经过化生/不典型增生等过程产生[4]. GCSC可通过不对称分裂, 产生具有较强增殖能力和异质性的子代肿瘤细胞, 而干细胞自身则保持相对幼稚/未分化的状态, 从而保持自我更新能力[5,6]; GCSC也同上皮间质转化(epithelial-mesenchymal transition, EMT)现象密切相关, 具有多向分化潜能的GCSC可分化出具有间质特性的肿瘤细胞[7], 从而为肿瘤的转移提供基础. 因此, GCSC既是肿瘤发生的起源, 也同时在肿瘤的转移、复发和化疗耐药中起到重要作用.
目前, 胃癌肿瘤干细胞的分离提取来源主要有人胃癌肿瘤组织和已建成的胃癌细胞系2种[8], 亦有从胃癌患者外周血中分离的报道, 但应用较少[9]. 在胃癌原代细胞或胃癌细胞系中, 应用流式细胞术或磁性活化细胞分选术分选出表达特定表面标志物的细胞, 无血清悬浮培养于超低吸附板中, 再进行干细胞特性鉴定, 是GCSC常见的培养鉴定流程. 现阶段GCSC的表面标志物比较公认的有CD44, 另外有学者分别提出CD24、CD54、CD133、EpCAM、ALDH1、Lgr5、Musashi-1等可作为GCSC的候选表面标志物[10-17], 上述标志物可单独或组合作为分选GCSC的表面标志物. 但是由于目前GCSC的表面标志物仍缺乏特异性, 因此部分文献也将分选出的GCSC称为胃癌干样细胞.
在分选出特定群体的胃癌细胞后, 需要进行干细胞特性的鉴定, 目前较为常用的实体瘤干细胞鉴定方法主要包括以下几种[18]: (1)细胞悬浮成球/克隆形成能力: 在无血清超低吸附环境中培养, 只有具有自我更新能力的干细胞能够形成悬浮球并且稳定传代; (2)放化疗耐药性: 经过一定剂量的放疗或化疗药物处理, 依然能够存活的细胞亚群可认为具有一定"干性"; (3)干性相关基因及蛋白表达情况: 应用流式细胞仪或qPCR检测"干性"相关基因[19], 包括了CD44、SOX-2、Oct-4、Nanog、Bmi1等, 上述基因的高表达代表细胞具有较强的增殖和自我更新能力; (4)细胞分化能力: 肿瘤干细胞可在不同的培养环境中产生EMT或者间质上皮转化现象; (5)免疫缺陷小鼠体内成瘤能力: 少量肿瘤干细胞即可在免疫缺陷小鼠(裸小鼠、SCID小鼠、NSG小鼠等)体内成瘤并稳定传代被认为是肿瘤干细胞鉴定的"金标准", 结合现有文献报道和我们的经验, 最少100个胃癌悬浮球即可在8 wk内形成体积达500 mm3的皮下移植瘤. 经过以上方法培养与鉴定的胃癌细胞, 可认为是GCSC或富集GCSC的胃癌干样细胞.
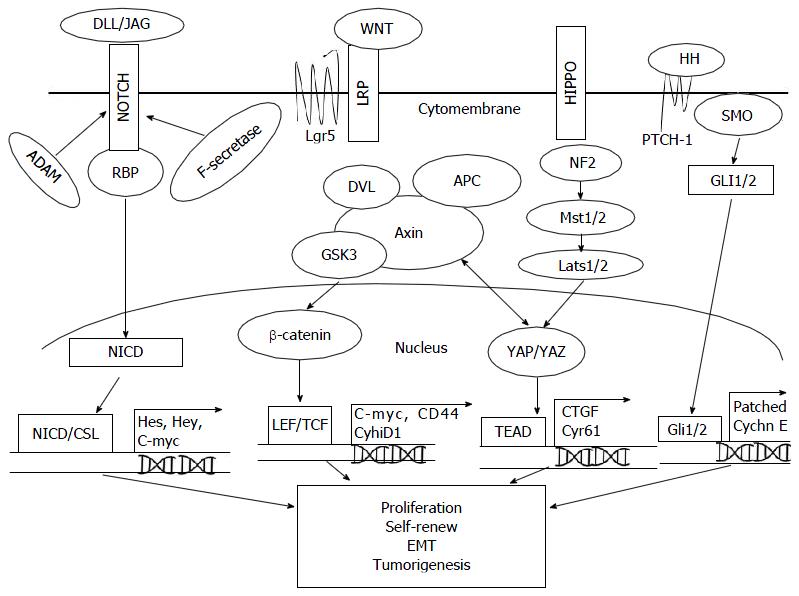
Notch基因最早于1917年由Morgan在果蝇中发现, 因其功能缺失可造成果蝇翅膀产生切迹命名. 在哺乳动物中, Notch信号通路由其配体(Delta-like1,3,4及Jagged1,2)、受体(Notch1-4)及细胞内效应机器-重组结合蛋白κ3部分组成[20]. Notch配体与受体的结合会启动由ADAM金属蛋白酶家族成员介导的级联蛋白分裂和由γ分泌酶介导的内部分裂, 从而促使Notch细胞内结构域(Notch intracellular domain, NICD)易位进入细胞核. 入核后的NICD与其转录因子结合从而激活其下游靶基因(Hes/Hey家族基因、CyclinD1、PI3K、AKT、C-Myc)等的表达(图1)[21].
Notch信号通路在肿瘤中经常处于活化状态. 在GCSC中, 抑制Notch信号受体与配体结合, 或者使用γ分泌酶抑制剂DAPT均可导致肿瘤干细胞的克隆形成能力降低[22]. Sun等[23]以免疫组化和蛋白印记等方法检测胃癌标本和细胞系中Notch受体及其关键下游基因的表达水平, 发现了肠型胃癌与Notch1异常激活密切相关, 而且Notch1的活性受Delta-like1配体的调节; 而在Notch2高表达的胃癌病例中, Hes基因及其翻译产物Hes1蛋白则异常高表达, 但是在这些组织中Notch1的表达水平较低(或表达缺失), 提示不同的Notch受体可能与不同的胃癌病理分型有关. 在肿瘤干细胞的起源方面, Notch通路的关键基因Hath1是GCSC的来源-胃黏膜主细胞中的重要转录调节因子, Hath1可调控胃正常干细胞的增殖分化, 其异常表达同肿瘤发生进展也密切相关[24]. 并且Notch通路相关基因(Hes/Hey等)在GCSC中异常高表达, 以上一系列发现均提示Notch通路可能在从正常胃黏膜细胞向肿瘤细胞转变过程中起到重要的作用.
DAPT可以通过阻断Notch受体的内部分裂来抑制信号通路的传导, 临床前研究发现其同糖皮质激素的联合使用能够降低药物的胃肠道副反应等不良作用, 这为后期临床试验的开展奠定了基础[25]. Li等[22]研究发现DAPT能够抑制CD44+ MKN45胃癌干样细胞的生长及EMT过程, 而对CD44- MKN45细胞则未发现上述改变, 提示DAPT可能选择性地针对胃癌干样细胞起到抑制作用. 然而, 不同Notch受体的表达与胃癌的病理分型紧密相关, 因此明确患者的病理类型以及选择合适的Notch受体抑制剂也尤为重要. 除此之外, 由于Notch信号通路在人体正常干细胞(somatic stem cells, SSCs)中也同样激活, 因此在抑制该信号通路时应选择合适的靶向位置以避免对正常SSCs产生影响[25].
Hedgehog基因是一种具有分节极性的基因, Hedgehog信号通路以Hedgehog-Ptch-Smo-Gli1为信号转导轴, 以细胞自分泌或旁分泌的3种配体Sonic(Shh)、Desert(Dhh)、Indian(Ihh)为起点[26]. 在Hedgehog(HH)配体缺失的情况下, 跨膜受体Ptch1与下游的Smo蛋白结合并抑制其活性; 当HH配体与Ptch1受体结合后, 则解除对Smo蛋白的抑制, 活化的Smo将信号传递到核转录因子Gli1/2, 从而启动下游基因(Bcl-2、Cyclins、Snail等)转录[27].
一般认为胃癌肿瘤干细胞的HH配体是通过自身分泌产生的配体来启动Hedgehog信号通路的, 该信号通路在肿瘤干细胞的特性维持、EMT过程中起到重要作用[28]. Song等[29]发现在人胃癌组织和细胞系分离的GCSC中, HH信号通路及下游关键蛋白(Ptch和Gli1)异常高表达, 随后使用药物环巴胺抑制HH通路并降低了干细胞悬浮球形成能力和化疗耐药能力. 在CD44+/Musashi-1+的胃癌干样细胞中, Hedgehog信号通路下游分子Gli1、ABCG2对干细胞的化疗耐药能力起到维持的作用. 研究者在小鼠Lgr5+的胃正常干细胞中过表达Gli2A(Gli2激活态), 3 wk后成功诱导小鼠胃癌发生(65%原位癌, 23%浸润癌), 同时在肿瘤中可发现Lgr5+的胃癌细胞产生肿瘤干细胞特性, 其形态发生间质样改变, 即产生EMT现象, 从而为肿瘤的侵袭转移提供可能[14,30].
第一种应用于临床的Hh通路的靶向抑制药物为环靶明-一种小分子的SMO蛋白抑制剂, 现阶段该药物主要应用于基底细胞肿瘤和髓母细胞瘤, 在胃癌中的应用已有体外实验证实其效果[31], 我们的前期研究也证实了环靶明可选择性诱导CD44+CD54+胃癌干样细胞的凋亡. GDC-0449同样是一种抑制SMO蛋白的药物, 目前正在多种包括胃癌等多种实体肿瘤中进行临床实验. 针对Hh受体与Ptch1的结合所开发的多种单克隆抗体, 在体外实验中也被证实有效[32]. 鉴于Hh信号通路与胃癌的密切关系, 以及已应用的靶向药物安全性、有效性的证实, 使得针对胃癌的靶向Hh通道的药物前景尤为令人期待.
Wnt信号通路包括经典(Wnt/β-catenin通路)和非经典(细胞极性通路、Wnt/Ca2+途径等)途径, 通过自分泌或旁分泌发挥作用. 近年来的研究证实经典Wnt信号通路在肿瘤干细胞的特性维持和肿瘤增殖中起到重要作用. 其信号传导主要通过Wnt蛋白配体与胞膜上的卷曲蛇纹石受体和低密度脂蛋白受体5/6结合, 激活胞质中的松散蛋白后将糖原合成酶3β磷酸化, 从而抑制β-catenin的降解, 导致β-catenin数量累积并进入细胞核内与转录因子(TCF/LEF)发生相互作用, 激活下游干性相关靶基因(如C-myc、CyclinD1、CD44、Lgr5等)从而引起干细胞特性的改变[32,33].
Mao等[34]和Xi等[35]研究者分别发现在胃癌组织和胃癌细胞系中, Wnt蛋白较正常组织和细胞高表达. 并且进一步过表达Wnt1蛋白或者上游受体Lgr5可以提高胃癌肿瘤干细胞的悬浮成球能力以及细胞化疗耐药性. 而通过DKK-1抑制Wnt/β-catenin通路后, CD44+的胃癌干样细胞悬浮成球能力、裸鼠成瘤能力也显著降低. 深入机制研究发现此现象可能是通过改变下游的β-catenin入核, 调节CD44等干性相关靶基因的转录有关. 另外, 胃癌发展过程中的重要治病菌-幽门螺旋杆菌(Helicobacter pylori, H. pylori)感染胃癌干样细胞后, 其悬浮成球能力较未感染者有显著提高[35], 而抑制Wnt信号通路之后可逆转上述现象. 机制研究发现, H. pylori可通过激活Wnt/β-catenin信号通路导致胃癌细胞干细胞相关蛋白(Nanog, Oct-4)的高表达, 这提示在H. pylori感染者体内, Wnt通路异常可能促进GCSC的进展过程.
靶向该信号通路的药物主要通过阻断β-catenin等关键蛋白以及各类Wnt分子的抗体, 这些药物尚处于研究向临床应用转换的阶段[36]. 沙利霉素是一种聚醚类抗生素, 其可通过选择性抑制钾离子载体从而抑制Wnt/β-catenin信号通路的活性. 在乳腺癌和淋巴细胞白血病中, 沙利霉素可选择性的抑制肿瘤干细胞和诱导肿瘤干细胞凋亡[37]. 而在胃癌中, 沙利霉素可选择性地抑制干细胞特性较高的胃癌细胞亚群[38], 对正常胃黏膜细胞系则影响较小, 这为该药今后的临床应用提供了基础. 另外, 一种植物来源的化合物-吴茱萸碱被证实可以在胃癌细胞系中抑制β-catenin的形成从而抑制Wnt信号通路, 并使得胃癌细胞干细胞特性减弱. 使用吴茱萸碱处理后, 胃癌干样细胞的悬浮成球能力明显降低, 干细胞相关基因(Sox2、Oct4、Bmi-1)等转录减少, 细胞迁移能力也明显降低, 并且使得胃癌细胞对铂类化疗药物更加敏感, 显示出其潜在的临床药用价值[39].
Hippo信号通路是一种抑制细胞生长、增殖和促进凋亡的抑癌信号通路[40]. 近年来的研究[41,42]表明, Hippo信号通路中的失活可能导致细胞生长调控失衡, 进而导致肿瘤发生. 在哺乳动物中, Hippo信号通路其组成成分依次为NF2、Mst1/2、Lats1/2、WW45, 以及核心蛋白-转录共激活因子YAP及其同源物转录共活化因子(transcriptional coactivator with PDZ-binding motif, TAZ). Hippo通路经过级联反应依次活化关键分子, 最终导致YAP/TAZ磷酸化及泛素化并发生降解, 从而发挥抑制细胞生长的作用; 在Hippo上游无相关激活因子或通路异常时, 非磷酸化状态的YAP/TAZ转移入核, 与转录激活因子TEAD/TEF家族结合调节靶基因的表达, 导致细胞增殖异常.
近来研究发现, Hippo/YAP信号通路在肿瘤干细胞形成的自我更新中起到重要作用. Gregorieff等[43]发现在Lg5+的胃肠道干细胞中, 细胞的自我更新能力获得及肿瘤干细胞的形成需要依赖YAP的异常表达. 日本学者Fujimoto等[44]的研究显示, 在胃癌干样细胞中, 抑制Hippo信号通路活性会导致胃癌干样细胞的自我更新能力、裸鼠成瘤能力、化疗耐药能力等明显增强, 并且提出胃癌细胞中蛋白酶激活受体1可能导致Hippo信号通路失活, 进而导致YAP累积随后入核启动下游转录因子, 从而导致细胞增殖并"干性"增强; 而在干细胞的EMT能力方面, Hippo通路的失活可能通过升高转录因子Snail调控E-cadherin表达降低, 从而促使肿瘤干细胞向间质细胞转化, 为细胞的侵袭转移提供基础.
靶向Hippo信号通路的药物尚处于研究阶段, 陆续有更多的Hippo通路抑制化合物被发现. 维替泊芬[45]可以竞争性抑制YAP-TEAD结合从而抑制Hippo通路传导, 在YAP过表达的小鼠中注射维替泊芬可以抑制肿瘤干细胞的增殖而对正常细胞及组织的生长发育没有影响. 另外, 多巴酚丁胺可通过激活异三聚体G蛋白导致YAP出核[46], 从而抑制Hippo下游基因转录表达; C19是一种新发现的小分子化合物, 可诱导TAZ降解, 从而抑制Hippo通路的原癌基因作用[47,48]. 但上述药物或化合物均只在体外实验中证实其效果, 尚需要更多的临床试验验证其疗效.
随着研究的深入, 更多的证据支持并证实了胃癌肿瘤干细胞的存在. 诚然, 由于现阶段研究存在的局限, 干细胞的分离鉴定、细胞内各信号通路上下游及相互关系还尚未完全阐明. 然而在探究其分子调控机制的同时, 已有相当部分的靶向药物开始进入临床或临床试验阶段, 虽然其疗效还有待结论验证, 但与传统治疗方法相比, 靶向肿瘤干细胞的药物能够更精确地作用于目标靶点, 更精准地抑制干细胞的特性和恶性生物学行为, 这势必为胃癌的治疗带来新的希望.
肿瘤干细胞在肿瘤形成和演化中往往会导致不同的信号通路改变, 常见的干细胞相关信号通路有Wnt、Hedgehog、Notch、转化生长因子-β、Hippo等. 其异常对干细胞的自我更新、多向分化、化疗耐药、上皮间质转化等方面起到不同的作用.
研究胃癌干细胞(gastric cancer stem cell, GCSC)的不同信号通路及关键靶点的异常变化, 为设计及应用靶向药物治疗提供了可能. 现阶段, 靶向肿瘤干细胞的药物主要有单克隆抗体、小分子化合物和中药提取物等.
胃癌肿瘤干细胞起源于正常的胃黏膜Lgr5+或Mist1+正常干细胞, 亦有报道其起源于骨髓源性间充质干细胞. 在肿瘤干细胞形成之后, 同普通体细胞相比, 往往存在信号通路的异常改变.
GCSC的起源和发展同干细胞信号通路的改变近来逐步为研究者所关注. 随着"精准医疗"概念的产生和应用, 特异性靶向肿瘤干细胞的药物必将成为今后研究的热点.
目前, 已有数种靶向GCSC信号通路关键靶点的药物上市或进入临床试验阶段(如环靶明等). 随着对GCSC发生发展机制的研究深入, 将有更多更具特异性、不良反应更小的GCSC靶向药物问世.
胃癌干细胞(GCSC): 指胃癌中存在的一群具有自我更新能力和多向分化潜能的细胞群. 理论上, 单个GCSC即可增殖分化出肿瘤所包含的肿瘤细胞和间质细胞.
沙杰, 副主任医师, 江苏省靖江市人民医院消化科; 张永生, 副研究员, 浙江中医药大学药学院
本文对胃癌肿瘤干细胞相关的信号通路进行了系统的分类论述, 是利用胃癌肿瘤干细胞应用于胃癌治疗靶点的基础所在, 为阐明和治疗胃癌提供了新的理论基础和依据, 有较好的学术价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 北京市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:胡珊
| 1. | Kreso A, Dick JE. Evolution of the cancer stem cell model. Cell Stem Cell. 2014;14:275-291. [PubMed] [DOI] |
| 2. | Karam SM. Lineage commitment and maturation of epithelial cells in the gut. Front Biosci. 1999;4:D286-D298. [PubMed] [DOI] |
| 3. | Hayakawa Y, Ariyama H, Stancikova J, Sakitani K, Asfaha S, Renz BW, Dubeykovskaya ZA, Shibata W, Wang H, Westphalen CB. Mist1 Expressing Gastric Stem Cells Maintain the Normal and Neoplastic Gastric Epithelium and Are Supported by a Perivascular Stem Cell Niche. Cancer Cell. 2015;28:800-814. [PubMed] [DOI] |
| 4. | Li XB, Yang G, Zhu L, Tang YL, Zhang C, Ju Z, Yang X, Teng Y. Gastric Lgr5(+) stem cells are the cellular origin of invasive intestinal-type gastric cancer in mice. Cell Res. 2016;26:838-849. [PubMed] [DOI] |
| 5. | Houghton J, Stoicov C, Nomura S, Rogers AB, Carlson J, Li H, Cai X, Fox JG, Goldenring JR, Wang TC. Gastric cancer originating from bone marrow-derived cells. Science. 2004;306:1568-1571. [PubMed] [DOI] |
| 6. | Kasashima H, Yashiro M, Nakamae H, Masuda G, Kinoshita H, Morisaki T, Fukuoka T, Hasegawa T, Sakurai K, Toyokawa T. Bone marrow-derived stromal cells are associated with gastric cancer progression. Br J Cancer. 2015;113:443-452. [PubMed] [DOI] |
| 7. | Sato R, Semba T, Saya H, Arima Y. Concise Review: Stem Cells and Epithelial-Mesenchymal Transition in Cancer: Biological Implications and Therapeutic Targets. Stem Cells. 2016;34:1997-2007. [PubMed] [DOI] |
| 9. | Chen T, Yang K, Yu J, Meng W, Yuan D, Bi F, Liu F, Liu J, Dai B, Chen X. Identification and expansion of cancer stem cells in tumor tissues and peripheral blood derived from gastric adenocarcinoma patients. Cell Res. 2012;22:248-258. [PubMed] [DOI] |
| 10. | Takaishi S, Okumura T, Tu S, Wang SS, Shibata W, Vigneshwaran R, Gordon SA, Shimada Y, Wang TC. Identification of gastric cancer stem cells using the cell surface marker CD44. Stem Cells. 2009;27:1006-1020. [PubMed] [DOI] |
| 11. | Zhang C, Li C, He F, Cai Y, Yang H. Identification of CD44+CD24+ gastric cancer stem cells. J Cancer Res Clin Oncol. 2011;137:1679-1686. [PubMed] [DOI] |
| 12. | Nosrati A, Naghshvar F, Khanari S. Cancer Stem Cell Markers CD44, CD133 in Primary Gastric Adenocarcinoma. Int J Mol Cell Med. 2014;3:279-286. [PubMed] |
| 13. | Nishikawa S, Konno M, Hamabe A, Hasegawa S, Kano Y, Fukusumi T, Satoh T, Takiguchi S, Mori M, Doki Y. Surgically resected human tumors reveal the biological significance of the gastric cancer stem cell markers CD44 and CD26. Oncol Lett. 2015;9:2361-2367. [PubMed] [DOI] |
| 14. | Xu M, Gong A, Yang H, George SK, Jiao Z, Huang H, Jiang X, Zhang Y. Sonic hedgehog-glioma associated oncogene homolog 1 signaling enhances drug resistance in CD44(+)/Musashi-1(+) gastric cancer stem cells. Cancer Lett. 2015;369:124-133. [PubMed] [DOI] |
| 15. | Goldenring JR, Nam KT, Mills JC. The origin of pre-neoplastic metaplasia in the stomach: chief cells emerge from the Mist. Exp Cell Res. 2011;317:2759-2764. [PubMed] [DOI] |
| 16. | Chen XL, Chen XZ, Wang YG, He D, Lu ZH, Liu K, Zhang WH, Wang W, Li CC, Xue L. Clinical significance of putative markers of cancer stem cells in gastric cancer: A retrospective cohort study. Oncotarget. 2016;7:62049-62069. [PubMed] [DOI] |
| 17. | Nguyen PH, Giraud J, Chambonnier L, Dubus P, Wittkop L, Belleannée G, Collet D, Soubeyran I, Evrard S, Rousseau B. Characterization of biomarkers of tumorigenic and chemoresistant cancer stem cells in human gastric carcinoma. Clin Cancer Res. 2016; Sep 12. [Epub ahead of print]. [PubMed] [DOI] |
| 19. | Zhang W, Sui Y, Ni J, Yang T. Insights into the Nanog gene: A propeller for stemness in primitive stem cells. Int J Biol Sci. 2016;12:1372-1381. [PubMed] [DOI] |
| 20. | Artavanis-Tsakonas S, Rand MD, Lake RJ. Notch signaling: cell fate control and signal integration in development. Science. 1999;284:770-776. [PubMed] [DOI] |
| 21. | Borggrefe T, Oswald F. The Notch signaling pathway: transcriptional regulation at Notch target genes. Cell Mol Life Sci. 2009;66:1631-1646. [PubMed] [DOI] |
| 22. | Li LC, Peng Y, Liu YM, Wang LL, Wu XL. Gastric cancer cell growth and epithelial-mesenchymal transition are inhibited by γ-secretase inhibitor DAPT. Oncol Lett. 2014;7:2160-2164. [PubMed] [DOI] |
| 23. | Sun Y, Gao X, Liu J, Kong QY, Wang XW, Chen XY, Wang Q, Cheng YF, Qu XX, Li H. Differential Notch1 and Notch2 expression and frequent activation of Notch signaling in gastric cancers. Arch Pathol Lab Med. 2011;135:451-458. [PubMed] [DOI] |
| 24. | Sekine A, Akiyama Y, Yanagihara K, Yuasa Y. Hath1 up-regulates gastric mucin gene expression in gastric cells. Biochem Biophys Res Commun. 2006;344:1166-1171. [PubMed] [DOI] |
| 25. | Real PJ, Ferrando AA. NOTCH inhibition and glucocorticoid therapy in T-cell acute lymphoblastic leukemia. Leukemia. 2009;23:1374-1377. [PubMed] [DOI] |
| 26. | Ingham PW, McMahon AP. Hedgehog signaling in animal development: paradigms and principles. Genes Dev. 2001;15:3059-3087. [PubMed] [DOI] |
| 27. | Wang B, Fallon JF, Beachy PA. Hedgehog-regulated processing of Gli3 produces an anterior/posterior repressor gradient in the developing vertebrate limb. Cell. 2000;100:423-434. [PubMed] [DOI] |
| 28. | Katoh Y, Katoh M. Hedgehog signaling pathway and gastric cancer. Cancer Biol Ther. 2005;4:1050-1054. [PubMed] [DOI] |
| 29. | Song Z, Yue W, Wei B, Wang N, Li T, Guan L, Shi S, Zeng Q, Pei X, Chen L. Sonic hedgehog pathway is essential for maintenance of cancer stem-like cells in human gastric cancer. PLoS One. 2011;6:e17687. [PubMed] [DOI] |
| 30. | Syu LJ, Zhao X, Zhang Y, Grachtchouk M, Demitrack E, Ermilov A, Wilbert DM, Zheng X, Kaatz A, Greenson JK. Invasive mouse gastric adenocarcinomas arising from Lgr5+ stem cells are dependent on crosstalk between the Hedgehog/GLI2 and mTOR pathways. Oncotarget. 2016;7:10255-10270. [PubMed] [DOI] |
| 32. | Scales SJ, de Sauvage FJ. Mechanisms of Hedgehog pathway activation in cancer and implications for therapy. Trends Pharmacol Sci. 2009;30:303-312. [PubMed] [DOI] |
| 33. | Krausova M, Korinek V. Wnt signaling in adult intestinal stem cells and cancer. Cell Signal. 2014;26:570-579. [PubMed] [DOI] |
| 34. | Mao J, Fan S, Ma W, Fan P, Wang B, Zhang J, Wang H, Tang B, Zhang Q, Yu X. Roles of Wnt/β-catenin signaling in the gastric cancer stem cells proliferation and salinomycin treatment. Cell Death Dis. 2014;5:e1039. [PubMed] [DOI] |
| 35. | Xi HQ, Cai AZ, Wu XS, Cui JX, Shen WS, Bian SB, Wang N, Li JY, Lu CR, Song Z. Leucine-rich repeat-containing G-protein-coupled receptor 5 is associated with invasion, metastasis, and could be a potential therapeutic target in human gastric cancer. Br J Cancer. 2014;110:2011-2020. [PubMed] [DOI] |
| 36. | Yong X, Tang B, Xiao YF, Xie R, Qin Y, Luo G, Hu CJ, Dong H, Yang SM. Helicobacter pylori upregulates Nanog and Oct4 via Wnt/β-catenin signaling pathway to promote cancer stem cell-like properties in human gastric cancer. Cancer Lett. 2016;374:292-303. [PubMed] [DOI] |
| 37. | Katoh M, Katoh M. WNT signaling pathway and stem cell signaling network. Clin Cancer Res. 2007;13:4042-4045. [PubMed] [DOI] |
| 38. | Lu D, Choi MY, Yu J, Castro JE, Kipps TJ, Carson DA. Salinomycin inhibits Wnt signaling and selectively induces apoptosis in chronic lymphocytic leukemia cells. Proc Natl Acad Sci USA. 2011;108:13253-13257. [PubMed] [DOI] |
| 39. | Zhi QM, Chen XH, Ji J, Zhang JN, Li JF, Cai Q, Liu BY, Gu QL, Zhu ZG, Yu YY. Salinomycin can effectively kill ALDH(high) stem-like cells on gastric cancer. Biomed Pharmacother. 2011;65:509-515. [PubMed] [DOI] |
| 40. | Wen Z, Feng S, Wei L, Wang Z, Hong D, Wang Q. Evodiamine, a novel inhibitor of the Wnt pathway, inhibits the self-renewal of gastric cancer stem cells. Int J Mol Med. 2015;36:1657-1663. [PubMed] [DOI] |
| 41. | Edgar BA. From cell structure to transcription: Hippo forges a new path. Cell. 2006;124:267-273. [PubMed] [DOI] |
| 42. | Hong W, Guan KL. The YAP and TAZ transcription co-activators: key downstream effectors of the mammalian Hippo pathway. Semin Cell Dev Biol. 2012;23:785-793. [PubMed] [DOI] |
| 43. | Gregorieff A, Liu Y, Inanlou MR, Khomchuk Y, Wrana JL. Yap-dependent reprogramming of Lgr5(+) stem cells drives intestinal regeneration and cancer. Nature. 2015;526:715-718. [PubMed] [DOI] |
| 44. | Fujimoto D, Ueda Y, Hirono Y, Goi T, Yamaguchi A. PAR1 participates in the ability of multidrug resistance and tumorigenesis by controlling Hippo-YAP pathway. Oncotarget. 2015;6:34788-34799. [PubMed] [DOI] |
| 45. | Steinhardt AA, Gayyed MF, Klein AP, Dong J, Maitra A, Pan D, Montgomery EA, Anders RA. Expression of Yes-associated protein in common solid tumors. Hum Pathol. 2008;39:1582-1589. [PubMed] [DOI] |
| 46. | Liu-Chittenden Y, Huang B, Shim JS, Chen Q, Lee SJ, Anders RA, Liu JO, Pan D. Genetic and pharmacological disruption of the TEAD-YAP complex suppresses the oncogenic activity of YAP. Genes Dev. 2012;26:1300-1305. [PubMed] [DOI] |
| 47. | Bao Y, Nakagawa K, Yang Z, Ikeda M, Withanage K, Ishigami-Yuasa M, Okuno Y, Hata S, Nishina H, Hata Y. A cell-based assay to screen stimulators of the Hippo pathway reveals the inhibitory effect of dobutamine on the YAP-dependent gene transcription. J Biochem. 2011;150:199-208. [PubMed] [DOI] |
| 48. | Jiao S, Wang H, Shi Z, Dong A, Zhang W, Song X, He F, Wang Y, Zhang Z, Wang W. A peptide mimicking VGLL4 function acts as a YAP antagonist therapy against gastric cancer. Cancer Cell. 2014;25:166-180. [PubMed] [DOI] |