修回日期: 2016-11-28
接受日期: 2016-12-05
在线出版日期: 2017-02-08
评价贝伐单抗在晚期结直肠癌患者维持治疗中的有效性和安全性, 并根据现有证据优选出最佳维持治疗方案.
电子检索Cochrane图书馆临床对照试验资料库、MEDLINE(1994/2016-08)、中国生物医学文献数据库(CBM, 1978/2016.08)、中文科技期刊全文数据库(CNKI, 1994/2016-08)根据纳入排除标准进一步筛选文献, 纳入文献均为随机对照试验, 试验组贝伐单抗联用化疗或其他靶向药, 对照组单用化疗加或不加安慰剂, 单用贝伐单抗; 或贝伐单抗联用不同药物之间疗效比较. 按照Cochrane系统评价员手册5.0版推荐的质量评价标准对纳入研究进行质量学评价. 并应用RevMan5.0软件进行统计分析.
共纳入8篇文献, 均为平行随机对照试验, 均未提及实施分配隐藏. 1篇报道采用了盲法. 均报道了脱落失访, 并行意向性分析, 所有文献对生存期及安全性进行比较, 化疗联合贝伐单抗组对比化疗组中位无进展生存期(progression free survival, PFS)、中位总生存期(overall survival, OS)均有延长, PFS(HR = 0.76, 95%CI: 0.64-0.90), OS(HR = 0.82, 95%CI: 0.74-0.89); XELOX方案(卡培他滨、5-氟尿嘧啶、奥沙利铂)联合贝伐单抗化疗6 wk后, 分为XELOX联合贝伐单抗组、卡培他滨联合贝伐单抗组, PFS(HR = 1.68, 95%CI: 1.21-2.35)、OS(HR = 1.38, 95%CI: 0.91-2.08); 应用标准一线化疗方案联合贝伐单抗进展后, 二线化疗方案联合贝伐单抗维持治疗对比化疗维持组更具生存优势, PFS(HR = 0.76, 95%CI: 0.69-0.83)、OS(HR = 0.83, 95%CI: 0.72-0.95). 化疗联合贝伐单抗3-4级不良反应增加(RR = 1.19, 95%CI: 1.11-1.28).
贝伐单抗联合化疗在转移性结直肠癌维持治疗中可以提高患者PFS、OS, 但同时3-4级不良反应增加.
核心提要: 在晚期结直肠癌维持治疗中, 根据目前现有证据, 推荐应用XELOX联合贝伐单抗6 wk后达到稳定以上效果, 以卡培他滨联合贝伐单抗方案作为维持治疗这一治疗模式作为维持治疗优选方案; 在给予一线标准化疗联合贝伐单抗进展后, 二线化疗方案联合贝伐单抗维持治疗可为患者带来生存获益.
引文著录: 马文华, 安永辉, 张勇乾, 郭英, 李娜. 贝伐单抗对转移性结直肠癌维持治疗的系统评价. 世界华人消化杂志 2017; 25(4): 340-350
Revised: November 28, 2016
Accepted: December 5, 2016
Published online: February 8, 2017
to perform a meta-analysis to evaluate the efficacy and safety of bevacizumab in the maintenance treatment of colorectal cancer.
Literature retrieval was conducted by searching Cochrane Controlled Trials Register (CCTR), MEDLINE (1994-August 2016), Chinese Biomedical database (1978-August 2016) and CNKI (1994-August 2016). The quality of included articles was assessed based on the approach commended by the International Cochrane Collaboration. Statistical analysis was performed using RevMan5.0 software.
Eight randomized controlled clinical trials were included, but concealed allocation was not mentioned in all of them. Although loss to follow-up was reported and intention-to-treat analysis was conducted in all the included articles, blinding method was covered only in one paper. Compared with chemotherapy alone, chemotherapy combined with bevacizumab was associated with prolonged progression free survival (PFS; HR = 0.76, 95%CI: 0.64-0.90) and median overall survival (OS; HR = 0.82, 95%CI: 0.74-0.89). After six cycles of XELOX (capecitabine, oxaliplatin, and fluorouracil) + bevacizumab, the patients received maintenance therapy comprising either XELOX + bevacizumab or capecitabine + bevacizumab (PFS: HR = 1.68, 95%CI: 1.21-2.35; OS: HR = 1.38, 95%CI: 0.91-2.08). In patients who had disease progression after first-line chemotherapy combined with bevacizumab, bevacizumab combined with second-line maintenance chemotherapy provided survival advantage (PFS: HR = 0.76, 95%CI: 0.69-0.83; OS: HR = 0.83, 95%CI: 0.72-0.95). chemotherapy plus bevacizumab increased the incidence of grade 3-4 toxicities (RR = 1.19, 95%CI: 1.11-1.28).
Bevacizumab combined with chemotherapy can improve the PFS and OS in the treatment of metastatic colorectal cancer, but increases the incidence of grade 3-4 toxicities.
- Citation: Ma WH, An YH, Zhang YQ, Guo Y, Li N. Bevacizumab maintenance treatment for colorectal cancer: A meta-analysis. Shijie Huaren Xiaohua Zazhi 2017; 25(4): 340-350
- URL: https://www.wjgnet.com/1009-3079/full/v25/i4/340.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i4.340
结直肠癌是最常见的恶性肿瘤之一, 中国结直肠癌发病率上升趋势明显[1]. 居恶性肿瘤发病率及死亡率第2位、第5位[2,3], 我国40岁以下人群发病率和死亡率处于较低水平, 从50岁开始呈现快速增长的趋势[4,5]. 结直肠起病隐匿, 由于结直肠癌的早期症状不明显, 一旦确诊大部分已属中、晚期, 失去手术的机会. 为了提高肿瘤患者的治疗效果提出了维持治疗概念[6], 维持治疗目的是最大限度提高疗效, 减少毒性反应, 即应用化疗药物和/或靶向药物维持治疗, 直至病情进展或不可耐受的毒性. 贝伐单抗属于分子靶向药物, 是一种直接作用于血管内皮生长因子的人源化单克隆抗体[7,8], 多个临床试验结果显示联合贝伐单抗方案可以明显提高有效率, 并延长无进展生存期(progression free survival, PFS)和总生存期(overall survival, OS)[9-13]. 目前贝伐单抗是治疗晚期结直肠癌的一线药物[14,15].
本研究对贝伐单抗在治疗转移性结直肠癌的随机对照试验进行系统评价, 以评估贝伐单抗在维持治疗中的有效性和安全性.
1.1.1 研究对象: 年龄>18岁, 经病理确诊的转移性结直肠癌患者, 有可测量可评估的肿瘤病灶, 预计生存期>3 mo, ECOG评分0-2分.
随机对照试验是指采用随机分配方法, 将符合要求的纳入对象分别分配到实验组和对照组, 然后接受相应的试验措施, 同步的进行研究并观察试验效应, 采用客观的效应指标, 对实验结果进行测量和评价的试验设计.
1.1.2 干预措施: 试验组贝伐单抗联用化疗或其他靶向药, 对照组单用化疗加或不加安慰剂, 单用贝伐单抗, 或贝伐单抗联用不同药物之间疗效比较.
1.1.3 纳入和排除标准: 主要从试验类型, 研究对象特点, 干预采取的措施几个方面进行评价是否符合纳入标准. 排除标准为孕期及哺乳期妇女; 控制不佳高血压及胃肠穿孔病史, 有脑瘤或中枢神经系统转移病情未控者; 肝、肾功能不全及严重心、脑血管疾病的患者.
1.1.4 结局指标: 肿瘤PFS: 自随机之日开始, 随访至肿瘤进展, 或临床进展, 死亡. 从随机之日开始到患者死亡为OS. 不良反应评价: 按照NCI-CTCAE毒性反应分度标准进行评价[16].
1.2.1 检索策略: 电子检索Cochrane图书馆临床对照试验资料库、PubMed(1994/2014-12)中国生物医学文献数据库(CBM, 1978/2014-12)外文数据库检索语种限制为英文.
检索词为: 转移性结直肠癌, 晚期结直肠癌, 转移性结肠癌, 晚期结肠癌, 转移性直肠癌, 晚期直肠癌, 临床试验、贝伐单抗、维持治疗, 将检索词1-6逐个检索合并, 在联合检索词7、8、9进行检索, 英文检索词为: Clinical rials、bevacizumab、metastatic colorectal cancer、maintenance treatment, 对其用"and"合并检索, 并对参考文献进行追溯检索, 并联系罗氏公司索取相关文献.
1.2.2 资料提取: 所有研究人员评价前均接受了正规的方法学培训, 充分理解系统评价的概念、方法学和技术. 由2位研究者独立阅读所获文献题目和摘要, 在排除明显不符合纳入标准的试验后, 对可能符合纳入标准的试验阅读全文, 以确定是否真正符合纳入标准. 而后交叉核对纳入试验的结果, 对有分歧而难以确定其是否纳入的试验通过讨论决定其是否纳入.
资料提取表格内容主要包括: 一般信息, 包括编号、评价员、文献题目、作者、原始文献出处、文种和是否有资助. 患者的一般情况, 包括平均性别、年龄、干预措施, 包括所用药物及方法、药物剂量、干预时间、随访周期. 临床结局指标.
1.2.3 质量评价标准: 根据Cochrane系统评价员手册5.0版推荐的质量评价标准评价对纳入研究进行质量学评价[17,18]. 主要从6个方面进行评价, 随机分配产生、分配隐藏实施、盲法应用、数据完整性、有无选择性报告结果、其他偏倚. 对于每一个条目如果满足是yes, 意味着低度偏倚, 不满足是no, 意味着高度偏倚. 当文献中没有充足的细节详细报告, 或风险未知, 或该条目与研究结果不相关是unclear, 意味着中度风险. 质量评价由2位研究者独立完成并交叉核对如有分歧, 进行讨论或由第3位研究者协助解决.
统计学处理 应用Cochrane系统提供的RevMan5.0进行统计分析, 此软件可对文献同时行质量学评价及数据合并分析, 生存资料(PFS、OS)用HR表示, 计数资料用RR及95%置信区间表示. 在无临床异质的条件下, 当试验之间存在统计学异质性时, 使用随机效应模型, 反之则采用固定效应模型[19]. 异质性检验水准设为P>0.05. 若试验间存在临床异质性, 则资料不做合并分析. 潜在的发表偏倚用漏斗图表示.
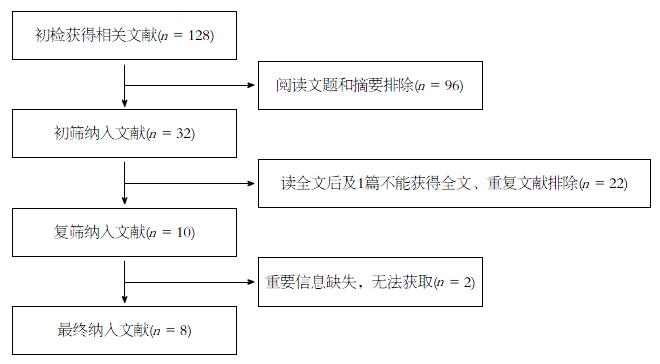
共检索相关文献128篇(中文20篇, 英文108篇)重复文献2篇, 排除非随机对照试验文献, 研究对象、干预措施、结果不符合纳入标准, 最终纳入8篇. 文献筛选流程图(图1)
主要包括纳入病例数、应用方案、肿瘤类型, 年龄、性别、ECOG评分、转移部位的基本情况(表1).
| 纳入研究 | 病例数 | 治疗方案 | 年龄 | 性别 | ECOG评分 | 肿瘤类型 | 转移部位 | |||||||||||
| T/C | T/C | T/C | T | C | T | C | T | C | T | C | ||||||||
| Díaz-Rubio等[27]2012 | 239/241 | XELOX+Bev/XELOX | 63(30-80)/64(33-82) | 男 | 152 | 154 | 0 | 116 | 143 | 结肠癌 | 136 | 160 | 肝脏 | 198 | 193 | |||
| 1 | 116 | 93 | 直肠癌 | 74 | 56 | 局部侵犯 | 39 | 40 | ||||||||||
| 女 | 87 | 87 | 2 | 6 | 4 | 结直肠癌 | 29 | 25 | 肺脏 | 98 | 91 | |||||||
| 无资料 | 1 | 1 | ||||||||||||||||
| Saltz等[26]2008 | 699/701 | FOLFOX4 or XELOX+ | 60(18-86)/64(18-83) | 男 | 418 | 391 | 0 | 405 | 418 | 结肠癌 | 459 | 466 | 局部侵犯 | 39 | 40 | |||
| Bev/FOLFOX4 or XELOX+Pla | 1 | 289 | 218 | 直肠癌 | 180 | 181 | ||||||||||||
| 女 | 281 | 310 | 2 | 1 | 0 | 结直肠癌 | 60 | 55 | 远处转移 | 98 | 91 | |||||||
| Wolff等[20]2012 | 58/59 | LV+5-Fu+Enzastaurin+ | 63(34-82)/65(33-82) | 男 | 21 | 21 | 0 | 42 | 45 | |||||||||
| Bev/LV+5-Fu+Pla+Bev | 1 | 16 | 13 | |||||||||||||||
| 女 | 37 | 38 | 2 | 0 | 1 | |||||||||||||
| Yalcin等[23]2013 | 62/61 | XELOX+Bev/Capecitabine+Bev | 59(25-77)/56(34-82) | 男 | 39 | 38 | 0 | 38 | 34 | 肝脏 | 3 | 4 | ||||||
| 肝脏+其他 | 47 | 42 | ||||||||||||||||
| 男 | 23 | 23 | 1 | 24 | 27 | 其他 | 12 | 15 | ||||||||||
| Johnsson等[21]2013 | 80/79 | Erlotinib+Bev/Bev | 64(48-80)/65(43-82) | 男 | 53 | 43 | 0 | 58 | 53 | 结肠癌 | 44 | 53 | 肝脏 | 62 | 58 | |||
| 直肠癌 | 30 | 19 | 肺脏 | 33 | 37 | |||||||||||||
| 女 | 27 | 36 | 1 | 22 | 26 | 结直肠癌 | 6 | 7 | 其他 | 5 | 9 | |||||||
| Hurwitz等[25]2005 | 402/411 | ILF+Bev/ILF+Pla | 64(48-80)/65(43-82) | 男 | 237 | 247 | 0 | 233 | 226 | 结肠癌 | 310 | 333 | ||||||
| 1 | 165 | 181 | ||||||||||||||||
| 女 | 165 | 164 | 2 | 4 | 4 | 直肠癌 | 92 | 78 | ||||||||||
| Giantonio等[24]2007 | 286/291/243 | FOLFOX4+Bev/FOLFOX4/Bev | 62(21-85)/60.8(25-84) /59.6(23-82) | 男 | 173 | 177 | 144 | 0 | 140 | 149 | 118 | 肝脏 | 210 | 221 | 172 | |||
| 1 | 134 | 125 | 106 | |||||||||||||||
| 女 | 113 | 114 | 99 | 2 | 12 | 17 | 19 | 肺脏 | 159 | 149 | 145 | |||||||
| Bennouna等[22]2013 | 409/411 | Irinotecan-based or | 63(27-84)/63(21-84) | 男 | 267 | 259 | 0 | 179 | 178 | 肝脏 | 300 | 292 | ||||||
| oxaliplatin-based+Bev/Bev | 1 | 209 | 212 | |||||||||||||||
| 女 | 142 | 152 | 2 | 19 | 19 | |||||||||||||
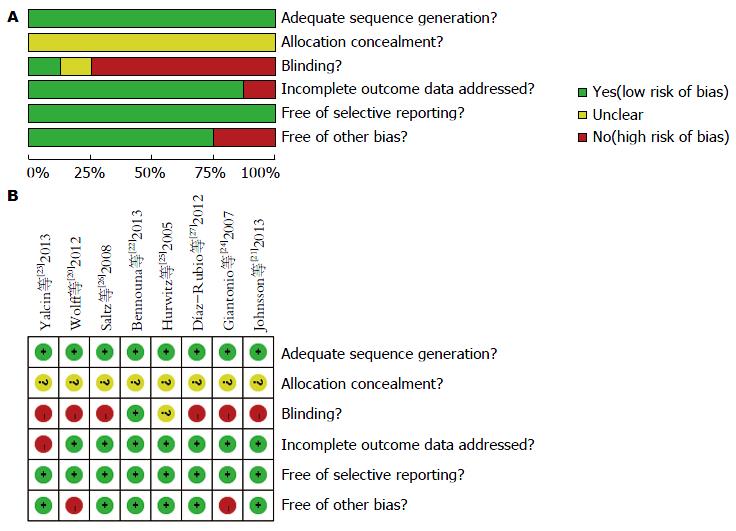
试验干预措施2篇[20-21]为2种靶向药物联合疗效比较. 6篇[22-27]化疗联合贝伐单抗疗效比较. 均为平行随机对照试验, 所有文章均未提及实施分配隐藏. 所有文献只有1篇报道采用了盲法[22]. 所有研究均报道了脱落失访, 并行意向性分析. 所有研究均行区组随机, 保证了组间基线平衡, 均对基线情况进行比较, 组间平衡具有可比性, 所有文献对生存期及安全性进行比较(图2).
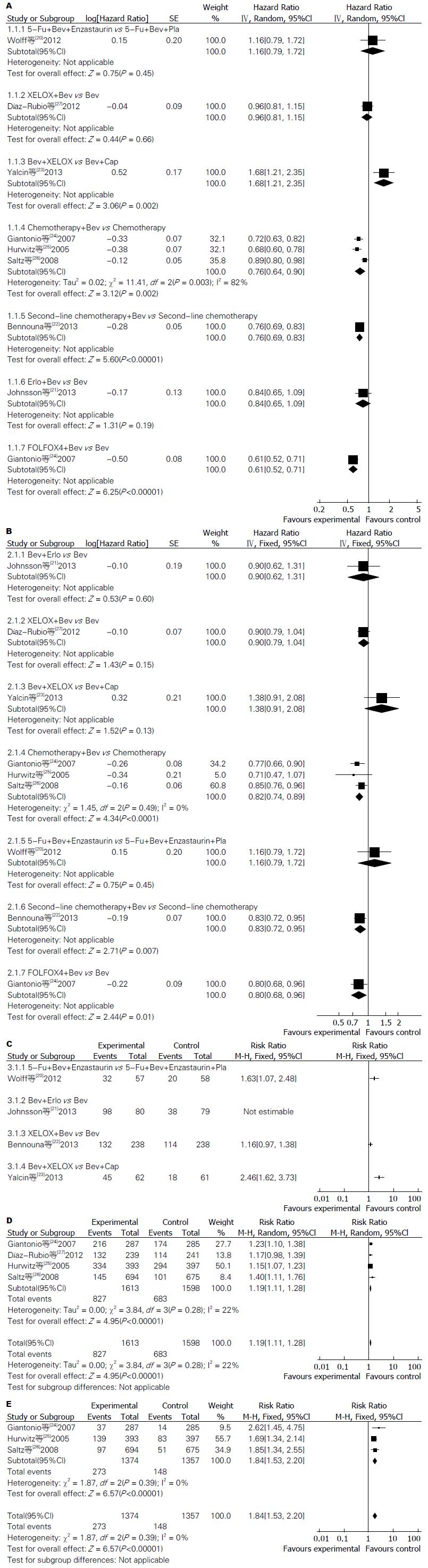
2个研究对靶向药物联合应用做了研究, 其中一个研究[20]在给予诱导化疗达到稳定以上疗效分为氟尿嘧啶(fluorouridine, Fu)联合贝伐单抗、Enzastaurin对Fu、贝伐单抗、安慰剂组, PFS分别为5.8、8.1 mo, 结果示(HR = 1.16, 95%CI: 0.79-1.72), 无统计学意义; 一个研究[21]给予诱导化疗达到稳定以上疗效随机分为贝伐单抗联合厄洛替尼和单用贝伐单抗组, PFS是5.73 mo对4.23 mo(HR = 0.84, 95%CI: 0.65-1.09), 无统计学意义; 一个临床试验[9]在给予一线标准化疗联合贝伐单抗进展后, 如患者中断治疗不超过3 mo, 二线化疗方案联合贝伐单抗维持治疗对比单纯化疗维持治疗组, PFS延长(HR = 0.76, 95%CI: 0.69-0.83), 有统计学意义; 一个研究[23]在给予XELOX方案联合贝伐单抗化疗6 wk后, 分为XELOX联合贝伐单抗组和卡培他滨联合贝伐单抗组, PFS(HR = 1.68, 95%CI: 1.21-2.35), 有统计学意义; 在化疗联合贝伐单抗组对比化疗研究中[24-26], PFS(HR = 0.76, 95%CI: 0.64, 0.90), 有统计学意义; 在2个化疗联合贝伐单抗与贝伐单抗单独应用对比研究中[24-27], 因存在临床异质性, 未合并分析, PFS分别为(HR = 0.61, 95%CI: 0.52-0.71)、(HR = 0.96, 0.81-1.15, 图3A).
一个研究[20]在给予诱导化疗达到稳定以上疗效分为, Fu联合贝伐单抗、Enzastaurin对Fu、贝伐单抗、安慰剂组OS分别为21.5和22.8 mo(HR = 1.16, 95%CI: 0.79-1.72); 另一个研究[21]给予诱导化疗达到稳定以上疗效随机分为贝伐单抗联合厄洛替尼和单用贝伐单抗组, OS是24.7和26.7 mo(HR = 0.90, 95%CI: 0.62-1.31), 均无统计学意义; 一个研究[22]在给予一线标准化疗联合贝伐单抗进展后, 如患者中断治疗不超过3 mo, 二线化疗方案联合贝伐单抗维持治疗对比单纯化疗维持治疗组OS延长(HR = 0.83, 95%CI: 0.72-0.95), 有统计学意义; 一个研究[10]在给予XELOX方案联合贝伐单抗化疗6 wk后, 分为XELOX联合贝伐单抗组和卡培他滨联合贝伐单抗组, OS(HR = 1.38, 95%CI: 0.91-2.08), 无统计学意义; 在化疗联合贝伐单抗组对比化疗组[24-26], PFS(HR = 0.82, 95%CI: 0.74-0.89), 有统计学意义; 在2个化疗联合贝伐单抗与贝伐单抗单独应用对比研究中[24,27], OS分别为(HR = 0.80, 95%CI: 0.67-0.96)、(HR = 0.90, 95%CI: 0.79-1.04, 图3B).
在靶向药物的联合应用3-4毒性反应, 一个研究[20](RR = 1.63, 95%CI: 1.07-2.48), 无统计学意义, Fu联合贝伐单抗、Enzastaurin联合未增加不良反应; 另一个研究[21]中贝伐单抗联合厄洛替尼明显增加毒性反应, 但不良反应病例总数大于样本量故未能行分析(图3C); 在化疗联合贝伐单抗研究中, 一个研究[22]中(RR = 1.16, 95%CI: 0.97-1.38), 无统计学意义; 化疗联合贝伐单抗对比卡培他滨联合贝伐单抗组[23](RR = 2.46, 95%CI: 1.62-3.73), 卡培他滨联合组毒性反应较小. 在化疗联合贝伐单抗与单独化疗比较中[24-27], (RR = 1.9, 95%CI: 1.11-1.28, 图3D), 亚组分析显示在胃肠道出血、穿孔、高血压、血栓方面为(RR = 1.84, 95%CI: 1.53-2.20), 均有统计学意义(图3E).
目前对于晚期结直肠癌患者治疗的最佳时间仍在争论. 一些医生主张维持治疗, 直到不可接受的毒性和/或进展发生时, 另一些医生则在患者治疗达到最佳效果后4-6 mo停止所有或部分药物, 以限制化疗的毒性, 达到最大获益, 这正是这篇文章所要探讨的问题.
靶向药物的联合并未带来PFS的延长, 而贝伐单抗联合厄洛替尼明显增加毒性反应, 在GERCOR DREAM[28]研究同样给予诱导化疗后, 贝伐单抗联合厄洛替尼维持治疗对单用贝伐单抗PFS(HR = 0.73, P = 0.005), 但OS没有延长, 目前试验结果并不推荐靶向药物联合应用.
在3个化疗联合贝伐单抗与单独化疗汇总分析显示, 化疗联用贝伐单抗组无论PFS、OS均优于对照组, 因文献没有对不同化疗方案联合组(以奥沙利铂为基础的化疗方案和以伊立替康为基础的方案)分别比较, 未能得出两者之间的疗效差异, 但通过森林图可以看出, 无论奥沙利铂为基础的化疗方案[11,13]还是伊立替康为基础的化疗[25]方案联合贝伐单抗组都更具生存优势, 显示了贝伐单抗与化疗的联合应用增强了化疗的效果, 展示了贝伐单抗在维持治疗中的优势. 在另一个研究中予6个周期的XELOX方案联合贝伐单抗治疗后, 给予卡培他滨联合贝伐单抗维持治疗优于继续XELOX联合贝伐单抗方案, 而且卡培他滨组毒性反应明显少于XELOX组, 其原因主要为奥沙利铂的累计应用导致的神经毒性限制了其在维持治疗中的长期应用[29,30], 而且口服化疗药物患者的依从性更好, 总之, 根据目前证据, 作者建议应用XELOX联合贝伐单抗6 wk后达到稳定以上效果, 以卡培他滨联合贝伐单抗方案作为维持治疗这一治疗模式作为维持治疗优选方案; 在给予一线标准化疗联合贝伐单抗进展后, 二线化疗方案联合贝伐单抗维持治疗对比单纯化疗维持治疗组PFS、OS均有延长, 提示一线方案进展后可给予二线化疗方案联用贝伐单抗作为维持治疗, 可为患者带来生存获益. 其理论基础是肿瘤细胞对化疗药物和贝伐单抗产生耐药分子通路不同[31], 而且贝伐单抗很少产生耐药, 所以在病情进展后仍可继续应用. 在化疗和贝伐单抗联合组与贝伐单抗单药组比较中, 一个研究[27]PFS、OS 2组间未见差异, 而另一研究[24]显示出联合组的优势, 因2组间存在临床异质性, 故未合并分析, 目前临床上并不推荐贝伐单抗单独应用[24]期望可行进一步临床试验. 在化疗联合贝伐单抗3-4级不良反应明显增加, 主要为高血压、胃肠道穿孔、出血、血栓性疾病, 所以要根据患者情况严格控制适应证, 减少毒性反应的发生, 总之, 证实了贝伐单抗在晚期结直肠癌患者维持治疗中的意义与价值.
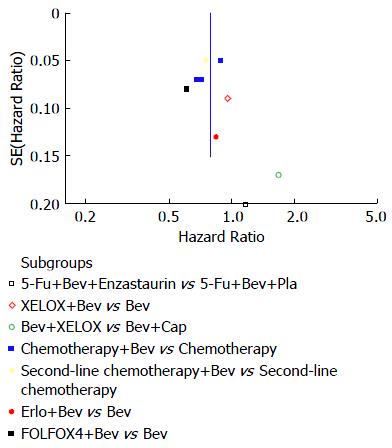
本文局限性在于临床同质性文献较少, 未能证明单独应用贝伐单抗在维持治疗中的作用与意义, 纳入文献均为英文, 漏斗图(图4)示图形非对称分布, 不可避免存在发表偏倚.
结直肠癌是最常见的恶性肿瘤之一, 中、晚期肿瘤失去手术的机会. 为了提高肿瘤患者的治疗效果提出了维持治疗概念, 贝伐单抗是一种直接作用于血管内皮生长因子的人源化单克隆抗体, 本文探讨贝伐单抗在维持治疗中作用与安全性.
维持治疗一直是中晚期肿瘤研究的重点, 目的是最大限度提高疗效, 减少毒性反应, 在本研究中没有来自中国本土研究, 而国人与西方人体质的差异也是影响治疗效果的一个因素, 期待进行相关的临床试验, 为临床应用提供更多高级别循证医学证据.
一些研究表明, 使用贝伐单抗为基础的维持治疗与终止治疗相比增加了TFS, 无进展生存期, 虽然无统计上的差异, 但维持治疗与终止治疗相比仍有倾向维持治疗的趋势. 建议维持治疗是一线诱导治疗后晚期结直肠癌患者的标准方案.
一些研究数据表明, 厄洛替尼联合贝伐单抗可能有临床获益, 但在本文中并未得出此结论, 故仍然建议以化疗药物联合贝伐单抗方案作为维持治疗优选方案.
晚期结直肠癌患者在给予化疗联合贝伐单抗4-6 wk后达到稳定以上效果, 以卡培他滨联合贝伐单抗方案作为维持治疗模式, 并根据患者年龄及身体情况, 适当减少卡培他滨剂量, 减少化疗不良反应, 以期给晚期结直肠癌患者带来生存获益.
卢宁, 副主任医师, 兰州军区乌鲁木齐总医院肿瘤科; 齐晓薇, 副主任医师, 江南大学附属医院(无锡市第四人民医院)病理科; 孙学刚, 教授, 南方医科大学中医药学院; 周建奖, 教授, 贵阳医学院分子生物学重点实验室
本文通过Meta分析, 评价贝伐单抗在晚期结直肠癌患者维持治疗中的有效性和安全性, 并根据现有证据优选出相当好的维持治疗方案. 结果提示贝伐单抗联合化疗在转移性结直肠癌维持治疗中可以提高患者PFS、OS, 但同时3-4级不良反应增加. 内容客观, 分析方法成熟, 观点真实, 具有一定的科学意义.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 河北省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): D
E级 (差): 0
编辑: 马亚娟 电编:胡珊
| 1. | 万 德森. 结直肠癌流行病学与预防. 中国中西医结合外科杂志. 2011;17:3-7. |
| 2. | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015. CA Cancer J Clin. 2015;65:5-29. [PubMed] [DOI] |
| 3. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 6. | Day RS. Treatment sequencing, asymmetry, and uncertainty: protocol strategies for combination chemotherapy. Cancer Res. 1986;46:3876-3885. [PubMed] |
| 7. | Ferrara N, Gerber HP, LeCouter J. The biology of VEGF and its receptors. Nat Med. 2003;9:669-676. [PubMed] [DOI] |
| 8. | Jain RK. Normalizing tumor vasculature with anti-angiogenic therapy: a new paradigm for combination therapy. Nat Med. 2001;7:987-989. [PubMed] [DOI] |
| 9. | Infante JR, Reid TR, Cohn AL, Edenfield WJ, Cescon TP, Hamm JT, Malik IA, Rado TA, McGee PJ, Richards DA. Axitinib and/or bevacizumab with modified FOLFOX-6 as first-line therapy for metastatic colorectal cancer: a randomized phase 2 study. Cancer. 2013;119:2555-2563. [PubMed] [DOI] |
| 10. | Kabbinavar FF, Hambleton J, Mass RD, Hurwitz HI, Bergsland E, Sarkar S. Combined analysis of efficacy: the addition of bevacizumab to fluorouracil/leucovorin improves survival for patients with metastatic colorectal cancer. J Clin Oncol. 2005;23:3706-3712. [PubMed] [DOI] |
| 11. | Garcia-Alfonso P, Chaves M, Muñoz A, Salud A, García-Gonzalez M, Grávalos C, Massuti B, González-Flores E, Queralt B, López-Ladrón A. Capecitabine and irinotecan with bevacizumab 2-weekly for metastatic colorectal cancer: the phase II AVAXIRI study. BMC Cancer. 2015;15:327. [PubMed] [DOI] |
| 12. | Tebbutt NC, Wilson K, Gebski VJ, Cummins MM, Zannino D, van Hazel GA, Robinson B, Broad A, Ganju V, Ackland SP. Capecitabine, bevacizumab, and mitomycin in first-line treatment of metastatic colorectal cancer: results of the Australasian Gastrointestinal Trials Group Randomized Phase III MAX Study. J Clin Oncol. 2010;28:3191-3198. [PubMed] [DOI] |
| 13. | Cunningham D, Lang I, Marcuello E, Lorusso V, Ocvirk J, Shin DB, Jonker D, Osborne S, Andre N, Waterkamp D. Bevacizumab plus capecitabine versus capecitabine alone in elderly patients with previously untreated metastatic colorectal cancer (AVEX): an open-label, randomised phase 3 trial. Lancet Oncol. 2013;14:1077-1085. [PubMed] [DOI] |
| 14. | Hochster HS, Hart LL, Ramanathan RK, Childs BH, Hainsworth JD, Cohn AL, Wong L, Fehrenbacher L, Abubakr Y, Saif MW. Safety and efficacy of oxaliplatin and fluoropyrimidine regimens with or without bevacizumab as first-line treatment of metastatic colorectal cancer: results of the TREE Study. J Clin Oncol. 2008;26:3523-3529. [PubMed] [DOI] |
| 15. | Heinemann V, von Weikersthal LF, Decker T, Kiani A, Vehling-Kaiser U, Al-Batran SE, Heintges T, Lerchenmüller C, Kahl C, Seipelt G. FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab as first-line treatment for patients with metastatic colorectal cancer (FIRE-3): a randomised, open-label, phase 3 trial. Lancet Oncol. 2014;15:1065-1075. [PubMed] [DOI] |
| 16. | Hay JL, Atkinson TM, Reeve BB, Mitchell SA, Mendoza TR, Willis G, Minasian LM, Clauser SB, Denicoff A, O'Mara A. Cognitive interviewing of the US National Cancer Institute's Patient-Reported Outcomes version of the Common Terminology Criteria for Adverse Events (PRO-CTCAE). Qual Life Res. 2014;23:257-269. [PubMed] [DOI] |
| 17. | 马 捷, 刘 莹, 钟 来平, 张 陈平, 张 志愿. Jadad量表与Cochrane偏倚风险图评估工具在随机对照试验质量评价中的应用与比较. 中国口腔颌面外科杂志. 2012;10:417-418. |
| 18. | Delaney A, Bagshaw SM, Ferland A, Manns B, Laupland KB, Doig CJ. A systematic evaluation of the quality of meta-analyses in the critical care literature. Crit Care. 2005;9:R575-R582. [PubMed] [DOI] |
| 19. | Nikolakopoulou A, Mavridis D, Salanti G. How to interpret meta-analysis models: fixed effect and random effects meta-analyses. Evid Based Ment Health. 2014;17:64. [PubMed] [DOI] |
| 20. | Wolff RA, Fuchs M, Di Bartolomeo M, Hossain AM, Stoffregen C, Nicol S, Heinemann V. A double-blind, randomized, placebo-controlled, phase 2 study of maintenance enzastaurin with 5-fluorouracil/leucovorin plus bevacizumab after first-line therapy for metastatic colorectal cancer. Cancer. 2012;118:4132-4138. [PubMed] [DOI] |
| 21. | Johnsson A, Hagman H, Frödin JE, Berglund A, Keldsen N, Fernebro E, Sundberg J, De Pont Christensen R, Garm Spindler KL, Bergström D. A randomized phase III trial on maintenance treatment with bevacizumab alone or in combination with erlotinib after chemotherapy and bevacizumab in metastatic colorectal cancer: the Nordic ACT Trial. Ann Oncol. 2013;24:2335-2341. [PubMed] [DOI] |
| 22. | Bennouna J, Sastre J, Arnold D, Österlund P, Greil R, Van Cutsem E, von Moos R, Viéitez JM, Bouché O, Borg C. Continuation of bevacizumab after first progression in metastatic colorectal cancer (ML18147): a randomised phase 3 trial. Lancet Oncol. 2013;14:29-37. [PubMed] [DOI] |
| 23. | Yalcin S, Uslu R, Dane F, Yilmaz U, Zengin N, Buyukunal E, Buyukberber S, Camci C, Sencan O, Kilickap S. Bevacizumab + capecitabine as maintenance therapy after initial bevacizumab + XELOX treatment in previously untreated patients with metastatic colorectal cancer: phase III 'Stop and Go' study results--a Turkish Oncology Group Trial. Oncology. 2013;85:328-335. [PubMed] [DOI] |
| 24. | Giantonio BJ, Catalano PJ, Meropol NJ, O'Dwyer PJ, Mitchell EP, Alberts SR, Schwartz MA, Benson AB. Bevacizumab in combination with oxaliplatin, fluorouracil, and leucovorin (FOLFOX4) for previously treated metastatic colorectal cancer: results from the Eastern Cooperative Oncology Group Study E3200. J Clin Oncol. 2007;25:1539-1544. [PubMed] [DOI] |
| 25. | Hurwitz H, Fehrenbacher L, Novotny W, Cartwright T, Hainsworth J, Heim W, Berlin J, Baron A, Griffing S, Holmgren E. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med. 2004;350:2335-2342. [PubMed] [DOI] |
| 26. | Saltz LB, Clarke S, Díaz-Rubio E, Scheithauer W, Figer A, Wong R, Koski S, Lichinitser M, Yang TS, Rivera F. Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer: a randomized phase III study. J Clin Oncol. 2008;26:2013-2019. [PubMed] [DOI] |
| 27. | Díaz-Rubio E, Gómez-España A, Massutí B, Sastre J, Abad A, Valladares M, Rivera F, Safont MJ, Martínez de Prado P, Gallén M. First-line XELOX plus bevacizumab followed by XELOX plus bevacizumab or single-agent bevacizumab as maintenance therapy in patients with metastatic colorectal cancer: the phase III MACRO TTD study. Oncologist. 2012;17:15-25. [PubMed] [DOI] |
| 28. | Samson B, Tournigand C, Scheithauer W, Lledo G, Viret F, Andre T. Bevacizumab (Bev) with or without erlotinib as maintenance therapy, following induction first-line chemotherapy plus Bev, in patients (pts) with metastatic colorectal cancer (mCRC): Efficacy and safety results of the International GERCOR DREAM Phase III trial. J Clin Oncol. 2012;30:Suppl: Abstract LBA3500. |
| 29. | Velasco R, Bruna J. Oxaliplatin Neurotoxicity. Curr Colorectal Cancer Rep. 2014;10:303-312. [DOI] |
| 30. | Tournigand C, Cervantes A, Figer A, Lledo G, Flesch M, Buyse M, Mineur L, Carola E, Etienne PL, Rivera F. OPTIMOX1: a randomized study of FOLFOX4 or FOLFOX7 with oxaliplatin in a stop-and-Go fashion in advanced colorectal cancer--a GERCOR study. J Clin Oncol. 2006;24:394-400. [PubMed] [DOI] |
| 31. | Giantonio BJ. Targeted therapies: Goldie-Coldman and bevacizumab beyond disease progression. Nat Rev Clin Oncol. 2009;6:311-312. [PubMed] [DOI] |