修回日期: 2016-11-27
接受日期: 2016-12-05
在线出版日期: 2017-02-08
研究二甲双胍对人胰腺癌细胞系BxPC-3、AsPC-1的侵袭和转移相关基因S100A4和基质金属蛋白酶(matrix metalloproteinase, MMP)-9 mRNA表达的影响.
体外培养胰腺癌BxPC-3、AsPC-1细胞, 用不同浓度二甲双胍与细胞培养液孵育后, 利用四甲基偶氮唑盐法测定细胞活性, 计算IC50值后, 应用IC50浓度二甲双胍作用于胰腺癌细胞48 h, 应用RT-PCR测定S100A4和MMP-9 mRNA表达的变化.
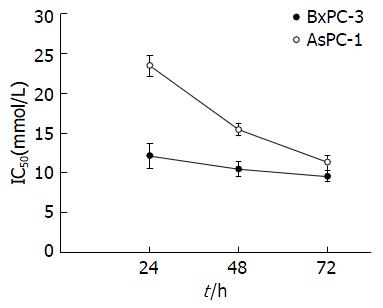
二甲双胍对2种细胞生长呈时间和剂量依赖性抑制; 二甲双胍处理后2种细胞在24、48、72 h的IC50值: BxPC-3细胞分别为12.13、10.43、9.55 mmol/L; AsPC-1的细胞分别为23.45、15.44、11.30 mmol/L. IC50浓度的二甲双胍作用48 h, BxPC-3、AsPC-1细胞S100A4和MMP-9 mRNA均较对照组明显下降(P<0.01).
二甲双胍可抑制胰腺癌细胞生长呈时间和剂量依赖性, 二甲双胍可能通过抑制转移相关基因S100A4和MMP-9的表达来抑制胰腺癌的侵袭和转移.
核心提要: 本研究探讨二甲双胍抑制胰腺癌细胞的侵袭和转移是否通过抑制转移相关基因S100A4和MMP-9来实现.
引文著录: 王璇, 张玉彪, 刘江伟, 李鹏. 二甲双胍对胰腺癌细胞转移相关基因S100A4和MMP-9 mRNA表达的影响. 世界华人消化杂志 2017; 25(4): 334-339
Revised: November 27, 2016
Accepted: December 5, 2016
Published online: February 8, 2017
To investigate the expression of metastasis related genes S100A4 and matrix metalloproteinase (MMP)-9 in pancreatic cancer cell lines BxPC-3 and AsPC-1 treated with metformin.
Cells were incubated with metformin at different concentrations for 24, 48, or 72 h. Then, cell viability was measured by MTT assay, and IC50 values were calculated. The two cell lines were then treated with metformin at IC50 concentrations for 48 h, and RT-PCR was used to detect the expression of S100A4 and MMP-9 mRNAs.
Cell viability was apparently inhibited by metformin in both cell lines, and the inhibitory effect showed a time- and dose-dependent manner. The IC50 values for BxPC-3 cells at 24, 48, and 72 h were 12.13 mmol/L, 10.43 mmol/L, and 9.55 mmol/L, respectively, and the corresponding values for AsPC-1 cells were 23.45 mmol/L, 15.44 mmol/L, and 11.30 mmol/L. After treatment with metformin for 48 h, the expression of S100A4 and MMP-9 mRNAs in the two cell lines was significantly decreased compared with control cells (P < 0.01).
Metformin inhibits pancreatic cancer cell growth in a time- and dose-dependent manner. Metformin may exert anti-metastasis effects by decreasing the expression of S100A4 and MMP-9 in pancreatic cancer cell lines.
- Citation: Wang X, Zhang YB, Liu JW, Li P. Expression of metastasis related genes S100A4 and MMP-9 in pancreatic cancer cells treated with metformin. Shijie Huaren Xiaohua Zazhi 2017; 25(4): 334-339
- URL: https://www.wjgnet.com/1009-3079/full/v25/i4/334.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i4.334
胰腺癌是极具侵袭潜能的恶性肿瘤, 早期可发生淋巴转移和远处转移, 即使早期行根治性切除其5年生存率仅24%, 不能行根治性切除的胰腺癌5年生存率低于2%. 胰腺癌患者中位生存时间<6 mo, 在西方国家, 肿瘤引起的死亡中, 胰腺癌继肺癌、大肠癌、乳腺癌之后居第4位[1-3], 胰腺癌预后较差的主要原因除了胰腺癌固有的对放疗、化疗的不敏感性, 还可能与其易侵袭、转移的自然特性有关, 因此如何抑制胰腺癌侵袭和转移可能是提高胰腺癌治疗效果的重要战略.
二甲双胍为一种胰岛素增敏剂被广泛用于Ⅱ型糖尿病的一线治疗, 近年来发现二甲双胍可明显降低乳腺癌, 前列腺癌, 胰腺癌, 肝细胞癌等的发生率, 并与抑制肿瘤的增殖、侵袭、转移和促进肿瘤细胞凋亡关系密切[3-7]. S100A4是S100家族的成员, 因其主要参与肿瘤的侵袭和转移为特征, 故又名转移素[8,9], S100A4在乳腺癌, 尤其是消化系肿瘤包括结肠癌、胃癌、食管癌和胰腺癌中高表达, 其高表达与肿瘤的转移和预后不良密切相关[10-15]. 基质金属蛋白酶家族(matrix metalloproteinases, MMPs)与肿瘤的生长密切相关并被认为是肿瘤侵袭、转移和血管生成的重要候选基因[16], 其家族成员MMP-9是一个与肿瘤侵袭、转移和在血管生成过程中降解细胞外基质和基底膜的重要蛋白酶[17], 胰腺癌中淋巴结转移以局部高表达的MMP-9为特征[16].
二甲双胍抑制肿瘤的增殖、侵袭和转移是近年研究的热点, 但其在抑制胰腺癌侵袭转移的机制尚未完全阐明, 本研究探讨其侵袭和转移是否通过抑制转移相关基因S100A4和MMP-9来实现.
人胰腺癌细胞株BxPC-3、AsPC-1由新疆军区总医院动物实验科保存. 二甲双胍购自Sigma公司; 胎牛血清和高糖DMEM培养基购自Gibco公司; 二甲基亚砜(dimethyl sulfoxide, DMSO)和四甲基偶氮唑盐(methyl thiazolyl tetrazolium, MTT)购自Amersco; TRIzol及琼脂糖购自Invitrogen; RT-PCR试剂盒、Marker购自TaKaRa; β-actin、S100A4和MMP-9引物由上海生工合成; 所用仪器包括酶标仪、C1000核酸扩增仪、电泳槽为Bio-Rad公司产品.
1.2.1 细胞系和细胞培养: BxPC-3、AsPC-1在37 ℃、50 mL/L CO2、95%湿度培养箱中培养. 培养液为含10%胎牛血清和双抗(100 U/ml链霉素和100 U/ml青霉素)的DMEM高糖培养基. 当细胞融合90%时, 用0.25%胰酶消化传代, 取对数生长期的细胞进行实验.
1.2.2 二甲双胍药液配置: 二甲双胍用高糖DMEM稀释为5、10、15、20、30 mmol/L不同浓度, 针式过滤后, 4 ℃保存.
1.2.3 MTT法检测药物对细胞抑制率: 消化收集对数生长期的BxPC-3、AsPC-1细胞进行计数, 调整细胞浓度2.5×104个/mL接种于96孔板中(5×103/孔). 贴壁24 h后, 分别加入含有不同浓度(5、10、15、20、30 mmol/L)二甲双胍孵育24、48、72 h, 分别加入MTT, 37 ℃孵育4 h, 弃去液体, 加入DMSO 150 μL, 震荡混匀, 在酶标仪490 nm波长处检测各孔吸光度(A)值, 抑制率 = (1-A实验组/A对照组)×100%, 同样实验重复3次, 取50%抑制率的药物浓度进行干预实验.
1.2.4 RT-PCR法检测S100A4、MMP-9的mRNA表达: 细胞接种于6孔板中, 贴壁后分别用二甲双胍IC50浓度孵育48 h. 收获细胞1×106, TRIzol法提取RNA后反转录为cDNA, 反转录体系为: 5×PrimeScript Buffer 5 μL, PrimeScript Enzyme MixⅠ 1.25 μL, Oligo dT primer 1.25 μL, Random 6 mers 5 μL, RNA 500/检测浓度, dd H2O(免酶)补齐至25 μL. PCR反应体系: TaKaRa Ex Taq 0.125 μL, 10×Ex Taq Buffer 2.5 μL, Mgcl2 0.5, d NTP MIX, 2 μL, cDNA 1 μL, Primer forward 1 μL, Primer reverse 1 Primer reverse, 加H2O补齐至25 μL. S100A4引物(上游: 5'-ATCCCGTGCCCTCTGGAGAA-3'; 下游: 5'-TCATTTCTTCCTGGGCTGCT-3'), MMP-9引物(上游5'-CAACATCACCTATTGGATCC-3'; 下游: 5'-CTGTAGAGTCTCTCGCT-3'); β-actin为内参(上游: 5'-GGACTTCGAGCAGGAGATGG-3'; 下游: 5'-GCACCGTGTTGGCGTAGAGG-3'). PCR产物扩增条件为: 94 ℃, 5 min; 94 ℃ 30 s; 60.5 ℃, 30 s; 72 ℃ 1 min, 35个循环, 72 ℃, 5 min, S100A4扩增产物320 bp; MMP-9扩增产物400 bp, β-actin产物233 bp. 电泳后凝胶成像仪紫外成像, Quantity One软件行灰度扫描.
统计学处理 数据采用SPSS23.0软件分析. 计量资料以mean±SD表示, 多个样本比较采用单因素方差分析, 两样本均数采用t检验, 以P<0.05为差异有统计学意义.
随着药物浓度升高和时间延长, 2种细胞活性均明显下降, 二甲双胍干预24、48、72 h的IC50值: BxPC-3细胞系分别为12.13 mmol/L±1.56 mmol/L、10.43 mmol/L±1.02 mmol/L、9.55 mmol/L±0.67 mmol/L; AsPC-1的细胞系分别为分别为23.45 mmol/L±1.35 mmol/L、15.44 mmol/L±0.76 mmol/L、11.30 mmol/L±0.94 mmol/L(图1).
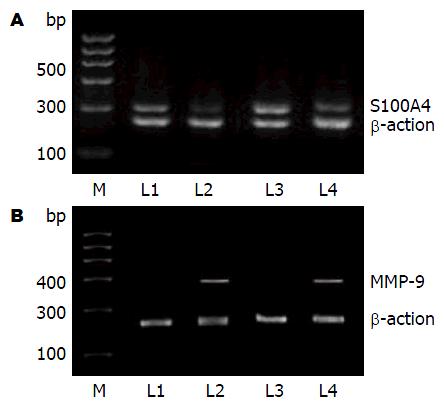
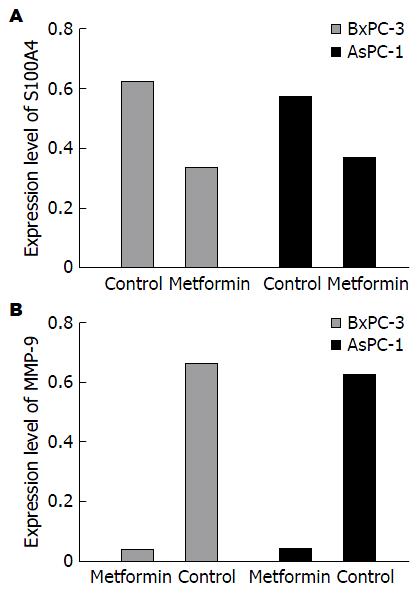
mRNA表达变化 分别用接近IC50浓度的二甲双胍浓度10 mmol/L和15 mmol/L作用于BxPC-3、AsPC-1细胞, S100A4 mRNA和MMP-9 mRNA的表达均较对照组明显下降(图2), S100A4 mRNA相对灰度值: BxPC-3细胞的对照组0.683±0.025, 二甲双胍组0.362±0.054(P<0.01); AsPC-1细胞的对照组0.621±0.021, 二甲双胍组0.397±0.049(P<0.01). MMP-9 mRNA相对灰度值: BxPC-3细胞的二甲双胍组0.038±0.017, 对照组0.673±0.029(P<0.01); AsPC-1细胞的二甲双胍组0.041±0.025, 对照组0.636±0.031(P<0.01, 图3).
二甲双胍是治疗二型糖尿的一线药物, 近年来发现其具有明显的抗肿瘤作用, 从而成为研究的热点[18]. 先前研究[19]表明二甲双胍对包括胰腺癌在内的多种肿瘤发挥作用, 一些应用裸鼠的体内体外实验[20-22]表明, 二甲双胍通过抑制肿瘤细胞增殖、迁徙、浸润和促进肿瘤细胞凋亡来抑制肿瘤生长. 高侵袭、易复发和转移是胰腺癌的重要特征之一, 如何抑制肿瘤的生长、减少其侵袭和转移可能是肿瘤治疗的重要方向, 最新研究表明二甲双胍能够减少乳腺癌术后转移例数[23]、减少分化型甲状腺癌颈部淋巴结的转移复发率[24]、减少前列腺癌复发风险[25], 能够阻止非小细胞肺癌由细胞转化生长因子-β诱导的上皮向间质细胞转化, 从而抑制肿瘤的转移[26], 二甲双胍还以可通过上调E-钙黏蛋白来抑制黑色素瘤B16F10细胞的运动、迁徙和侵袭[27].
我们选择BxPC-3和AsPC-1细胞用于本研究, BxPC-3来源于人胰体部腺癌, 是一种中-低分化腺癌, 可在肿瘤周围出现淋巴细胞浸润[28]; AsPC-1细胞来源于胰头腺癌患者的腹水, 分化程度为高-低分化腺癌, 可出现局部淋巴细胞浸润[29]. 本研究发现, 二甲双胍可明显降低胰腺癌BxPC-3、AsPC-1细胞S100A4和MMP-9 mRNA的表达, 由此可以推测二甲双胍可以通过抑制转移相关基因S100A4和MMP-9来发挥抑制肿瘤侵袭和转移.
S100A4蛋白与S100家族的共同特点在于其结构上具有EF双螺旋结构的氨基酸序列(手型钙离子结合区), 当此区与钙离子结合后其构象就发生变化, 暴露出其结合位点, 进而通过与相应靶蛋白的结合发挥其特定的生物学效应, 在细胞的运动、侵袭、细胞分裂、存活中发挥重要作用. S100A4被公认为肿瘤转移的标志物, S100A4过表达与乳腺癌、胰腺癌、肺癌、膀胱癌、胃癌的高侵袭性和预后不良有关[30]. MMPs属于锌和钙依赖性肽链内切酶家族, 其主要功能是降解细胞外基质, 尤其是MMP-9被确认为肿瘤细胞转移的重要分子, 在人类前列腺癌细胞系研究中发现, 当S100A4因RNA干涉表达降低后, MMP-9的表达随之降低[31], 研究表明, 人S100A4高表达可以提高MMP-9活性并使其分泌增加, 因而认为MMPs的活性与S100A4的迁移性密切相关. 其他学者应用骨肉瘤细胞系和软骨细胞研究发现S100A4和MMPs活性相关, 因此S100A4能够参与控制内皮细胞基底膜降解并且破坏细胞外基质以促进肿瘤细胞的侵袭[32], 另外, 有研究[9]表明S100A4能够降低MMPs的抑制剂E-钙黏蛋白来促使细胞的侵袭和转移.
总之, 根据所查国内外文献报道, 我们首次发现了二甲双胍可以抑制胰腺癌细胞S100A4及MMP 9 mRNA表达, 推测二甲双胍可能通过S100A4/MMP-9途径发挥抗肿瘤侵袭和转移, 为二甲双胍抗肿瘤研究和临床应用提供新思路及实验基础.
胰腺癌是极具侵袭潜能的恶性肿瘤, 早期可发生淋巴转移和远处转移, 胰腺癌已成为全球第4大死因, 由于诊断困难、预后差、发生率高成为了一个世界性的健康问题. 二甲双胍是治疗二型糖尿的一线药物, 近年来发现其具有明显的抗肿瘤作用, 从而成为研究的热点.
二甲双胍抑制肿瘤的增殖、侵袭和转移是近年研究的热点, 但其在抑制胰腺癌侵袭转移的机制尚未完全阐明.
Donadon等研究发现, 二甲双胍可明显降低乳腺癌、前列腺癌、胰腺癌、肝细胞癌等的发生率, 并与抑制肿瘤的增殖、侵袭、转移和促进肿瘤细胞凋亡关系密切.
本研究首次发现二甲双胍可明显降低胰腺癌细胞转移相关基因S100A4和MMP-9表达.
本文研究提示二甲双胍可能通过S100A4和基质金属蛋白酶(matrix metalloproteinase, MMP)-9通路发挥抗侵袭和转移机制, 为二甲双胍抗肿瘤研究和临床应用提供新思路及实验基础.
肿瘤转移基因: 指某基因改变和表达能够促进或导致肿瘤转移的基因. 主要指一些编码细胞表面受体的基因, 他们的突变或失活会导致细胞黏附能力的下降, 促使肿瘤的发生和转移.
杜奕奇, 教授, 中国人民解放军第二军医大学长海医院; 王雅棣, 教授, 主任医师, 北京军区总医院放疗科
本文研究了二甲双胍对胰腺癌细胞转移相关基因S100A4和MMP-9 mRNA表达的影响, 结果表明二甲双胍可抑制胰腺癌细胞生长呈时间和剂量依赖性, 在研究设计上有一定创新性.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 新疆维吾尔自治区
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 马亚娟 电编:胡珊
| 1. | Jemal A, Siegel R, Xu J, Ward E. Cancer statistics, 2010. CA Cancer J Clin. 2010;60:277-300. [PubMed] [DOI] |
| 2. | Hidalgo M. Pancreatic cancer. N Engl J Med. 2010;362:1605-1617. [PubMed] [DOI] |
| 3. | Ambe CM, Mahipal A, Fulp J, Chen L, Malafa MP. Effect of Metformin Use on Survival in Resectable Pancreatic Cancer: A Single-Institution Experience and Review of the Literature. PLoS One. 2016;11:e0151632. [PubMed] [DOI] |
| 4. | Bodmer M, Meier C, Krähenbühl S, Jick SS, Meier CR. Long-term metformin use is associated with decreased risk of breast cancer. Diabetes Care. 2010;33:1304-1308. [PubMed] [DOI] |
| 5. | Donadon V, Balbi M, Ghersetti M, Grazioli S, Perciaccante A, Della Valentina G, Gardenal R, Dal Mas M, Casarin P, Zanette G. Antidiabetic therapy and increased risk of hepatocellular carcinoma in chronic liver disease. World J Gastroenterol. 2009;15:2506-2511. [PubMed] [DOI] |
| 6. | McAuliffe JC, Christein JD. Type 2 diabetes mellitus and pancreatic cancer. Surg Clin North Am. 2013;93:619-627. [PubMed] [DOI] |
| 7. | Wright JL, Stanford JL. Metformin use and prostate cancer in Caucasian men: results from a population-based case-control study. Cancer Causes Control. 2009;20:1617-1622. [PubMed] [DOI] |
| 8. | Salama I, Malone PS, Mihaimeed F, Jones JL. A review of the S100 proteins in cancer. Eur J Surg Oncol. 2008;34:357-364. [PubMed] [DOI] |
| 9. | Huang S, Zheng J, Huang Y, Song L, Yin Y, Ou D, He S, Chen X, Ouyang X. Impact of S100A4 Expression on Clinicopathological Characteristics and Prognosis in Pancreatic Cancer: A Meta-Analysis. Dis Markers. 2016;2016:1-9. [PubMed] [DOI] |
| 10. | Liu Y, Tang W, Wang J, Xie L, Li T, He Y, Qin X, Li S. Clinicopathological and prognostic significance of S100A4 overexpression in colorectal cancer: a meta-analysis. Diagn Pathol. 2013;8:181. [PubMed] [DOI] |
| 11. | Lee SJ, Choi SY, Kim WJ, Ji M, Lee TG, Son BR, Yoon SM, Sung R, Lee EJ, Youn SJ. Combined aberrant expression of E-cadherin and S100A4, but not β-catenin is associated with disease-free survival and overall survival in colorectal cancer patients. Diagn Pathol. 2013;8:99. [PubMed] [DOI] |
| 12. | Xuan X, Li Q, Zhang Z, Du Y, Liu P. Increased expression levels of S100A4 associated with hypoxia-induced invasion and metastasis in esophageal squamous cell cancer. Tumour Biol. 2014;35:12535-12543. [PubMed] [DOI] |
| 13. | Chai J, Jamal MM. S100A4 in esophageal cancer: is this the one to blame? World J Gastroenterol. 2012;18:3931-3935. [PubMed] [DOI] |
| 14. | Zhai X, Zhu H, Wang W, Zhang S, Zhang Y, Mao G. Abnormal expression of EMT-related proteins, S100A4, vimentin and E-cadherin, is correlated with clinicopathological features and prognosis in HCC. Med Oncol. 2014;31:970. [PubMed] [DOI] |
| 15. | Ji YF, Huang H, Jiang F, Ni RZ, Xiao MB. S100 family signaling network and related proteins in pancreatic cancer (Review). Int J Mol Med. 2014;33:769-776. [PubMed] [DOI] |
| 16. | Xu Y, Li Z, Jiang P, Wu G, Chen K, Zhang X, Li X. The co-expression of MMP-9 and Tenascin-C is significantly associated with the progression and prognosis of pancreatic cancer. Diagn Pathol. 2015;10:211. [PubMed] [DOI] |
| 17. | Yang N, Cui H, Han F, Zhang L, Huang T, Zhou Y, Zhou J. Paeoniflorin inhibits human pancreatic cancer cell apoptosis via suppression of MMP-9 and ERK signaling. Oncol Lett. 2016;12:1471-1476. [PubMed] [DOI] |
| 18. | He H, Ke R, Lin H, Ying Y, Liu D, Luo Z. Metformin, an old drug, brings a new era to cancer therapy. Cancer J. 2015;21:70-74. [PubMed] [DOI] |
| 19. | Morales DR, Morris AD. Metformin in cancer treatment and prevention. Annu Rev Med. 2015;66:17-29. [PubMed] [DOI] |
| 20. | Kisfalvi K, Moro A, Sinnett-Smith J, Eibl G, Rozengurt E. Metformin inhibits the growth of human pancreatic cancer xenografts. Pancreas. 2013;42:781-785. [PubMed] [DOI] |
| 21. | Bao B, Wang Z, Ali S, Ahmad A, Azmi AS, Sarkar SH, Banerjee S, Kong D, Li Y, Thakur S. Metformin inhibits cell proliferation, migration and invasion by attenuating CSC function mediated by deregulating miRNAs in pancreatic cancer cells. Cancer Prev Res (Phila). 2012;5:355-364. [PubMed] [DOI] |
| 22. | Wang LW, Li ZS, Zou DW, Jin ZD, Gao J, Xu GM. Metformin induces apoptosis of pancreatic cancer cells. World J Gastroenterol. 2008;14:7192-7198. [PubMed] [DOI] |
| 23. | El-Haggar SM, El-Shitany NA, Mostafa MF, El-Bassiouny NA. Metformin may protect nondiabetic breast cancer women from metastasis. Clin Exp Metastasis. 2016;33:339-357. [PubMed] [DOI] |
| 24. | Jang EK, Kim WG, Kwon H, Choi YM, Jeon MJ, Kim TY, Shong YK, Kim WB, Kim EY. Metformin Is Associated with a Favorable Outcome in Diabetic Patients with Cervical Lymph Node Metastasis of Differentiated Thyroid Cancer. Eur Thyroid J. 2015;4:181-188. [PubMed] [DOI] |
| 25. | Raval AD, Thakker D, Vyas A, Salkini M, Madhavan S, Sambamoorthi U. Impact of metformin on clinical outcomes among men with prostate cancer: a systematic review and meta-analysis. Prostate Cancer Prostatic Dis. 2015;18:110-121. [PubMed] [DOI] |
| 26. | Koeck S, Amann A, Huber JM, Gamerith G, Hilbe W, Zwierzina H. The impact of metformin and salinomycin on transforming growth factor β-induced epithelial-to-mesenchymal transition in non-small cell lung cancer cell lines. Oncol Lett. 2016;11:2946-2952. [PubMed] [DOI] |
| 27. | Liang G, Ding M, Lu H, Cao NA, Niu Y, Gao Y, Lu J. Metformin upregulates E-cadherin and inhibits B16F10 cell motility, invasion and migration. Oncol Lett. 2015;10:1527-1532. [PubMed] [DOI] |
| 28. | Jendrzejewski J, Thomas A, Liyanarachchi S, Eiterman A, Tomsic J, He H, Radomska HS, Li W, Nagy R, Sworczak K. PTCSC3 Is Involved in Papillary Thyroid Carcinoma Development by Modulating S100A4 Gene Expression. J Clin Endocrinol Metab. 2015;100:E1370-E1377. [PubMed] [DOI] |
| 29. | Tan MH, Nowak NJ, Loor R, Ochi H, Sandberg AA, Lopez C, Pickren JW, Berjian R, Douglass HO, Chu TM. Characterization of a new primary human pancreatic tumor line. Cancer Invest. 1986;4:15-23. [PubMed] [DOI] |
| 30. | Chen WH, Horoszewicz JS, Leong SS, Shimano T, Penetrante R, Sanders WH, Berjian R, Douglass HO, Martin EW, Chu TM. Human pancreatic adenocarcinoma: in vitro and in vivo morphology of a new tumor line established from ascites. In Vitro. 1982;18:24-34. [PubMed] [DOI] |