修回日期: 2016-07-25
接受日期: 2016-07-31
在线出版日期: 2017-01-28
潘氏细胞(Paneth cells, PCs)及其抗微生物肽(antimicrobial peptides, AMPs)与肠道微生物的生态学失衡、肠道炎症、全身感染等病理状况的发生密切相关. 肠黏膜屏障与固有免疫功能的损害, 常伴随着机体α-防御素等AMPs水平及其他炎症介质水平的改变. 研究发现: PCs能在胆碱能兴奋剂、微生物及其抗原成分、肠内营养状态、遗传易感因素等因素的作用下, 改变其本身的功能状态及效应分子的释放, 诱发炎症性肠病、细菌移位、肠内细菌过度生长、自身免疫耐受损害等疾病及相关改变, 对PCs的研究给临床治疗提供了新的靶点和策略. 本文对近十年来人们对PCs、AMPs和肠道黏膜屏障及固有免疫之间关系的研究进展作一述评.
核心提要: 抗微生物肽在机体与微生物的相互作用中, 能充当重要的调节因子, 维持与共生微生物之间的内环境稳态, 以及介导针对肠道病原微生物的免疫保护作用.
引文著录: 龙振昼, 聂青和. 潘氏细胞及其抗微生物肽与肠道黏膜免疫. 世界华人消化杂志 2017; 25(3): 209-219
Revised: July 25, 2016
Accepted: July 31, 2016
Published online: January 28, 2017
Paneth cells (PCs) and their antimicrobial peptides (AMPs) are closely related to the ecological unbalance of gut microbiota, intestinal inflammation, and systemic infections. The dysfunction of intestinal mucosal barrier and innate immunity is always accompanied with changes in the levels of AMPs, for example, alpha-defensins and other inflammatory mediators produced by PCs. Studies show that PCs can alter their functional status and release effector molecules under some conditions such as cholinergic agonists, microorganisms and their antigens, enteral nutrition, and genetic susceptibility. Therefore, these conditions can induce inflammatory bowel disease, bacterial translocation, overgrowth of gut microbe, and damage to immune tolerance. The research on PCs can provide new targets and strategies for clinical treatment of the relevant diseases. In this paper, we discuss the relationship of PCs and their AMPs with intestinal mucosal barrier and innate immunity.
- Citation: Long ZZ, Nie QH. Paneth cells, antimicrobial peptides, and intestinal mucosal immunity. Shijie Huaren Xiaohua Zazhi 2017; 25(3): 209-219
- URL: https://www.wjgnet.com/1009-3079/full/v25/i3/209.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i3.209
潘氏细胞(Paneth cells, PCs)是一类特殊的上皮细胞, 位于小肠隐窝的基底部, 其胞浆靠近细胞顶部有大量密集分布的颗粒, 所含的小分子物质参与机体多种功能的调控. PCs分泌颗粒内具有抗微生物作用的多肽和蛋白质, 称为抗微生物肽(antimicrobial peptides, AMPs). 最近几年的研究发现, AMPs在机体与微生物的相互作用中, 能充当重要的调节因子, 维持与共生微生物之间的内环境稳态, 以及介导针对肠道病原微生物的免疫保护作用. 此外, PCs所分泌的分子, 还能维护肠上皮屏障完整性和参与邻近肠上皮干细胞和祖细胞的分化与更新. PCs的功能失调, 可能导致慢性炎症性肠病(inflammatory bowel disease, IBD)、全身性感染的发生, 以及肠黏膜屏障功能的改变, 从而影响多种相关疾病的病情发展及预后. 基于此, 本文就PCs及其AMPs和相关分子在维护宿主-微生物相互关系中的作用, 以及二者在肠道黏膜固有免疫中的作用及机制等研究进展作一述评.
PCs的发现至今已有一个多世纪. 早在1872年及1888年, Bevins等[1]和Wehkamp等[2]在他们的研究中曾描述: PCs是小肠黏膜上的柱状上皮细胞, 细胞胞浆内充满明显的颗粒. 然而, 直到最近40年, 由于认识到PCs颗粒内含有一些具有生物效应的分子, 他们可能参与或介导了小肠黏膜免疫, 学者们对PCs的研究才逐渐增多起来. 近年来, 更多的研究确定了PCs分泌的这些具有抗微生物作用的物质, 属于AMPs大家族, 他们是宿主-微生物相互作用的关键介质, 参与了包括肠道定植微生物群的内环境稳态、抵御肠道病原侵袭的保护性固有免疫、维持和调节与PCs处于同一个生态位的肠上皮干细胞和祖细胞的分化及小肠上皮更新的等生理和病理过程.
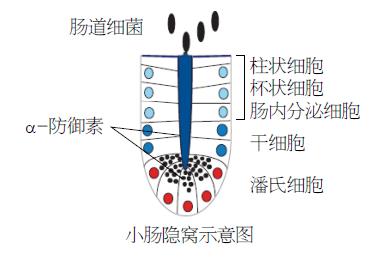
小肠上皮由6种主要的细胞类型组成: PCs、杯状细胞、丛细胞、M细胞、吸收细胞和肠内分泌细胞, 他们都起源于普通的肠干细胞[3]. 这些细胞一起形成单细胞层, 排列于肠道表面, 是宿主与肠道微生物之间的一个重要的交界面. 在生理及内环境平衡的状态下, PCs位于小肠隐窝的基底部, 能分泌包括α-防御素和溶菌酶在内的多种AMPs, 调节与宿主共生的微生物群的结构与组成. 同时, PCs与其他上皮细胞快速更新(一般3-5 d)的特点完全不同, 其寿命达30 d以上, 故在固有免疫和干细胞发生的生态系统中, 也起着重要作用[4].
形态学上, PCs顶部所含的丰富颗粒, 是该细胞最突出的表现, 所以, 可以作为一种组织学标志物, 通过辨别隐窝腔的分泌颗粒而识别. 除此之外, PCs还具有发达的内质网和高尔基体. 一直以来, PCs颗粒的内容不为人所知, 直到1967年Deckx等首次发现并确定溶菌酶定位于PCs, 同时发现该分子在肠道宿主防御中起重要作用, 从而推动了一系列研究, 其重点集中在PCs AMPs的释放、结构、功能和调节等功能上[5].
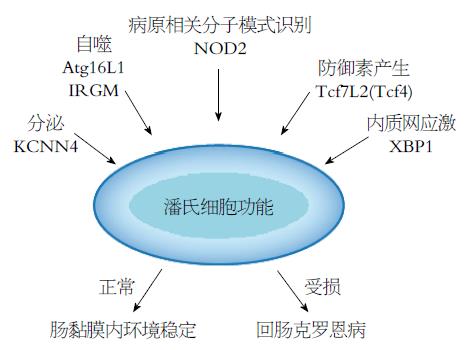
PCs通过胞吐方式将胞浆内的颗粒排入小肠隐窝腔, 引起脱颗粒的刺激包括胆碱能兴奋类药物、细菌细胞壁的表面成分以及Toll样受体(Toll-like receptor, TLR)兴奋剂等. 在上述刺激因素的作用下, PCs内外钙离子开始动员, 导致胞浆内钙离子浓度增加, 促进颗粒的释放. 这个过程中, 由KCNN4基因编码的钙离子激活的钾通道KCa3.1介导了钙离子内流的过程, 而给予选择性的KCNN4阻滞剂, 能抑制钙离子内流, 进而明显减少PCs大约50%的分泌[6]. PCs颗粒一旦分泌出来, 表达于临近隐窝细胞的囊性纤维化跨膜蛋白调节因子能帮助将其成分带入肠腔[7].
由于寿命长, PCs在大量分泌颗粒后, 必须自我更新, 以适应其参与机体防御功能的需要. 自噬就是PCs的自我更新方式之一[4]. 自噬是一种进化上保守的细胞行为, 几乎发生在机体所有的细胞类型, 主要是通过自我消化而重复再利用原有的细胞内成分. 自我吞噬形成具有双层膜的自噬体, 是其形态学标志. 自噬囊泡形成后, 被运送到细胞的溶酶体, 在其中, 内层膜被水解酶降解. 哺乳动物介导自噬的分子称为Atg蛋白[8]. 有些自噬蛋白尚有其他功能, 能与细胞内其他成分相互作用, 调节细胞活动, 包括免疫功能. 对于像PCs一样终末分化的长寿命细胞, 自噬对于细胞生理功能的维护及自身更新, 具有非常重要的意义. 正常情况下, 通过自噬, 重复利用的蛋白和细胞器不会在细胞的自我更新过程中被破坏. 在小肠上皮中, 某些刺激源能选择性地诱发PCs自噬, 如小鼠在全身γ射线照射后, 能产生自噬囊泡, 并表达Atg8; 同样, 经历48 h饥饿的小鼠PCs也会出现自噬体, 诱导Atg8的激活, 在这个过程中, 小鼠还会出现分泌颗粒的形态学变化, 以及AMPs水平的下降[9].
PCs合成颗粒时, 在蛋白质及多肽进入内质网早期, 多肽链尚未折叠, 进入内质网后, 再经历折叠以至成熟. 为确保分泌产物的质量, 分泌细胞会根据进入内质网的新合成蛋白的速度, 调整蛋白的折叠能力. 这个过程由内质网内的感受器控制, 并依赖其他细胞成分的信号转导通路介导. 这种自我平衡的信号通路, 是一种进化上高度保守的机制, 称为未折叠蛋白反应(unfolded protein response, UPR). 进入内质网的未折叠蛋白量与内质网处理蛋白的平衡失调, 称为内质网应激(endoplasmic reticulum stress, ERS), 能诱发UPR. UPR能减慢蛋白合成的速度, 减少进入内质网的蛋白数量, 增强内质网处理未折叠蛋白的能力. 如果UPR未恢复平衡, 可诱发细胞凋亡, 对PCs这样制造大量蛋白的分泌细胞来说, ERS是一种大的挑战[10]. Kaser等[11]应用遗传工程小鼠, 展示了PCs对ERS的易感性, X-盒结合蛋白1(X-box-binding protein 1, XBP1)是内质网中重要的转录因子, 参与调控未折叠蛋白的折叠、修饰、分选与包装. 特异性的删除XBP1基因, 可导致PCs缺乏及杯状细胞减少, 说明PCs对ERS非常敏感, 易受攻击. 此外, 在缺血-再灌注损伤小鼠, UPR能诱导PCs的凋亡, 而肥胖小鼠也显示PCs及其功能的改变, 表现为结合蛋白和活化转录因子4水平的升高, 二者的水平与体质量指数及机体内编码PCs AMPs mRNA水平密切相关[12]. 这些研究提示, PCs易受ERS的影响, 为研究PCs、肠微生物群落及营养代谢之间的关系提供了新的思路.
PCs实现其功能的途径是脱颗粒, 在各种因素的刺激下, 富含各种效应分子的颗粒从细胞顶端以胞吐的方式释放至隐窝腔. 目前知道, 多种分子参与了PCs脱颗粒和AMPs的释放过程. 研究[13]证实, 外源性的毒覃碱受体激动剂卡巴胆碱和核苷酸结合寡聚化结构域(nucleotide-binding oligomerization domain, NOD)配体胞壁酰二肽(muramyl dipeptide, MDP)能刺激PCs释放AMPs, 而内源性的白介素(interleukin, IL)-4和IL-13亦能刺激PCs脱颗粒和AMPs的释放. IL-13的这一功能需要磷脂酰肌醇3肌酶的参与, 且与PCs内蛋白激酶B的磷酸化有关, 流式细胞分析证实, 游离的PCs能表达IL-13受体α1. 在另一项研究[14]中, 研究人员发现, PCs脱颗粒并不是在微生物抗原和细菌本身刺激后直接出现脱颗粒活动, 而是在促炎细胞因子干扰素(interferon, IFN)-γ的诱导下快速脱颗粒, 并且在使用抗CD3抗体诱导内源性IFN-γ分泌后, 同样能观察到PCs内颗粒的减少和杯状细胞的分泌活动.
AMPs几乎存在于所有活的生物体内, 是进化上保守的最古老免疫成分之一, 可能也是机体应用最广的宿主防御效应分子[15]. PCs分泌颗粒内所含的内源性抗微生物分子, 与粒细胞或巨噬细胞内的效应分子, 要么是同样的物质, 要么是同源的. 溶菌酶是首个发现特异性表达于PCs的AMPs, 由此开始关注PCs的宿主防御功能. 其后, 有研究发现α-防御素(也叫隐窝防御素, 简称隐窝素)表达于小鼠PCs, 从而开始了一系列对该分子结构、功能、分子调控等的研究, 对PCs在固有免疫中的作用有了更进一步的了解. 研究人员发现第三种表达于PCs的AMPs, 是分泌型磷脂酶A2(type Ⅱ secretory phospholipase A, sPLA2), 是一种对革兰阳性菌有强大抗菌作用的分子. 其他AMPs也都在陆续发现中, 应用逆转录多聚酶链反应方法检测人回肠相关AMPs mRNA, 结果显示α-防御素(HD5和HD6)是PCs表达最多的AMPs类[16].
AMPs是一类小分子多肽, 通常包括少于40个氨基酸, 对革兰氏阴性和阳性细菌、真菌, 甚至包膜病毒等具有广泛的抗菌活性[17]. 目前发现的AMPs有500多种, 由于结构的多样性, 通常依据他们二级结构分类, 蛙皮素等AMPs含有一个α-螺旋, 而防御素则具有一个包括3个二硫键的β-折叠, 还有一种AMPs, PR-39, 则含有一个线性的非α-螺旋结构[18]. 防御素包括3个AMPs家族: α-、β-、δ-防御素, 一般以非氧化应激的方式杀灭微生物, α-防御素是首个特征化的AMPs家族, 是哺乳动物吞噬性白细胞颗粒的主要组成部分, 大量表达于人和小鼠小肠的PCs胞浆颗粒中[19]. 到目前为止, 小肠中只有PCs能合成并分泌AMPs, 而存在于肠道相关淋巴样组织中的M细胞, 只能摄取病原和过敏原, 并将之提呈给淋巴细胞. PCs AMPs的基本功能有二: (1)是保护机体免受肠道病原的攻击; (2)是塑造肠道微生物群落的结构组成. 正常肠道菌群之所以不引起病理改变, 与肠上皮的定植耐受有关, 当PCs功能受损时, 可影响上述两种主要功能, 出现肠道共生菌群紊乱, 甚至出现细菌向无菌的远隔器官移位. 细菌移位(bacterial translocation, BT)是许多疾病感染或炎症并发症的病理基础, 包括自噬和ERS, 以及免疫缺陷病毒感染[20].
人PCs表达两种α-防御素, 即HD5和HD6, 而小鼠的α-防御素(也称cryptdin, 即隐窝素)基因家族庞大, 编码大约20种不同的防御素, 目前cryptdin1-6已经纯化, 其中, 在体外试验显示cryptdin4具有最强的抗微生物活性[21]. 实验表明, PCsα-防御素前体必须在金属基质蛋白酶7(matrix metalloproteinase 7, MMP7)的作用下, 才能变成有活性的效应分子, 而MMP7缺陷小鼠无法清除体内通过口服而定植或感染的致病菌[22]. 同样, 在囊性纤维化小鼠, PCs分泌出的未溶解颗粒堆积在隐窝腔, 无法发挥抗微生物作用, 会导致肠杆菌科细菌的过度生长[23].
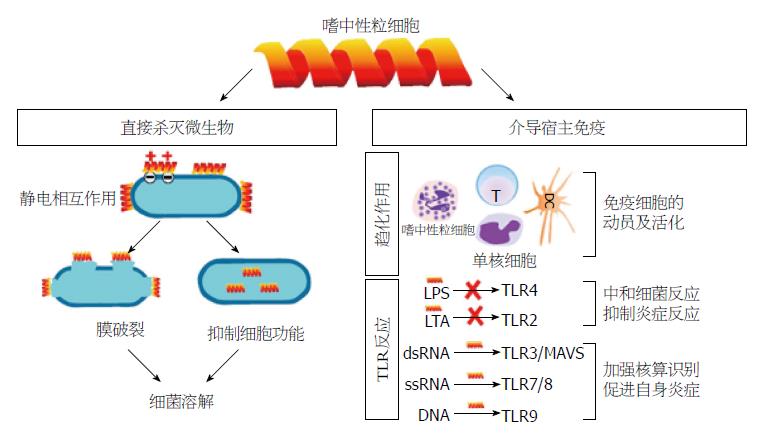
α-防御素的杀菌能力通常依赖于与细菌胞膜成分的结合, AMPs通常带正电荷, 具有疏水性, 有利于他们选择性地与带负电荷的细菌胞膜成分结合, 在其表面形成膜孔, 破坏其细胞膜结构的完整性, 导致细菌溶解[24](图1).
除α-防御素外, PCs还分泌其他AMPs, 如溶菌酶、分泌型磷酯酶A2、再生岛衍生蛋白ⅢA(regenerating islet-derived protein ⅢA, RegⅢA)等, 已知分泌量最大的是两种α-防御素. 研究PCs生物学最好的动物模型是大鼠和小鼠, 二者表达的AMPs中, α-防御素也同样占优势, 尽管其种类比人类多得多. 种系不同的小鼠, PCs分泌的AMPs谱不一样, 有些品种能特异性的表达大量隐窝素相关肽类, 以及一种叫做血管生成素的抗微生物RNase[25]. 人类、大鼠、小鼠PCs分泌的AMPs具有相似的生物活性[26].
人PCs表达最多的α-防御素是HD5, 由三个二硫键连接三对半胱氨酸残基, 其配对方式是C1-6、C2-4和C3-5, 其抗菌活性主要针对革兰氏阳性菌(金黄色葡萄球菌), 对大肠杆菌等革兰氏阴性菌也有作用. HD5的精氨酸-6和谷氨酸-14之间有高度保守的盐桥, 是该肽类分子抵抗蛋白水解作用的关键部位; 亮氨酸-29是其生物活性二聚体形成的关键[27]. HD5在抵抗肠道病原的侵袭和调节肠道微生物群落组成方面, 有非常重要的意义; HD6则缺乏直接的抗菌活性, 但Chu等[28]研究认为, HD6可结合沙门菌鞭毛和Ⅰ型菌毛等表面蛋白, 再通过自我装配的方式形成微纤维丝和微网格, 环绕、包围目标细菌, 在体外抵御鼠伤寒沙门菌侵袭及转基因表达HD5小鼠模型保护口服细菌侵入方面, 显示参与抵御病原入侵肠道的作用.
AMPs的分泌机制尚不完全清楚. 有研究[29]表明, 虽然α-防御素具有强大的抗菌作用, 但在严格无菌喂养的小鼠及出生前小鼠是同样有表达, 说明其分泌却并不依赖于细菌及其抗原成分的诱导. α-防御素在人类新生儿及哺乳期大、小鼠的表达水平低, 但成熟期后表达逐渐增加. α-防御素以外的其他AMPs的表达, 如人RegⅢγ(小鼠同源基因为RegⅢA)和血管生成素, 则会因为细菌在肠道的存在而发生急剧的变化.
PCsα-防御素基因转录表达的调控, 与细胞分化相关的转录因子有关, T细胞转录因子7样2(T cell transcription factor-7-like-2, Tcf7L2)可能是这类关键的转录因子之一. 该转录因子在Wnt/β-连环蛋白的调控下, PCs在Tcf7L2的作用下表达病原模式识别受体, 包括NOD2, 这是识别细菌成分胞壁酰二肽的关键细胞内识别受体. α-防御素的基线表达与NOD2有关, 而RegⅢγ表达的上游信号则来源于与TLR及MyD88有关的细菌模式识别受体通路[30].
肠道微生物群与人类的健康息息相关, 其基因数量庞大, 大约是人类基因组的100倍以上. 肠道微生物群的主要功能是参与氨基酸、维生素的合成和分解难以吸收的多糖并从中提取能量; 同时, 对维护肠黏膜屏障的完整性也有重要作用, 能对抗致病病原的入侵及促进免疫系统的发育. 因此, 可将肠道菌群看成人体内一个完整而独立的"虚拟器官"[31]. 小肠上皮是成年哺乳动物自我更新最快的组织之一, 上皮祖细胞密集的增殖就发生在PCs的上方隐窝部位. 从这个部位上行的更新至绒毛的两侧, 这些细胞包括杯状细胞、丛细胞、肠内分泌细胞和肠细胞. 隐窝基底部每更新分化出一个细胞替代旧的细胞, 而后进入凋亡. PCs的更新与上述方法完全不一样, 是向下行到底部, 在那里, 持续生存1 mo或更久, 所以, 最老的细胞往往在最底部. 此外, PCs还能感知肠内的营养状况, 加强干细胞在热量限制时的功能. 肠上皮中的PCs能对各种微生物的刺激作出反应, 合成和分泌多种蛋白质和抗微生物多肽(图2).
组成肠黏膜屏障的肠上皮层中, 绒毛肠细胞更新较快, 一般寿命为2-3 d; 而PCs以缓慢的速度更新, 其寿命一般超过30 d. PCs对氨基甲酰胆碱、细菌及其抗原产物的反应是分泌α-防御素及其他分子, 能引起PCs分泌的细菌抗原有脂多糖(lipopolysaccharide, LPS)、MDP. 钙离子活化钾通道mIKCa1是小鼠小肠上皮的PCs特有的, 能对细胞做出反应性的分泌活动; 通过应用mIKCa1抑制剂能抑制LPS诱导的隐窝素释放[6]. PCs对肠道黏膜免疫的贡献, 在转基因小鼠的研究中得到更多的证实. 表达HD5的转基因小鼠能表达人PCsα-防御素, 可保护小鼠抵抗致死剂量的鼠伤寒沙门氏菌感染[23]. 所以, PCs能通过控制细菌的侵入口, 维护绒毛-隐窝微环境的内稳态. PCs的分泌功能, 确定了其在肠道固有免疫中的地位和作用, 以及在肠道上皮表面建立黏膜免疫的新角色. 有趣的是, PCsα-防御素水平与细菌之间存在着不同的相关性. PCs颗粒可表达TLR9, 给小鼠注射富含CqG序列的寡核苷酸, 可引起TLR9的下调及大分泌颗粒的减少, 从而能增加小鼠对毒力强大的鼠伤寒沙门氏菌的抵抗, 说明PCs可通过TLR9起到哨兵的作用[32].
小肠及其黏膜的固有免疫反应涉及多种机制: (1)物理作用: 如肠蠕动和肠上皮的不断更新; (2)化学屏障: 如表面覆盖的黏液; (3)细胞活动: 如吞噬细胞的作用; (4)信号通路: 如微生物模式识别受体、细胞因子和脂质介质等. 这些机制与消化功能有关, 如胃液酸度、消化酶和胆盐, 都可能影响肠道局部的抗微生物宿主防御效果, 而PCs及其AMPs正是通过各种信号通路发挥作用的.
回肠克罗恩病(Crohn's disease, CD)是IBD的一种重要病理类型, 表现为肠道内平衡状态的破坏而引起的慢性炎症. 人α-防御素(HD5和HD6)是由小肠PCs产生的重要AMPs, 在肠道炎症的发病机制中起重要作用. 在CD中, NOD2突变可引起HD5和HD6的表达水平明显减少. 研究[33-35]发现, 尽管NOD2本身能通过激活核因子-κB(nuclear factor-κB, NF-κB)轻微上调肠α-防御素的表达, 但在PCs分化过程中, 更能通过抑制MAPK通路的激活而下调这些α-防御素的表达; 而CD患者过表达NOD2以及编码NOD2的基因突变, 不能引起NF-κB的激活, 可以解释CD患者为何α-防御素表达明显减少, 甚至出现NOD2的突变.
PCs及其分泌的多种效应蛋白与肠黏膜生理内稳态和疾病的发生密切相关. 肠道的单层上皮是外环境与循环之间的物理屏障, 营养吸收所在的刷状缘, 完全暴露于肠道定植菌群及随饮食带来的微生物流中. 在这种情况下, 上皮的转运必须维持平衡, 以保持微生物数量处于可控制的状态. 近端小肠相对于远端回肠、盲肠和结肠, 其细菌数量更低, 说明PCsAMPs参与肠道的固有免疫, 以抵抗大多微生物的定植. PCs的分泌颗粒富含各种与宿主防御有关的蛋白质和多肽, 包括α-防御素、sPLA2、溶菌酶、脂多糖结合蛋白, RegⅢA(或RegⅢγ)、黄嘌呤氧化酶、MMP7、CD95配体、IgA、CD1d、富含半胱氨酸的肠多肽、CD15,、金属硫蛋白、诱导IL-17A产生的一系列炎性因子、肿瘤坏死因子α(tumor necrosis factor α, TNFα)、IL-1b和脂肪因子等, 这些分子参与了肠黏膜的固有免疫过程, 共同维护肠黏膜屏障处于平衡状态[18,19,36].
PCsα-防御素究竟是通过直接的多肽介导的杀菌活性, 还是通过调节肠道定植菌群的组成, 而发挥其在肠道感染中的作用, 至今尚未有明确的结论. 表达人PCsHD5的转基因小鼠, 在抵抗野生型鼠伤寒沙门菌的感染时, 其存活率明显高于对照组. 同时, 在分析该转基因小鼠肠道细菌种群及群落生态学的研究中发现, 小鼠远端15 cm菌群的组成有明显的变化, 其中, 在MMP7缺陷小鼠厚壁菌占63.4%、拟杆菌类占17.5%, 而转基因小鼠厚壁菌只占17.5%, 拟杆菌占69.3%, 而肠道定植菌的组成及感染在IBD的发病中占重要地位[37]. 在一个C57BL/6小鼠感染模型中, 刚地弓形虫能诱导TLR9 mRNA积聚、Ⅰ型干扰素mRNA水平的升高, 并增加Crp3及Crp5 mRNA的表达, 基因敲除TLR9后予IFN-β, 上述其他分子水平的变化能复制, 而在敲除Ⅰ型干扰素受体后, 不再出现上述变化, 说明Ⅰ型干扰素可诱导小鼠隐窝素的产生.
PCs一般定位于小肠, 有时也会在出现在胃肠道的其他部位, 如胃和结肠, 其机制尚不完全清楚, 目前考虑是对黏膜炎症诱发的一种化生反应[38]. CD最常发生在远端小肠(回肠), 是PCs最多的部位. 目前, 与PCs有关的CD易感基因, 正在不断鉴定和研究中, 他们之间的关系对阐明CD的发病机制有重要的意义[38](图3).
编码NOD2的基因突变是首个被确定的CD易感因素, 在CD患者中存在过表达[39,40]. 西方国家中, 超过50%的CD患者存在突变体, 其中5%-20%属于同一个突变的纯和子和混合杂合子. 小鼠模型中PCs自噬功能失调加重的ERS, 能激发肠道炎症, 表达自噬蛋白Atg16l1突变体T300A的患者, 刚表现为异常的PCs形态和分泌颗粒的结构无序状态. 富亮氨酸重复激酶2(leucine-rich repeat kinase 2, LRRK2)和NOD2都可调节PCs的功能, 这些基因的单核苷酸多态性(single nucleotide polymorphism, SNP)与CD的发病机制密切相关. 由于NOD2表达于PCs, 在体外实验研究中发现, PCs能对NOD2的配体胞壁酰二肽直接发生应答, 从而动员颗粒释放并分泌入隐窝腔中, 而CD相关的NOD2 SNP改变会导致PCs对MDP应答缺陷[41,42]. 然而, 从小鼠体内分离培养的类器官, 也就是所谓的"迷你肠", 给予细菌产物刺激, 包括MDP直接刺激, 并不能诱导PCs分泌, 说明NOD2可能通过控制其他通路来调节PCs的功能. 在全基因组关联分析中[43,44], LRRK2与帕金森病(Parkinson disease, PD)患者并发CD和麻风病有关, 然而LRRK2在神经系统与胃肠道的功能之间的关联, 尚待进一步研究; PD患者LRRK2能调节囊泡的转运、自噬、细胞支架的组织和线粒体效应, 这个发现对于研究PCs合成的AMPs如何转运至致密核心囊泡(dense core vesicles, DCVs), 有很大的启示.
NOD2不是一个膜结合分子, 而是一个胞浆分子, 故不是一个细菌识别的直接靶目标. NOD2和多功能的蛋白激酶LRRK2, 二者都由IBD相关的基因编码, 肠道共生菌可以通过招募NOD2和GTP结合蛋白Rab2a到富含DCVs上, 从而介导溶菌酶的正确转运; 而NOD2、LRRK2和Rab2a缺陷均能重要的AMPs转动异常并快速降解而失去生物活性, 进而影响小鼠对肠道菌群的控制能力, 诱发IBD[41]. 研究[45]发现, 感染鼠伤寒沙门氏菌后, 小肠PCs特异性溶菌酶、溶菌酶阳性PCs以及PCs内的颗粒数均减少, 同时伴随着PCs总数的增加, 隐窝有丝分裂频率增加(通过增殖标志物PCNA染色的增加而体现)和绒毛凋亡, 认为PCs数量的增加可能与感染后发生的急性肠道炎症反应有关, 类似于系统感染后中性粒细胞的增加.
鉴于PCs在固有免疫中的作用, 在器官移植中亦可能影响患者的生理功能. 移植物抗宿主病是同种异体造血干细胞移植的一个重要并发症, 研究[46]发现, 接受移植的患者粪便中AMPs的α-防御素表达水平受影响, 导致肠道微生物群落的生物多样性发生改变, 继而出现微生物移位至血流引起全身感染, 说明粪便α-防御素可能成为监测肠微生物平衡的一个重要的标志物.
自身免疫性多内分泌腺-念珠菌病-外胚层营养障碍是一种以慢性皮肤黏膜念珠菌病、甲状旁腺功能减退及肾上腺功能不全为主要特征的自身免疫性疾病, 患者多伴有肠道功能紊乱, 研究发现患者持续出现的胃肠道症症状与针对PCs颗粒的自身免疫激活有关. 当小鼠缺乏自身免疫调节因子, 或编码该因子的基因发生突变时, 会导致机体对PCs颗粒失去耐受, 引起针对肠道α-防御素的自身免疫反应, 诱导机体产生α-防御素特异性自身抗体, 激活特异性的CD8+细胞, 攻击PCs, 导致该细胞数量的减少或消失, 从而出现相关的消化道症状, 如肠道菌群组成的变化等[47].
对溃疡性结肠炎风险基因的预测发现: 1型干扰素受体表达于肠上皮细胞, 可抑制PCs及杯状细胞功能, 当其数量减少时, 可改变肠道微生物的组成和上皮的再生速度, 促进结肠炎相关肿瘤的形成; 而将该基因缺陷小鼠与正常小鼠混合同笼喂养后, 其肠道微生物群的改变与上皮的高增殖性均有所好转, 为PCs、其周围细胞与肠道正常微生物群落之间的关系, 提供了一个有趣的研究范例[38].
自噬通路的缺陷能损害PCs, 研究[48]报道Atg16l1突变小鼠出现PCs功能异常, 可能与CD的发病有关, 而低水平的Atg16l1能导致分泌颗粒形成及释放入肠腔出现异常; 肠上皮Atg7基因敲除小鼠, 其PCs颗粒明显变小, 溶菌酶的水平也降低; 而予以自噬抑制剂的小鼠, 能导致溶菌酶脱酸化, 引起PCs功能异常. 说明机体自噬通路损害时, 机体暴露于一些特殊的病原微生物, 可能激发肠道炎症, 与CD的发病类似.
有研究表明, PCs还能直接诱导炎症. 在由TNFα诱导的休克小鼠模型中, IL-17R缺陷小鼠及给予抗IL-17A后的野生小鼠, 休克症状明显轻于对照组. 尽管IL-17A首次鉴定来自于活化的Th17细胞, 实验显示TNFα诱导的机体功能紊乱主要由来自PCs颗粒中的IL-17介导, 而不是由髓源性或Th17细胞源性的IL-17介导[49]. 由于源自PCs的促炎症细胞因子在诱导休克或肠道免疫反应中的作用, 可能成为全身或局部炎症治疗的新靶点.
坏死性小肠结肠炎(necrotizing enterocolitis, NEC)是一种主要发生于早产儿的疾病, 是新生儿重症监护室最常见的死亡因素之一. 一项对NEC患儿LPS感受器TLR/MD-2受体的分析研究认为, NEC与早产儿黏膜免疫缺陷有关; 正常新生儿和成年人MD-2的免疫反应非常明显, 而在早产儿NEC的PCs中, 该分子的表达是阴性的. PCs是目前发现的唯一对这种共受体免疫阳性的细胞类型, 研究[50]说明早产儿PCs对LPS的识别缺陷, 一旦早产儿暴露于肠道细菌不断定植刺激的环境下, 微生态的改变可能成为NEC的一个易感因素.
抗生素的使用拯救了一大批严重感染的患者, 但即使这样, 也有许多不利的因素存在, 包括多重耐抗生素细菌的增加、机会性感染在住院患者的高发生率, 以及投入-产出效益等问题. 由此, AMPs的应用, 以及对一些分泌细胞如PCs的功能调控, 就具有许多优势. 例如, 从抗微生物机制上, 相对于抗生素的使用, 机体不会出现耐药的问题, 并且, 由于是内源性多肽类, 使用上也相对安全. 此外, 固有免疫在肠道宿主防御中起着关键的作用. 肠上皮固有免疫不是一个消极的非特异性过程, 而是一个潜在的井然有序的系统. Rishi等[51]在研究中, 将α-防御素应用于鼠伤寒沙门菌感染, 但是, 考虑到α-防御素机体可能因胃酸等诸多胃肠道不利因素的存在而影响其生物利用度, 用壳聚糖和三聚磷酸盐按5:2的比例, 通过离子凝胶法将重组的cryptdin2装载于大小约105 nm±7 nm的纳米颗粒中, 4.5 h后, 药物的包封率为60%, 体外试验显示65%的成分能正常释放出来; 同时, cryptdin2纳米胶囊给感染致命鼠伤寒沙门氏菌的小鼠口服后, 生存率达83%, 小鼠体内的细菌裁量明显减少, 而对照组的死亡率达100%. 肝纤维化和肝衰竭与肠道BT有密切的关系, 移位多属于肠道正常菌群, 在肠道屏障功能损害的情况下, 移位至本来无菌的器官. Teltschik等[52]研究发现, 40%的肝纤维化大鼠模型能检测到BT, 与无BT的大鼠比较, 出现BT的大鼠PCsα-防御素水平明显降低, 发生BT的肝纤维化大鼠, 远端小肠黏膜对不同肠道细菌的抗菌活性减弱. 针对BT在肝病中的发生, 我们应用GFP标记的大肠杆菌给肝衰竭大鼠服用后, 观察到发生BT的肝衰竭大鼠, 其肝功能损害重于无BT的对照组动物, 而在应用乳果糖或思密达后, 能减少移位细菌的数量, 进而改善大鼠的肝脏病理改变[53]; 同时, 进一步的研究[54,55]发现肝衰竭大鼠PCs脱颗粒后, 随着AMPs水平的变化, 其病原相关分子模式发生改变, 影响BT及肠道细菌的生态学改变. 这些临床前研究, 通过合适的包装技术, 延长了药物的保存期、保护了药物免于破坏, 也增加了药物的生物利用度, 最大限度地发挥了其生物学功能. 同时, 我们将在之前建立的肝衰竭大鼠模型基础上, 更深入也探索PCs及其AMPs、BT和肝衰竭病程中的肠黏膜屏障及固有免疫变化之间的关系及分子机制, 给未来AMPs的临床应用带来了曙光[56,57].
位于小肠隐窝基底部的PCs, 通过分泌AMPs及其他相关免疫分子, 参与了肠道微生物群落结构的塑造及肠黏膜固有免疫等重要的生理、病理机制. 近年来, 关于PCs的生物学、AMPs的功能、肠黏膜屏障的维护、BT的发生、宿主-微生物的相互关系以及PCs与肠道炎症、全身感染的关系等方面的研究逐渐增多, 推动了肠黏膜免疫机制的研究进展, 为肠道微生态平衡的研究及应用奠定了基础, 也为PCs及AMPs的临床应用提供了新的思路[58].
潘氏细胞(Paneth cells, PCs)及其抗微生物肽(antimicrobial peptides, AMPs)与肠道微生物的生态学失衡、肠道炎症、全身感染等病理状况的发生密切相关. 肠黏膜屏障与固有免疫功能的损害, 常伴随着机体α-防御素等AMPs水平及其他炎症介质水平的改变.
朱元民, 主任医师, 北京大学人民医院消化内科
本文较全面综述了PCs及其AMPs与肠道黏膜免疫方面的研究, 文字表达流畅, 条理清楚, 具有较高的参考价值.
手稿来源: 邀请约稿
学科分类: 胃肠病学和肝病学
手稿来源地: 陕西省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 于明茜 电编:李瑞芳
| 1. | Bevins CL, Salzman NH. Paneth cells, antimicrobial peptides and maintenance of intestinal homeostasis. Nat Rev Microbiol. 2011;9:356-368. [PubMed] [DOI] |
| 2. | Wehkamp J, Stange EF. Paneth's disease. J Crohns Colitis. 2010;4:523-531. [PubMed] [DOI] |
| 3. | Clevers H. The Paneth cell, caloric restriction, and intestinal integrity. N Engl J Med. 2012;367:1560-1561. [PubMed] [DOI] |
| 4. | Hosomi S, Kaser A, Blumberg RS. Role of endoplasmic reticulum stress and autophagy as interlinking pathways in the pathogenesis of inflammatory bowel disease. Curr Opin Gastroenterol. 2015;31:81-88. [PubMed] [DOI] |
| 5. | Porter EM, Bevins CL, Ghosh D, Ganz T. The multifaceted Paneth cell. Cell Mol Life Sci. 2002;59:156-170. [PubMed] |
| 6. | Ayabe T, Wulff H, Darmoul D, Cahalan MD, Chandy KG, Ouellette AJ. Modulation of mouse Paneth cell alpha-defensin secretion by mIKCa1, a Ca2+-activated, intermediate conductance potassium channel. J Biol Chem. 2002;277:3793-3800. [PubMed] [DOI] |
| 7. | De Lisle RC. Altered transit and bacterial overgrowth in the cystic fibrosis mouse small intestine. Am J Physiol Gastrointest Liver Physiol. 2007;293:G104-G111. [PubMed] [DOI] |
| 8. | Levine B, Mizushima N, Virgin HW. Autophagy in immunity and inflammation. Nature. 2011;469:323-335. [PubMed] [DOI] |
| 9. | Hodin CM, Lenaerts K, Grootjans J, de Haan JJ, Hadfoune M, Verheyen FK, Kiyama H, Heineman E, Buurman WA. Starvation compromises Paneth cells. Am J Pathol. 2011;179:2885-2893. [PubMed] [DOI] |
| 10. | Kaser A, Flak MB, Tomczak MF, Blumberg RS. The unfolded protein response and its role in intestinal homeostasis and inflammation. Exp Cell Res. 2011;317:2772-2779. [PubMed] [DOI] |
| 11. | Kaser A, Lee AH, Franke A, Glickman JN, Zeissig S, Tilg H, Nieuwenhuis EE, Higgins DE, Schreiber S, Glimcher LH. XBP1 links ER stress to intestinal inflammation and confers genetic risk for human inflammatory bowel disease. Cell. 2008;134:743-756. [PubMed] [DOI] |
| 12. | Hodin CM, Verdam FJ, Grootjans J, Rensen SS, Verheyen FK, Dejong CH, Buurman WA, Greve JW, Lenaerts K. Reduced Paneth cell antimicrobial protein levels correlate with activation of the unfolded protein response in the gut of obese individuals. J Pathol. 2011;225:276-284. [PubMed] [DOI] |
| 13. | Stockinger S, Albers T, Duerr CU, Ménard S, Pütsep K, Andersson M, Hornef MW. Interleukin-13-mediated paneth cell degranulation and antimicrobial peptide release. J Innate Immun. 2014;6:530-541. [PubMed] [DOI] |
| 14. | Farin HF, Karthaus WR, Kujala P, Rakhshandehroo M, Schwank G, Vries RG, Kalkhoven E, Nieuwenhuis EE, Clevers H. Paneth cell extrusion and release of antimicrobial products is directly controlled by immune cell-derived IFN-γ. J Exp Med. 2014;211:1393-1405. [PubMed] [DOI] |
| 15. | Zasloff M. Antimicrobial peptides of multicellular organisms. Nature. 2002;415:389-395. [PubMed] [DOI] |
| 16. | Bevins CL. The Paneth cell and the innate immune response. Curr Opin Gastroenterol. 2004;20:572-580. [PubMed] |
| 17. | Stromberg R, Ottosson H, Miraglia E, Nylen F, Gudmundsson G, Agerberth B. Boosting Innate Immunity with New Potent Inducers of Antimicrobial Peptide Expression. Scand J Immunol. 2014;79:432-432. |
| 18. | Lee TH, Hall KN, Aguilar MI. Antimicrobial Peptide Structure and Mechanism of Action: A Focus on the Role of Membrane Structure. Curr Top Med Chem. 2016;16:25-39. [PubMed] |
| 19. | Cole JN, Nizet V. Bacterial Evasion of Host Antimicrobial Peptide Defenses. Microbiol Spectr. 2016;4:VMBF-0006-2015. [PubMed] [DOI] |
| 20. | Zaragoza MM, Sankaran-Walters S, Canfield DR, Hung JK, Martinez E, Ouellette AJ, Dandekar S. Persistence of gut mucosal innate immune defenses by enteric α-defensin expression in the simian immunodeficiency virus model of AIDS. J Immunol. 2011;186:1589-1597. [PubMed] [DOI] |
| 21. | Lehrer RI, Lu W. α-Defensins in human innate immunity. Immunol Rev. 2012;245:84-112. [PubMed] [DOI] |
| 22. | Mastroianni JR, Costales JK, Zaksheske J, Selsted ME, Salzman NH, Ouellette AJ. Alternative luminal activation mechanisms for paneth cell α-defensins. J Biol Chem. 2012;287:11205-11212. [PubMed] [DOI] |
| 23. | Liu J, Walker NM, Cook MT, Ootani A, Clarke LL. Functional Cftr in crypt epithelium of organotypic enteroid cultures from murine small intestine. Am J Physiol Cell Physiol. 2012;302:C1492-C1503. [PubMed] [DOI] |
| 24. | Bevins CL. Innate immune functions of α-defensins in the small intestine. Dig Dis. 2013;31:299-304. [PubMed] [DOI] |
| 25. | Andersson ML, Karlsson-Sjöberg JM, Pütsep KL. CRS-peptides: unique defense peptides of mouse Paneth cells. Mucosal Immunol. 2012;5:367-376. [PubMed] [DOI] |
| 26. | Hooper LV, Stappenbeck TS, Hong CV, Gordon JI. Angiogenins: a new class of microbicidal proteins involved in innate immunity. Nat Immunol. 2003;4:269-273. [PubMed] [DOI] |
| 27. | Rajabi M, Ericksen B, Wu X, de Leeuw E, Zhao L, Pazgier M, Lu W. Functional determinants of human enteric α-defensin HD5: crucial role for hydrophobicity at dimer interface. J Biol Chem. 2012;287:21615-21627. [PubMed] [DOI] |
| 28. | Chu H, Pazgier M, Jung G, Nuccio SP, Castillo PA, de Jong MF, Winter MG, Winter SE, Wehkamp J, Shen B. Human α-defensin 6 promotes mucosal innate immunity through self-assembled peptide nanonets. Science. 2012;337:477-481. [PubMed] [DOI] |
| 29. | Putsep K, Axelsson LG, Boman A, Midtvedt T, Normark S, Boman HG, Andersson M. Germ-free and colonized mice generate the same products from enteric prodefensins. J Biol Chem. 2000;275:40478-40482. [PubMed] [DOI] |
| 30. | Vaishnava S, Yamamoto M, Severson KM, Ruhn KA, Yu X, Koren O, Ley R, Wakeland EK, Hooper LV. The antibacterial lectin RegIIIgamma promotes the spatial segregation of microbiota and host in the intestine. Science. 2011;334:255-258. [PubMed] [DOI] |
| 31. | Giorgetti G, Brandimarte G, Fabiocchi F, Ricci S, Flamini P, Sandri G, Trotta MC, Elisei W, Penna A, Lecca PG. Interactions between Innate Immunity, Microbiota, and Probiotics. J Immunol Res. 2015;2015:501361. [PubMed] [DOI] |
| 32. | Bauer S, Kirschning CJ, Häcker H, Redecke V, Hausmann S, Akira S, Wagner H, Lipford GB. Human TLR9 confers responsiveness to bacterial DNA via species-specific CpG motif recognition. Proc Natl Acad Sci USA. 2001;98:9237-9242. [PubMed] [DOI] |
| 33. | Brant SR, Huang C, Haritunians T, Okou DT, Cutler DJ. 387 immunochip Implicates Multiple Genetic Loci for African American IBD Including HLA-DRB1 for UC, NOD2, PTGER4, IL23R, LZKF3 and STAT5A/STAT3 for CD and Several Regions of Significant Admixture Linkage Disequilibrium. Gastroenterology. 2015;148:S80-S80. [DOI] |
| 34. | Corridoni D, Marinis J, Abbott D, Cominelli F. Defective NOD2 Signaling and Innate Cytokine Production in Response to MDP in Experimental Crohn's Disease (CD). Gastroenterology. 2012;142:S873-S873. [DOI] |
| 35. | Lawrance IC. NOD2 and CD. Inflamm Bowel Dis. 2011;17:2596-2597. [PubMed] [DOI] |
| 36. | Tan G, Zeng B, Zhi FC. Regulation of human enteric α-defensins by NOD2 in the Paneth cell lineage. Eur J Cell Biol. 2015;94:60-66. [PubMed] [DOI] |
| 37. | Packey CD, Sartor RB. Commensal bacteria, traditional and opportunistic pathogens, dysbiosis and bacterial killing in inflammatory bowel diseases. Curr Opin Infect Dis. 2009;22:292-301. [PubMed] [DOI] |
| 38. | Clevers HC, Bevins CL. Paneth cells: maestros of the small intestinal crypts. Annu Rev Physiol. 2013;75:289-311. [PubMed] [DOI] |
| 39. | Pierdomenico M, Cesi V, Cucchiara S, Vitali R, Prete E, Costanzo M, Aloi M, Oliva S, Stronati L. NOD2 Is Regulated By Mir-320 in Physiological Conditions but this Control Is Altered in Inflamed Tissues of Patients with Inflammatory Bowel Disease. Inflamm Bowel Dis. 2016;22:315-326. [PubMed] [DOI] |
| 40. | Cleynen I, Boucher G, Jostins L, Schumm LP, Zeissig S, Ahmad T, Andersen V, Andrews JM, Annese V, Brand S. Inherited determinants of Crohn's disease and ulcerative colitis phenotypes: a genetic association study. Lancet. 2016;387:156-167. [PubMed] [DOI] |
| 41. | Zhang Q, Pan Y, Yan R, Zeng B, Wang H, Zhang X, Li W, Wei H, Liu Z. Commensal bacteria direct selective cargo sorting to promote symbiosis. Nat Immunol. 2015;16:918-926. [PubMed] [DOI] |
| 42. | Schnitzler F, Friedrich M, Wolf C, Stallhofer J, Angelberger M, Diegelmann J, Olszak T, Tillack C, Beigel F, Göke B. The NOD2 Single Nucleotide Polymorphism rs72796353 (IVS4+10 A& gt; C) Is a Predictor for Perianal Fistulas in Patients with Crohn's Disease in the Absence of Other NOD2 Mutations. PLoS One. 2015;10:e0116044. [PubMed] [DOI] |
| 43. | Shaikh KT, Yang A, Youshin E, Schmid S. Transgenic LRRK2 (R1441G) rats-a model for Parkinson disease? PeerJ. 2015;3:e945. [PubMed] [DOI] |
| 44. | Gan-Or Z, Leblond CS, Mallett V, Orr-Urtreger A, Dion PA, Rouleau GA. LRRK2 mutations in Parkinson disease; a sex effect or lack thereof? A meta-analysis. Parkinsonism Relat Disord. 2015;21:778-782. [PubMed] [DOI] |
| 45. | Martinez Rodriguez NR, Eloi MD, Huynh A, Dominguez T, Lam AH, Carcamo-Molina D, Naser Z, Desharnais R, Salzman NH, Porter E. Expansion of Paneth cell population in response to enteric Salmonella enterica serovar Typhimurium infection. Infect Immun. 2012;80:266-275. [PubMed] [DOI] |
| 46. | Eriguchi Y, Nakamura K, Hashimoto D, Shimoda S, Shimono N, Akashi K, Ayabe T, Teshima T. Decreased secretion of Paneth cell α-defensins in graft-versus-host disease. Transpl Infect Dis. 2015;17:702-706. [PubMed] [DOI] |
| 47. | Dobeš J, Neuwirth A, Dobešová M, Vobořil M, Balounová J, Ballek O, Lebl J, Meloni A, Krohn K, Kluger N. Gastrointestinal Autoimmunity Associated With Loss of Central Tolerance to Enteric α-Defensins. Gastroenterology. 2015;149:139-150. [PubMed] [DOI] |
| 48. | Wittkopf N, Günther C, Martini E, Waldner M, Amann KU, Neurath MF, Becker C. Lack of intestinal epithelial atg7 affects paneth cell granule formation but does not compromise immune homeostasis in the gut. Clin Dev Immunol. 2012;2012:278059. [PubMed] [DOI] |
| 49. | Takahashi N, Vanlaere I, de Rycke R, Cauwels A, Joosten LA, Lubberts E, van den Berg WB, Libert C. IL-17 produced by Paneth cells drives TNF-induced shock. J Exp Med. 2008;205:1755-1761. [PubMed] [DOI] |
| 50. | Wolfs TG, Derikx JP, Hodin CM, Vanderlocht J, Driessen A, de Bruïne AP, Bevins CL, Lasitschka F, Gassler N, van Gemert WG. Localization of the lipopolysaccharide recognition complex in the human healthy and inflamed premature and adult gut. Inflamm Bowel Dis. 2010;16:68-75. [PubMed] [DOI] |
| 51. | Rishi P, Bhogal A, Arora S, Pandey SK, Verma I, Kaur IP. Improved oral therapeutic potential of nanoencapsulated cryptdin formulation against Salmonella infection. Eur J Pharm Sci. 2015;72:27-33. [PubMed] [DOI] |
| 52. | Teltschik Z, Wiest R, Beisner J, Nuding S, Hofmann C, Schoelmerich J, Bevins CL, Stange EF, Wehkamp J. Intestinal bacterial translocation in rats with cirrhosis is related to compromised Paneth cell antimicrobial host defense. Hepatology. 2012;55:1154-1163. [PubMed] [DOI] |
| 53. | Yang J, Nie QH, Wang AH, Huang XF, Liu QQ, Li YM. Effects of intestinal intervention on bacterial translocation in a rat model of acute liver failure in vivo. Eur J Gastroenterol Hepatol. 2010;22:1316-1322. [PubMed] [DOI] |