修回日期: 2017-08-03
接受日期: 2017-08-23
在线出版日期: 2017-09-28
探讨异常黑胆质成熟剂(abnormal savda munziq, ASM)对异常黑胆质型肝癌病证大鼠模型候选基因表达水平的影响.
选取♂清洁Wistar大鼠随机分为6个组. 联合维吾尔医学理论及二乙基亚硝胺(diethylnitrosamine, DEN)诱导建立异常黑胆质型肝癌病证大鼠模型, 并用ASM高(6.0 g/kg), 中(3.0 g/kg), 低(1.5 g/kg)不同剂量对模型组全程干预20 wk, 观察肝脏组织形态学变化, 并通过RT-qPCR验证表达谱芯片筛选出的部分差异表达候选基因.
观察肝脏组织形态学变化发现, 异常黑胆质型肝癌病证模型组成癌率明显高于对照肝癌组, ASM干预组成癌率明显低于异常黑胆质型肝癌病证模型组; 芯片结果显示, 与对照肝癌组比较, 异常黑胆质型肝癌病证模型组上调表达基因438种、表达下调基因451种, 对从异常黑胆质型肝癌病证模型组与ASM干预组表达变化相反的11种基因中选出6种进行RT-qPCR验证, 结果发现, 在大部分组间mRNA表达水平有差异并具有统计学意义(P<0.01, P<0.05).
STAT3、CyclinD1、EGLN3、EMP1、NEFL、IGFALS基因可能是ASM抗癌的作用靶点.
核心提要: 维药异常黑胆质成熟剂(abnormal savda munziq, ASM)其药物成分复杂, 在各种难治性肿瘤的预防和治疗中有良好的作用. 本研究结果提示, 黑胆质成熟剂可能通过阻遏STAT3、CyclinD1、EGLN3等基因的表达, 而诱导EMP1、NEFL、IGFALS等基因的表达而起抗癌作用.
引文著录: 娜孜拉木·玉苏甫江, 王延蛟, 祖力皮喀尔·阿卜杜热合曼, 古丽尼格尔·雪合拉提, 斯坎德尔·白克力. 异常黑胆质成熟剂对异常黑胆质型肝癌病证大鼠模型候选基因表达的影响. 世界华人消化杂志 2017; 25(27): 2449-2458
Revised: August 3, 2017
Accepted: August 23, 2017
Published online: September 28, 2017
To identify the differentially expressed genes in an abnormal savda rat model of hepatocarcinoma treated with abnormal savda munziq (ASM).
Male Wistar rats were randomly divided into six groups. An abnormal savda rat model of hepatocarcinoma was established with diethylnitrosamine (DEN) according to Uyghur medicine theory. Different doses of ASM (6.0, 3.0, and 1.5 g/kg) were used to intervene the model rats for 20 wk. The histological changes in hepatocarcinoma tissue were observed. The genes with differential expression were screened, several of which were investigated by RT-qPCR.
The histology of liver tissue showed that the cancerogenic rate was significantly higher in rats with abnormal savda than in those without. Cancerogenic rates in the ASM intervention groups were significantly lower than those in rats with abnormal savda. Compared with the control group, 438 genes were up-regulated and 451 down-regulated in abnormal savda rats with hepatocarcinoma. Among these differentially expressed genes, 11 showed converse expression patterns between the hepatocarcinoma group and ASM intervention groups. RT-qPCR verified that STAT3, CyclinD1, EGLN3, EMP1, NEFL, and IGFALS were differentially expressed in different groups (P < 0.01 or P < 0.05).
STAT3, CyclinD1, EGLN3, EMP1, NEFL, and IGFALS may be involved in the anti-cancer effects of ASM.
- Citation: Nazilamu·Yusufujiang, Wang YJ, Zulipikaer·Abudureheman, Gulinigeer·Xuehelati, Sikandeer·Baikeli. Identification of differentially expressed genes in an abnormal savda rat model of hepatocarcinoma treated with abnormal Savda munziq. Shijie Huaren Xiaohua Zazhi 2017; 25(27): 2449-2458
- URL: https://www.wjgnet.com/1009-3079/full/v25/i27/2449.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i27.2449
肝癌是在我国发病率排列第4位的恶性肿瘤[1]. 异常黑胆质成熟剂是以维吾尔医学理论的指导下由多种草药组成的复方制剂, 一直被用于复杂性疾病治疗, 而且在基础研究上治疗效果已经被证实. 前期研究[2-4]发现异常黑胆质成熟剂可以防止大鼠肝癌的发生发展, 但其作用机制尚不清楚. 本研究以建立的异常黑胆质型肝癌病证大鼠模型各组肝脏组织为研究对象, 通过表达谱芯片技术筛选出异常黑胆质型肝癌病证大鼠模型差异表达的候选基因, 选中其中信号传导与转录激活因子3(signal transducer and activator of transcription 3, STAT3)、细胞周期蛋白(CyclinD1)、EGLN3、上皮膜蛋白1(epithelial membrane protein 1, EMP1)、神经丝轻链(neurofilament light chain, NEFL)、胰岛素样生长因子酸不稳定亚基(insulin-like growth factor acid volatile subunits, IGFALS)等6种候选基因, 应用RT-qPCR方法对mRNA表达水平进行检测, 探讨异常黑胆质成熟剂(abnormal savda munziq, ASM)对上述候选基因表达水平的影响, 并寻找其抗肝癌可能的作用靶点.
实验动物由新疆医科大学实验动物中心提供. 许可证号: SCXK(新)20032001. 氯仿、异丙醇、无水乙醇是由天津永晟精细化工有限公司提供; TRIzol购自中山金桥; 荧光定量SYBR Premix Ex TaqTMⅡ TaKaRa公司产品; cDNA试剂盒Thermo公司产品; 二乙基亚硝胺(diethylnitrosamine, DEN)购自Sigma公司. 仪器: 电泳仪(DYY-6D型)北京市六一仪器厂; DYZ-Z 26型电泳槽(北京); Veriti9902PCR仪(德国).
1.2.1 动物分组及喂养: 选取体质量为130-160 g♂健康的清洁Wistar大鼠75只、室温(25 ℃±3 ℃)稳定饲养3 d后, 分为2组: 实验组和对照组. 实验组(53只): 参考文献[5]为基础, 按每公斤加入基础饲料, 大麦和芫荽子以7.0:1.5:1.5的比例混合制作干寒属性饲料, 动物置于干寒气候环境(每天放入7 ℃气候箱6 h), 实验过程中进行间断足底电刺激(第1周: 1次/d, 30 min/次, 电压18 V; 第2周: 1次/d, 35 min/次, 电压20 V; 第3周: 1次/d, 45 min/次, 电压35 V)、制动(第1周: 1次/d, 50 min/次; 第2周: 1次/d, 60 min/次; 第3周: 1次/d, 90 min/次)、强迫游泳(5 min/次, 水温20 ℃±5 ℃, 1次/d), 夹尾巴等实验步骤连合作用21 d, 建立维吾尔医学异常黑胆质证载体大鼠模型. 在此基础上将实验组分为2组: (1)异常黑胆质型肝癌病证模型组(异黑肝癌组); 使用灭菌食用水配制浓度为0.1 mg/mL的DEN溶液以诱发肝癌, 自由饮用, 每天更换一次, 20 wk停药; (2)ASM干预组: 包括高剂量给药组(6.0 g/kg)、中剂量给药组(3.0 g/kg)、低剂量给药组(1.5 g/kg). ASM干预组给予DEN诱导的同时每天分别灌胃相当于临床应用的等效剂量, 即分别灌胃6.0、3.0和1.5 g/kg的ASM. 实验组持续进行异常黑胆质证造模复合因素, 直至实验结束. 对照组(22只)分为: 正常对照组和对照肝癌组. (1)正常对照组: 用普通饲料饲养, 自由饮水, 等剂量生理盐水灌胃作为安慰剂(2 mL/只); (2)对照肝癌组: 在正常对照组的条件基础上21 d正常饲养后, 饮用水改为灭菌水配制的0.1 mg/mL的DEN溶液, 自由饮用且每天更换1次, 连续20 wk停药, 未收到其他刺激.
1.2.2 样品制备: 20 wk时对6组动物进行处理, 部分肝脏组织用10%甲醛固定, 进行石蜡包埋, 切片, 苏木精-伊红染色后进行病理组织学检查, 并在光学显微镜下观察, 其余部分-80 ℃保存备用.
1.2.3 mRNA表达谱芯片: 本研究以正常对照组、对照肝癌组, 异常黑胆质型肝癌病证模型组及ASM干预组其中包括(高剂量给药组、中剂量给药组、低剂量给药组)大鼠为研究对象, 每组选取3只大鼠质检合格的肝脏组织RNA, 通过由北京博奥生物有限公司提供的大鼠全基因组表达谱芯片杂交、LuxScan10KA双通道激光扫描仪扫描、图像数据由美国昂飞公司生产的AGCC(Affymetrix, GeneChip, Command Console, software)专业软件进行处理, 获得了肝癌特异表达基因群.
1.2.4 RT-qPCR法: 提取肝脏组织总RNA, 反转录合成cDNA. 从GenBank检索STAT3、CyclinD1、EGLN3、EMP1、NEFL、IGFALS等基因的mRNA序列, 根据该序列采用Primer Premier 5.0软件分别设计特异性的引物并进行PCR, 内参对照选用大鼠GAPDH(表1). 以cDNA为模板, PCR反应体系如表2. 在PCR反应管中充分混匀以上反应体系, 1000 r/min离心15 s, 置入BIO-RAD荧光定量PCR仪中进行RT-qPCR反应. PCR反应条件为: 95 ℃ 30 s预变性, 95 ℃ 5 s变性, 60 ℃ 30 s退火, 72 ℃ 30 s延伸, 共40个循环, 再加55 ℃-95 ℃ 10 s溶解曲线分析, 共81个循环, 评价扩增效率.
| 引物名称 | 引物序列 | 扩增片段(bp) |
| GAPDH | 上游引物: 5'-GTGCTGAGTATGTCGTGGAGT-3' | 290 |
| 下游引物: 5'-TGTCTTCTGAGTGGCAGTGAT-3' | ||
| STAT3 | 上游引物: 5'-GCTTCTCGTTCTGGGTCTG-3' | 223 |
| 下游引物: 5'-GTCTTGCCACTGATGTCCTT-3' | ||
| CyclinD1 | 上游引物: 5'-TGACTGCCGAGAAGTTGTGC-3' | 247 |
| 下游引物: 5'-GAGGGTGGGTTGGAAATGAA-3' | ||
| EGLN3 | 上游引物: 5'-TGCCTCGTGTTCGCACTTTA-3' | 218 |
| 下游引物: 5'-:CGCTATGACAGCAGCCCTTT-3' | ||
| NEFL | 上游引物: 5'-AAGAAGGTGGTGAGGGTGA-3' | 176 |
| 下游引物: 5'-AACTGGTTGGTTTGGTGATG-3' | ||
| EMP1 | 上游引物: 5'-GGTGAGATGAATAAAGTCCTGGTG-3' | 212 |
| 下游引物: 5'-GGGTGGTCTTCTAAGGGCAATA-3' | ||
| IGFALS | 上游引物: 5'-TTTCAATGTGGCGGTTATG-3' | 194 |
| 下游引物: 5'-:CGATGCTGGAGATGCTGT-3' |
| 体系成份 | 体积(μL) |
| SYBR Premix Ex TaqTMⅡ | 12.5 |
| PCR Forword Primer(10 umol/L) | 1.0 |
| PCR Revers Primer(10 umol/L)) | 1.0 |
| ddH2O (RNase/DNaseFreeWater) | 8.5 |
| Template cDNA | 2.0 |
| Final Volume | 25.0 |
统计学处理 采用SPSS17.0数据分析软件, 服从正态分布, 由于本实验6个不同组计量资料故应用单因素方差分析各项数据采用mean±SD表示, 检验水准α = 0.05, P<0.05为差异具有统计学意义.
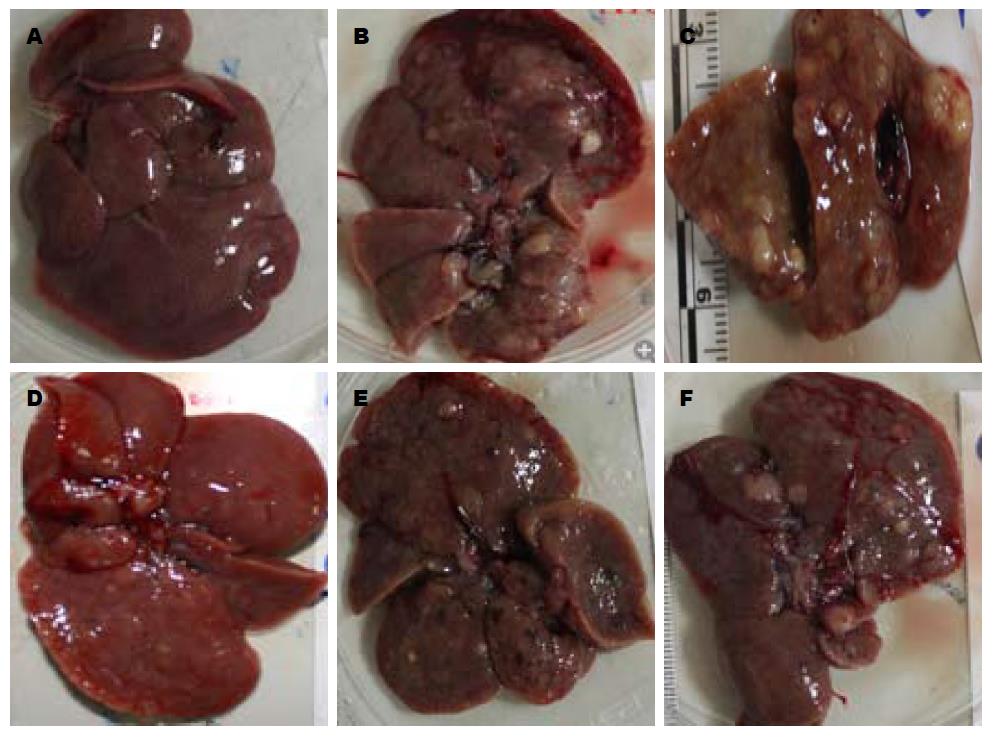
正常对照组: 肝脏呈正常外观, 表面光滑、色泽红润、无增生结节或肝癌发生. 对照肝癌组: 肝脏表面比较粗糙, 表面有颗粒感. 异常黑胆质性肝癌组: 肝脏质地较硬, 表面粗糙, 色暗淡, 多个大小不一的灰白色结节, 成瘤数可见比对照肝癌组多, 可见出血和坏死. ASM给药组尤其是高剂量组有明显的好转(图1).
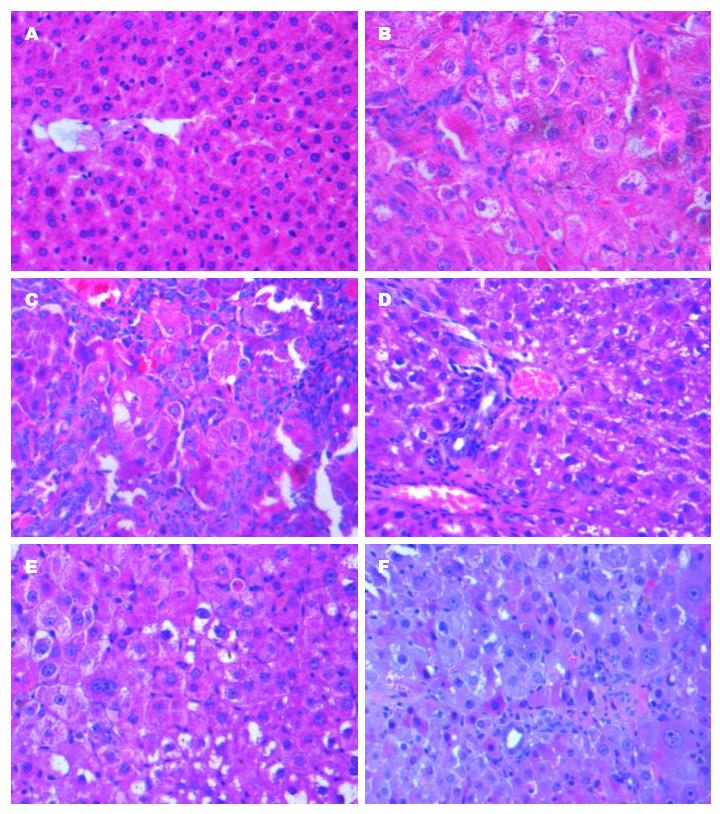
正常对照组: 肝脏组织肝小叶结构正常、肝窦扩张呈条索状排列、未见纤维间隔、未见细胞水肿、未见坏死肝细胞. 对照肝癌组: 假小叶形成, 细胞水肿, 肝细胞排列紊乱, 部分肝细胞呈不典型增生, 中央静脉缺如, 小叶周围纤维结缔组织增生. 异黑肝癌组: 肝癌组织呈巣状结构, 肿瘤细胞异型性明显, 大小不一, 核浆比例增大, 核仁清楚, 部分细胞水肿呈气球样变, 胆管增生, 扩张. ASM干预组: 有不同程度的好转(图2). 最终确定各组成癌率: 异常黑胆质型肝癌病证模型组为100%(13/13), 对照肝癌组为42.9%(6/14)、高剂量ASM干预组为14.3%(3/14)、中剂量ASM干预组为27.8%(5/18)、低剂量ASM干预组为25%(2/8).
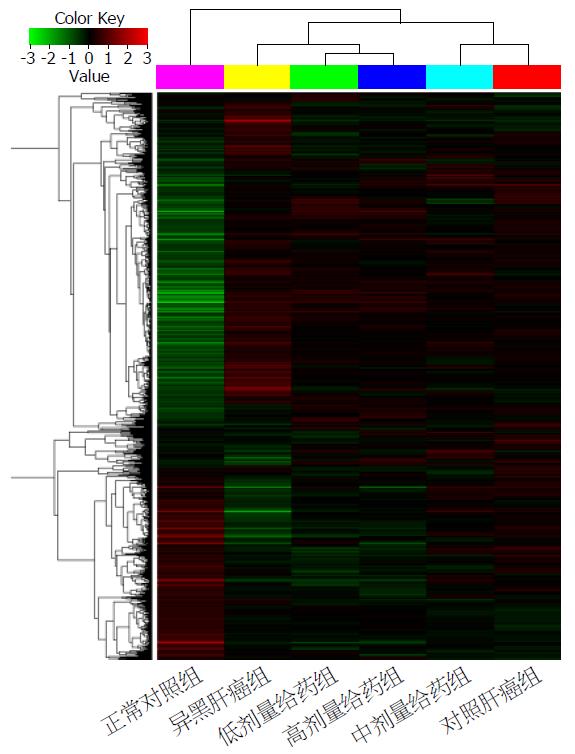
2.3.1 肝癌特异性上调, 下调表达候选基因的转录组学筛查研究: 利用SAM软件分析2倍以上表达差异的基因, 并使用Cluster软件进行分层聚类分析, 然后用TreeView软件可以制作聚类分析图. 经过在线数据库、查基因功能以及表达调控网络或途径分析, 上述差异表达候选基因主要是原癌基因、抑癌基因、细胞周期蛋白类、细胞信号、免疫相关蛋白及凋亡相关基因.
2.3.2 聚类分析图: 如图3, 横列, 不同肝组织标本; 纵排, 差异表达基因; 红色为表达上调基因; 绿色为表达下调. 其中红色、绿色和叠加色表示差异表达情况.
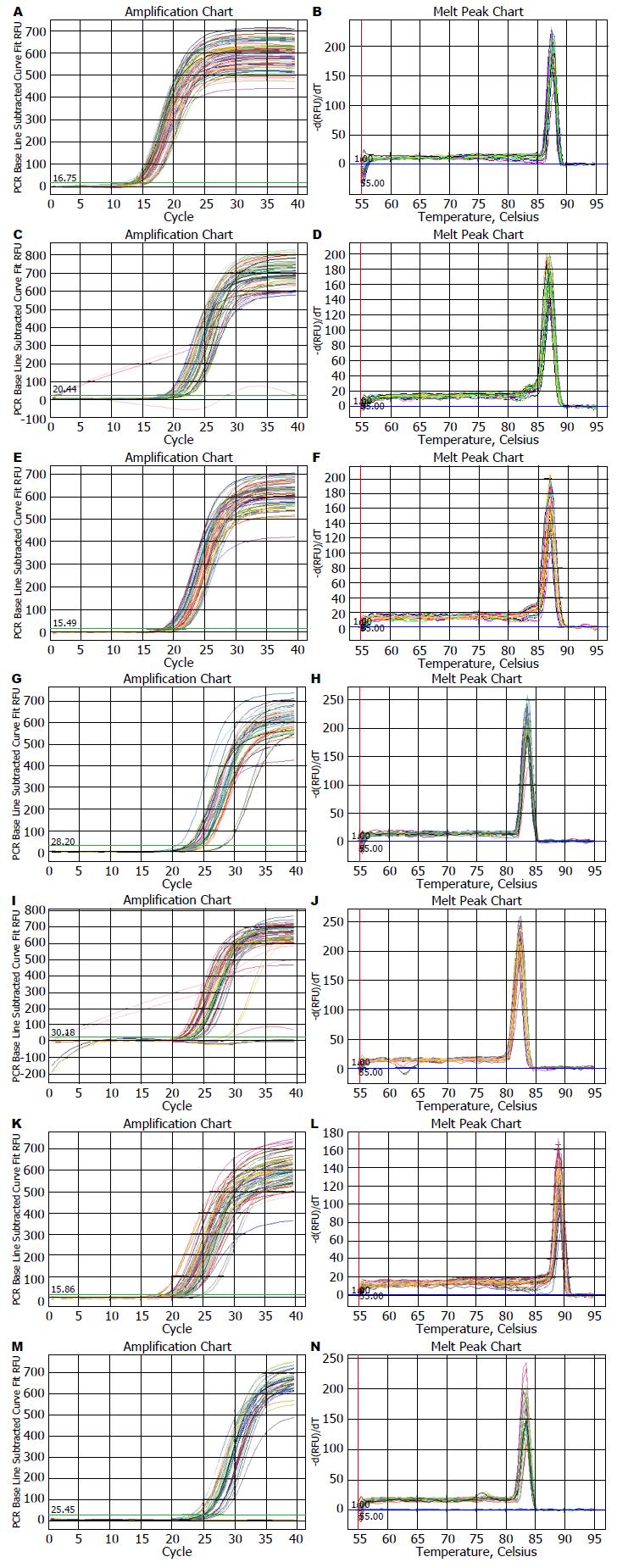
结果指出, 扩增曲线(图4A, C, E, G, I, K, M)图中可见所有样品均已进入平台期, 说明反应条件设定准确. 从溶解曲线图中可以看出(图4B, D, F, H, J, L, N)都是单峰, 未见杂峰, 扩增产物是单一的. 说明这6种基因所选的荧光定量PCR引物具有特异性(表3).
| 分组 | n | STAT3 | Cyclin D1 | EGLN3 | EMP1 | NEFL | IGFALS |
| 正常对照组 | 8 | 1.23±0.12 | 1.44±0.10 | 0.87±0.10 | 1.25±0.25 | 1.01±0.13 | 0.91±0.19 |
| 对照肝癌组 | 14 | 1.78±0.26 | 2.32±0.26a | 3.17±0.48b | 0.50±0.12a | 0.54±0.08a | 0.19±0.05a |
| 异黑肝癌组 | 13 | 3.09±0.24bc | 4.42±0.56bc | 4.11±0.55b | 0.30±0.06b | 0.17±0.12bc | 0.16±0.05b |
| 高剂量给药组 | 14 | 1.34±0.25f | 2.04±0.67e | 1.11±0.54cf | 0.81±0.10f | 0.73±0.19e | 0.38±0.08ae |
| 中剂量给药组 | 18 | 2.12±0.46 | 1.16±0.19cf | 1.05±0.30df | 0.37±0.04ag | 0.50±0.12a | 0.24±0.10a |
| 低剂量给药组 | 8 | 2.05±0.50be | 1.56±0.24f | 1.72±0.25acf | 0.46±0.11a | 0.35±0.07b | 0.18±0.03b |
维吾尔医学具有悠久的历史和较完整的理论体系以及丰富的实践经验和独特的理论内涵. 体液论作为维吾尔医辩证理论的精华, 体液在机体内连续地生成, 又一直被利用, 是人类各种生命活动提供能量的物质基础[6]. 人体是否健康, 与体液的平衡及正常密切相关. 临床研究[7]中发现, 恶性肿瘤中可以发现异常黑胆质型相比非异常黑胆质型更为普遍. ASM是维医临床上治疗异常黑胆质型肿瘤等疑难复杂性疾病常用的有效方剂, 具有抗肿瘤作用、抗血小板聚集、控制血流变性, 抗凋亡以及凝血等各种药理作用[8], 其治疗效果明显, 但其作用机制未知.
动物模型20 wk时异常黑胆质型肝癌病证模型组和对照肝癌组肝脏均发生癌变, 并且前者成癌率明显高于后者, 而ASM干预组成癌率明显低于异常黑胆质型肝癌病证模型组与前期研究结果[9]一致. 根据表达谱芯片结果确定候选基因, 并对STAT3、CyclinD1、EGLN3、EMP1、NEFL、IGFALS基因表达变化进行验证.
STAT3是JAK-STAT信号转导途径的重要环节[10], 在多种肝癌细胞系和肝癌组织中均高表达[11,12]. STAT3可以在许多环节参与肿瘤的免疫逃逸及调整, 将会是肿瘤免疫治疗及其新型抗肿瘤药物设计的一个有效的潜在靶标[13]. CyclinD1作为STAT3作用的一个下游基因, 参与细胞周期的调控与肿瘤的发生密切相关[14,15]. 在不同难治性肿瘤中发现CyclinD1基因的过表达[16,17]. 本研究结果显示, 上述两个基因在异常黑胆质型肝癌病证模型组中的表达水平最高, 与文献报道一致, 而不同剂量ASM组中不同程度降低, 并具有统计学意义(P<0.05, P<0.01).
脯氨酸羟化酶(EGLN3)属于亚铁离子和2-酮戊二酸依赖羟化酶家族, 是一个潜在的肿瘤抑制因子[18]. 尽管EGLs被认为是抑癌因子, 但其在不同类型和分化程度不同的肿瘤中表达有差别, 其家族每个成员的作用也有差异, 具体机制也不十分明确. EGLN3在非小细胞肺癌、胰腺癌、乳腺癌、结肠癌、头颈部鳞癌等许多肿瘤细胞和组织中, 有着不同程度的表达[19-21]. 本研究中EGLN3在异黑肝癌组中上调表达, 与文献报道结果一致, 而ASM干预组中明显降低. EGLN3虽然作为抑癌基因, 但在肿瘤组织中随着肿瘤的增长可能他的表达也随着上升. 为异常黑胆质成熟剂在临床应用提供用药理论指导和科学依据.
EMP1可编码一种含4段跨膜区域的糖蛋白, 参与涉及细胞周期调控、肿瘤形成、肿瘤细胞增殖及分化等多方面的细胞信号传导通路与肿瘤的发生发展关系密切[22]. 在胃癌、结肠癌, 乳腺癌, 前列腺癌等肿瘤组织中EMP1基因表达量明显低于正常组织[23-25]. 但对其在发病机制中的作用以及相关信号转导通路方面的研究比较少, 而且EMP1绝大多数文献中提示其可能是一种抑癌基因. 在本研究中发现EMP1基因mRNA表达量在异黑肝癌组中明显降低, 与文献报道一致, 而在不同剂量ASM干预组中有不同程度的升高. 该基因对异常黑胆质型肝癌的发生有何影响有待进一步研究, 也有可能异常黑胆质成熟剂治疗肝癌的作用点.
根据神经丝蛋白(neurofilaments, NFs)相对分子质量的不同, 分为NEFL、中链和重链3种多肽. NEFL可自我组装并且能调节其他神经丝蛋白的表达, 故其被认为是最重要的NFs. 位于染色体8p21[26], 与各器官的癌症有关. 被视为一个潜在的肿瘤抑制基因. 对NEFL蛋白的作用研究已主要限于神经系统疾病. 也有文献报道, NEFL在正常乳腺癌组织中不表达或极少表达[27,28], 在人脑星型胶质母细胞瘤中也是下调表达[29]. 在我们的研究中NEFL在异黑肝癌中表达降低, 与文献报道一致, 而在不同剂量ASM干预组中有不同程度的升高. NEFL的表达能诱导肿瘤凋亡, 与肿瘤的发生、发展、治疗等都有紧密的联系, 并有可能成为癌症早期筛查或判断预后的标志物, 这也可能为ASM作用提供靶点.
胰岛素样生长因子(insulin-like growth factor, IGF)系统主要由IGFs、IGF结合蛋白(insulin-like growth factor binding proteins, IGFBPs)以及IGFALS组成. IGFs系统对发育、生长和生殖都起着重要的调控作用. IGFALS是IGFs系统中的重要一员. 可以与IGFs、IGFBP3/5形成三聚体, 延长IGFs半衰期, 从而参与对IGFs的调控. IGFs在受体、结合蛋白和酸不稳定亚基的调节下, 通过自分泌、旁分泌和内分泌的方式作用于靶器官, 影响细胞的生长和分化, 并抑制细胞凋亡. 所以IGFALS在调节IGFs的生物功能方面具有重要作用[30,31]. 我们的研究中发现IGFALS基因在异黑肝癌组中下调表达而在ASM给药组中上调, 目前IGFALS基因在肿瘤组织中表达水平有关的报道尚未发现, Grandone等[32]发现IGFALS的杂合突变导致患者血清中GF1、IGFBP3和IGFALS水平降低. IGFALS基因与肝癌的发生发展具体有什么样的作用及影响在后续实验当中更进一步的研究.
总之, 在异常黑胆质型肝癌病证模型组中肝癌发生率最高, STAT3、CyclinD1、EGLN3等基因的表达水平上调, 而EMP1、NEFL、IGFALS等基因的表达水平下调. 在异常黑胆质成熟剂干预组中肝癌发生率明显降低, 上述基因的表达水平也有不同程度的恢复, 尤其是异黑肝癌高剂量ASM组. 因此, 本研究结果提示, ASM可能通过阻遏STAT3、CyclinD1、EGLN3等基因的表达, 而诱导EMP1、NEFL、IGFALS等基因的表达而起抗癌作用. ASM调控上述基因的作用机制在后续工作中需要深入研究.
通过表达谱芯片技术筛选出的差异表达候选基因主要是抑癌基因、细胞周期蛋白类、细胞信号及凋亡相关, 这些基因表达水平的研究在肝癌的发生和发展当中具有重要意义.
肝癌是在我国发病率排列第4位的恶性肿瘤, 寻找其发生发展及治疗的靶点是热点、重点, 异常黑胆质成熟剂(abnormal savda munziq, ASM)可以防止肝癌的发生发展, 但其作用机制尚不清楚.
国内外已证实STAT3、CyclinD1、EGLN3、EMP1、NEFL、IGFALS基因表达能诱导肿瘤凋亡, 与肿瘤的发生、发展、治疗等都有紧密的联系, 并有可能成为癌症早期筛查或判断预后的标志物.
本文以维吾尔医学体液论为基础及二乙基亚硝胺诱导建立异常黑胆质型肝癌病证大鼠模型, 并用ASM高、中、低不同剂量对模型组全程干预20 wk并通过RT-qPCR验证表达谱芯片筛选出的部分差异表达候选基因, 探讨ASM抗癌作用.
本研究结果提示, ASM可能通过调控STAT3、CyclinD1、EGLN3、EMP1、NEFL、IGFALS基因的表达而起抗癌作用, 因此为ASM今后的研究提供实验依据.
维吾尔医学体液论: 体液论是在四大物质和气质论的基础上产生的, 是维医的重要学说之一. 胆液质、血液质、黏液质、黑胆质等四种不同体液的知识是体液论的根本基础. 各体液之间呈现着相互制约相互补充的关系, 保持着相对平衡的状态;
异常黑胆质成熟剂(ASM): 由芹菜根、香青兰子、菊苣根、骆驼蓬子、茴芹果、罗勒子、黑种草子、蜀葵子、茴香根皮、菊苣子、香茅、甘草和洋甘菊等维药调制而成的复方制剂.
陈钟, 教授, 南通大学附属医院普外科, 南通大学肝胆外科研究所; 冯众一, 主任医师, 大连市友谊医院肝胆外一科; 金博, 主任医师, 解放军第309医院(总参谋部总医院)消化内科; 李铮, 教授, 西北大学; 祁兴顺, 主治医师, 沈阳军区总医院消化内科; 潘光栋, 主任医师, 柳州市人民医院肝胆外科; 朱继业, 教授, 主任医师, 博士生导师, 北京大学人民医院肝胆外科
本文研究了维医中的ASM药物对不同肝癌模型中基因表达水平的影响, 为这种药物的临床治疗寻找科学解释, 全文思路清晰, 内容具有一定的创新性, 对于拓展该药物的应用有指导意义.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 新疆维吾尔自治区
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C, C, C, C, C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:李瑞芳
| 1. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 3. | 阻力皮卡尔•阿卜杜热合曼, 哈木拉提•吾甫尔, 斯坎德尔•白克力, 那孜拉木•玉苏甫江, 古丽尼格尔•雪合拉提, 王延蛟. 异常黑胆质成熟剂对多因素诱发肝癌大鼠模型中P53和P21基因表达的影响. 新疆医科大学学报. 2017;4:540-544. |
| 4. | 王延蛟, 热沙来提•阿不都瓦衣特, 哈木拉提•吾甫尔, 热斯拉特•艾力木, 阿尤甫江•阿布都热依木, 斯坎德尔•白克力. 异常黑胆质成熟剂对异常黑胆质型肝癌病证大鼠模型肝脏形态学的影响. 科技导报. 2015;33:84-89. |
| 6. | 哈木拉提•吾甫尔. 维吾尔医气质, 体液论及其现代研究. 乌鲁木齐: 新疆科学技术出版社 2003; 34-37, 131-133. |
| 7. | 张莉, 哈木拉提•吾甫尔, 玛依努尔•艾力, 阿依努尔•麦提斯迪克, 张建清. 恶性肿瘤的维医分型及其神经内分泌免疫网络紊乱研究. 中国中医基础医学杂志. 2008;14:119-121. |
| 9. | 王延蛟, 哈木拉提•吾甫尔, 依马木•买买提依明, 热斯拉特•艾力木, 阿尤甫江•阿布都热依木, 斯坎德尔•白克力. 异常黑胆质型肝癌病证模型肝脏形态学研究. 科技导报. 2014;32:74-78. |
| 10. | Niu G, Bowman T, Huang M, Shivers S, Reintgen D, Daud A, Chang A, Kraker A, Jove R, Yu H. Roles of activated Src and Stat3 signaling in melanoma tumor cell growth. Oncogene. 2002;21:7001-7010. [PubMed] [DOI] |
| 12. | Lirdprapamongkol K, Sakurai H, Abdelhamed S, Yokoyama S, Athikomkulchai S, Viriyaroj A, Awale S, Ruchirawat S, Svasti J, Saiki I. Chrysin overcomes TRAIL resistance of cancer cells through Mcl-1 downregulation by inhibiting STAT3 phosphorylation. Int J Oncol. 2013;43:329-337. [PubMed] [DOI] |
| 13. | Lee H, Pal SK, Reckamp K, Figlin RA, Yu H. STAT3: a target to enhance antitumor immune response. Curr Top Microbiol Immunol. 2011;344:41-59. [PubMed] [DOI] |
| 15. | Luo KJ, Hu Y, Wen J, Fu JH. CyclinD1, p53, E-cadherin, and VEGF discordant expression in paired regional metastatic lymph nodes of esophageal squamous cell carcinoma: a tissue array analysis. J Surg Oncol. 2011;104:236-243. [PubMed] [DOI] |
| 18. | Su C, Huang K, Sun L, Yang D, Zheng H, Gao C, Tong J, Zhang Q. Overexpression of the HIF hydroxylase PHD3 is a favorable prognosticator for gastric cancer. Med Oncol. 2012;29:2710-2715. [PubMed] [DOI] |
| 19. | Andersen S, Donnem T, Stenvold H, Al-Saad S, Al-Shibli K, Busund LT, Bremnes RM. Overexpression of the HIF hydroxylases PHD1, PHD2, PHD3 and FIH are individually and collectively unfavorable prognosticators for NSCLC survival. PLoS One. 2011;6:e23847. [PubMed] [DOI] |
| 20. | Chen S, Zhang J, Li X, Luo X, Fang J, Chen H. The expression of prolyl hydroxylase domain enzymes are up-regulated and negatively correlated with Bcl-2 in non-small cell lung cancer. Mol Cell Biochem. 2011;358:257-263. [PubMed] [DOI] |
| 21. | Peurala E, Koivunen P, Bloigu R, Haapasaari KM, Jukkola-Vuorinen A. Expressions of individual PHDs associate with good prognostic factors and increased proliferation in breast cancer patients. Breast Cancer Res Treat. 2012;133:179-188. [PubMed] [DOI] |
| 22. | Sun GG, Wang YD, Cui DW, Cheng YJ, Hu WN. Epithelial membrane protein 1 negatively regulates cell growth and metastasis in colorectal carcinoma. World J Gastroenterol. 2014;20:4001-4010. [PubMed] [DOI] |
| 23. | Sun G, Zhao G, Lu Y, Wang Y, Yang C. Association of EMP1 with gastric carcinoma invasion, survival and prognosis. Int J Oncol. 2014;45:1091-1098. [PubMed] [DOI] |
| 24. | Sun GG, Wang YD, Lu YF, Hu WN. EMP1, a member of a new family of antiproliferative genes in breast carcinoma. Tumour Biol. 2014;35:3347-3354. [PubMed] [DOI] |
| 25. | Sun GG, Wang YD, Cui DW, Cheng YJ, Hu WN. EMP1 regulates caspase-9 and VEGFC expression and suppresses prostate cancer cell proliferation and invasion. Tumour Biol. 2014;35:3455-3462. [PubMed] [DOI] |
| 26. | Imbert A, Chaffanet M, Essioux L, Noguchi T, Adélaïde J, Kerangueven F, Le Paslier D, Bonaïti-Pellié C, Sobol H, Birnbaum D. Integrated map of the chromosome 8p12-p21 region, a region involved in human cancers and Werner syndrome. Genomics. 1996;32:29-38. [PubMed] [DOI] |
| 27. | Li XQ, Li L, Xiao CH, Feng YM. NEFL mRNA expression level is a prognostic factor for early-stage breast cancer patients. PLoS One. 2012;7:e31146. [PubMed] [DOI] |
| 28. | Kang S, Kim B, Park SB, Jeong G, Kang HS, Liu R, Kim SJ. Stage-specific methylome screen identifies that NEFL is downregulated by promoter hypermethylation in breast cancer. Int J Oncol. 2013;43:1659-1665. [PubMed] [DOI] |
| 29. | Peng G, Yuan X, Yuan J, Liu Q, Dai M, Shen C, Ma J, Liao Y, Jiang W. miR-25 promotes glioblastoma cell proliferation and invasion by directly targeting NEFL. Mol Cell Biochem. 2015;409:103-111. [PubMed] [DOI] |
| 31. | 郑 凯迪. 斑马鱼Igfals的表达、转录调控及功能研究. 重庆: 西南大学 2010; 12-14. |
| 32. | Grandone A, Miraglia del Giudice E, Cirillo G, Abbondanza C, Cioffi M, Romano T, Micillo F, Marzuillo P, Perrone L. Clinical features of a new acid-labile subunit (IGFALS) heterozygous mutation: anthropometric and biochemical characterization and response to growth hormone administration. Horm Res Paediatr. 2014;81:67-72. [PubMed] [DOI] |