修回日期: 2017-08-05
接受日期: 2017-08-16
在线出版日期: 2017-09-08
观察当归补血汤有效组分及其配伍对大鼠肝星状细胞(hepatic stellate cell, HSC)-T6转化生长因子β1(transforming growth factor-β1, TGF-β1)/Smad信号通路的调控作用.
当归的有效成分阿魏酸、黄芪的有效成分黄芪甲苷单独应用及联合处理HSC-T6细胞24 h, 收集细胞, Western blot检测HSC-T6细胞Ⅲ型胶原蛋白、Smad4和Smad7蛋白表达, 实时定量PCR检测HSC-T6细胞Smad3和Ⅱ型TGF-β1受体mRNA表达.
阿魏酸显著抑制HSC-T6细胞中Ⅲ型胶原蛋白和Smad4蛋白表达(均P<0.05), 抑制Smad3和Ⅱ型TGF-β1受体mRNA表达(均P<0.05), 对Smad7蛋白表达无显著性影响(P>0.05), 黄芪甲苷对这些指标均无显著性影响(均P>0.05). 与阿魏酸单独处理组比较, 联合处理的作用效果无显著性提高(均P>0.05).
当归补血汤的有效组分阿魏酸通过TGF-β1/Smad信号通路抑制了肝星状细胞Ⅲ型胶原蛋白表达.
核心提要: 临床研究发现当归补血汤在改善机体纤维化方面疗效显著, 我们研究发现当归补血汤有效组分配伍具有抑制肝星状细胞转化生长因子β1/Smad信号通路的作用, 阿魏酸是调控该通路的主要有效组分, 这些发现对当归补血汤的二次开发具有重大意义.
引文著录: 于春磊, 邹宇, 孙晓杰, 牛英才. 当归补血汤有效组分及其配伍对肝星状细胞TGF-β1/Smad信号通路的调控作用. 世界华人消化杂志 2017; 25(25): 2275-2280
Revised: August 5, 2017
Accepted: August 16, 2017
Published online: September 8, 2017
To investigate if the compatibility of active components of Danggui Buxue decoction can regulate the transforming growth factor-β1 (TGF-β1)/Smad signaling pathway in hepatic stellate cell (HSC)-T6 cells.
HSC-T6 cells were treated with astragaloside Ⅳand/or ferulic acid for 24 h. Protein expression of type Ⅲ collagen, Smad4, and Smad7 was analyzed by Western blot. Messenger RNA expression of Smad3 and TGF-β1 type Ⅱ receptor was analyzed by real-time polymerase chain reaction.
Ferulic acid, but not astragaloside Ⅳ, inhibited the protein expression of type Ⅲ collagen and Smad4 (P < 0.05), down-regulated the mRNA expression of Smad3 and TGF-β1 type Ⅱ receptor (P < 0.05), but did not significantly modify Smad7 protein expression in HSC-T6 cells (P > 0.05). The combination treatment of ferulic acid and astragaloside Ⅳ failed to cause a greater inhibitory effect than ferulic acid alone (P > 0.05).
Ferulic acid, an active component of Danggui Buxue decoction, inhibits type Ⅲ collagen expression through inhibition of the TGF-β1/Smad pathway in HSC-T6 cells.
- Citation: Yu CL, Zou Y, Sun XJ, Niu YC. Ferulic acid is an active component of Danggui Buxue decoction to regulate TGF-β1/Smad signaling pathway in hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2017; 25(25): 2275-2280
- URL: https://www.wjgnet.com/1009-3079/full/v25/i25/2275.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i25.2275
当归补血汤为金代医家李东垣所创之经典方剂, 由健脾益气的黄芪和养血活血的当归组成, 广泛用于肝纤维化等多种疾病的治疗[1,2]. 黄芪与当归配伍的"黄芪当归合剂"有良好抗肾纤维化作用[3]. 我们前期研究发现, 黄芪甲苷和阿魏酸可能是当归补血汤中抑制肝星状细胞(hepatic stellate cell, HSC)活化的有效组分[4,5], 其配伍使用具有协同作用[6]. 肝纤维化是大多慢性肝脏疾病的共同病理过程, HSC激活是肝纤维化的中心环节[7], 转化生长因子-β1(transforming growth factor-β1, TGF-β1)可激活HSC和促进细胞外基质过度沉积, 被认为是肝纤维化中最关键的因素[8]. 而作为TGF-β1唯一的受体后蛋白, Smad在肝纤维化过程中发挥着重要作用[9], Smad3活化TGF-β1/Smad信号通路[10], Smad4主要同Smad3结合, 是TGF-β1信号传导必需的中转分子[11], 而Smad7对TGF-β1信号传递起负性调控作用[12]. 本研究以黄芪甲苷和阿魏酸配伍组成精简组分方剂, 观察其单独应用及配伍对TGF-β1/Smad信号通路的调控作用, 从而为当归补血汤的二次开发和临床应用提供科学依据.
(1)细胞株: HSC-T6由中国医学科学院肿瘤医院肿瘤研究所提供; (2)药物: 阿魏酸(批号: JZ131210A)和黄芪甲苷(批号: JZ140508)购自南京景竹生物科技有限公司; (3)试剂: 胎牛血清(批号: NYE0873)和DMEM培养液(批号: NAD1364)购自Thermo公司; 细胞核蛋白与细胞浆蛋白抽提试剂盒(产品编号: P0028)购自碧云天公司; Smad4抗体(批号: 0004)购自Cell signaling公司; COL3A1抗体(批号: H1715)购自Santa Cruz公司; Smad7抗体(批号: F1016)购自Santa Cruz公司; 二抗(批号: 00051405)和GAPDH抗体(批号: 00111407)购自康为世纪公司; ECL超敏发光检测试剂盒(批号: 20140303)购自Solarbi公司; TRIzol Reagent(批号: 47323)购自Ambion公司; SYBR premix Ex Taq™ kit(批号: AK2603)和primeScript™ RT reagent kit(批号: BK4001)购自TakaRa宝生物工程大连有限公司. 引物由上海生工生物公司合成, 引物TGF-β1 Ⅱ型受体: 上游引物: 5'-CTACAAGGCCAAGCTGAAGC-3', 下游引物: 5'-AGCCATGGAGTAGACATCCG-3'; 引物Smad3: 上游引物: 5'-CTGGCTACCTGAGTGAAGATG-3', 下游引物: 5'-TGTGAAGCGTGGAATGTCTC-3'; 引物GAPDH: 上游引物: 5'-GACAACTTTGGCATCGTGGA-3', 下游引物: 5'-ATGCAGGGATGATGTTCTGG-3'. (4)仪器: Forma 88000超低温冰箱(美国Thermo Scientific公司); CKX41型倒置显微镜(OLYMPUS公司); BSC-1300IIA2型生物安全柜(苏州安泰空气技术有限公司); 5417R型离心机(eppendorf公司); 3111型二氧化碳培养箱(Thermo Scientific公司); XPE504分析天平(Mettler Toledo公司); Smart Chemi™ Image Analysis System(北京赛智创业科技有限公司); JY-ZY5电泳槽和JY200C电泳仪(北京君意东方电泳设备有限公司); HL-2000分子杂交箱(美国UVP公司); S1000™ Thermal Cycler(BIO-RAD公司); Stratagene Mx3005P Real-time PCR仪(Agilent公司); ELX800全自动酶标仪(BioTek公司).
1.2.1 细胞培养及药物处理: 在37 ℃、50 mL/L CO2饱和湿度条件下, 大鼠HSC-T6细胞置于含10%小牛血清和青链霉素混合液的DMEM培养液培养, 待细胞长至70%-80%密度时进行传代. 实验共分为4组: 空白对照组、黄芪甲苷单独处理组、阿魏酸单独处理组、阿魏酸和黄芪甲苷联合处理组, 药物处理24 h后收集细胞进行相关指标的检测. 所有实验均采用对数生长期的细胞. 黄芪甲苷(终浓度为2 μmol/L)和阿魏酸(终浓度为4 μmol/L)均溶于二甲基亚砜(dimethyl sulfoxide, DMSO).
1.2.2 Western blot检测: 采用细胞核蛋白与细胞浆蛋白抽提试剂盒提取HSC-T6细胞蛋白质, 蛋白质热变性后经SDS-PAGE分离并转印到硝酸纤维素膜上, 5%脱脂牛奶和TBST混合液室温封闭硝酸纤维素膜膜2 h, TBST洗膜. 加入COL3A1、Smad4和Smad7抗体杂交液4 ℃孵育过夜. TBST洗膜, 加入HRP偶联二抗37 ℃孵育1.5 h, TBST洗涤后置于发光液中在暗室压片曝光, 显影, 定影. 图像分析软件分析印迹条带的积分光密度.
1.2.3 实时定量PCR检测: 经典TRIzol-氯仿法抽提HSC-T6细胞总RNA. 以提取的总RNA为模板, 按primeScript™ RT reagent kit说明书进行逆转录反应, 合成cDNA第一链. 采用SYBR Green法在Mx3005P实时定量PCR系统上进行PCR反应. 以GAPDH作为内参基因, Smad3和Ⅱ型TGF-β1受体的mRNA表达水平采用2-△△Ct法进行相对定量分析.
统计学处理 采用SPSS13.0软件进行统计分析, 所有数据以mean±SD形式表示, 组间比较采用单因素方差分析和SNK-q检验. P<0.05为差异存在统计学意义.
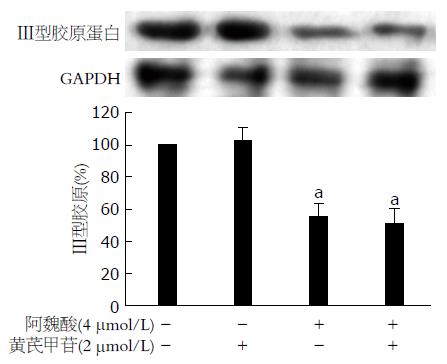
Western blot检测结果显示: 与空白对照组比较, 4 μmol/L阿魏酸显著减少HSC-T6细胞中Ⅲ型胶原蛋白表达(P<0.05), 2 μmol/L黄芪甲苷对HSC-T6细胞中Ⅲ型胶原蛋白表达无显著性影响(P>0.05). 黄芪甲苷和阿魏酸联合应用下调HSC-T6细胞Ⅲ型胶原蛋白表达的效应与阿魏酸单独应用相当(P>0.05, 图1).
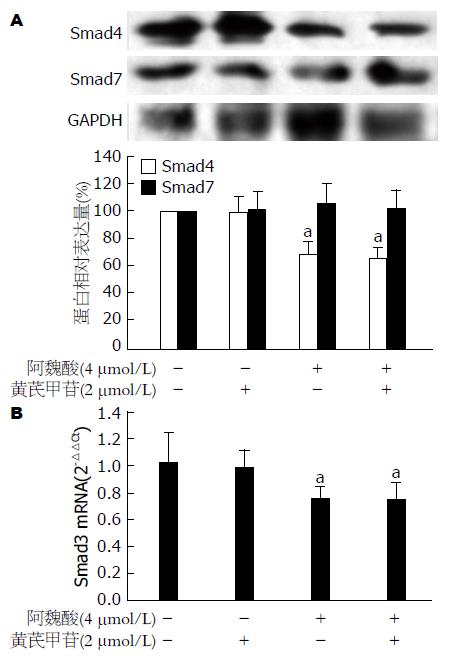
Western blot和PCR结果显示: 与空白对照组比较, 4 μmol/L阿魏酸显著减少HSC-T6细胞Smad4蛋白和Smad3 mRNA表达(均P<0.05), 2 μmol/L黄芪甲苷对HSC-T6细胞Smad4蛋白和Smad3 mRNA表达无显著性影响(均P>0.05). 黄芪甲苷和阿魏酸联合应用抑制HSC-T6细胞Smad4蛋白和Smad3 mRNA表达的效应与阿魏酸单独应用相当(均P>0.05). 而黄芪甲苷单独处理、阿魏酸单独处理或黄芪甲苷和阿魏酸联合处理对Smad7蛋白表达均无显著性差异(均P>0.05, 图2).
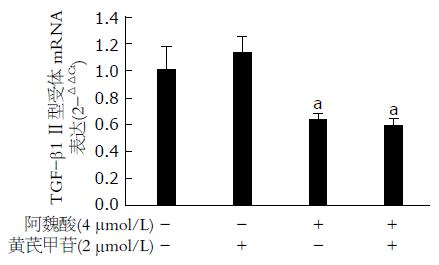
PCR结果显示: 与空白对照组比较, 4 μmol/L阿魏酸显著减少HSC-T6细胞Ⅱ型TGF-β1受体的mRNA表达(P<0.05), 2 μmol/L黄芪甲苷对HSC-T6细胞Ⅱ型TGF-β1受体的mRNA表达表达无显著性影响(P>0.05). 黄芪甲苷和阿魏酸联合应用抑制HSC-T6细胞Ⅱ型TGF-β1受体mRNA表达的效应与阿魏酸单独应用相当(P>0.05, 图3).
肝纤维化是肝脏对多种慢性损伤的病理修复反应, 是多数慢性肝病的共同病理特征, 以肝脏细胞外基质过度沉积为特征[7,13]. 临床和实验研究[3,14]发现当归补血汤在改善机体纤维化方面疗效显著. 目前国内对当归补血汤复方作用机制研究较为深入[15], 相继研制成功了当归补血口服液等新制剂, 取得了较好的经济效益和社会效益, 而对当归补血汤的有效成分和配伍机制研究仍然薄弱[16]. 本研究显示当归补血组分中药中阿魏酸组分显著抑制了HSC-T6细胞中Ⅲ型胶原、Smad4、Smad3和Ⅱ型TGF-β1受体表达. 而另一组分黄芪甲苷对这些指标无显著性影响, 黄芪甲苷对阿魏酸的这些抑制作用也无显著性提高效应.
肝纤维化是一个复杂的过程, TGF-β1/Smad信号通路在其发生发展有着重要的作用[8,17]. TGF-β超家族是一类具有旁分泌和自分泌作用的细胞因子[18], TGF-β1的生理和病理效应由靶细胞膜特异性受体TGF-β1 Ⅰ型受体和TGF-β1 Ⅱ型受体介导[19]. TGF-β1 Ⅰ型受体须在TGF-β1 Ⅱ型受体存在条件下才能与TGF-β1结合[20], 而TGF-β1 Ⅱ型受体依赖TGF-β1 Ⅰ型受体传递信号[21]. Smad蛋白是TGF-β1受体胞内底物, 介导TGF-β1的胞内信号转导[22], 是TGF-β1信号从受体到核的细胞内转导分子[11]. Smad蛋白可分为3类: Smad1、2、3、5和8为膜受体激活的Smad[23], 其中Smad2和3参与TGF-β1信号通路的激活[24]. Smad 4为通用Smad, Smad 6和7为抑制性Smad, 是TGF-β1/Smad信号通路的抑制分子[25]. 本研究结果显示, 当归补血汤有效组分调节了Ⅱ型TGF-β1受体、Smad4和Smad3等分子, 本研究结果与我们以前的研究结果在基因的转录和翻译水平显示[6], TGF-β1/Smad信号通路介导当归补血汤抑制HSC胶原产生.
中药复方在长期的发展中形成了自己特有的组方理论和方法, 从现代医药学角度如何理解中药复方配伍规律及如何科学评价中药复方的多靶点作用是一个令人困扰的问题[26]. 中药复方不仅可以用中医药理论阐述清楚, 也能用现代药理学的语言解释明白. 目前, "组分中药"尚存在诸多学术争议, 如从中药材提取出来的有效组分是否能代表原来的中药材[27]. 但是, 由于组分中药的化学物质基本清楚、质量可控, 药理和毒理明确[28], 复方组分中药较传统复方距离中医药现代化和国际化的目标更接近[27]. 我们在前期研究中, 取黄芪的活性成分黄芪甲苷和当归的有效成分阿魏酸, 通过利用中效原理(Chou-Talalay联合指数法)优选了黄芪甲苷和阿魏酸配伍剂量, 组成当归补血汤有效组分方剂[6]. 本研究发现, 当归补血汤有效组分中, 阿魏酸是抑制HSC细胞TGF-β1/Smad信号通路的组分, 黄芪甲苷的作用靶点有待将来进一步研究.
"药有个性之特长, 方有合群之妙用", 组分中药与其他类型药物相比, 最突出的特点是配伍, 也是"组分中药"研究的核心内容[29]. 我们选择药少力专、具有良好临床基础的当归补血为研究对象, 开展组分配伍机制研究, 这对当归补血汤的二次开发以提高其有效性及安全性具有重大意义. TGF-β1/Smad在人体内具有多种生物学效应, 药物在抑制TGF-β1/Smad信号传导通路防治肝纤维化的同时, 可能会引发人体其他不良反应[30]. 因此, 当归补血组分中药的不良反应也需要进一步研究.
总之, 当归补血汤有效组分配伍具有抑制HSC细胞TGF-β1/Smad信号通路的作用, 阿魏酸是调控该通路的主要有效组分. 我们前期研究发现阿魏酸和黄芪甲苷具有协同抑制HSC活化的作用, 黄芪甲苷调控的信号通路还需要进一步研究. 本研究为阿魏酸和黄芪甲苷配伍治疗肝纤维化提供实验依据.
中药复方在长期的发展中形成了自己特有的组方理论和方法, 从现代医药学角度如何理解中药复方配伍规律是一个令人困扰的问题, 开展当归补血汤组分配伍抗肝纤维化的机制研究, 对中药配伍规律研究具有示范意义.
转化生长因子β1(transforming growth factor-β1, TGF-β1)/Smad信号通路在肝纤维化的发生发展有着重要的作用, 调控TGF-β1/Smad信号通路是防治肝纤维化研究的热点, 虽然当归补血汤治疗肝纤维化具有良好的临床基础, 但TGF-β1/Smad信号通路在当归补血汤组分配伍抑制肝纤维化中的作用尚不清楚.
当归补血汤广泛用于肝纤维化等多种疾病的治疗. 孟立强等研究发现, 黄芪与当归配伍的"黄芪当归合剂"有良好抗肾纤维化作用, Dong等研究发现黄芪甲苷和阿魏酸可能是当归补血汤中抑制肝星状细胞活化的有效组分.
本研究第一次发现当归补血汤有效组分配伍具有抑制HSC细胞TGF-β1/Smad信号通路的作用, 阿魏酸是调控该通路的主要有效组分.
在当归补血口服液等制剂已广泛应用于临床, 而对当归补血汤的有效成分和配伍机制进行深入研究, 不仅用现代药理学语言解释当归和黄芪的中医药配伍理论, 而且对当归补血汤的二次开发以提高其有效性及安全性具有重要意义.
组分配伍: 在中药药效组分理论指导下, 在传统经方、验方基础上对中药有效成分配伍而成的中药新药.
刘绍能, 主任医师, 中国中医科学院广安门医院消化科; 鲁玉辉, 教授, 福建中医药大学中医学院; 秦臻, 副教授, 贵州医科大学
本文实验设计严谨, 研究方法合理, 语言逻辑性较好, 在中医药干预肝纤维化机制研究方面具有较好的创新性.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 黑龙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:李瑞芳
| 1. | 魏 明刚, 何 伟明, 刘 蔚, 顾 冬梅, 李 凤玲, 陆 迅, 张 新苹, 杨 彦裕, 孙 伟. 加味当归补血汤抗肾脏纤维化的实验研究. 中国中医基础医学杂志. 2014;20:904-908. |
| 2. | Zhao MM, Zhang Y, Li LS, Yu ZK, Li B. Efficacy and safety of Danggui Buxue Decoction in combination with western medicine treatment of anemia for renal anemia: a systematic review and meta-analysis. Ann Transl Med. 2017;5:136. [PubMed] [DOI] |
| 4. | Li X, Wang X, Han C, Wang X, Xing G, Zhou L, Li G, Niu Y. Astragaloside IV suppresses collagen production of activated hepatic stellate cells via oxidative stress-mediated p38 MAPK pathway. Free Radic Biol Med. 2013;60:168-176. [PubMed] [DOI] |
| 5. | Xu T, Pan Z, Dong M, Yu C, Niu Y. Ferulic acid suppresses activation of hepatic stellate cells through ERK1/2 and Smad signaling pathways in vitro. Biochem Pharmacol. 2015;93:49-58. [PubMed] [DOI] |
| 6. | Dong H, Guo H, Liang Y, Wang X, Niu Y. Astragaloside IV synergizes with ferulic acid to suppress hepatic stellate cells activation in vitro. Free Radic Res. 2017;51:167-178. [PubMed] [DOI] |
| 7. | Huang Y, Deng X, Liang J. Modulation of hepatic stellate cells and reversibility of hepatic fibrosis. Exp Cell Res. 2017;352:420-426. [PubMed] [DOI] |
| 8. | Wang P, Deng L, Zhuang C, Cheng C, Xu K. p-CREB-1 promotes hepatic fibrosis through the transactivation of transforming growth factor-β1 expression in rats. Int J Mol Med. 2016;38:521-528. [PubMed] [DOI] |
| 9. | Tang LY, Heller M, Meng Z, Yu LR, Tang Y, Zhou M, Zhang YE. Transforming Growth Factor-β (TGF-β) Directly Activates the JAK1-STAT3 Axis to Induce Hepatic Fibrosis in Coordination with the SMAD Pathway. J Biol Chem. 2017;292:4302-4312. [PubMed] [DOI] |
| 10. | Murata M, Yoshida K, Yamaguchi T, Matsuzaki K. Linker phosphorylation of Smad3 promotes fibro-carcinogenesis in chronic viral hepatitis of hepatocellular carcinoma. World J Gastroenterol. 2014;20:15018-15027. [PubMed] [DOI] |
| 11. | Khanizadeh S, Ravanshad M, Hosseini S, Davoodian P, Nejati Zadeh A, Sarvari J. Blocking of SMAD4 expression by shRNA effectively inhibits fibrogenesis of human hepatic stellate cells. Gastroenterol Hepatol Bed Bench. 2015;8:262-269. [PubMed] |
| 12. | Lei XF, Fu W, Kim-Kaneyama JR, Omoto T, Miyazaki T, Li B, Miyazaki A. Hic-5 deficiency attenuates the activation of hepatic stellate cells and liver fibrosis through upregulation of Smad7 in mice. J Hepatol. 2016;64:110-117. [PubMed] [DOI] |
| 13. | Sitanggang EJ, Antarianto RD, Jusman SWA, Pawitan JA, Jusuf AA. Bone Marrow Stem Cells Anti-liver Fibrosis Potency: Inhibition of Hepatic Stellate Cells Activity and Extracellular Matrix Deposition. Int J Stem Cells. 2017;10:69-75. [PubMed] [DOI] |
| 15. | Lin HQ, Gong AG, Wang HY, Duan R, Dong TT, Zhao KJ, Tsim KW. Danggui Buxue Tang (Astragali Radix and Angelicae Sinensis Radix) for menopausal symptoms: A review. J Ethnopharmacol. 2017;199:205-210. [PubMed] [DOI] |
| 17. | Zhang X, Zhang J, Jia L, Xiao S. Dicliptera Chinensis polysaccharides target TGF-β/Smad pathway and inhibit stellate cells activation in rats with dimethylnitrosamine-induced hepatic fibrosis. Cell Mol Biol (Noisy-le-grand). 2016;62:99-103. [PubMed] |
| 18. | Meng XM, Nikolic-Paterson DJ, Lan HY. TGF-β: the master regulator of fibrosis. Nat Rev Nephrol. 2016;12:325-338. [PubMed] [DOI] |
| 19. | Kamato D, Burch ML, Piva TJ, Rezaei HB, Rostam MA, Xu S, Zheng W, Little PJ, Osman N. Transforming growth factor-β signalling: role and consequences of Smad linker region phosphorylation. Cell Signal. 2013;25:2017-2024. [PubMed] [DOI] |
| 20. | Yuan W, Liu W, Cai H, Sun X, Yang D, Xu F, Jin C. SB-431542, a specific inhibitor of the TGF-β type I receptor inhibits hypoxia-induced proliferation of pulmonary artery adventitial fibroblasts. Pharmazie. 2016;71:94-100. [PubMed] |
| 21. | Sousa Vde O, Almeida JC, Eller CM, Gomes FC. Characterization of TGF-beta1 type II receptor expression in cultured cortical astrocytes. In Vitro Cell Dev Biol Anim. 2006;42:171-175. [PubMed] [DOI] |
| 22. | Park SJ, Choi YS, Lee S, Lee YJ, Hong S, Han S, Kim BC. BIX02189 inhibits TGF-β1-induced lung cancer cell metastasis by directly targeting TGF-β type I receptor. Cancer Lett. 2016;381:314-322. [PubMed] [DOI] |
| 23. | Ko JW, Shin NR, Park SH, Kim JS, Cho YK, Kim JC, Shin IS, Shin DH. Pine bark extract (Pycnogenol®) suppresses cigarette smoke-induced fibrotic response via transforming growth factor-β1/Smad family member 2/3 signaling. Lab Anim Res. 2017;33:76-83. [PubMed] [DOI] |
| 24. | Lakshmi SP, Reddy AT, Reddy RC. Transforming growth factor β suppresses peroxisome proliferator-activated receptor γ expression via both SMAD binding and novel TGF-β inhibitory elements. Biochem J. 2017;474:1531-1546. [PubMed] [DOI] |
| 25. | Xu F, Liu C, Zhou D, Zhang L. TGF-β/SMAD Pathway and Its Regulation in Hepatic Fibrosis. J Histochem Cytochem. 2016;64:157-167. [PubMed] [DOI] |
| 28. | Jin Y, Qu C, Tang Y, Pang H, Liu L, Zhu Z, Shang E, Huang S, Sun D, Duan JA. Herb pairs containing Angelicae Sinensis Radix (Danggui): A review of bio-active constituents and compatibility effects. J Ethnopharmacol. 2016;181:158-171. [PubMed] [DOI] |
| 30. | Macias MJ, Martin-Malpartida P, Massagué J. Structural determinants of Smad function in TGF-β signaling. Trends Biochem Sci. 2015;40:296-308. [PubMed] [DOI] |