修回日期: 2017-04-18
接受日期: 2017-04-24
在线出版日期: 2017-09-08
随着人们对早期胃癌的认识的深入, 在追求肿瘤根治的同时, 越来越兼顾患者的术后生活质量, 功能保留的胃切除术应运而生. 其应遵循以下三个基本原则: (1)尽可能多地保留残胃的体积; (2)需保留贲门或幽门的功能; (3)尽量保留迷走神经的功能. 功能保留的胃切除术包括幽门保留胃切除术、联合不同重建方式的近端胃切除术、近次全胃切除术、节段胃切除术及部分胃切除术, 而前哨淋巴结活检技术的临床有效性尚待于进一步证实. 精准的术前诊断及定位是开展功能保留的胃切除术的前提.
核心提要: 早期胃癌远期治疗效果好, 可以开展功能保留的胃切除术, 包括幽门保留胃切除术、联合不同重建方式的近端胃切除术、近次全胃切除术、节段胃切除术及部分胃切除术, 精准的术前诊断及定位是开展功能保留胃切除术的前提.
引文著录: 蒋小华. 早期胃癌功能保留的胃外科手术进展与展望. 世界华人消化杂志 2017; 25(25): 2241-2248
Revised: April 18, 2017
Accepted: April 24, 2017
Published online: September 8, 2017
With the increasing understanding of early gastric cancer, besides the pursuit of radical tumor resection, more attention is focused on patients' quality of life after surgery. Thus, function-preserving gastrectomies emerge. Function-preserving gastrectomies should follow the following three basic principles: (1) retaining the volume of residual stomach as much as possible; (2) retaining the function of the cardia or pylorus; and (3) retaining the function of the vagus nerve. Function-preserving gastrectomies include pylorus-preserving gastrectomy, proximal gastrectomy combined with different reconstruction methods, near-total gastrectomy, segmental gastrectomy, and partial gastrectomy. The effectiveness of sentinel lymph node biopsy is still to be confirmed. Accurate preoperative diagnosis and localization are the precondition of function-preserving gastrectomy.
- Citation: Jiang XH. Progress and prospects of function-preserving gastric surgeries for early gastric cancer. Shijie Huaren Xiaohua Zazhi 2017; 25(25): 2241-2248
- URL: https://www.wjgnet.com/1009-3079/full/v25/i25/2241.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i25.2241
根据中国最新癌症数据统计, 我国胃癌的发病率及死亡率均高居第2位, 仅次于肺癌[1]. 在日本及韩国, 早期胃癌已占据所有胃癌的70%以上[2], 而我国早期胃癌所占的比例在10%以下, 在少数大的医学中心能达到20%[3]. 早期胃癌的治疗效果较好, 5年生存率在90%以上. 所以, 对于早期胃癌患者, 在根治肿瘤的同时, 如何减少创伤、提高患者的生活质量成为研究的重点. 在日本及韩国, 早期胃癌已不需做根治性D2手术, 而代之以D1+手术[4]; 而且, 功能保留的胃癌手术亦得到广泛的应用[5]. 然而, 我国尚未重视早期胃癌的研究, 在很多医院早期胃癌仍采用根治性D2手术, 增加了患者的创伤, 影响了术后康复. 随着我国医疗水平的进步和胃癌筛查的开展, 不久的将来早期胃癌的比例势必不断增加; 因此, 有必要加强早期胃癌的研究, 开展功能保留的胃外科手术.
功能保留的胃外科手术种类繁多, 但所有手术均遵循以下3个基本原则: (1)尽可能多地保留残胃的体积; (2)需保留贲门或幽门的功能; (3)尽量保留迷走神经的功能[5]. 从这一角度讲, 内镜下黏膜切除(endoscopic mucosal resection, EMR)或内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)是一个极限保胃的功能保留的胃外科手术, 但是其有严格的适应证, 仅限于: (1)不伴溃疡, 直径≥2 cm的分化型黏膜内癌; (2)伴有溃疡, 直径<3 cm的分化型黏膜内癌; (3)不伴溃疡, 直径<2 cm的未分化型黏膜内癌[4]. 因此, 很多早期胃癌仍需要外科手术治疗. 目前, 早期胃癌的外科手术多数通过腹腔镜或机器人微创手术的方式进行. 本文将对早期胃癌功能保留胃外科手术术式、适应证、并发症、生活质量评价及预后作一综述.
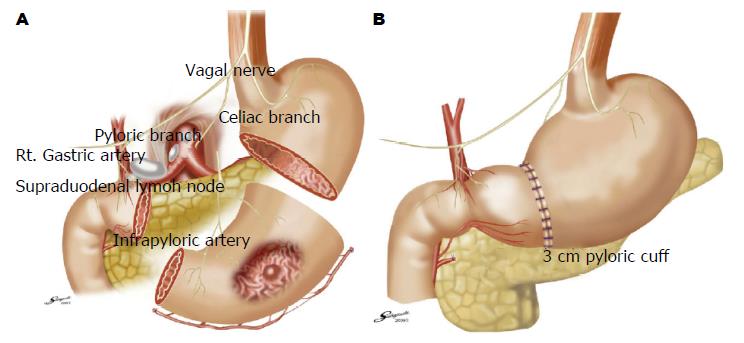
Maki等[6]于1967年首先报道幽门保留胃切除术(pylorus-preserving gastrectomy, PPG)作为治疗胃溃疡的一种手术方式, 当时术式为切除1/2-2/3的胃, 保留至少1.5 cm的幽门, 以达到减少倾倒综合征、防止胆汁返流及增加胃的储存食物功能. 但是, 食物潴留成为PPG后常见的问题[7]. 进一步的研究[8]发现, 增加保留幽门的长度可减少食物潴留. 20世纪80年代开始, 日本外科医生将PPG应用于早期胃癌的治疗, 但在我国仅有少部分医生在做这个手术术式. PPG治疗早期胃癌的适应证为: (1)早期胃癌T1N0; (2)肿瘤位于胃中段, 最大直径<5 cm; (3)至少保留3 cm以上的幽门(图1)[9]. Jiang等[9]研究发现, 腹腔镜辅助的PPG(laparoscopic assisted pylorus preserved gastrectomy, LAPPG)可安全实施, 307例LAPPG患者术后Clavien-Diono并发症分级Ⅲb以上的并发症仅有4例(1.3%). 近来更有全腹腔镜PPG的报道. Fujita等[10]的研究发现PPG能改善患者的术后生活质量, 与传统远端胃大部切除术相比, PPG可减少腹泻、减少倾倒综合征. 目前腹腔镜PPG治疗早期胃癌已成为日韩的常规手术, 手术中一般要求保留胃右动脉及幽门下动脉, 从而能保证幽门的血供, 肿瘤上切缘距肿瘤至少2 cm以上, 而近端残胃不能太小, 否则术后进食后饱胀感较明显[11]. 术中的迷走神经保护也是提高PPG术后生活质量的重要措施, 一般要求保留迷走神经肝支及幽门支, 而迷走神经腹腔支不是必须的, 但保留迷走神经腹腔支可减少术后腹泻及倾倒综合征的发生[10].
PPG保留了幽门功能, 从而减少了倾倒综合征及胆汁返流, 但残留幽门受到血供及神经支配的影响, 导致术后幽门的水肿及动力障碍, 导致术后迟发性胃潴留的发生, 这也是PPG术后最常见的并发症, Jiang等[9]报道PPG术后胃潴留的发生率在6.2%, 但多数通过保守治疗可缓解, 仅少数需要内镜扩张. Kiyokawa等[12]的研究发现保留幽门下静脉可减轻幽门水肿, 从而可减少胃潴留的发生风险. Tokunaga等[13]发现保留迷走神经腹腔支并不能减少胃潴留. Morita等[14]认为术后胃潴留与残存幽门的长度无关, Nunobe等[15]的研究认为保留迷走神经及幽门下血管可减少胃潴留的发生. 因此, 目前认为, 为减少术后胃潴留, 最好能保留胃右静脉及幽门下静脉, 同时尽可能保留迷走神经.
对早期胃癌实施PPG, 由于需要保留幽门的血供, 导致胃右血管周围(第5组)的淋巴结无法清扫, 而幽门下血管周围(第6组)淋巴结的清扫也无法像D2清扫那样彻底, 这导致另外一个问题的产生: 对早期胃癌患者实施PPG安全吗? 因为, 通常认为对位于胃中部的胃癌, 第5组淋巴结和第6组淋巴结均在第1站淋巴结清扫的范围. Kodera等[16]的研究发现胃体肿瘤的第5、6组淋巴结转移与肿瘤侵犯深度明显相关, 而黏膜层及黏膜下层早期胃癌第5、6组淋巴结转移的风险极低. Kim等[17]对220例胃体部早癌的患者淋巴结转移分析发现, 第5组及第6组淋巴结转移风险均仅为0.45%. 日本的癌研究所的数据库中, 3646例早期胃体癌第5组淋巴结转移率仅为0.2%[18]. 因此, 从淋巴结转移风险看, 只要术前诊断准确, 早期胃体癌是可以实施PPG的. 那么, PPG术后远期生存的数据到底如何呢? 文献报道, PPG术后5年生存率在93%-98%之间. Jiang等[19]研究发现腹腔镜PPG术后3年生存率为99.3%, 韩国的一组研究数据报道[20]比较了腹腔镜PPG与胃大部切除术, 发现PPG术后3年生存率为98.8%, 与胃大部切除术无差异. 日本的Hiki等[21]及Tsujiura等[22]报道PPG术后5年生存率均为98%. 这些数据均说明, PPG术后远期生存并不比传统胃大部切除术低.
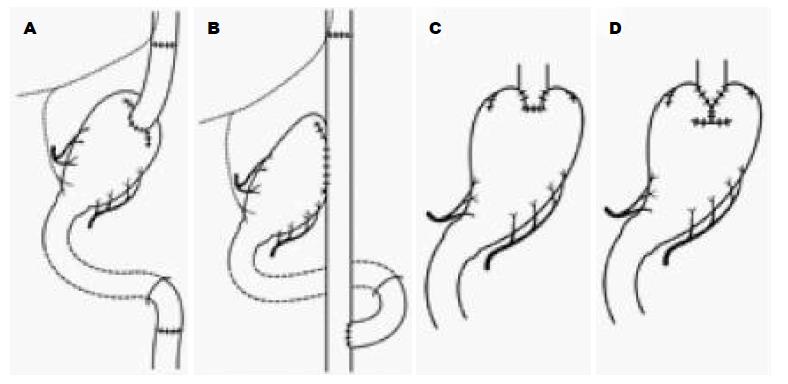
在中国, 近端胃癌的发生率近年来有升高趋势[23]. 近端胃切除术(proximal gastrectomy, PG)由于能保留了部分胃、保留了幽门功能, 有相对正常的消化道解剖, 所以术后部分胃的消化功能, 对早期胃癌来讲是属于功能保留的胃切除术, 其术后的消化功能及生活质量较全胃切除术要高, 术后体质量下降及贫血的发生程度均较全胃切除低[24]. 但是, 由于PG切除了贲门, 导致术后食道返流症状, 文献[25]报道PG术后有60%-70%的患者存在返流性食管炎表现; 而PG术后的幽门痉挛亦会导致患者术后有饱胀感; 同时, PG术后食道胃吻合口狭窄的发生率也偏高. 这些均严重影响了患者的术后生活质量. 因此, 有学者认为PG患者术后的生活质量并不高于全胃切除术, 甚至低于全胃切除术, 而提出对近端胃癌患者即使是早期胃癌亦需做全胃切除术. An等[25]比较了PG与全胃切除术, 发现两者的手术安全性和根治度相似, 但PG有较高的吻合口狭窄及返流性食管炎的发生率, 而在术后营养状况方面并无优势. 近年来, 随着人们对胃功能的进一步认识及手术技术的改进, 近端胃切除术后又出现了一些新的消化道重建的方式, 以图减轻术后的食管返流(图2), 介绍如下.
近端胃切除术后, 食道不与残胃直接吻合, 而是距离屈氏韧带下约20 cm处切取15 cm左右的空肠, 保留其系膜和血供, 分别与食道及残胃吻合, 由于有了这一段间置的空肠, 其术后食道返流的几率有所下降. Fan等[26]通过Meta分析发现, 与全胃切除相比, 空肠间置术后倾倒综合征发生率低, 术后体质量下降少, 而营养状况更好. Nozaki等[27]的研究也认为PG加空肠间置与全胃切除术相比, 肿瘤根治度无差异, 但术后贫血发生率更低.
双通道法与空肠间置法原理相似. 在距屈氏韧带下20 cm处切断空肠后, 带血管弓远端空肠上提, 与食管端侧吻合, 距食管空肠吻合口下方约15 cm处行空肠与残胃吻合, 但在距胃空肠吻合口约20 cm处行输入袢空肠与远端空肠侧侧吻合. Jung等[28]认为PG加空肠间置后有助于VitB12的吸收, 从而术后贫血的发生率会下降. Ahn等[29]发现, PG加双通道法术后食管返流的发生率为4.6%, 较传统PG要低.
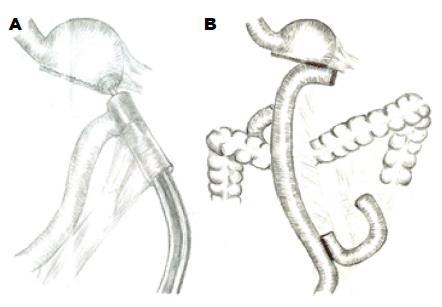
对近端早期胃癌, 一般手术方式为近端胃切除或全胃切除, 两者均无法保留贲门功能. 在某些近端胃癌患者, 病灶离食道尚有一定的距离, 所以在切除病变后, 理论上仍能保留很少一部分胃. 因此, 早在1984 年Takagi等[35]就提出近次全胃切除术这一术式. Jiang等[36]于2011年首次报道腹腔镜下的近次全胃切除术, 并认为近次全胃切除术的指征如下: (1)早期胃癌T1N0; (2)肿瘤位于近端胃或累及近端胃; (3)肿瘤与胃食管结合部仍有一定的距离; (4)残留的胃残端离食管胃结合部有2-3 cm距离. 近次全胃切除术的手术要点一是要求肿瘤定位准确, 一般术前需内镜下钛夹定位肿瘤位置及阴性上切缘, 术中最好结合内镜进一步精确定位; 二是在消化道重建方法方面. 由于残存胃过小, 若行B-Ⅱ式重建, 胆汁返流很重, 所以只能选择Roux-en-Y重建. Jiang等[36]借鉴食道空肠使用OrVil重建的方法, 经口从胃大弯残端置入OrVil钉头, 以25 mm圆形吻合器行胃空肠吻合, 并行Roux-en-Y空肠重建(图3); 手术后无吻合口瘘发生, 23例患者仅有1例发生轻度吻合口狭窄. Kim等[37]也报道了采用切割闭合器的方法完成超小胃空肠侧侧吻合, 手术后无吻合口瘘, 无阳性肿瘤切缘. 为保证肿瘤的R0切除, 术中上切缘需距肿瘤2 cm以上, 且送术中冰冻以保证阴性上切缘. 而胃网膜左血管根部淋巴结亦需送术中冰冻, 以明确淋巴结阴性. 如上切缘或淋巴结阳性, 将做标准全胃切除加D2淋巴结清扫. Kosuga等[38]对近全胃切除术后患者的随访结果表明, 其远期体质量维持及营养指标均优于全胃切除患者.
对于一些淋巴结转移风险极低的早期胃癌, 节段甚至部分胃切除术就能达到根除病灶的目的, 这些病灶一般是内镜下切除的指征, 但是病变范围较大或位置较特殊如胃底近贲门部位时, 内镜切除难度较大, 可选择节段或部分胃切除术. Ishikawa等[39]研究发现, 与远端胃切除术比较, 节段胃切除术能减轻术后早期倾倒综合征及返流性胃炎, 而两者远期生存并无明显差异, Isozaki等[40]也发现节段胃切除术后患者的生活质量高于远端胃切除术. Nunobe等[41]采用腹腔镜联合内镜的方法切除了直径6 cm的胃黏膜内癌. 由于节段或部分胃切除术均无法行根治性淋巴结清扫, 很多学者担心残留阳性淋巴结问题. Matsuda等[42]报道了节段胃切除联合淋巴结清扫技术, 认为能达到与传统淋巴结清扫同样的淋巴结个数. 近年来, 节段或部分胃切除术联合前哨淋巴结活检技术亦逐步应用于临床[43-47]. 但是, 由于胃淋巴官网过于复杂, 且胃癌有跳跃式淋巴结转移的现象, 故前哨淋巴结活检技术的临床有效性尚待进一步证实[48-52].
随着人们对早期胃癌的认识的深入, 在追求肿瘤根治的同时, 越来越兼顾患者的术后生活质量, 以腹腔镜为代表的微创手术下的功能保留的胃切除术, 包括幽门保留胃切除术、联合不同重建方式的近端胃切除术、近次全胃切除术、节段胃切除术及部分胃切除术, 而前哨淋巴结活检技术能进一步减少手术创伤, 但仍有待于进一步证实其有效性. 我国的胃肠外科医生应对此有所了解并逐步尝试这些技术, 以使更多患者获益. 但是, 所有功能保留的胃切除术都是建立在肿瘤的根治性切除基础上, 所以精准的术前诊断及定位是开展功能保留的胃切除术的前提.
早期胃癌的治疗效果较好, 目前研究重点集中在如何减少创伤、提高患者的生活质量. 然而, 我国尚未重视早期胃癌的研究, 在很多医院仍采用根治性D2手术, 增加了患者的创伤, 影响了术后康复. 因此, 有必要加强早期胃癌的研究, 开展功能保留的胃外科手术.
缩小的淋巴结清扫术(D1+手术)和功能保留的胃切除术是国际上早期胃癌治疗的方法及热点.
Jiang等发现幽门保留的胃切除术手术技术安全, 术后并发症少, 术后营养状况维持良好, 而3年生存率达99.3%.
本文系统阐述了功能保留的胃切除术包括幽门保留胃切除术、联合不同重建方式的近端胃切除术、近次全胃切除术、节段胃切除术及部分胃切除术以及前哨淋巴结活检技术.
应加强对早期胃癌手术的研究, 根据肿瘤部位、类型及大小选择合适的功能保留胃外科手术; 而精准的术前诊断及定位是开展功能保留的胃切除术的前提.
关泉林, 教授, 兰州大学第一医院肿瘤外科; 李云龙, 副教授, 哈尔滨医科大学附属二院普通外科; 吴文溪, 教授, 主任医师, 江苏省人民医院普外科; 南京医科大学第一附属医院
本文综述了早期胃癌功能保留的胃外科手术的基本原则及技术要点, 文献量大, 有一定的可读性.
手稿来源: 邀请约稿
学科分类: 胃肠病学和肝病学
手稿来源地: 上海市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:李瑞芳
| 1. | Chen W, Zheng R, Zuo T, Zeng H, Zhang S, He J. National cancer incidence and mortality in China, 2012. Chin J Cancer Res. 2016;28:1-11. [PubMed] [DOI] |
| 2. | Kurokawa Y, Sasako M. The Asian Perspective on the Surgical and Adjuvant Management of Esophagogastric Cancer. Surg Oncol Clin N Am. 2017;26:213-224. [PubMed] [DOI] |
| 3. | Shen L, Shan YS, Hu HM, Price TJ, Sirohi B, Yeh KH, Yang YH, Sano T, Yang HK, Zhang X. Management of gastric cancer in Asia: resource-stratified guidelines. Lancet Oncol. 2013;14:e535-e547. [PubMed] [DOI] |
| 4. | Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2014 (ver 4). Gastric Cancer. 2017;20:1-19. [PubMed] [DOI] |
| 5. | Nomura E, Okajima K. Function-preserving gastrectomy for gastric cancer in Japan. World J Gastroenterol. 2016;22:5888-5895. [PubMed] [DOI] |
| 6. | Maki T, Shiratori T, Hatafuku T, Sugawara K. Pylorus-preserving gastrectomy as an improved operation for gastric ulcer. Surgery. 1967;61:838-845. [PubMed] |
| 7. | Goodale RL, Tsung MS, Prevost M, Edlich RF, Wangensteen OH. Pylorus preserving gastrectomy (Maki). Effects upon antral function, gastric emptying and ulcerogenesis in the dog. Arch Surg. 1969;99:193-197. [PubMed] [DOI] |
| 8. | Oh SY, Lee HJ, Yang HK. Pylorus-Preserving Gastrectomy for Gastric Cancer. J Gastric Cancer. 2016;16:63-71. [PubMed] [DOI] |
| 9. | Jiang X, Hiki N, Nunobe S, Fukunaga T, Kumagai K, Nohara K, Sano T, Yamaguchi T. Postoperative outcomes and complications after laparoscopy-assisted pylorus-preserving gastrectomy for early gastric cancer. Ann Surg. 2011;253:928-933. [PubMed] [DOI] |
| 10. | Fujita J, Takahashi M, Urushihara T, Tanabe K, Kodera Y, Yumiba T, Matsumoto H, Takagane A, Kunisaki C, Nakada K. Assessment of postoperative quality of life following pylorus-preserving gastrectomy and Billroth-I distal gastrectomy in gastric cancer patients: results of the nationwide postgastrectomy syndrome assessment study. Gastric Cancer. 2016;19:302-311. [PubMed] [DOI] |
| 11. | Hiki N, Shimoyama S, Yamaguchi H, Kubota K, Kaminishi M. Laparoscopy-assisted pylorus-preserving gastrectomy with quality controlled lymph node dissection in gastric cancer operation. J Am Coll Surg. 2006;203:162-169. [PubMed] [DOI] |
| 12. | Kiyokawa T, Hiki N, Nunobe S, Honda M, Ohashi M, Sano T. Preserving infrapyloric vein reduces postoperative gastric stasis after laparoscopic pylorus-preserving gastrectomy. Langenbecks Arch Surg. 2017;402:49-56. [PubMed] [DOI] |
| 13. | Tokunaga M, Hiki N, Fukunaga T, Ohyama S, Nunobe S, Yamada K, Yamaguchi T. Is preservation of the celiac branch of the vagal nerve effective in preventing stasis following pylorus-preserving gastrectomy? Hepatogastroenterology. 2011;58:1046-1050. [PubMed] |
| 14. | Morita S, Sasako M, Saka M, Fukagawa T, Sano T, Katai H. Correlation between the length of the pyloric cuff and postoperative evaluation after pylorus-preserving gastrectomy. Gastric Cancer. 2010;13:109-116. [PubMed] [DOI] |
| 15. | Nunobe S, Hiki N, Fukunaga T, Tokunaga M, Ohyama S, Seto Y, Yamaguchi T. Laparoscopy-assisted pylorus-preserving gastrectomy: preservation of vagus nerve and infrapyloric blood flow induces less stasis. World J Surg. 2007;31:2335-2340. [PubMed] [DOI] |
| 16. | Kodera Y, Yamamura Y, Kanemitsu Y, Shimizu Y, Hirai T, Yasui K, Morimoto T, Kato T. Lymph node metastasis in cancer of the middle-third stomach: criteria for treatment with a pylorus-preserving gastrectomy. Surg Today. 2001;31:196-203. [PubMed] [DOI] |
| 17. | Kim BH, Hong SW, Kim JW, Choi SH, Yoon SO. Oncologic safety of pylorus-preserving gastrectomy in the aspect of micrometastasis in lymph nodes at stations 5 and 6. Ann Surg Oncol. 2014;21:533-538. [PubMed] [DOI] |
| 18. | Hiki N, Nunobe S, Kubota T, Jiang X. Function-preserving gastrectomy for early gastric cancer. Ann Surg Oncol. 2013;20:2683-2692. [PubMed] [DOI] |
| 19. | Jiang X, Hiki N, Nunobe S, Fukunaga T, Kumagai K, Nohara K, Katayama H, Ohyama S, Sano T, Yamaguchi T. Long-term outcome and survival with laparoscopy-assisted pylorus-preserving gastrectomy for early gastric cancer. Surg Endosc. 2011;25:1182-1186. [PubMed] [DOI] |
| 20. | Suh YS, Han DS, Kong SH, Kwon S, Shin CI, Kim WH, Kim HH, Lee HJ, Yang HK. Laparoscopy-assisted pylorus-preserving gastrectomy is better than laparoscopy-assisted distal gastrectomy for middle-third early gastric cancer. Ann Surg. 2014;259:485-493. [PubMed] [DOI] |
| 21. | Hiki N, Sano T, Fukunaga T, Ohyama S, Tokunaga M, Yamaguchi T. Survival benefit of pylorus-preserving gastrectomy in early gastric cancer. J Am Coll Surg. 2009;209:297-301. [PubMed] [DOI] |
| 22. | Tsujiura M, Hiki N, Ohashi M, Nunobe S, Kumagai K, Ida S, Hayami M, Sano T, Yamaguchi T. Excellent Long-Term Prognosis and Favorable Postoperative Nutritional Status After Laparoscopic Pylorus-Preserving Gastrectomy. Ann Surg Oncol. 2017;24:2233-2240. [PubMed] [DOI] |
| 23. | Shi J, Sun Q, Xu BY, Yu HP, Zhang YF, Zou XP, Huang L, Gold JS, Mashimo H, Yu CG. Changing trends in the proportions of small (≤ 2 cm) proximal and non-proximal gastric carcinomas treated at a high-volume tertiary medical center in China. J Dig Dis. 2014;15:359-366. [PubMed] [DOI] |
| 24. | Ichikawa D, Komatsu S, Kubota T, Okamoto K, Shiozaki A, Fujiwara H, Otsuji E. Long-term outcomes of patients who underwent limited proximal gastrectomy. Gastric Cancer. 2014;17:141-145. [PubMed] [DOI] |
| 25. | An JY, Youn HG, Choi MG, Noh JH, Sohn TS, Kim S. The difficult choice between total and proximal gastrectomy in proximal early gastric cancer. Am J Surg. 2008;196:587-591. [PubMed] [DOI] |
| 26. | Fan KX, Xu ZF, Wang MR, Li DT, Yang XS, Guo J. Outcomes for jejunal interposition reconstruction compared with Roux-en-Y anastomosis: A meta-analysis. World J Gastroenterol. 2015;21:3093-3099. [PubMed] [DOI] |
| 27. | Nozaki I, Hato S, Kobatake T, Ohta K, Kubo Y, Kurita A. Long-term outcome after proximal gastrectomy with jejunal interposition for gastric cancer compared with total gastrectomy. World J Surg. 2013;37:558-564. [PubMed] [DOI] |
| 28. | Jung DH, Lee Y, Kim DW, Park YS, Ahn SH, Park DJ, Kim HH. Laparoscopic proximal gastrectomy with double tract reconstruction is superior to laparoscopic total gastrectomy for proximal early gastric cancer. Surg Endosc. 2017; Mar 24. [Epub ahead of print]. [PubMed] [DOI] |
| 29. | Ahn SH, Jung DH, Son SY, Lee CM, Park DJ, Kim HH. Laparoscopic double-tract proximal gastrectomy for proximal early gastric cancer. Gastric Cancer. 2014;17:562-570. [PubMed] [DOI] |
| 30. | Nakamura M, Nakamori M, Ojima T, Katsuda M, Iida T, Hayata K, Matsumura S, Kato T, Kitadani J, Iwahashi M. Reconstruction after proximal gastrectomy for early gastric cancer in the upper third of the stomach: an analysis of our 13-year experience. Surgery. 2014;156:57-63. [PubMed] [DOI] |
| 31. | Sakuramoto S, Yamashita K, Kikuchi S, Futawatari N, Katada N, Moriya H, Hirai K, Watanabe M. Clinical experience of laparoscopy-assisted proximal gastrectomy with Toupet-like partial fundoplication in early gastric cancer for preventing reflux esophagitis. J Am Coll Surg. 2009;209:344-351. [PubMed] [DOI] |
| 32. | Mine S, Nunobe S, Watanabe M. A Novel Technique of Anti-reflux Esophagogastrostomy Following Left Thoracoabdominal Esophagectomy for Carcinoma of the Esophagogastric Junction. World J Surg. 2015;39:2359-2361. [PubMed] [DOI] |
| 33. | Muraoka A, Kobayashi M, Kokudo Y. Laparoscopy-Assisted Proximal Gastrectomy with the Hinged Double Flap Method. World J Surg. 2016;40:2419-2424. [PubMed] [DOI] |
| 34. | Hayami M, Hiki N, Nunobe S, Mine S, Ohashi M, Kumagai K, Ida S, Watanabe M, Sano T, Yamaguchi T. Clinical Outcomes and Evaluation of Laparoscopic Proximal Gastrectomy with Double-Flap Technique for Early Gastric Cancer in the Upper Third of the Stomach. Ann Surg Oncol. 2017;24:1635-1642. [PubMed] [DOI] |
| 35. | Takagi H, Morimoto T. Near-total gastrectomy. J Surg Oncol. 1984;26:14-16. [PubMed] [DOI] |
| 36. | Jiang X, Hiki N, Nunobe S, Nohara K, Kumagai K, Sano T, Yamaguchi T. Laparoscopy-assisted subtotal gastrectomy with very small remnant stomach: a novel surgical procedure for selected early gastric cancer in the upper stomach. Gastric Cancer. 2011;14:194-199. [PubMed] [DOI] |
| 37. | Kim HS, Kim BS, Lee IS, Lee S, Yook JH, Kim BS. Intracorporeal laparoscopic Roux-en-Y gastrojejunostomy after 95% gastrectomy for early gastric cancer in the upper third of the stomach: a report on 21 cases. J Laparoendosc Adv Surg Tech A. 2013;23:250-257. [PubMed] [DOI] |
| 38. | Kosuga T, Hiki N, Nunobe S, Noma H, Honda M, Tanimura S, Sano T, Yamaguchi T. Feasibility and nutritional impact of laparoscopy-assisted subtotal gastrectomy for early gastric cancer in the upper stomach. Ann Surg Oncol. 2014;21:2028-2035. [PubMed] [DOI] |
| 39. | Ishikawa K, Arita T, Ninomiya S, Bandoh T, Shiraishi N, Kitano S. Outcome of segmental gastrectomy versus distal gastrectomy for early gastric cancer. World J Surg. 2007;31:2204-2207. [PubMed] [DOI] |
| 40. | Isozaki H, Matsumoto S, Murakami S, Takama T, Sho T, Ishihara K, Sakai K, Takeda M, Nakada K, Fujiwara T. Diminished Gastric Resection Preserves Better Quality of Life in Patients with Early Gastric Cancer. Acta Med Okayama. 2016;70:119-130. [PubMed] |
| 41. | Nunobe S, Hiki N, Gotoda T, Murao T, Haruma K, Matsumoto H, Hirai T, Tanimura S, Sano T, Yamaguchi T. Successful application of laparoscopic and endoscopic cooperative surgery (LECS) for a lateral-spreading mucosal gastric cancer. Gastric Cancer. 2012;15:338-342. [PubMed] [DOI] |
| 42. | Matsuda T, Kaneda K, Takamatsu M, Aishin K, Awazu M, Okamoto A, Kawaguchi K. Segmental gastrectomy with radical lymph node dissection for early gastric cancer. World J Gastroenterol. 2010;16:5247-5251. [PubMed] [DOI] |
| 43. | Kitagawa Y, Takeuchi H, Takagi Y, Natsugoe S, Terashima M, Murakami N, Fujimura T, Tsujimoto H, Hayashi H, Yoshimizu N. Sentinel node mapping for gastric cancer: a prospective multicenter trial in Japan. J Clin Oncol. 2013;31:3704-3710. [PubMed] [DOI] |
| 44. | Takahashi N, Nimura H, Fujita T, Mitsumori N, Shiraishi N, Kitano S, Satodate H, Yanaga K. Laparoscopic sentinel node navigation surgery for early gastric cancer: a prospective multicenter trial. Langenbecks Arch Surg. 2017;402:27-32. [PubMed] [DOI] |
| 45. | Lee CM, Park S, Park SH, Jung SW, Choe JW, Sul JY, Jang YJ, Mok YJ, Kim JH. Sentinel Node Mapping Using a Fluorescent Dye and Visible Light During Laparoscopic Gastrectomy for Early Gastric Cancer: Result of a Prospective Study From a Single Institute. Ann Surg. 2017;265:766-773. [PubMed] [DOI] |
| 46. | Takahashi N, Nimura H, Fujita T, Yamashita S, Mitsumori N, Yanaga K. Quantitative assessment of visual estimation of the infrared indocyanine green imaging of lymph nodes retrieved at sentinel node navigation surgery for gastric cancer. BMC Surg. 2016;16:35. [PubMed] [DOI] |
| 47. | Fujimura T, Fushida S, Tsukada T, Kinoshita J, Oyama K, Miyashita T, Takamura H, Kinami S, Ohta T. A new stage of sentinel node navigation surgery in early gastric cancer. Gastric Cancer. 2015;18:210-217. [PubMed] [DOI] |
| 48. | Tani T, Sonoda H, Tani M. Sentinel lymph node navigation surgery for gastric cancer: Does it really benefit the patient? World J Gastroenterol. 2016;22:2894-2899. [PubMed] [DOI] |
| 49. | Ohdaira H, Nimura H, Mitsumori N, Takahashi N, Kashiwagi H, Yanaga K. Validity of modified gastrectomy combined with sentinel node navigation surgery for early gastric cancer. Gastric Cancer. 2007;10:117-122. [PubMed] [DOI] |
| 50. | Saikawa Y, Otani Y, Kitagawa Y, Yoshida M, Wada N, Kubota T, Kumai K, Sugino Y, Mukai M, Kameyama K. Interim results of sentinel node biopsy during laparoscopic gastrectomy: possible role in function-preserving surgery for early cancer. World J Surg. 2006;30:1962-1968. [PubMed] [DOI] |
| 51. | Ryu KW, Eom BW, Nam BH, Lee JH, Kook MC, Choi IJ, Kim YW. Is the sentinel node biopsy clinically applicable for limited lymphadenectomy and modified gastric resection in gastric cancer? A meta-analysis of feasibility studies. J Surg Oncol. 2011;104:578-584. [PubMed] [DOI] |
| 52. | Tokunaga M, Ohyama S, Hiki N, Fukunaga T, Yamada K, Sano T, Yamaguchi T. Investigation of the lymphatic stream of the stomach in gastric cancer with solitary lymph node metastasis. World J Surg. 2009;33:1235-1239. [PubMed] [DOI] |