修回日期: 2017-05-20
接受日期: 2017-06-12
在线出版日期: 2017-08-18
肝纤维化是肝脏对慢性损伤的一种修复反应, 多是持续性肝脏损伤或纤维化刺激因子刺激产生的共有病理改变, 是一项严重的全球性健康难题. 近年来临床研究发现, 由病毒性肝炎造成肝纤维化或肝硬化的患者, 在成功接受病毒性肝炎治疗后, 其肝纤维化甚至肝硬化发生了逆转现象. 因此研究和了解肝纤维化逆转的机制有利于发现新的针对肝纤维化的治疗靶向. 本文就近年来有关肝纤维化逆转机制的研究以及治疗概况作一综述, 以期为肝纤维化的研究提供帮助.
核心提要: 研究和了解肝纤维化逆转的机制有利于发现新的针对肝纤维化的治疗靶向. 本文就近年来有关肝纤维化逆转机制的研究以及治疗概况作一综述, 以期为肝纤维化的研究提供帮助.
引文著录: 吴兰婷, 刘文兰. 肝纤维化逆转机制的研究进展及治疗概况. 世界华人消化杂志 2017; 25(23): 2123-2132
Revised: May 20, 2017
Accepted: June 12, 2017
Published online: August 18, 2017
Liver fibrosis is a repair response to chronic liver injury. It is common pathological changes resulting from chronic liver damage or exposure to fibrosis stimulators. Liver fibrosis has become a serious global health problem now. According to recent clinical studies, liver fibrosis or even cirrhosis caused by viral hepatitis in some patients can be reversed after successful treatment. Therefore, studying and understanding the mechanism of liver fibrosis reversal can help to discover new targets of treatment for liver fibrosis. This review discusses the mechanism to reverse liver fibrosis according to studies in recent years and gives an overview of its treatment.
- Citation: Wu LT, Liu WL. Reverse mechanism and therapeutic overview of liver fibrosis. Shijie Huaren Xiaohua Zazhi 2017; 25(23): 2123-2132
- URL: https://www.wjgnet.com/1009-3079/full/v25/i23/2123.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i23.2123
时至今日, 除了去除根本发病原以及肝移植以外, 在临床上并无对于肝纤维化有效可行的疗法[1]. 这让肝纤维化成为除癌症外急需临床医学研究的领域.
目前认为, 肝纤维化时肝组织中细胞外基质(extracellular matrix, ECM)的病理性改变是由于控制ECM形成及降解的稳态机制失调所致. 任何原因使得ECM形成过多或降解减少均可导致ECM过度沉积. 肝纤维化过程中肝细胞会发生持续、反复的坏死或炎症, 大量纤维增生同时伴有纤维降解的相对或绝对不足, 细胞外基质在肝内大量沉积并最终演变为肝硬化. 而一旦发展为肝硬化, 患者则处于极高危的患肝细胞癌的风险中[2]. 肝纤维化如果进展为肝硬化甚至肝细胞癌, 会出现一系列并发症如食管静脉曲张破裂出血、肝性脑病、腹水、肝肾综合征等, 给患者带来巨大的痛苦甚至威胁其生命[3,4].
肝纤维化以及肝硬化主要是慢性肝病造成的, 已经成为世界性的难题. 目前临床对晚期肝硬化唯一有效的方法仍是肝移植. 但是, 即使在一些发达国家, 由于可利用的捐献器官少并且接受移植者的病情复杂化, 限制了这种技术的应用. 况且肝纤维化初期临床表现不明显, 易被人们所忽视. 因此肝纤维化有无逆转的可能性, 对于研究其治疗方法是一个关键性的环节.
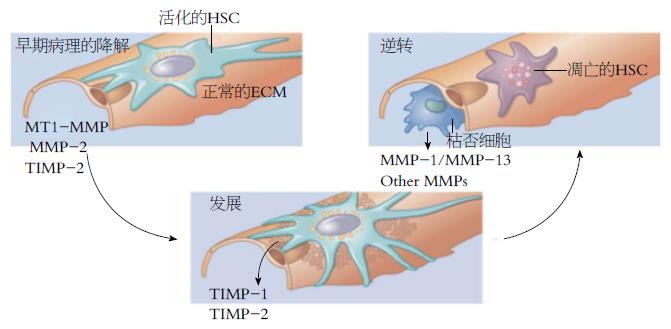
关于肝纤维化可逆的现象很早就已经被提出了. Popper和Udenfreind[5]在1970年发表的文章中提出此观点并强调了酶促过程对肝纤维化逆转的重要性. 近年来, 学者也进行了大量实验及临床研究, 以探讨肝纤维化的可逆性. 在一些动物模型上, 如CCl4(carbon tetrachloride)模型、大鼠胆管结扎梗阻性模型、血吸虫性模型、硫乙酞胺模型等证明了肝纤维化是可逆的[6-10]. 对于临床患者, 也逐渐有一些证据证明人类的肝纤维化也是可逆的. 例如血色病、Wilson病、原发性胆汁性肝硬化[11,12]等. 其中一些现象被认为是肝纤维化逆转的决定性因素, 包括: 肝星状细胞(hepatic stellate cell, HSC)的减少, 巨噬细胞分泌胶原酶的增加(在机体创伤修复过程中, 巨噬细胞能大量分泌多种生物活性物质以及酶类物质, 其中酶类物质主要包括胶原酶、弹性蛋白酶、纤溶酶原激活剂等, 直接引导着机体修复的整体进程), 以及组织金属蛋白酶抑制剂(tissue inhibitors of matrix metalloproteinase, TIMP)含量的降低等[13]. 基质金属蛋白酶(matrix metalloproteinase, MMP)是降解ECM的主要酶系, 而其组织抑制因子TIMP通过抑制MMP, 阻止ECM的降解, 从而形成或促进肝纤维化. 活化的HSC由于缺乏致纤维化的细胞因子可能经历衰老和受体介导的细胞凋亡[14].
那么肝硬化又是否可逆呢? 第1篇有关人类肝硬化逆转的文章"Regression of Human Cirrhosis: Morphologic Features and the Genesis of Incomplete Septal Cirrhosis", 由Ian R. Wanless, Eisuke Nakashima以及Morris Sherman发表[15]. 在他们的文章中, Wanless和他的同事描述了一个由乙型肝炎病毒诱发肝硬化的患者, 经拉米夫定治疗后肝硬化有明显逆转的现象. 受此现象影响, 他们继续进行深入研究, 观察到该逆转过程的微观特点, 他们称之为"肝修复复合体". 并且基于研究得出了"小叶间隔和实质中大部分纤维化区域可以被逆转为正常形态"的结论[16]. 而后, Xu等[17]研究发现慢性乙型肝炎患者经过长期的(实验为10年)拉米夫定治疗后, 19例患者中有4例肝纤维化/肝硬化得到了完全逆转, 9例患者肝纤维化/肝硬化程度得到不同程度改善, 但是仍有6例患者的肝纤维化/肝硬化状况没有得到改善. 由此证明慢性乙型肝炎患者经长期拉米夫定治疗可以改善病情恶化, 并有实现肝纤维化/肝硬化逆转的可能. Zimmermann和Tacke[18]提出: 近期临床研究中病毒性肝炎患者治疗成功的例子, 显示出肝纤维化甚至肝硬化均可能被逆转.
总的来说, 积累的资料证明, 肝纤维化是可以逆转的, 肝硬化的逆转也是可能的. 但肝硬化的完全逆转例子较少, 且在研究样本中完全逆转的患者所占比例较低, 因此, 肝硬化的可逆性仍有待研究. 可以预见, 这些能够逆转肝纤维化的方法将利于抗纤维化技术的发展, 使纤维化基质降解为正常组织[19].
关于肝纤维化逆转的途径, 2015年Zimmermann提出肝纤维化的逆转主要遵循四个机制, 包括: (1)终止肝脏所受到的慢性损伤; (2)抑制肝脏炎症反应; (3)减弱肌成纤维细胞(myofibroblasts, MFB)活化作用; (4)降解基质. 同年, Scott L. Friedman也发表文章, 认为逆转肝纤维化的主要靶向为: (1)控制发病原; (2)减轻肝脏损伤; (3)抑制MFB活化; (4)刺激基质降解; (5)促进细胞凋亡或促进活化的星状细胞逆转. 下面就近年来研究的肝纤维化逆转途径进行归纳与总结.
正如酒精性肝纤维化应先戒酒, 慢性病毒性肝炎给予抗病毒治疗, 血吸虫性肝纤维化给予吡喹酮杀灭血吸虫, 以及用静脉切放血术治疗遗传性血色素沉着症(静脉切放血术是治疗这类卟啉症的方法之一: 静脉切开放血以耗竭过多储存铁, 口服氯喹均能改善皮损, 一些患者甚至长期消退)等等[20]. 控制发病原, 减轻肝脏的炎症损伤, 是首先要做并且非常重要的事. 因减轻炎症坏死, 就能减少转化生长因子β(transforming growth factor, TGF-β)等细胞因子的释放, 进而减少刺激HSC活化的因素, 减少ECM的产生. 在啮齿类动物肝纤维化模型的研究发现, 移除病原体、中断发病原刺激下的肝纤维化可以得到逆转. 此结论已经在CCl4[8-10]、酒精以及胆道结扎(bile duct ligation, BDL)[11,12]诱发肝纤维化的模型中得以证实[13].
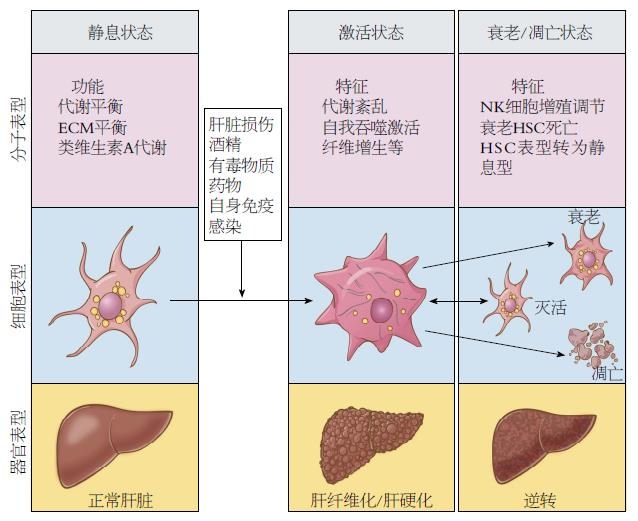
HSC是肝脏间质细胞之一, 位于窦周间隙, 正常情况下HSC呈静止状态, 在肝脏中的生理功能主要有参与维生素A的代谢, 储存脂肪的功能, HSC的胞浆中含有类视黄醇物质的脂滴, 是维生素A的主要储存处, HSC还有调节血管和肝窦血流的作用. 在病理条件下如肝脏受到物理、化学及病毒感染生物因素的刺激时, HSC增殖并激活, 转变为MFB[21], 表达α-平滑肌动蛋白、合成ECM等. 在CCl4和BDL诱发的大鼠肝纤维化模型中, HSC的减少可以显著地减弱肝纤维化以及肝脏损伤[22]. 自然杀伤细胞(natural killer, NK)和NKT也涉及肝纤维化逆转的过程. 被干扰素α激活后, NK与NKT迅速杀死HSC. 此外, 近期研究[23,24]表明, 除了细胞衰老和凋亡, 活化的肝星状细胞也可以在肝纤维化逆转进程中恢复到静息表型.
减少活化的HSC数量是逆转肝纤维化的关键之一. 3个减少活化HSC的途径是: (1)促进细胞凋亡[25]; (2)促进细胞衰老[21]; (3)逆转为静息表型[23](图1). 促进活化HSC的凋亡从而逆转肝纤维化已经在啮齿动物实验模型(胆管结扎和CCl4模型)中被证明. 细胞衰老从遗传角度上看是一个细胞超过其限定的增殖能力后的调控过程. 实验性肝纤维化模型中HSC经历衰老后积累, 衰老的HSC在体内仍可被NK细胞定向清除, 因此也对肝纤维化的逆转起作用. 关于啮齿类动物肝纤维化模型中将活化的HSC逆转为静息表型也有充足的证据[24]. 然而, 这些被恢复为静息表型的细胞保留了重新被肝纤维化刺激因素刺激的能力, 且刺激效果更加显著. 目前对于这三种在体内肝纤维化逆转的方法(衰老、凋亡、逆转为静息表型)并不清楚哪一种是对减少活化的HSC最重要的. 但是近年的实验证据表明, 将活化的HSC逆转为静息表型与细胞衰老和凋亡相比, 更占主导地位[3](图2).
TGF-β可以增加ECM中胶原蛋白、纤黏连蛋白的含量和抑制ECM的降解, 对细胞的形态发生、增殖和分化过程起着重要作用, 有利于胚胎发育和细胞修复. TGF-β是肝纤维化发病机制中的关键调节物. TGF-β1可以促进HSC合成胶原、纤维连接蛋白及蛋白多糖等细胞外基质[26]. TGF-β1与其相应的受体结合后可发挥其生物学效应. 被活化的TGF-β1受体通过Smad(Smad是TGF-β超家族的特异性受体后信使分子, 介导TGF-β1信号从细胞膜传入细胞核的过程.)等蛋白分子, 使该信号在胞内逐级转递直至转位细胞核内, 从而调控目的基因表达. TGF-β/Smad信号通路在HSC的激活、降解以及ECM积累中起重要作用. 当肝脏受损时, 肝脏内大量TGF-β1与HSC表面的活性TβRⅡ(TGF-β受体Ⅱ)结合, 并吸引TβRⅠ, 形成信号复合物. TβRⅠ与受体Smad结合, 使受体Smad MH2区的SSXS结构域被磷酸化活化, 因而受体Smad与TβRⅠ分离并进入HSC, TβRⅠ与通用型Smad结合, 并一起转移至细胞核内, 与DNA转录因子结合, 激活目的基因复制转录, 最终导致大量胶原产生, 引起肝纤维化[27].
槲寄生生物碱可以通过抑制HSC活化、抑制TGF-β1/Smad 2和Smad 7信号通路, 来减少ECM积累. 揭示了槲寄生生物碱可以用于调控肝纤维化进程[28].
Shi等[29]研究发现绿原酸也具有抑制HSC活化的能力, 同时可以抑制TGF-β1和血管内皮生长因子的产生, 但是具体作用机制有待进一步研究.
2.3.1 脂多糖/TLR4信号通路: Toll样受体(Toll-like receptors, TLR)是参与非特异性免疫的一类重要蛋白质分子, 也是连接非特异性免疫和特异性免疫的桥梁. TLR是单个的跨膜非催化性蛋白质, 可以识别来源于微生物的具有保守结构的分子. 当微生物突破机体的物理屏障, 如皮肤、黏膜等时, TLR可以识别他们并激活产生细胞免疫应答. 目前, 在哺乳动物及人类中已经发现的人TLRs家族成员有11个. 脂多糖/TLR4是TLR中最早被发现的1个, 其配体主要是脂多糖. 在用CCl4建立肝纤维化模型的实验过程中发现, 肝组织损伤程度与TLR4呈正相关[30]. HSC受到自身表面的脂多糖/TLR4的调控. 脂多糖能通过HSC表面的TLR4信号转导, 活化核因子-κB(nuclear factor-κB, NF-κB)和c-Jun氨基端激酶, 促进炎性因子白介素-8(interleukin-8, IL-8)、单核细胞趋化蛋白1、细胞间黏附分子1和血管细胞黏附分子1的表达, 增强炎症反应, 最终促进肝的纤维化[31,32]. Qian等[33]提出有力证据, 表明槐果碱对肝纤维化的治疗效果是通过抑制HSC活化和增殖达成的. 槐果碱对TLR4信号通路表现出很强的阻碍作用.
2.3.2 FAK-ERK信号通路: 有研究指出, 丹参的一个主要生物活性成分--单体IH764-3能够抑制HSC增殖并在体外实验中诱导活化的HSC凋亡. 相关机制为抑制黏着斑激酶-细胞外信号调节激酶(focal adhesion kinase-extracellular signal-regulated kinase, FAK-ERK)信号传导通路[34]. FAK是整合素信号转导系统中的重要细胞因子. FAK发生磷酸化而活化, 激活下游的蛋白激酶, 其中, 蛋白激酶B被激活后通过调节其下游靶蛋白来调节细胞的黏附、迁移、增殖等活动. FAK的C端包含一个黏着斑定位序列, 其作用是促进FAK定位于黏着斑. 黏着斑激酶相关非激酶(FAK-related non-kinase, FRNK)是FAK单独表达C末端结构域产生的一个FAK相关非激酶蛋白, 虽然FRNK缺乏激酶区, 但可以作为FAK的一种内源性抑制因子, 通过与FAK竞争在黏着斑上的结合位点参与体内FAK功能的负向调节. 在FAK活化后, 可通过丝裂原蛋白激酶(mitogen activated protein kinases, MAPK)途径引起级联反应, 该信号传导通路可参与细胞迁移、增殖等多种功能活动. 随着FAK及其磷酸化水平的上调, ERK磷酸化水平增加, HSC胶原合成增加; FRNK过表达后, 随FAK表达下调, ERK磷酸化水平降低, HSC胶原合成受到抑制. 这便是FAK-ERK信号传导通路参与FRNK使HSC胶原合成能力降低的机制.
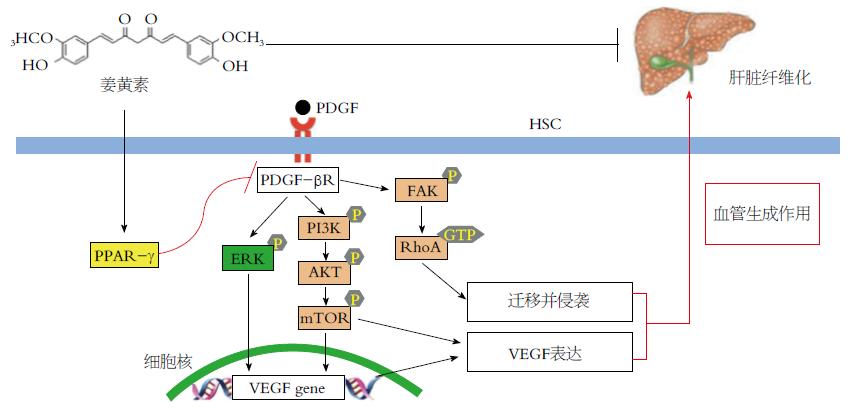
2.3.3 PPAR通道: 过氧化物酶体增殖物激活受体PPAR是一种配体激活受体, 因由过氧化物酶体增殖物激活而得名, 包括PPAR-α、PPAR-β、PPAR-γ 3种表型[35]. 研究发现, PPAR-γ激动剂能抑制HSC的活化, 且活化的HSC中PPAR-γ的相关表达减少. 由此可见, 通过上调PPAR-γ的表达可以抑制HSC增殖和凋亡, 从而逆转肝纤维化.
Zhang等[36]实验总结出, 姜黄素在肝纤维化进程中减弱血管生成可能通过PPAR-γ(peroxisome prolifera- tor-activated receptor-γ)激活机制作用于HSC(图3).
2.3.4 血小板源性生长因子通道: 血小板源性生长因子(platelet-derived growth factor, PDGF)是一种重要的促有丝分裂因子, 具有刺激特定细胞群分裂增殖的能力. 在生理状态下, PDGF以α颗粒的形式储存于血小板中, 当血液凝固时由崩解的血小板释放出来并且被激活, 具有刺激特定细胞趋化与促进特定细胞生长的生物活性; 在肝受损时, PDGF被巨噬细胞、血小板、浸润的炎细胞、受损的内皮细胞及激活的HSC大量分泌, 并刺激间质HSC增殖, 转化为肌纤维样母细胞, 并促使HSC迁移, 聚集于炎症受损区. 而肌纤维样母细胞合成大量ECM沉积于肝细胞间质, 促进肝纤维化发生. 有多种信号分子是PDGF受体的底物. 这些分子基本都含有一个SH-2的结构区域, 在其被活化后可启动多种信号传导通路, 主要有MAPK、Janus激酶/STAT、磷脂酞肌醇3-激酶等通路, 统称为PDGF通道.
PDGF包含PDGF-AA、BB、AB, 而PDGF-BB在HSC的增殖中演绎着重要角色. PDGF-BB是HSC的促细胞分裂剂, 可以促进肝纤维化. 在肝纤维化的发生过程中, PDGF-BB可被多种细胞分泌[37]. Liu等[38]认为高剂量的大豆异黄酮(soy isoflavone, SI)可以显著地抑制经硫代乙酰胺诱导的大鼠肝纤维化. 其原因是其阻止了HSC活化和增殖. 在一个体外实验中, SI中的染料木黄酮成分, 被证实阻止了HSC的增殖和活化. 一些研究者[39-41]用实验验证, SI可以降低HSC的增殖和活化. SI可以降低血小板源性生长因子PDGF-BB水平.
2.3.5 骨髓间充质干细胞: 骨髓间充质干细胞(bone marrow mesenchymal stem cells, BM-MSCs)有分泌多种生长因子和细胞因子的能力, 可以逆转肝纤维化并加强肝细胞功能. BM-MSCs显著减少HSC中α平滑肌肌动蛋白的产生以及降低活化HSC的生存能力, 诱导活化HSC的细胞凋亡[42].
2.3.6 Snail-1转录因子: 近年来研究[43]发现, 在肝纤维化进程中Snail-1转录因子可以影响HSC活化. 在脊椎动物体内Snail-1被ERK2、NF-κB和磷脂酰肌醇3-激酶等不同的信号通路激活[44-46], 这些通路全部与HSC的活化有关. 一些人也认为Snail-1的超表达与ECM的沉积相关联.
Gordillo-Bastidas等[47]研究得出, 咖啡因(caffeine, CFA)抑制转录因子Snail-1, 下调纤维发生的相关基因表达并且激活Nrf2诱导的抗氧化酶系统, 阻止炎症反应和肝纤维化. 有流行病学调查数据指出, CFA可以阻止慢性肝病的发展, 并且减轻病情的严重性[48,49]. 体外实验显示出, 慢性肝脏损伤大鼠体内CFA治疗减弱了Snail-1的表达, 说明CFA有防止HSC活化与增殖的良好影响[50,51].
2.3.7 A2AR拮抗剂: A2AR的活化可以促进HSC的活化. Raskovalova等[52]和Chiang等[53]实验证实在适量乙醇摄入和在体内暴露CCl4时, A2AR拮抗剂可以减弱HSC的活化. 应用A2AR拮抗剂不仅在实验第2周的模型中阻止了纤维化进程, 也在第5周逆转了肝纤维化.
2.3.8 LXRb: 经CCl4诱导的肝纤维化小鼠体内, TGF-β刺激HSC的实验发现, 肝脏X受体(liver X receptors, LXRs)在五加酸减轻肝纤维化中作为调节信号. Bai等[54]研究得出结论, 认为五加酸可以激活LXRa和LXR, 通过激活LXRb阻止活化HSC, 进而有逆转CCl4诱导的小鼠肝纤维化的可能.
正常情况下纤维生成同时伴以纤维降解. 肝纤维化时MMP在早期生成总量虽也略增, 但不及纤维生成明显, 而后期MMP日趋减少以至降解活性不足, 此为肝纤维化形成的机制之一, 也可由此入手逆转肝纤维化. MMP是一类依赖Ca2+、Zn2+的内源性蛋白酶, 肝内主要由HSC、Kuffer细胞合成, 中性pH条件下可降解多种ECM成分. 参与ECM降解的主要是MMP-2. 通过肝纤维化可逆性模型研究发现MMP-2基因表达升高了18倍, 当给予CCL4 4 wk后停药, 肝纤维化则自发退变, 逆转录PCR测定发现MMP-2一直保持较高水平达(76%-88%)[55]. 在肝纤维化逆转阶段MMP-2表达增加的意义在于其有助于降解组织中过剩的IV型胶原, 以促进肝脏正常结构的恢复[56].
也可通过增加内源基质降解酶活性或者中和天然拮抗剂, 特别是TIMP的拮抗剂, 来逆转肝纤维化. 目前已经有了将TIMP拮抗剂成功应用于动物模型的研究[57], 但是对于人类的实验还没有进展. 在很多动物模型试验中应用单克隆抗体胶原交联酶赖氨酰氧化酶2[58]. 目前认为没有充分交联的胶原更有可能被内源胶原酶降解, 但还需要额外的研究. 尽管如此, 很多学者正在进行临床尝试, 在肝和肺纤维化中测试这个方法[59].
高迁移率族蛋白1(High mobility group box-1 protein, HMGB1)可激活纤维蛋白酶, 还能诱导MMP-2、MMP-9的活化, 这样HMGB1就能直接地诱导细胞运动和间接地促进ECM降解, 从而有利于细胞迁移、细胞侵袭、肿瘤生长和转移. 由于HMGB1与肿瘤的发生有如此密切的相关性, 使其成为具有希望的抗肿瘤治疗的靶向分子.
Chen等[60]在体外实验中发现了新的分子靶点. 他们认为在通过晚期糖基化终末产物受体(receptor of advanced glycation end, RAGE)通路激活的纤维化发生过程中血清高迁移率族蛋白-1(Serum high mobility group box 1, HMGB-1)与TGF-β产物及胶原沉积有明确关联. 被CCl4处理的SD大鼠第2周尾部静脉注射RAGEsiRNA, 第6周显示出血清中炎症细胞因子, NF-κB, Ⅲ型前胶原以及肝纤维化水平的降低, 这表明HMGB-1/RAGE可能是逆转肝纤维化的一个新的研究靶点.
近年来研究发现, 调节细胞因子微环境和改变炎症细胞组成是新兴的逆转肝纤维化途径. 有趣的是, 代表性地被认为有促进肝纤维化和促进生成血管作用的血管内皮生长因子也可能是肝纤维化逆转所需要的条件[59]. 这意味着在探索逆转途径的时候我们不能只一味地研究那些可以逆转肝纤维化的因素, 还应关注到其他所需要的重要因素.
半乳糖凝集素3蛋白是在炎症反应中显著增多的半乳凝素[61-63], 近年在一些疾病模型中被认为与纤维化的发病机制有关. Traber等[64]研究证实, 在毒素诱导的大鼠肝纤维化模型中半乳凝素复合体糖类药物可以促进肝纤维化的逆转, 并且与降低门静脉高压有联系. Cha等[65]认为, 支链氨基酸(branched-chain amino acids, BCAA)通过抑制TGF-β1, 下调对Smad-4、TIMP-1和Col1a2刺激的反应. 此外, BCAA抑制肝细胞癌的血管再生及细胞增殖并加大肝脏癌细胞的凋亡.
目前临床对肝脏纤维化的治疗主要有以下几个方向: (1)保护肝细胞: 如熊去氧胆酸、多烯磷脂酰胆碱、前列腺素E等药物能在各种慢性肝病中保护肝细胞并且抑制其凋亡; (2)抑制或中和细胞因子活性: 如抑制PDGF和TGF-β等调控HSC活化从而抑制纤维化发生; (3)抑制HSC活性或者促进HSC凋亡: 目前临床治疗常用干扰素阻止HSC的增殖和活化, 减少Ⅰ、Ⅲ型胶原成分mRNA的转录, 从而减少ECM的表达. 索拉非尼是一种多效激酶抑制剂, 体外实验表明其可以抑制肝纤维化的大鼠和患者肝脏中的HSC活性, 促进其凋亡. 沙格雷酯是5-TH2A和5-TH2B受体拮抗剂, 因其可以减轻肝硬化模型肝脏的炎症及降低HSC活性, 有可能被用于肝纤维化的治疗[66]; (4)直接抑制肝脏ECM的合成和分泌: 如秋水仙碱直接抑制肝细胞内微管形成、干扰胶原分泌、促进胶原降解, 从而抑制肝脏ECM的合成与分解; (5)改善肝脏微循环: Liu等[67]证实HGF具有促新生血管生成作用, 从而改善机体局部微循环, 促进肝功能恢复; (6)基因治疗: 有研究证实rIL-10基因在肝组织中高表达可能通过直接或间接抑制或下调肝组织内肿瘤坏死因子和COX-2的表达而抑制HSC的活化起到抗纤维化作用. Huang等[68]证实转染rIL-10可减轻大鼠肝纤维化; (7)中药治疗: 很多中药具有清除氧自由基及抗氧化促进肝细胞再生、增加肝血流量, 改善肝脏微循环、改善缺血缺氧的作用. 主要是抑制HSC活化和抑制胶原纤维生成及降解现有胶原、阻断特定信号通路等途径发挥抗肝纤维化作用.
肝纤维化的形成机制非常复杂, 而HSC的活化与增殖作为肝纤维化的中心环节已得到公认. 肝纤维化的可逆性为肝纤维化的治疗提供了很多潜在的方法. 目前将HSC作为肝纤维化治疗的靶点已看到可观的前景. 但绝大部分研究仍处于动物实验阶段, 并不能完全效仿人类肝病致病因素. 在动物实验中有效的方案是否在人体具有同样的效果等问题还有待研究. 且除HSC相关途径外其他的逆转途径也不容忽视, 需继续研究. 肝纤维化的治疗虽已取得较大进展, 但由于作用靶位单一, 往往导致疗效并不理想. 因此, 进一步完善肝纤维化的分子机制, 探索有效的抗肝纤维化方案仍然是研究的重点.
肝纤维化是肝脏对慢性损伤的一种修复反应, 多是持续性肝脏损伤或纤维化刺激因子刺激产生的共有病理改变, 是一项严重的全球性健康难题. 近年来临床研究发现, 由病毒性肝炎造成肝纤维化或肝硬化的患者, 在成功接受病毒性肝炎治疗后, 其肝纤维化甚至肝硬化发生了逆转现象.
肝纤维化以及肝硬化主要是慢性肝病造成的, 已经成为世界性的难题. 目前临床对晚期肝硬化唯一有效的方法仍是肝移植. 但是这种技术的应用受限, 况且肝纤维化初期临床表现不明显, 易被人们所忽视. 因此肝纤维化有无逆转的可能性, 对于研究治疗方法是一个关键性的环节.
Huang等的Modu-lation of hepatic stellate cells and reversibility of hepatic fibrosis一文提供了肝纤维化可以逆转的证据并整理了HSC对肝纤维化的调控机制.
本文就近年来有关肝纤维化逆转机制的研究以及治疗概况作综述, 总结了肝纤维化的多方面逆转机制, 并以图文结合的形式阐释部分机制.
结合不同肝纤维化逆转机制, 对于研究相关治疗靶点有参考价值. 同时通过对相关机制的整理, 指出今后还需深入研究的方向.
细胞外基质(ECM): 是由细胞合成并分泌到胞外、分布在细胞表面或细胞之间的大分子, 主要是一些多糖和蛋白或蛋白聚糖. 这些物质构成复杂的网架结构, 支持并连接组织结构、调节组织的发生和细胞的生理活动. 目前认为, 肝纤维化时肝组织中EMC的病理性改变是由于控制ECM形成及降解的稳态机制失调所致.
肝星状细胞(HSC): 肝星状细胞是ECM的主要来源, HSC激活并转化为肌成纤维细胞样细胞, 各种致纤维化因素均把HSC作为最终靶细胞. 正常情况下肝星状细胞处于静止状态. 当肝脏受到炎症或机械刺激等损伤时, 肝星状细胞被激活, 其表型由静止型转变为激活型.
张永生, 副研究员, 浙江中医药大学药学院; 赵铁建, 教授, 广西中医药大学基础医学院生理学教研室
作为综述文章整理了近年来有关肝纤维化逆转的机制和治疗概况. 本文多处使用清晰的插图, 可以直观地解释肝纤维化的机制.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 北京市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 马亚娟 电编:李瑞芳
| 1. | Sun M, Kisseleva T. Reversibility of liver fibrosis. Clin Res Hepatol Gastroenterol. 2015;39 Suppl 1:S60-S63. [PubMed] [DOI] |
| 3. | Lee YA, Wallace MC, Friedman SL. Pathobiology of liver fibrosis: a translational success story. Gut. 2015;64:830-841. [PubMed] [DOI] |
| 4. | Ismail MH, Pinzani M. Reversal of liver fibrosis. Saudi J Gastroenterol. 2009;15:72-79. [PubMed] [DOI] |
| 5. | Popper H, Uenfriend S. Hepatic fibrosis. Correlation of biochemical and morphologic investigations. Am J Med. 1970;49:707-721. [PubMed] [DOI] |
| 6. | Morcos SH, Khayyal MT, Mansour MM, Saleh S, Ishak EA, Girgis NI, Dunn MA. Reversal of hepatic fibrosis after praziquantel therapy of murine schistosomiasis. Am J Trop Med Hyg. 1985;34:314-321. [PubMed] [DOI] |
| 7. | Bataller R, Brenner DA. Liver fibrosis. J Clin Invest. 2005;115:209-218. [PubMed] [DOI] |
| 8. | Iredale JP, Benyon RC, Pickering J, McCullen M, Northrop M, Pawley S, Hovell C, Arthur MJ. Mechanisms of spontaneous resolution of rat liver fibrosis. Hepatic stellate cell apoptosis and reduced hepatic expression of metalloproteinase inhibitors. J Clin Invest. 1998;102:538-549. [PubMed] [DOI] |
| 9. | Issa R, Zhou X, Constandinou CM, Fallowfield J, Millward-Sadler H, Gaca MD, Sands E, Suliman I, Trim N, Knorr A. Spontaneous recovery from micronodular cirrhosis: evidence for incomplete resolution associated with matrix cross-linking. Gastroenterology. 2004;126:1795-1808. [PubMed] [DOI] |
| 10. | Issa R, Williams E, Trim N, Kendall T, Arthur MJ, Reichen J, Benyon RC, Iredale JP. Apoptosis of hepatic stellate cells: involvement in resolution of biliary fibrosis and regulation by soluble growth factors. Gut. 2001;48:548-557. [PubMed] [DOI] |
| 11. | Kaplan MM, DeLellis RA, Wolfe HJ. Sustained biochemical and histologic remission of primary biliary cirrhosis in response to medical treatment. Ann Intern Med. 1997;126:682-688. [PubMed] [DOI] |
| 13. | Liu X, Xu J, Brenner DA, Kisseleva T. Reversibility of Liver Fibrosis and Inactivation of Fibrogenic Myofibroblasts. Curr Pathobiol Rep. 2013;1:209-214. [PubMed] [DOI] |
| 14. | Kisseleva T, Brenner DA. Hepatic stellate cells and the reversal of fibrosis. J Gastroenterol Hepatol. 2006;21 Suppl 3:S84-S87. [PubMed] [DOI] |
| 15. | Chejfec G. Controversies in pathology. Is cirrhosis of the liver a reversible disease? Arch Pathol Lab Med. 2000;124:1585-1586; discussion 1592-1593. [PubMed] [DOI] |
| 16. | Wanless IR, Nakashima E, Sherman M. Regression of human cirrhosis. Morphologic features and the genesis of incomplete septal cirrhosis. Arch Pathol Lab Med. 2000;124:1599-1607. [PubMed] [DOI] |
| 17. | Xu B, Lin L, Xu G, Zhuang Y, Guo Q, Liu Y, Wang H, Zhou X, Wu S, Bao S. Long-term lamivudine treatment achieves regression of advanced liver fibrosis/cirrhosis in patients with chronic hepatitis B. J Gastroenterol Hepatol. 2015;30:372-378. [PubMed] [DOI] |
| 18. | Zimmermann HW, Tacke F. In search of the magic bullet: can liver inflammation and fibrosis be reversed with medications? Expert Rev Gastroenterol Hepatol. 2015;9:1139-1141. [PubMed] [DOI] |
| 20. | Duseja A. Reversibility of hepatic fibrosis and cirrhosis-another evidence. J Clin Exp Hepatol. 2013;3:167-168. [PubMed] [DOI] |
| 21. | Krizhanovsky V, Yon M, Dickins RA, Hearn S, Simon J, Miething C, Yee H, Zender L, Lowe SW. Senescence of activated stellate cells limits liver fibrosis. Cell. 2008;134:657-667. [PubMed] [DOI] |
| 22. | Puche JE, Lee YA, Jiao J, Aloman C, Fiel MI, Muñoz U, Kraus T, Lee T, Yee HF, Friedman SL. A novel murine model to deplete hepatic stellate cells uncovers their role in amplifying liver damage in mice. Hepatology. 2013;57:339-350. [PubMed] [DOI] |
| 23. | Kisseleva T, Cong M, Paik Y, Scholten D, Jiang C, Benner C, Iwaisako K, Moore-Morris T, Scott B, Tsukamoto H. Myofibroblasts revert to an inactive phenotype during regression of liver fibrosis. Proc Natl Acad Sci USA. 2012;109:9448-9453. [PubMed] [DOI] |
| 24. | Troeger JS, Mederacke I, Gwak GY, Dapito DH, Mu X, Hsu CC, Pradere JP, Friedman RA, Schwabe RF. Deactivation of hepatic stellate cells during liver fibrosis resolution in mice. Gastroenterology. 2012;143:1073-1083.e22. [PubMed] [DOI] |
| 25. | Pellicoro A, Ramachandran P, Iredale JP, Fallowfield JA. Liver fibrosis and repair: immune regulation of wound healing in a solid organ. Nat Rev Immunol. 2014;14:181-194. [PubMed] [DOI] |
| 27. | Cao S, Yaqoob U, Das A, Shergill U, Jagavelu K, Huebert RC, Routray C, Abdelmoneim S, Vasdev M, Leof E. Neuropilin-1 promotes cirrhosis of the rodent and human liver by enhancing PDGF/TGF-beta signaling in hepatic stellate cells. J Clin Invest. 2010;120:2379-2394. [PubMed] [DOI] |
| 28. | Jiang Y, Wang C, Li YY, Wang XC, An JD, Wang YJ, Wang XJ. Mistletoe alkaloid fractions alleviates carbon tetrachloride-induced liver fibrosis through inhibition of hepatic stellate cell activation via TGF-β/Smad interference. J Ethnopharmacol. 2014;158 Pt A:230-238. [PubMed] [DOI] |
| 29. | Shi H, Dong L, Bai Y, Zhao J, Zhang Y, Zhang L. Chlorogenic acid against carbon tetrachloride-induced liver fibrosis in rats. Eur J Pharmacol. 2009;623:119-124. [PubMed] [DOI] |
| 30. | 朱 晓静, 张 峰, 孔 德松. 脂多糖/Toll样受体4信号转导与肝纤维化的研究进展. 中国药理学与毒理学杂志. 2013;27:106-108. |
| 31. | Paik YH, Schwabe RF, Bataller R, Russo MP, Jobin C, Brenner DA. Toll-like receptor 4 mediates inflammatory signaling by bacterial lipopolysaccharide in human hepatic stellate cells. Hepatology. 2003;37:1043-1055. [PubMed] [DOI] |
| 32. | Zhu Q, Zou L, Jagavelu K, Simonetto DA, Huebert RC, Jiang ZD, DuPont HL, Shah VH. Intestinal decontamination inhibits TLR4 dependent fibronectin-mediated cross-talk between stellate cells and endothelial cells in liver fibrosis in mice. J Hepatol. 2012;56:893-899. [PubMed] [DOI] |
| 33. | Qian H, Shi J, Fan TT, Lv J, Chen SW, Song CY, Zheng ZW, Xie WF, Chen YX. Sophocarpine attenuates liver fibrosis by inhibiting the TLR4 signaling pathway in rats. World J Gastroenterol. 2014;20:1822-1832. [PubMed] [DOI] |
| 34. | Liu L, Wei J, Huo X, Fang S, Yao D, Gao J, Jiang H, Zhang X. The Salvia miltiorrhiza monomer IH764-3 induces apoptosis of hepatic stellate cells in vivo in a bile duct ligation-induced model of liver fibrosis. Mol Med Rep. 2012;6:1231-1238. [PubMed] [DOI] |
| 35. | 鲍 佳春, 袁 凤来, 陆 伟国. 肝星状细胞激活与增殖相关信号转导通路在肝纤维化中的作用及机制. 中国临床药理学与治疗学. 2009;14:455-459. |
| 36. | Zhang F, Zhang Z, Chen L, Kong D, Zhang X, Lu C, Lu Y, Zheng S. Curcumin attenuates angiogenesis in liver fibrosis and inhibits angiogenic properties of hepatic stellate cells. J Cell Mol Med. 2014;18:1392-1406. [PubMed] [DOI] |
| 37. | Li JF, Chen BC, Lai DD, Jia ZR, Andersson R, Zhang B, Yao JG, Yu Z. Soy isoflavone delays the progression of thioacetamide-induced liver fibrosis in rats. Scand J Gastroenterol. 2011;46:341-349. [PubMed] [DOI] |
| 38. | Liu XJ, Yang L, Mao YQ, Wang Q, Huang MH, Wang YP, Wu HB. Effects of the tyrosine protein kinase inhibitor genistein on the proliferation, activation of cultured rat hepatic stellate cells. World J Gastroenterol. 2002;8:739-745. [PubMed] [DOI] |
| 39. | Hoch RV, Soriano P. Roles of PDGF in animal development. Development. 2003;130:4769-4784. [PubMed] [DOI] |
| 40. | Abdollahi A, Li M, Ping G, Plathow C, Domhan S, Kiessling F, Lee LB, McMahon G, Gröne HJ, Lipson KE. Inhibition of platelet-derived growth factor signaling attenuates pulmonary fibrosis. J Exp Med. 2005;201:925-935. [PubMed] [DOI] |
| 41. | Heldin CH, Westermark B. Mechanism of action and in vivo role of platelet-derived growth factor. Physiol Rev. 1999;79:1283-1316. [PubMed] |
| 42. | Jang YO, Jun BG, Baik SK, Kim MY, Kwon SO. Inhibition of hepatic stellate cells by bone marrow-derived mesenchymal stem cells in hepatic fibrosis. Clin Mol Hepatol. 2015;21:141-149. [PubMed] [DOI] |
| 43. | Scarpa M, Grillo AR, Brun P, Macchi V, Stefani A, Signori S, Buda A, Fabris P, Giordani MT, De Caro R. Snail1 transcription factor is a critical mediator of hepatic stellate cell activation following hepatic injury. Am J Physiol Gastrointest Liver Physiol. 2011;300:G316-G326. [PubMed] [DOI] |
| 44. | Bachelder RE, Yoon SO, Franci C, de Herreros AG, Mercurio AM. Glycogen synthase kinase-3 is an endogenous inhibitor of Snail transcription: implications for the epithelial-mesenchymal transition. J Cell Biol. 2005;168:29-33. [PubMed] [DOI] |
| 45. | Barberà MJ, Puig I, Domínguez D, Julien-Grille S, Guaita-Esteruelas S, Peiró S, Baulida J, Francí C, Dedhar S, Larue L. Regulation of Snail transcription during epithelial to mesenchymal transition of tumor cells. Oncogene. 2004;23:7345-7354. [PubMed] [DOI] |
| 46. | Peinado H, Quintanilla M, Cano A. Transforming growth factor beta-1 induces snail transcription factor in epithelial cell lines: mechanisms for epithelial mesenchymal transitions. J Biol Chem. 2003;278:21113-21123. [PubMed] [DOI] |
| 47. | Gordillo-Bastidas D, Oceguera-Contreras E, Salazar-Montes A, González-Cuevas J, Hernández-Ortega LD, Armendáriz-Borunda J. Nrf2 and Snail-1 in the prevention of experimental liver fibrosis by caffeine. World J Gastroenterol. 2013;19:9020-9033. [PubMed] [DOI] |
| 48. | Muriel P, Arauz J. Coffee and liver diseases. Fitoterapia. 2010;81:297-305. [PubMed] [DOI] |
| 49. | Gressner OA. Less Smad2 is good for you! A scientific update on coffee's liver benefits. Hepatology. 2009;50:970-978. [PubMed] [DOI] |
| 50. | Gressner OA, Lahme B, Rehbein K, Siluschek M, Weiskirchen R, Gressner AM. Pharmacological application of caffeine inhibits TGF-beta-stimulated connective tissue growth factor expression in hepatocytes via PPARgamma and SMAD2/3-dependent pathways. J Hepatol. 2008;49:758-767. [PubMed] [DOI] |
| 51. | Uemura M, Swenson ES, Gaça MD, Giordano FJ, Reiss M, Wells RG. Smad2 and Smad3 play different roles in rat hepatic stellate cell function and alpha-smooth muscle actin organization. Mol Biol Cell. 2005;16:4214-4224. [PubMed] [DOI] |
| 52. | Raskovalova T, Huang X, Sitkovsky M, Zacharia LC, Jackson EK, Gorelik E. Gs protein-coupled adenosine receptor signaling and lytic function of activated NK cells. J Immunol. 2005;175:4383-4391. [PubMed] [DOI] |
| 53. | Chiang DJ, Roychowdhury S, Bush K, McMullen MR, Pisano S, Niese K, Olman MA, Pritchard MT, Nagy LE. Adenosine 2A receptor antagonist prevented and reversed liver fibrosis in a mouse model of ethanol-exacerbated liver fibrosis. PLoS One. 2013;8:e69114. [PubMed] [DOI] |
| 54. | Bai T, Yao YL, Jin XJ, Lian LH, Li Q, Yang N, Jin Q, Wu YL, Nan JX. Acanthoic acid, a diterpene in Acanthopanax koreanum, ameliorates the development of liver fibrosis via LXRs signals. Chem Biol Interact. 2014;218:63-70. [PubMed] [DOI] |
| 55. | Lee HS, Huang GT, Chen CH, Chiou LL, Lee CC, Yang PM, Chen DS, Sheu JC. Less reversal of liver fibrosis after prolonged carbon tetrachloride injection. Hepatogastroenterology. 2001;48:1312-1315. [PubMed] |
| 57. | Parsons CJ, Bradford BU, Pan CQ, Cheung E, Schauer M, Knorr A, Krebs B, Kraft S, Zahn S, Brocks B. Antifibrotic effects of a tissue inhibitor of metalloproteinase-1 antibody on established liver fibrosis in rats. Hepatology. 2004;40:1106-1115. [PubMed] [DOI] |
| 58. | Barry-Hamilton V, Spangler R, Marshall D, McCauley S, Rodriguez HM, Oyasu M, Mikels A, Vaysberg M, Ghermazien H, Wai C. Allosteric inhibition of lysyl oxidase-like-2 impedes the development of a pathologic microenvironment. Nat Med. 2010;16:1009-1017. [PubMed] [DOI] |
| 59. | Yang L, Kwon J, Popov Y, Gajdos GB, Ordog T, Brekken RA, Mukhopadhyay D, Schuppan D, Bi Y, Simonetto D. Vascular endothelial growth factor promotes fibrosis resolution and repair in mice. Gastroenterology. 2014;146:1339-1350.e1. [PubMed] [DOI] |
| 60. | Chen RJ, Wu HH, Wang YJ. Strategies to prevent and reverse liver fibrosis in humans and laboratory animals. Arch Toxicol. 2015;89:1727-1750. [PubMed] [DOI] |
| 61. | Iacobini C, Menini S, Ricci C, Blasetti Fantauzzi C, Scipioni A, Salvi L, Cordone S, Delucchi F, Serino M, Federici M. Galectin-3 ablation protects mice from diet-induced NASH: a major scavenging role for galectin-3 in liver. J Hepatol. 2011;54:975-983. [PubMed] [DOI] |
| 62. | Mackinnon AC, Gibbons MA, Farnworth SL, Leffler H, Nilsson UJ, Delaine T, Simpson AJ, Forbes SJ, Hirani N, Gauldie J. Regulation of transforming growth factor-β1-driven lung fibrosis by galectin-3. Am J Respir Crit Care Med. 2012;185:537-546. [PubMed] [DOI] |
| 63. | Henderson NC, Mackinnon AC, Farnworth SL, Kipari T, Haslett C, Iredale JP, Liu FT, Hughes J, Sethi T. Galectin-3 expression and secretion links macrophages to the promotion of renal fibrosis. Am J Pathol. 2008;172:288-298. [PubMed] [DOI] |
| 64. | Traber PG, Chou H, Zomer E, Hong F, Klyosov A, Fiel MI, Friedman SL. Regression of fibrosis and reversal of cirrhosis in rats by galectin inhibitors in thioacetamide-induced liver disease. PLoS One. 2013;8:e75361. [PubMed] [DOI] |
| 65. | Cha JH, Bae SH, Kim HL, Park NR, Choi ES, Jung ES, Choi JY, Yoon SK. Branched-chain amino acids ameliorate fibrosis and suppress tumor growth in a rat model of hepatocellular carcinoma with liver cirrhosis. PLoS One. 2013;8:e77899. [PubMed] [DOI] |
| 66. | Kim DC, Jun DW, Kwon YI, Lee KN, Lee HL, Lee OY, Yoon BC, Choi HS, Kim EK. 5-HT2A receptor antagonists inhibit hepatic stellate cell activation and facilitate apoptosis. Liver Int. 2013;33:535-543. [PubMed] [DOI] |
| 67. | Liu R, Wu S, Cao G, Wang W, Liu K, Wu S. Transfection of human hepatocyte growth factor gene inhibits advancing pulmonary arterial hypertension induced by shunt flow in a rabbit model. Transplant Proc. 2013;45:705-712. [PubMed] [DOI] |
| 68. | Huang YH, Chen YX, Zhang LJ, Chen ZX, Wang XZ. Hydrodynamics-based transfection of rat interleukin-10 gene attenuates porcine serum-induced liver fibrosis in rats by inhibiting the activation of hepatic stellate cells. Int J Mol Med. 2014;34:677-686. [PubMed] [DOI] |
| 69. | Friedman SL, Bansal MB. Reversal of hepatic fibrosis -- fact or fantasy? Hepatology. 2006;43:S82-S88. [PubMed] [DOI] |