修回日期: 2017-05-02
接受日期: 2017-05-22
在线出版日期: 2017-08-18
Vav基因家族包括Vav1、Vav2、Vav3基因, 在生理及病理过程中都发挥着重要的调控作用. 近年来发现Vav基因家族成员与消化系恶性肿瘤有较为密切的关系, 已取得了一些研究成果. 但迄今为止有关Vav基因家族成员与消化系恶性肿瘤关系的研究还不全面, 且有一些结果不一致. 因此, 总结Vav基因家族成员的调控机制并分析其在消化系恶性肿瘤中发挥的作用有可能对阐明发病机制、提出新的治疗靶点有益. 故本文对Vav基因家族的分子功能、调控机制及在消化系恶性肿瘤中的作用进行了综述及总结, 并对该基因家族的潜在价值进行了预测.
核心提要:Vav基因家族的成员通过其广泛的基因调控功能参与了消化系恶性肿瘤的生物学活动, 与肿瘤进展相关, 深入研究其作用机制可能对消化系恶性肿瘤的综合诊治有益.
引文著录: 李勇, 檀碧波. Vav基因家族的分子调控机制及其与消化系恶性肿瘤的关系. 世界华人消化杂志 2017; 25(23): 2102-2108
Revised: May 2, 2017
Accepted: May 22, 2017
Published online: August 18, 2017
Vav1, Vav2, and Vav3 genes are three members of the Vav family, which play important roles in physiological and pathological processes. In recent years, it has been reported that Vav family members are closely associated with malignant digestive system tumors. However, there are still some inconsistent results. Thus, it is valuable to investigate the molecular mechanisms of Vav family members in malignant digestive system tumors, which may be beneficial in understanding the pathogenesis of these malignancies and identifying new therapeutic targets. In this paper, we review the functions, regulatory mechanisms, and roles of Vav family members in digestive system malignancies, and discuss their potential application value.
- Citation: Li Y, Tan BB. Relationship between Vav family members and digestive system malignancies. Shijie Huaren Xiaohua Zazhi 2017; 25(23): 2102-2108
- URL: https://www.wjgnet.com/1009-3079/full/v25/i23/2102.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i23.2102
消化系恶性肿瘤在我国发病率、死亡率均居于恶性肿瘤前列. 其中胃癌、肝癌、食管癌、结直肠癌均在发病率死亡率的前十位之内[1-3]. 因此, 积极探讨消化系恶性肿瘤的发病机制、确定与发病有关的分子对于筛选肿瘤标志物、鉴定潜在的治疗靶标有重要的意义. 这一领域是近年来研究的热点, 已有多种基因、RNA、蛋白等分子被证实参与了消化系恶性肿瘤的发生及进展[4-6]. Vav基因家族成员也被证实在包括消化系恶性肿瘤在内的多种疾病中发挥了重要作用[7-9]. 由于Vav基因家族成员参与多条信号通路, 具有较为广泛的调控功能, 因而该基因家族在消化系恶性肿瘤的作用已受到研究者的关注. 但相关研究开展时间较短, 且以基础研究为主, 因而得到的结果较为分散, 尚未形成完整的研究体系. 本文对目前本领域所取得的成果进行了总结综述, 进而对Vav基因家族研究的前景及价值进行了预测.
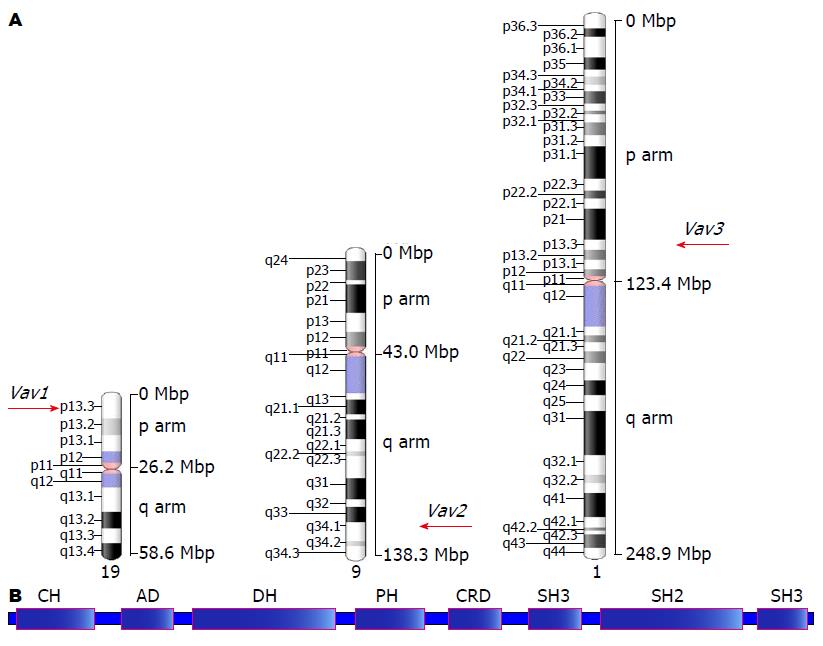
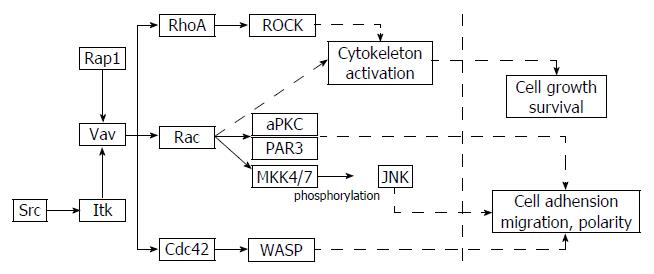
Vav基因家族是受酪氨酸激酶调控的一组基因, 其主要功能是作为鸟嘌呤核苷酸交换因子在细胞调控中发挥作用[10-12]. Vav基因家族包括3个成员, 即Vav1、Vav2、Vav3基因[13-15]. 其中Vav1基因位于人染色体19p13.3, 全长84.7 kb, 包括27个外显子, 编码的蛋白包括790个氨基酸, 能够调整细胞骨架, 调控T、B淋巴细胞的功能[16,17]. Vav2基因位于人染色体9q34.2, 全长230.5 kb, 包括32个外显子, 编码的蛋白由878个氨基酸构成, Vav2基因可在大多组织中检测到, 发挥着多种转录功能[18,19]. Vav3基因位于人染色体1p13.3, 全长393.8 kb, 包括32个外显子, 编码的蛋白由875个氨基酸组成, 可与Rho蛋白家族的成员Rho A、Rac1结合而发挥作用[20,21]. Vav家族成员的基因定位及蛋白质结构域简图如图1. Vav家族的蛋白功能主要是与小G蛋白超家族的亚家族Rho家族的成员结合, 可参与细胞的骨架构建及黏着斑复合体组装、促进细胞的伪足及皱褶的形成等作用, 在细胞内信号转导过程中能发挥分子开关作用, 调控信号转导通路的活性, 从而发挥其作用[22]. Vav家族成员的主要调节功能如图2.
口腔为消化道的起始部分, 该部位发生的恶性肿瘤多为鳞状细胞癌(oral squamous cell carcinoma, OSCC). 有关Vav基因与口腔癌的研究较为少见. Trenkle等[23]研究发现Vav3的同源异构体(isoform)Vav3.1在OSCC组织中表达降低, 作者认为Vav3.1能够通过直接或竞争性调节Vav3的表达而在OSCC的转移进展中发挥了作用. 但有关Vav基因在口腔癌细胞中的调控机制目前还不明确, 需要深入研究.
食管癌的发生率和死亡率均居于我国恶性肿瘤的前列[24,25], 探讨食管癌的发病机制有明显的临床意义, 因此食管癌的相关基因研究为肿瘤研究的热点之一. 但有关Vav基因家族与食管癌关系的报道罕见. 张强[26]研究发现木犀草素作用于食管癌细胞株后可以诱导细胞周期停滞、促进凋亡, 细胞的Vav3表达下降, 提示Vav3可能与食管癌细胞的增殖及凋亡有关. 但迄今还没有关于食管癌中Vav基因家族作用的直接证据, 相关研究还有待深入.
迄今关于Vav基因家族中的Vav1、Vav3与胃癌的关系研究报道较多, 研究大多证实Vav基因在胃癌的发生、进展过程中都发挥了重要的作用, 可能作为胃癌标志物或治疗的靶点对胃癌的综合诊治作出贡献.
2.3.1 Vav1与胃癌的关系: Shin等[27]研究发现合并活动性幽门螺杆菌胃癌患者的Vav1甲基化水平升高, 提示Vav1与胃癌发病有关. 张明明等[28]研究发现Vav1在胃癌患者外周血中表达水平增高, 且证实Vav1基因E59K位点多态性与胃癌有关. 这些研究提示Vav1基因可能是导致胃癌发病的重要因素, 且有可能作为新的胃癌分子标志物. 本课题组研究[29]发现, Vav1蛋白可能促进了胃癌的侵袭转移, 胃癌组织中Vav1蛋白高表达是患者预后差的标志, Vav1蛋白参与胃癌侵袭转移可能是通过调控基质金属蛋白酶-基质金属蛋白酶抑制剂系统而实现的. 赵志华等[30]的研究也得到了与我们相似的结果. 这些研究都证实Vav1基因与胃癌有关, 但研究比较分散, 所得到的结论是否有临床应用价值还有待深入分析.
2.3.2 Vav3与胃癌的关系:Vav3基因与胃癌的关系在目前已有较多研究报道. Li等[31]研究发现, 胃癌患者血清中Vav3的甲基化率为54.2%, 作者认为检测血清中的Vav3甲基化情况对诊断胃癌有帮助. Lin等[32]的队列研究证实, Vav3蛋白在胃癌组织中表达增高, 是肿瘤侵袭转移及预后不良的标志; 研究还发现, 抑制胃癌细胞中的Vav3表达后细胞的增殖能力减弱, 说明Vav3是导致胃癌进展的重要因素. 关于Vav3基因在胃癌细胞中的调控机制, 本课题组进行了比较深入的研究. 本课题组研究[33]发现, 胃癌组织中Vav3的表达增高, 抑制胃癌细胞中的Vav3基因表达可以通过调控PCNA、cyclin E1、MMP、MMP-7、P21、P27、TIMP-1、TIMP-2等基因而使胃癌细胞的增殖和侵袭迁移能力减弱. 本课题组还发现[34], 抑制胃癌耐药细胞的Vav3表达可以逆转细胞对化疗药物的耐药性, 其机制与Vav3基因通过调控JNK信号通路影响MDR1/P-gp、GST-π、Bcl-2等耐药基因表达有关. 这些结果提示Vav3的异常表达(甲基化、表达增加等)在胃癌进展中发挥了重要作用, 深入研究可能确定新的胃癌治疗靶基因.
迄今关于Vav基因家族成员与结直肠癌的关系已有一些报道, 大多认为Vav基因家族成员与结直肠癌有关, 但整体研究还不完整, 有待系统化及深入化.
2.4.1 Vav1与结直肠癌的关系: 张明明等[35]应用免疫组织化学技术检测结直肠癌组织中的Vav1表达, 结果发现肿瘤组织中的Vav1蛋白存在高表达, 作者推断Vav1可能通过调控肿瘤细胞的增殖相关基因促进了肿瘤的进展. Huang等[36]研究发现, Vav1基因与结直肠癌的预后有关, 并可作为结直肠癌放疗预测的标志物. 这些研究结果提示Vav1基因在结直肠癌中具有原癌基因的特征, 在促进结直肠癌的进展中可能发挥了作用. 但Zenker等[37]的动物实验结果显示, Vav1表达的缺失并不能阻断肿瘤的发生. 因此, 有关Vav1与结直肠癌的具体关系还有待深入研究.
2.4.2 Vav2与结直肠癌的关系: 目前还未见有关Vav2在结直肠癌组织中表达的相关报道. Doleman等[38]进行的体外研究发现, 应用鱼油的重要成分二十碳五烯酸作用于结肠癌细胞株HT-29后细胞中的Vav2基因发生明显变化, 这为Vav2用于结直肠癌的治疗提供了一些线索. 但目前研究过少, Vav2与结直肠癌的具体关系还有待深入研究.
2.4.3 Vav3与结直肠癌的关系: Uen等[39]研究发现, Vav3表达是结直肠癌预后的独立危险因素, 这一结论与Vuong等[40]的研究结果符合. 这些都提示Vav3在结直肠癌的进展转移过程中发挥了重要作用, 深入研究Vav3的作用机制对深入阐明结直肠癌的发病机制有帮助.
关于Vav基因与肝癌的关系迄今未见直接的研究结果. Wang等[41]研究发现, miR-195可以通过抑制肝癌细胞中的Vav2表达而抑制肝癌的血管生成及转移. 这一结果间接证实Vav2有促进肝癌进展的作用. 但这种间接的、非系统研究的结果还不能证实Vav2与肝癌的关系, 具体情况还有待深入研究. Qi等[42]应用蛋白质组学技术检测了三萜黄芪甲苷(triterpenoid astragaloside, IV)作用后肝癌细胞株HepG2蛋白质的变化, 结果发现IV可以抑制HepG2细胞的生长, 细胞中Vav3表达受到抑制, 提示Vav3蛋白可能参与了肝癌细胞的生长. 但这些研究尚待进一步深入, 以阐明Vav基因与肝癌的关系.
关于Vav基因与胰腺癌关系的研究开展的时间较长, 取得的结果也较多, 对于Vav基因在胰腺癌中的价值已有了一定的研究基础.
2.6.1 Vav1与胰腺癌的关系: Lazer等[43]认为在胰腺癌等肿瘤的治疗中, Vav1是有潜在治疗价值的靶基因. Fernandez-Zapico等[44]在2005年的研究中就发现Vav1表达阳性的胰腺癌患者预后较差. 作者进一步通过细胞实验及体内研究证实Vav1具有调控胰腺癌细胞增殖、凋亡的作用, 对Vav1与胰腺癌的关系进行了较为深入的阐述. Yeh等[45]也认为Vav1可能为胰腺癌治疗的靶基因. Razidlo等[46]的研究发现Vav1与胰腺癌对化疗药物的耐药有关, 硫唑嘌呤可以通过抑制Vav1表达而抑制Vav1阳性胰腺癌的肿瘤生长, 提示此类药物用于Vav1阳性胰腺癌的治疗可能取得更好的效果. 这些研究都证实Vav1与胰腺癌关系密切, 将基础研究结果转化应用于胰腺癌临床治疗可能对改善胰腺癌综合诊治水平有益.
2.6.2 Vav2与胰腺癌的关系: 关于Vav2与胰腺癌关系尚无直接关系的报道. 有研究发现Vav2可以激活胰腺细胞中Rac1的表达[47], 而Rac1则对胰腺癌的进展有促进作用[48]. 综合上述研究结果, 可以推测Vav2在胰腺癌中可能发挥了作用, 但Vav2与胰腺癌的确切关系及分子机制还有待深入研究.
2.6.3 Vav3与胰腺癌的关系: 关于Vav3与胰腺癌关系报道较少. Tsuboi等[49]的报道显示Vav3能促进胰腺癌的侵袭, Vav3阳性表达是预后差的标志. Ouyang等[50]应用转录组测序技术确定胰腺癌相关基因, 发现Vav3与胰腺癌关系密切. 有关Vav3与胰腺癌的研究目前较为零散, 因而还没有统一认识, 有待深入研究.
虽然Vav基因家族成员与消化系恶性肿瘤关系的研究已开展10余年且取得了可观的成果, 但本领域的研究仍然处于初始阶段. 目前仍存在许多问题, 需要继续深入. 主要的问题存在于下列方面: (1)Vav家族的成员由于具有较为广泛的调控作用, 且能够影响多条信号通路的状态, 因而该家族成员可从多个方面参与肿瘤的恶性生物学行为, 为消化系恶性肿瘤的诊治提供了新的思路. 但同时这种广泛的调控作用有可能导致比较明显的非特异性效应, 使基因的靶向性减弱, 从而影响其进一步应用; (2)有关Vav基因家族成员与消化系恶性肿瘤关系的研究较为分散, 尚未形成大规模的纵深研究. 就研究领域而言, 基础研究较多而临床研究较少. 在临床研究中, 单中心、小样本研究多, 多中心、大样本研究少见; (3)就基础研究的方法而言, 对Vav基因的干扰技术仍以RNA干扰为主, 而从DNA水平进行基因敲除的研究较少, 因而在Vav的分子功能研究方面尚有待进一步改进技术, 深入研究. 但从目前结果分析, Vav基因家族成员在消化系恶性肿瘤的发生、进展过程中发挥了重要作用, 深入研究并进行临床转化是具有重要价值的.
本文根据研究结果初步总结了Vav基因家族成员与消化系恶性肿瘤的关系, 发现Vav家族成员在消化系恶性肿瘤的发生、进展过程中发挥了重要的作用, 深入研究Vav1-3的功能具有潜在的临床价值, 逐渐将结果应用于临床可能对改善消化系恶性肿瘤的诊治水平有益. 将Vav基因家族成员的功能与临床相结合可能发现新的肿瘤标志物及治疗靶基因, 对提高肿瘤的综合诊治水平有益.
胃癌、肝癌、食管癌、结直肠癌等消化系恶性肿瘤均在发病率死亡率的前列. 积极探讨消化系恶性肿瘤的发病机制、确定与发病有关的分子有重要的意义. 由于Vav基因家族成员参与多条信号通路, 具有较为广泛的调控功能.
探讨Vav家族成员与消化系恶性肿瘤的关系对于阐明肿瘤发病机制、确定标志物及新的治疗靶基因有重要价值.
报道显示Vav基因家族成员在消化系恶性肿瘤中发挥了重要作用. 由于Vav基因家族成员参与多条信号通路, 具有较为广泛的调控功能, 因而该基因家族在消化系恶性肿瘤的作用已受到研究者的关注并取得了许多研究成果.
本文根据各学者的研究结果初步总结了Vav基因家族成员与消化系恶性肿瘤的关系, 发现Vav家族成员在消化系恶性肿瘤的发生、进展过程中发挥了重要的作用.
从目前结果分析, Vav基因家族成员在消化系恶性肿瘤的发生、进展过程中发挥了重要作用, 深入研究并进行临床转化是具有重要价值的.
陈鑫, 副主任医师, 天津医科大学总医院消化科; 崔彦, 主任医师, 解放军第306医院普通外科; 施宏, 主任医师, 福建省肿瘤医院内镜中心
本文总结了Vav基因家族在消化系恶性肿瘤发生、发展过程中的作用, 对消化系恶性肿瘤诊断治疗具有一定参考价值.
手稿来源: 邀请约稿
学科分类: 胃肠病学和肝病学
手稿来源地: 河北省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:李瑞芳
| 1. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 2. | Liang H, Fan JH, Qiao YL. Epidemiology, etiology, and prevention of esophageal squamous cell carcinoma in China. Cancer Biol Med. 2017;14:33-41. [PubMed] [DOI] |
| 3. | Chen W, Zheng R, Zhang S, Zeng H, Zuo T, Xia C, Yang Z, He J. Cancer incidence and mortality in China in 2013: an analysis based on urbanization level. Chin J Cancer Res. 2017;29:1-10. [PubMed] [DOI] |
| 4. | Bertotti A, Papp E, Jones S, Adleff V, Anagnostou V, Lupo B, Sausen M, Phallen J, Hruban CA, Tokheim C. The genomic landscape of response to EGFR blockade in colorectal cancer. Nature. 2015;526:263-267. [PubMed] [DOI] |
| 5. | Shen Q, Fan J, Yang XR, Tan Y, Zhao W, Xu Y, Wang N, Niu Y, Wu Z, Zhou J. Serum DKK1 as a protein biomarker for the diagnosis of hepatocellular carcinoma: a large-scale, multicentre study. Lancet Oncol. 2012;13:817-826. [PubMed] [DOI] |
| 6. | Cancer Genome Atlas Research Network. Comprehensive molecular characterization of gastric adenocarcinoma. Nature. 2014;513:202-209. [PubMed] [DOI] |
| 7. | Bustelo XR. Vav family exchange factors: an integrated regulatory and functional view. Small GTPases. 2014;5:9. [PubMed] [DOI] |
| 8. | Jiang K, Lu Q, Li Q, Ji Y, Chen W, Xue X. Astragaloside IV inhibits breast cancer cell invasion by suppressing Vav3 mediated Rac1/MAPK signaling. Int Immunopharmacol. 2017;42:195-202. [PubMed] [DOI] |
| 9. | Huang PH, Lu PJ, Ding LY, Chu PC, Hsu WY, Chen CS, Tsao CC, Chen BH, Lee CT, Shan YS. TGFβ promotes mesenchymal phenotype of pancreatic cancer cells, in part, through epigenetic activation of VAV1. Oncogene. 2017;36:2202-2214. [PubMed] [DOI] |
| 10. | Roth S, Bergmann H, Jaeger M, Yeroslaviz A, Neumann K, Koenig PA, Prazeres da Costa C, Vanes L, Kumar V, Johnson M. Vav Proteins Are Key Regulators of Card9 Signaling for Innate Antifungal Immunity. Cell Rep. 2016;17:2572-2583. [PubMed] [DOI] |
| 11. | Luft V, Reinhard J, Shibuya M, Fischer KD, Faissner A. The guanine nucleotide exchange factor Vav3 regulates differentiation of progenitor cells in the developing mouse retina. Cell Tissue Res. 2015;359:423-440. [PubMed] [DOI] |
| 12. | Sebban S, Farago M, Rabinovich S, Lazer G, Idelchuck Y, Ilan L, Pikarsky E, Katzav S. Vav1 promotes lung cancer growth by instigating tumor-microenvironment cross-talk via growth factor secretion. Oncotarget. 2014;5:9214-9226. [PubMed] [DOI] |
| 13. | Chen CH, Piraner D, Gorenstein NM, Geahlen RL, Beth Post C. Differential recognition of syk-binding sites by each of the two phosphotyrosine-binding pockets of the Vav SH2 domain. Biopolymers. 2013;99:897-907. [PubMed] [DOI] |
| 14. | Wan YJ, Yang Y, Leng QL, Lan B, Jia HY, Liu YH, Zhang CZ, Cao Y. Vav1 increases Bcl-2 expression by selective activation of Rac2-Akt in leukemia T cells. Cell Signal. 2014;26:2202-2209. [PubMed] [DOI] |
| 15. | Nomura T, Yamasaki M, Hirai K, Inoue T, Sato R, Matsuura K, Moriyama M, Sato F, Mimata H. Targeting the Vav3 oncogene enhances docetaxel-induced apoptosis through the inhibition of androgen receptor phosphorylation in LNCaP prostate cancer cells under chronic hypoxia. Mol Cancer. 2013;12:27. [PubMed] [DOI] |
| 16. | Fry AL, Laboy JT, Huang H, Hart AC, Norman KR. A Conserved GEF for Rho-Family GTPases Acts in an EGF Signaling Pathway to Promote Sleep-like Quiescence in Caenorhabditis elegans. Genetics. 2016;202:1153-1166. [PubMed] [DOI] |
| 17. | Helou YA, Petrashen AP, Salomon AR. Vav1 Regulates T-Cell Activation through a Feedback Mechanism and Crosstalk between the T-Cell Receptor and CD28. J Proteome Res. 2015;14:2963-2975. [PubMed] [DOI] |
| 18. | Cho CY, Lee KT, Chen WC, Wang CY, Chang YS, Huang HL, Hsu HP, Yen MC, Lai MZ, Lai MD. MST3 promotes proliferation and tumorigenicity through the VAV2/Rac1 signal axis in breast cancer. Oncotarget. 2016;7:14586-14604. [PubMed] [DOI] |
| 19. | Fabbiano S, Menacho-Márquez M, Sevilla MA, Albarrán-Juárez J, Zheng Y, Offermanns S, Montero MJ, Bustelo XR. Genetic dissection of the vav2-rac1 signaling axis in vascular smooth muscle cells. Mol Cell Biol. 2014;34:4404-4419. [PubMed] [DOI] |
| 20. | Hirai K, Nomura T, Yamasaki M, Inoue T, Narimatsu T, Chisato Nakada PD, Yoshiyuki Tsukamoto PD, Matsuura K, Sato F, Moriyama M. The Vav3 oncogene enhances the malignant potential of prostate cancer cells under chronic hypoxia. Urol Oncol. 2014;32:101-109. [PubMed] [DOI] |
| 21. | Aguilar H, Urruticoechea A, Halonen P, Kiyotani K, Mushiroda T, Barril X, Serra-Musach J, Islam A, Caizzi L, Di Croce L. VAV3 mediates resistance to breast cancer endocrine therapy. Breast Cancer Res. 2014;16:R53. [PubMed] [DOI] |
| 22. | Barreira M, Fabbiano S, Couceiro JR, Torreira E, Martínez-Torrecuadrada JL, Montoya G, Llorca O, Bustelo XR. The C-terminal SH3 domain contributes to the intramolecular inhibition of Vav family proteins. Sci Signal. 2014;7:ra35. [PubMed] [DOI] |
| 23. | Trenkle T, Hakim SG, Jacobsen HC, Sieg P. Differential Gene Expression of the Proto-oncogene VAV3 and the Transcript Variant VAV3.1 in Oral Squamous Cell Carcinoma. Anticancer Res. 2015;35:2593-2600. [PubMed] |
| 24. | Bode AM, Dong Z, Wang H. Cancer prevention and control: alarming challenges in China. Natl Sci Rev. 2016;3:117-127. [PubMed] [DOI] |
| 26. | 张 强. 黄酮和黄酮醇对两株人食管癌细胞的抑制作用. 哈尔滨: 东北农业大学 2008; . |
| 27. | Shin CM, Kim N, Park JH, Kang GH, Kim JS, Jung HC, Song IS. Prediction of the risk for gastric cancer using candidate methylation markers in the non-neoplastic gastric mucosae. J Pathol. 2012;226:654-665. [PubMed] [DOI] |
| 29. | 范 立侨, 谭 明, 李 勇, 檀 碧波, 王 冬, 刘 庆伟. 胃癌组织中Vav1蛋白表达与胃癌临床生物学行为及预后的关系. 东南大学学报(医学版). 2017;36:4-8. |
| 31. | Li WH, Zhou ZJ, Huang TH, Guo K, Chen W, Wang Y, Zhang H, Song YC, Chang DM. Detection of OSR2, VAV3, and PPFIA3 Methylation in the Serum of Patients with Gastric Cancer. Dis Markers. 2016;2016:5780538. [PubMed] [DOI] |
| 32. | Lin KY, Wang LH, Hseu YC, Fang CL, Yang HL, Kumar KJ, Tai C, Uen YH. Clinical significance of increased guanine nucleotide exchange factor Vav3 expression in human gastric cancer. Mol Cancer Res. 2012;10:750-759. [PubMed] [DOI] |
| 33. | Tan B, Li Y, Zhao Q, Fan L, Wang D, Liu Y. Inhibition of gastric cancer cell growth and invasion through siRNA-mediated knockdown of guanine nucleotide exchange factor Vav3. Tumour Biol. 2014;35:1481-1488. [PubMed] [DOI] |
| 34. | Tan B, Li Y, Zhao Q, Fan L, Liu Y, Wang D, Zhao X. Inhibition of Vav3 could reverse the drug resistance of gastric cancer cells by downregulating JNK signaling pathway. Cancer Gene Ther. 2014;21:526-531. [PubMed] [DOI] |
| 36. | Huang MY, Wang JY, Chang HJ, Kuo CW, Tok TS, Lin SR. CDC25A, VAV1, TP73, BRCA1 and ZAP70 gene overexpression correlates with radiation response in colorectal cancer. Oncol Rep. 2011;25:1297-1306. [PubMed] [DOI] |
| 37. | Zenker S, Neurath MF, Atreya I. Targeted inhibition of Vav1 activity does not favour development of colitis-associated colon cancer. Inflamm Bowel Dis. 2013;19:E72-E73. [PubMed] [DOI] |
| 38. | Doleman JF, Eady JJ, Elliott RM, Foxall RJ, Seers J, Johnson IT, Lund EK. Identification of the Eph receptor pathway as a novel target for eicosapentaenoic acid (EPA) modification of gene expression in human colon adenocarcinoma cells (HT-29). Nutr Metab (Lond). 2010;7:56. [PubMed] [DOI] |
| 39. | Uen YH, Fang CL, Hseu YC, Shen PC, Yang HL, Wen KS, Hung ST, Wang LH, Lin KY. VAV3 oncogene expression in colorectal cancer: clinical aspects and functional characterization. Sci Rep. 2015;5:9360. [PubMed] [DOI] |
| 40. | Vuong H, Cheng F, Lin CC, Zhao Z. Functional consequences of somatic mutations in cancer using protein pocket-based prioritization approach. Genome Med. 2014;6:81. [PubMed] [DOI] |
| 41. | Wang R, Zhao N, Li S, Fang JH, Chen MX, Yang J, Jia WH, Yuan Y, Zhuang SM. MicroRNA-195 suppresses angiogenesis and metastasis of hepatocellular carcinoma by inhibiting the expression of VEGF, VAV2, and CDC42. Hepatology. 2013;58:642-653. [PubMed] [DOI] |
| 42. | Qi H, Wei L, Han Y, Zhang Q, Lau AS, Rong J. Proteomic characterization of the cellular response to chemopreventive triterpenoid astragaloside IV in human hepatocellular carcinoma cell line HepG2. Int J Oncol. 2010;36:725-735. [PubMed] |
| 43. | Lazer G, Katzav S. Guanine nucleotide exchange factors for RhoGTPases: good therapeutic targets for cancer therapy? Cell Signal. 2011;23:969-979. [PubMed] [DOI] |
| 44. | Fernandez-Zapico ME, Gonzalez-Paz NC, Weiss E, Savoy DN, Molina JR, Fonseca R, Smyrk TC, Chari ST, Urrutia R, Billadeau DD. Ectopic expression of VAV1 reveals an unexpected role in pancreatic cancer tumorigenesis. Cancer Cell. 2005;7:39-49. [PubMed] [DOI] |
| 45. | Yeh JJ, Der CJ. Targeting signal transduction in pancreatic cancer treatment. Expert Opin Ther Targets. 2007;11:673-694. [PubMed] [DOI] |
| 46. | Razidlo GL, Magnine C, Sletten AC, Hurley RM, Almada LL, Fernandez-Zapico ME, Ji B, McNiven MA. Targeting Pancreatic Cancer Metastasis by Inhibition of Vav1, a Driver of Tumor Cell Invasion. Cancer Res. 2015;75:2907-2915. [PubMed] [DOI] |
| 47. | Veluthakal R, Tunduguru R, Arora DK, Sidarala V, Syeda K, Vlaar CP, Thurmond DC, Kowluru A. VAV2, a guanine nucleotide exchange factor for Rac1, regulates glucose-stimulated insulin secretion in pancreatic beta cells. Diabetologia. 2015;58:2573-2581. [PubMed] [DOI] |
| 48. | Yan Y, Ouellette MM. Rac1 GTPase in pancreatic cancer. Aging (Albany NY). 2015;7:609-610. [PubMed] [DOI] |
| 49. | Tsuboi M, Taniuchi K, Furihata M, Naganuma S, Kimura M, Watanabe R, Shimizu T, Saito M, Dabanaka K, Hanazaki K. Vav3 is linked to poor prognosis of pancreatic cancers and promotes the motility and invasiveness of pancreatic cancer cells. Pancreatology. 2016;16:905-916. [PubMed] [DOI] |
| 50. | Ouyang Y, Pan J, Tai Q, Ju J, Wang H. Transcriptomic changes associated with DKK4 overexpression in pancreatic cancer cells detected by RNA-Seq. Tumour Biol. 2016;37:10827-10838. [PubMed] [DOI] |