修回日期: 2017-06-20
接受日期: 2017-06-27
在线出版日期: 2017-08-08
探讨SHP-2蛋白在结直肠癌中的表达情况及其与病理特征的关系.
采用免疫组织化学法和Western blot方法检测SHP-2蛋白在人结直肠癌组织中的表达情况, 分析其与患者临床病理因素的关系.
结直肠癌组织中SHP-2阳性表达率为25.6%(43/168), 与正常结直肠组织比较, 差异有统计学意义(P<0.05). 结直肠癌组织中SHP-2的蛋白水平为0.2396±0.0655, 与配对正常结直肠组织比较(0.7665±0.1133), 差异有统计学意义(P<0.0001). SHP-2蛋白的低表达与分化程度和淋巴结转移有关, 与性别、年龄、浸润程度、远处转移、TNM分期无关.
SHP-2可能在结直肠癌的发生发展过程中起抑制作用, 并可能成为潜在的治疗靶点.
核心提要: 国内外多项研究表明SHP-2与肿瘤关系密切. 本文采用免疫组织化学、Western blot方法检测SHP-2蛋白在人结直肠癌组织中的表达, 提示SHP-2在结直肠癌中表达明显下调, 并与结直肠癌的分化程度和淋巴结转移密切相关. SHP-2可能通过ERK/MAPK通路和JAK/STAT3通路来发挥抑癌作用, 但具体信号通路有待进一步研究.
引文著录: 谭婉燕, 熊枝繁. SHP-2在结直肠癌组织中的表达及临床意义. 世界华人消化杂志 2017; 25(22): 2039-2044
Revised: June 20, 2017
Accepted: June 27, 2017
Published online: August 8, 2017
To detect the expression of SHP-2 protein in colorectal carcinoma (CRC) and to analyze its relationship with clinical characteristics.
The expression of SHP-2 in CRC specimens was detected by immunohistochemisty and Western blot, and the association of CRC expression with clinicopathologic parameters of CRC patients was statistically analyzed.
The rate of positive expression of SHP-2 was significantly lower in CRC (25.6%) than in normal colorectal tissues (P < 0.05). SHP-2 protein expression level in CRC (0.2396 ± 0.0655) was significantly lower than that in paired normal colorectal tissues (0.7665 ± 0.1133, P < 0.0001). The low expression of SHP-2 in CRC tissues was correlated with poor differentiation and lymph node metastasis, but not with gender, age, invasion depth, distant metastasis or TNM stage.
SHP-2 may be a tumor suppressor in CRC, and it may be used as a potential therapeutic target for this malignancy.
- Citation: Tan WY, Xiong ZF. Clinical significance of expression of SHP-2 in colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2017; 25(22): 2039-2044
- URL: https://www.wjgnet.com/1009-3079/full/v25/i22/2039.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i22.2039
结直肠癌是常见的消化系肿瘤, 其发病率在我国恶性肿瘤中居第3位, 且呈上升趋势[1,2]. 结直肠癌的发生、发展与和转移与多种细胞信号转导通路密切相关. SHP-2属于蛋白酪氨酸磷酸酶(protein tyrosine phosphatase, PTPase)家族成员之一, 近年来有研究[3-6]表明, SHP-2与白血病、乳腺癌、肺癌、肝癌等肿瘤关系密切, 但与结直肠癌发生、发展的关系鲜见报道. 本研究通过免疫组织化学、Western blot方法检测SHP-2蛋白在人结直肠癌组织中的表达情况, 分析其与患者临床病理因素的关系, 探讨SHP-2在结直肠癌发生、发展中的作用, 为其今后用于临床诊治和预后判断提供一定的实验依据.
标本来源: 选取168例结直肠癌标本, 其中40例为2016-5/2016-12华中科技大学同济医学院附属梨园医院结直肠癌手术切除标本, 包括结直肠原发肿瘤组织及配对上(下)切缘正常黏膜组织, 癌旁组织均经病理证实无癌组织侵犯. 所有组织离体后迅速置于液氮, 存于-80 ℃, 用于Western blot试验, 同时取少许配对组织进行石蜡包埋, 用于免疫组织化学法检测. 其余128例由梨园医院病理科诊断为结直肠癌的石蜡包埋组织, 一起用于免疫组织化学法检测. 所有组织学诊断均由2位病理医师再次确认证实. 其中结肠癌90例, 直肠癌78例; 男性94例, 女性74例, 年龄30-89岁, 平均年龄65.49岁±12.67岁. 按美国癌症联合委员会/国际抗癌联盟制定的TNM分期标准分为Ⅰ期14例, Ⅱ期105例, Ⅲ期41例, Ⅳ期8例; 按肿瘤浸润深度(T), T1 6例, T2 28例, T3 113例, T4 21例; 按淋巴结转移(N), N0 111例, N1 39例, N2 18例; 按手术时有无远处转移(M), M0 154例, M1 14例; 按分化程度, 高分化62例, 中分化74例, 低、未分化32例. 主要试剂: 免疫组织化学试剂盒购自北京中杉金桥生物技术有限公司; SHP-2单克隆抗体购自Abcam公司; Western blot试验GAPDH抗体购自杭州贤至生物有限公司; 蛋白MAKER购自北京全式金生物技术公司; SHP-2购自Elabscience公司.
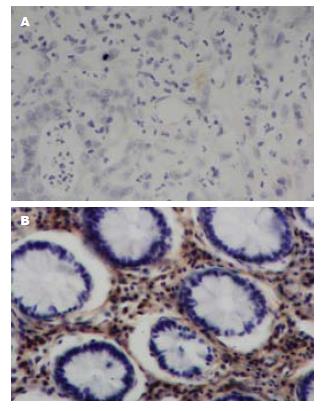
1.2.1 免疫组织化学法检测: 免疫组织化学技术采用SABC法, 检测168例结直肠癌组织标本, 操作按试剂盒说明书进行. 组织切片经脱蜡、水化、加热修复抗原、3%过氧化氢溶液消除内源性过氧化物酶活性, 1:50羊血清封闭液室温封闭抗原15 min, 一抗SHP-2在4 ℃下孵育过夜, 工作浓度为1:100, 生物素化二抗室温孵育15 min, 滴加ABC复合物, DAB显色, 苏木精对比染色后封片, 光学显微镜下观察, 以PBS替代一抗作为阴性对照.
1.2.2 免疫组织化学结果判定: 根据蛋白在细胞内的定位, 分别以蛋白表达阳性信号强度和阳性表达面积两种观测标准进行综合评分. 计数20个高倍视野的免疫组织化学反应着色的细胞, 染色强度积分为: 无染色0分, 染成淡黄色1分, 黄色2分, 棕褐色3分; 染色面积积分为: 着色范围≤10%为0分, 10%-25%为1分, 25%-50%为2分, 50%-75%为3分, >75%为4分. 若两者积分之和≥3分则为阳性, 低于3分则为阴性. 结果由两位病理学专家盲法判定.
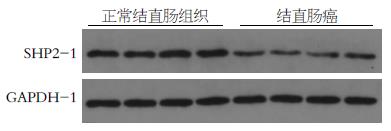
1.2.3 Western blot方法检测: 用Western blot方法检测40例结直肠癌组织中的SHP-2蛋白, 分别取各组结直肠标本组织, 用适量RIPA裂解液匀浆组织, 测蛋白浓度后, 各样品取50 μg总蛋白上样电泳, 根据蛋白分子量配制10%的PAGE胶电泳. 根据预染Marker显示, 判断目的蛋白得到充分分离后, 停止电泳. 取出凝胶根据Marker切下目的条带, 用蒸馏水冲洗, 剪与PAGE凝胶相同大小的PVDF膜和滤纸, 然后用半干式电转的方法将蛋白质转移至PVDF膜上, 5%牛血清白蛋白37 ℃封闭2 h, 1:200的兔抗SHP-2单克隆抗体中4 ℃孵育过夜; 生物素标记的羊抗兔IgG中37 ℃孵育2 h, DAB显色, 见有清晰条带出现即用双蒸水终止显色. 所得图像用扫描仪扫描, 应用BandScan图像分析系统测量条带的吸光度值, 将目的蛋白吸光度值与GAPDH的比值作为结果.
统计学处理 采用SPSS17.0软件进行统计分析, 结果用mean±SD表示, 计数资料采用两个或多个样本率比较的χ2检验, 组间差异比较采用t检验, P<0.05为差异有统计学意义.
SHP-2的阳性表达主要位于细胞质, 也有少部分位于细胞核, 结直肠癌组织中SHP-2蛋白表达阳性率为25.6%(43/168)(图1A), 与正常结直肠组织比较(图1B), 结直肠癌组织中SHP-2的表达明显降低, 差异有统计学意义(P<0.05).
SHP-2蛋白的定量采用与GAPDH的蛋白水平相比较的方法进行测量. 结直肠癌组织中SHP-2的蛋白水平为0.2396±0.0655, 配对正常结直肠组织中SHP-2的蛋白水平为0.7665±0.1133, 2组比较, 差异有统计学意义(P<0.0001, 图2).
168例结直肠癌组织中, SHP-2的阳性表达率在低/未分化的患者中较低, 与高分化的患者相比, 差异有统计学意义(P = 0.01); 在有淋巴结转移的患者中较低, 与无淋巴结转移的患者相比, 差异有统计学意义(P = 0.037). 而在不同年龄、性别、浸润程度、远处转移、TNM分期间, SHP-2的表达差异无统计学意义(表1).
| 分组 | n | SHP-2的表达 | P值 |
| 性别 | 0.463 | ||
| 男 | 94 | 22(23.4) | |
| 女 | 74 | 21(28.4) | |
| 年龄(岁) | 0.282 | ||
| <60 | 90 | 20(22.2) | |
| ≥6 | 78 | 23(29.5) | |
| 分化程度 | |||
| 高分化 | 62 | 21(33.9) | |
| 中分化 | 74 | 19(25.7) | 0.296 |
| 低、未分化 | 32 | 3(9.4) | 0.01 |
| 浸润程度 | |||
| T1 | 6 | 2(33.3) | |
| T2 | 28 | 10(35.7) | 0.912 |
| T3 | 113 | 25(22.1) | 0.523 |
| T4 | 21 | 6(28.6) | 0.822 |
| 淋巴结转移 | 0.037 | ||
| 阴性 | 111 | 34(30.6) | |
| 阳性 | 57 | 9(15.8) | |
| 远处转移 | 0.709 | ||
| 无 | 154 | 40(26.0) | |
| 有 | 14 | 3(21.4) | |
| TNM分期 | |||
| Ⅰ | 14 | 5(35.7) | |
| Ⅱ | 105 | 28(26.7) | 0.477 |
| Ⅲ | 41 | 8(19.5) | 0.218 |
| Ⅳ | 8 | 2(25.0) | 0.604 |
全球每年有超过120万的结直肠癌新发病例, 其中大约20%具有家族遗传史, 其他则与吸烟、过量饮酒、多食红肉等不良生活习惯, 以及肠道的共生菌、病原体和慢性肠道炎症有关, 其中由慢性炎症诱发的结直肠癌近几年受到广泛关注[7-9]. 菌群失调、组织损伤及坏死产物均能激活免疫细胞中核因子-κB通路, 使其持续活化, 后者能继续刺激肿瘤微环境中的免疫细胞产生过多的细胞因子; 而过多的细胞因子、趋化因子及活性氧等则诱发了细胞的DNA突变, 这些细胞在慢性炎症作用下通过抑制凋亡、加速增殖, 最终导致了肿瘤的发生[10-12].
SHP-2属于PTPase家族成员之一, 有两个SH2功能域和一个PTP功能域, 其中SH2功能域是与酪氨酸磷酸蛋白质的结合位点, 两者结合后使PTP酶激活, 从而作为如PDGF、EGF、IGF-1等多种生长因子胞外刺激因素的下游信号分子, 参与信号转导[13-15]. 有研究[16-18]表明, SHP-2能够正向调控ERK/MAPK通路的激活, 从而促进细胞增殖或调控细胞分化. 同时, SHP-2能够通过JAK1/2及STAT3的去磷酸化, 负向调控JAK/STAT3通路的功能, 抑制STAT3的激活[19-21]. 因为ERK和STAT3两者都可以与正向调控细胞的增殖、分化和存活, 所以肠组织中SHP-2可通过这两条通路, 影响了肠上皮细胞的增殖分化, 调节肠道炎症的发生, 同时能够被多种化合物激活, 调控结直肠癌的起始与进展. 因此, SHP-2与炎症和肿瘤均有密切联系.
近年来, SHP-2突变在白血病、实体瘤和努南综合征中陆续被发现, 是最早被定义为癌基因的酪氨酸磷酸酶[22-24]. Tao等[25]发现, 在宫颈癌中, SHP-2的阳性表达与人乳头状瘤病毒的感染显著相关. Tang等[26]发现, 在非小细胞肺癌中, SHP-2的表达与淋巴结转移密切相关, 机制可能是通过血管再生和淋巴系统促进侵袭和转移. 但是, SHP-2作为癌基因被广泛认可的同时, 也有很多研究发现了SHP-2的抑癌功能, Toso等[27]发现, 在前列腺癌中, SHP-2与抑癌蛋白PTEN正向相关, 通过下调JAK/STAT3通路的活性发挥抑癌功能; Bard-Chapeau等[28]亦发现, SHP-2在肝细胞中对STAT3有重要的负调控作用, 在肝细胞中敲除SHP-2可导致STAT3磷酸化水平明显增高, 使肝脏中的炎症信号增强, 从而推动了炎症引发的肝癌形成. 这说明在不同的遗传学背景及组织器官中, SHP-2对肿瘤发生发展的调控功能不同.
近几年来, 越来越多的学者关注SHP-2在结直肠癌中的表达. Chang等[29]研究发现, SHP-2在结直肠癌中的低表达与高死亡率等不良预后相关, 提示SHP-2在结直肠癌中发挥抑癌功能. Cai等[30]研究表明, 在结直肠癌细胞株、动物组织和临床样本中, SHP-2表达均降低, 并与肿瘤的恶性程度密切相关, 浸润程度较深的患者, SHP-2的阳性表达率明显降低. 本实验研究发现: 与正常结直肠组织比较, SHP-2在结直肠癌中表达明显下调. 同时, SHP-2的表达与结直肠癌的分化程度和淋巴结转移密切相关, 在分化程度较低及出现淋巴结转移的患者中, SHP-2的阳性表达率明显降低.
总之, SHP-2在结直肠癌中表达下调, SHP-2可能通过ERK/MAPK通路和JAK/STAT3通路来发挥抑癌作用, 但具体信号通路有待进一步研究. 相信随着作用机制的不断明确, SHP-2将会成为一个新的抗肿瘤药物的作用靶点.
结直肠癌是常见的消化系肿瘤, 其发病率在我国恶性肿瘤中居第3位. 正常的结直肠黏膜组织经过腺瘤逐步发展为癌, 涉及到一个复杂的多阶段的过程, 其中包括多种细胞信号转导通路的变化. 酪氨酸磷酸酶SHP-2在这过程中扮演了重要角色.
近年来多项研究表明, SHP-2与白血病、乳腺癌、肺癌、肝癌等肿瘤关系密切, 但与结直肠癌发生、发展的关系鲜见报道, 在结直肠癌中作用的研究也不尽一致. SHP-2在结直肠"炎-癌"中的作用及具体的信号通路成为目前结直肠癌研究的热点之一.
近年来关于SHP-2与肿瘤的关系以及SHP-2在结直肠"炎-癌"中作用的相关重要研究均已被收录在本文中, 这些成果为本文的研究结果提供了理论支持, 更为结直肠癌病因学的研究提供重要思路.
本文检测SHP-2蛋白在人结直肠癌组织中的表达, 并分析其与患者临床病理因素的关系, 为结直肠癌的诊断、预后及治疗药物的开发提供依据.
SHP-2在结直肠癌中表达下调, SHP-2可能通过ERK/MAPK通路和JAK/STAT3通路来发挥抑癌作用, 但具体信号通路有待进一步研究. 相信随着作用机制的不断明确, SHP-2将会成为一个新的抗肿瘤药物的作用靶点.
SHP-2: 为蛋白酪氨酸磷酸酶, 由人PTPN11基因编码. 在不同的细胞类型中, SHP-2能在生长因子、细胞因子的作用下激活ERK/MAPK通路, 也能够抑制JAK/STAT3通路. SHP-2通过调控这两条通路, 发挥了不同甚至相反的作用.
牛伟新, 教授, 主任医师, 复旦大学附属中山医院普外科; 肖秀英, 副主任医师, 上海交通大学医学院附属仁济医院
本文探讨了SHP-2在人结直肠癌组织中的表达及其与临床病理特征的关系, 设计合理, 文笔流畅, 统计学应用恰当, 具有一定的科学性、创新性和可读性.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:李瑞芳
| 1. | Douaiher J, Ravipati A, Grams B, Chowdhury S, Alatise O, Are C. Colorectal cancer-global burden, trends, and geographical variations. J Surg Oncol. 2017;115:619-630. [PubMed] [DOI] |
| 3. | Zhang F, Liu X, Chen C, Zhu J, Yu Z, Xie J, Xie L, Bai H, Zhang Y, Fang X. CD244 maintains the proliferation ability of leukemia initiating cells through SHP-2/p27(kip1) signaling. Haematologica. 2017;102:707-718. [PubMed] [DOI] |
| 4. | Coulombe G, Rivard N. New and Unexpected Biological Functions for the Src-Homology 2 Domain-Containing Phosphatase SHP-2 in the Gastrointestinal Tract. Cell Mol Gastroenterol Hepatol. 2016;2:11-21. [PubMed] [DOI] |
| 5. | 何 玲娟, 程 洪强, 柯 越海, 王 临润. 蛋白酪氨酸磷酸酶SHP-2在肺癌中作用的研究进展. 中国药理学与毒理学杂志. 2016;30:82-86. |
| 6. | Sausgruber N, Coissieux MM, Britschgi A, Wyckoff J, Aceto N, Leroy C, Stadler MB, Voshol H, Bonenfant D, Bentires-Alj M. Tyrosine phosphatase SHP2 increases cell motility in triple-negative breast cancer through the activation of SRC-family kinases. Oncogene. 2015;34:2272-2278. [PubMed] [DOI] |
| 8. | Amitay EL, Werner S, Vital M, Pieper DH, Höfler D, Gierse IJ, Butt J, Balavarca Y, Cuk K, Brenner H. Fusobacterium and colorectal cancer: Causal factor or passenger? Results from a large colorectal cancer screening study. Carcinogenesis. 2017; Jun 5. [Epub ahead of print]. [PubMed] [DOI] |
| 9. | Yamashita H, Kotani T, Park JH, Murata Y, Okazawa H, Ohnishi H, Ku Y, Matozaki T. Role of the protein tyrosine phosphatase Shp2 in homeostasis of the intestinal epithelium. PLoS One. 2014;9:e92904. [PubMed] [DOI] |
| 10. | Iliopoulos D, Hirsch HA, Struhl K. An epigenetic switch involving NF-kappaB, Lin28, Let-7 MicroRNA, and IL6 links inflammation to cell transformation. Cell. 2009;139:693-706. [PubMed] [DOI] |
| 11. | Karin M, Greten FR. NF-kappaB: linking inflammation and immunity to cancer development and progression. Nat Rev Immunol. 2005;5:749-759. [PubMed] [DOI] |
| 12. | Grivennikov S, Karin E, Terzic J, Mucida D, Yu GY, Vallabhapurapu S, Scheller J, Rose-John S, Cheroutre H, Eckmann L. IL-6 and Stat3 are required for survival of intestinal epithelial cells and development of colitis-associated cancer. Cancer Cell. 2009;15:103-113. [PubMed] [DOI] |
| 13. | Agazie YM, Hayman MJ. Molecular mechanism for a role of SHP2 in epidermal growth factor receptor signaling. Mol Cell Biol. 2003;23:7875-7886. [PubMed] [DOI] |
| 14. | Hu Z, Fang H, Wang X, Chen D, Chen Z, Wang S. Overexpression of SHP2 tyrosine phosphatase promotes the tumorigenesis of breast carcinoma. Oncol Rep. 2014;32:205-212. [PubMed] [DOI] |
| 16. | Mohi MG, Neel BG. The role of Shp2 (PTPN11) in cancer. Curr Opin Genet Dev. 2007;17:23-30. [PubMed] [DOI] |
| 17. | Siegfried A, Cances C, Denuelle M, Loukh N, Tauber M, Cavé H, Delisle MB. Noonan syndrome, PTPN11 mutations, and brain tumors. A clinical report and review of the literature. Am J Med Genet A. 2017;173:1061-1065. [PubMed] [DOI] |
| 18. | Heuberger J, Kosel F, Qi J, Grossmann KS, Rajewsky K, Birchmeier W. Shp2/MAPK signaling controls goblet/paneth cell fate decisions in the intestine. Proc Natl Acad Sci USA. 2014;111:3472-3477. [PubMed] [DOI] |
| 19. | Sturla LM, Zinn PO, Ng K, Nitta M, Kozono D, Chen CC, Kasper EM. Src homology domain-containing phosphatase 2 suppresses cellular senescence in glioblastoma. Br J Cancer. 2011;105:1235-1243. [PubMed] [DOI] |
| 20. | Zhang W, Chan RJ, Chen H, Yang Z, He Y, Zhang X, Luo Y, Yin F, Moh A, Miller LC. Negative regulation of Stat3 by activating PTPN11 mutants contributes to the pathogenesis of Noonan syndrome and juvenile myelomonocytic leukemia. J Biol Chem. 2009;284:22353-22363. [PubMed] [DOI] |
| 21. | Zheng H, Li S, Hsu P, Qu CK. Induction of a tumor-associated activating mutation in protein tyrosine phosphatase Ptpn11 (Shp2) enhances mitochondrial metabolism, leading to oxidative stress and senescence. J Biol Chem. 2013;288:25727-25738. [PubMed] [DOI] |
| 22. | Zhu HH, Luo X, Zhang K, Cui J, Zhao H, Ji Z, Zhou Z, Yao J, Zeng L, Ji K. Shp2 and Pten have antagonistic roles in myeloproliferation but cooperate to promote erythropoiesis in mammals. Proc Natl Acad Sci USA. 2015;112:13342-13347. [PubMed] [DOI] |
| 23. | Hu ZQ, Ma R, Zhang CM, Li J, Li L, Hu ZT, Gao QI, Li WM. Expression and clinical significance of tyrosine phosphatase SHP2 in thyroid carcinoma. Oncol Lett. 2015;10:1507-1512. [PubMed] [DOI] |
| 25. | Tao XH, Shen JG, Pan WL, Dong YE, Meng Q, Honn KV, Jin R. Significance of SHP-1 and SHP-2 expression in human papillomavirus infected Condyloma acuminatum and cervical cancer. Pathol Oncol Res. 2008;14:365-371. [PubMed] [DOI] |
| 26. | Tang C, Luo D, Yang H, Wang Q, Zhang R, Liu G, Zhou X. Expression of SHP2 and related markers in non-small cell lung cancer: a tissue microarray study of 80 cases. Appl Immunohistochem Mol Morphol. 2013;21:386-394. [PubMed] [DOI] |
| 27. | Toso A, Revandkar A, Di Mitri D, Guccini I, Proietti M, Sarti M, Pinton S, Zhang J, Kalathur M, Civenni G. Enhancing chemotherapy efficacy in Pten-deficient prostate tumors by activating the senescence-associated antitumor immunity. Cell Rep. 2014;9:75-89. [PubMed] [DOI] |
| 28. | Bard-Chapeau EA, Li S, Ding J, Zhang SS, Zhu HH, Princen F, Fang DD, Han T, Bailly-Maitre B, Poli V. Ptpn11/Shp2 acts as a tumor suppressor in hepatocellular carcinogenesis. Cancer Cell. 2011;19:629-639. [PubMed] [DOI] |
| 29. | Chang W, Gao X, Han Y, Du Y, Liu Q, Wang L, Tan X, Zhang Q, Liu Y, Zhu Y. Gene expression profiling-derived immunohistochemistry signature with high prognostic value in colorectal carcinoma. Gut. 2014;63:1457-1467. [PubMed] [DOI] |
| 30. | Cai P, Guo W, Yuan H, Li Q, Wang W, Sun Y, Li X, Gu Y. Expression and clinical significance of tyrosine phosphatase SHP-2 in colon cancer. Biomed Pharmacother. 2014;68:285-290. [PubMed] [DOI] |