修回日期: 2017-06-17
接受日期: 2017-07-05
在线出版日期: 2017-08-08
研究自然杀伤(natural killer, NK)细胞对肝癌的抑制作用, 为临床应用提供实验依据.
从人外周血分离培养及鉴定NK细胞. 在体外, 研究NK细胞抑制肝癌细胞的增殖、迁徙、转移. 在体内, 检测NK细胞在裸鼠肝脏存活情况. 利用人肝癌组织裸鼠肝脏原位移植模型来评估NK细胞在体内对肝癌生长、转移的抑制功能. 通过检测NK细胞活化受体、NKB1、穿孔素和颗粒酶的表达情况来评估白介素(interleukin, IL)-2对NK细胞免疫功能的刺激作用.
采用密度梯度法可以获取较大量的外周血单个核细胞, 且能够从中分离到高活力的NK细胞. NK细胞经IL-2激活后活力增高, 成簇悬浮繁殖、扩增、生长. 在体外, NK细胞可抑制肝癌细胞的增殖、迁移和侵袭. 在体内, NK细胞在裸鼠肝脏可长期存活; NK细胞可明显抑制裸鼠肝癌肺转移. 然而, NK细胞对肝脏肿瘤生长抑制不明显. IL-2可诱导NK细胞免疫相关分子的表达并提高其肿瘤抑制功能.
NK细胞的免疫学功能可被IL-2活化从而抑制肝癌的转移.
核心提要: 本研究发现自然杀伤(natural killer, NK)细胞在体外对MHCC97-H细胞的增殖、迁移和侵袭有明显的抑制作用. NK细胞在裸鼠肝脏可长期存活并能在体内抑制肝细胞癌肺转移. 数据表明, 白介素-2通过诱导免疫相关分子的表达而增强NK细胞介导的抑制肿瘤转移的功能.
引文著录: 申九妹, 熊共鹏, 郑启忠, 张宏斌, 洪再发. 自然杀伤细胞抑制肝癌肺转移. 世界华人消化杂志 2017; 25(22): 2028-2038
Revised: June 17, 2017
Accepted: July 5, 2017
Published online: August 8, 2017
To investigate the inhibitory role of natural killer (NK) cells in liver cancer metastasis.
NK cells were isolated from human peripheral blood mononuclear cells, cultivated and identified. In vitro, NK cells were used to suppress liver cancer cell proliferation, migration and metastasis. In vivo, the homing of NK cells in the liver of nude mice was detected. A nude mouse orthotopic liver transplantation model was used to assess the role of NK cells in inhibiting the growth and metastasis of liver cancer in vivo. The expression of NKG2D, NKB1, perforin and granular enzyme was detected to assess the stimulatory effect of interleukin (IL)-2 on NK cell immune function.
In vitro, NK cells inhibited the proliferation, migration and invasion of liver cancer cells. In vivo, NK cells could survive in the liver of nude mice for a long time. NK cells significantly inhibit the pulmonary metastasis of liver cancer in nude mice. However, the liver tumor growth was not inhibited by NK cells. IL-2 can strengthen the suppressor function of NK cells in tumors.
The immunological function of NK cells can be strengthened by IL-2 to inhibit liver cancer metastasis.
- Citation: Shen JM, Xiong GP, Zheng QZ, Zhang HB, Hong Z. Natural killer cells inhibit pulmonary metastasis of hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2017; 25(22): 2028-2038
- URL: https://www.wjgnet.com/1009-3079/full/v25/i22/2028.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i22.2028
肝癌是世界范围内尤其是在东南亚最常见的人类癌症之一[1]. 尽管外科技术和医疗一直在进展, 肝癌患者5年生存率仍然很低, 每年约600000患者死亡[2]. 肝癌早期缺乏典型症状, 晚期症状包括衰弱、体质量减轻、厌食、腹胀、恶心、呕吐、发热和腹泻. 目前, 有许多方法有助于肝癌的诊断, 包括血液甲胎蛋白、彩色多普勒超声、X射线、计算机断层扫描和磁共振成像(magnetic resonance imaging, MRI)[3,4]. 然而, 转移是肝癌预后不良的主要原因之一, 并是当前治疗肝癌经常面对的困难. 多种肿瘤患者抗肿瘤免疫力低下是肿瘤发生、发展和转移的主要因素, 包括肝癌[5-7] . 自然杀伤(natural killer, NK)细胞在抑制肿瘤发生方面发挥着重要的作用[5]. 既往研究[5,8]表明NK细胞可抑制肿瘤生长, 白介素(interleukin, IL)-2是NK细胞增殖和活化重要的细胞因子. 因此, NK细胞可作为抑制肝癌转移的一种有效的治疗方法. 然而, NK细胞抑制肝癌肺转移的作用及机制尚不明确. 在本研究中, 我们评估NK细胞经IL-2活化后在体外和体内是否可抑制肝细胞癌的转移.
细胞: 高肺转移特性人肝癌细胞株MHCC97H, 复旦大学附属中山医院, 上海肝癌研究所赠送. 动物: 裸鼠由厦门大学动物中心提供, 并在SPF环境饲养. 试剂和药品: 人类NK细胞分离试剂盒(Miltenyi Biotec GmbH, Bergisch Gladbach, Germany); RPMI 1640培养基(HyClone; GE Healthcare Life Sciences, Logan, Utah, United States); 胎牛血清(Gibco; Thermo Fisher Scien-tific, Inc., Waltham, MA, United States); 重组人IL2(PeproTech, Inc., Rocky Hill, NJ, United States); PE-鼠抗人CD56(clone B159; BD Biosciences, San Diego, CA, United States); APC-鼠抗人CD3(clone UCHTI; BD Pharmingen, San Diego, CA, United States); FITC-抗人NK细胞活化受体(NK activating receptor, NKG2D)(clone 1D11; eBioscience, Inc., San Diego, CA, United States); FITC-抗人NKB1(clone DX9; BD Pharmingen); FITC-穿孔素试剂盒[含FITC鼠抗人穿孔素(clone δG9)和FITC鼠免疫球蛋白G2bκ(clone 2735); BD Pharmingen]; FITC鼠抗人颗粒酶(clone GB11; BD Pharmingen); 抗体亚型对照: PE鼠IgG1κ(clone MOPC21), APC鼠IgG1κ(clone MOPC21), FITC鼠IgG1κ(clone MOPC21)和PerCPCyTM5.5鼠IgG1κ(clone MOPC21)(所有都是BD Pharmingen); 5溴脱氧尿嘧啶核苷(5bromo2'deoxyuridine, BrdU; Roche Diagnostics, Basel, Switzerland); PerCPCyTM5.5鼠抗BrdU(clone 3D4; BD Pharmingen); Transwell小室(Invasion和Migration)(BD Biosciences, Franklin Lakes, NJ, United States); 羧基荧光素琥珀酰亚胺酯(carboxyfluorescein diacetatesuccinimidyl ester, CFDASE)、4 7, 6-二脒基-2-苯基吲哚(4', 6-diamidino-2-phenylindole, DAPI)(EnoGene Biotech, Co., Ltd., 南京, 中国); IX73U荧光显微镜(Olympus Corporation, 东京, 日本).
1.2.1 细胞的分离和培养: 本实验涉及人体的实验均遵守《赫尔斯基宣言》伦理准则且接受厦门中医院伦理委员会的监督和管理. 健康志愿者血液采用梯度离心法来分离外周血单个核细胞. 根据NK细胞分离试剂盒说明分离NK细胞. 然后用含10%胎牛血清、2 pg/mL浓度IL-2的RPMI 1640培养基中培养和活化[9]. MHCC97H在含10%胎牛血清的RPMI 1640培养基中培养.
1.2.2 NK细胞表面受体及效应分子的检测: 根据实验要求收集相应的NK细胞并与相应的抗体孵育后上流式细胞仪来检测NK细胞表面受体CD56、CD3、NKG2D、NKG2D、NKB1及活化NK细胞的效应分子穿孔素和颗粒酶. 根据抗体的要求配予相应的对照亚型. 所有抗体的稀释浓度均为1:100.
1.2.3 增殖试验: NK细胞用IL-2(2 pg/mL)在37 ℃刺激48 h, 然后与MHCC97-H细胞共培养. 培养的细胞为2×106细胞/板(MHCC97-H细胞浓度为1×106细胞/毫升), 使用RPMI 1640培养基中含有10%胎牛血清. 共培养时间为48 h, 收集MHCC97-H细胞. 按照相应说明采用BrdU进行活细胞染色、固定及与抗BrdU抗体孵育, 上流式细胞仪进行检测.
1.2.4 细胞划痕实验: NK细胞对MHCC97-H迁移能力的影响采用细胞划痕实验来评价. MHCC97-H细胞在6孔板(106细胞/孔)用含10%胎牛血清的RPMI 1640培养基进行培养, 待细胞铺满底层的80%时去除培养基用无菌吸管尖端直线划痕. 随后在含有IL-2(2 pg/mL)的0.2%胎牛血清的培养基中与NK细胞(106细胞/孔)共孵育72 h. 对照组未添加NK细胞. 光学显微镜下观察MHCC97-H迁移情况.
1.2.5 Transwell细胞迁移及细胞侵袭实验: NK细胞对MHCC97-H迁移能力和侵袭能力的影响采用Transwell小室(Migration)和Transwell小室(Invation)来评价. 在NK组, 200 μL 0.2%小牛血清培养基, 含5×104 MHCC97-H细胞和5×104已经活化的NK细胞, 加入到Transwell小室的上室. 600 μL 10%FBS的培养基中加入下室. 在对照组中, 用培养基代替NK细胞. 在培养箱孵育48 h. 用棉签去除停留在上室的非侵入细胞. 侵袭到下室的细胞用结晶紫染色. 用显微镜计数(×200倍)沿纵向或横向轴不重叠的5个视野的细胞总数, 取平均值.
1.2.6 NK细胞在裸鼠肝脏生存的检测: 所有涉及动物的实验均在厦门大学动物中心进行并获得厦门大学动物保护和使用委员会的批准. 2×106 NK细胞首先用CFDA-SE染色并通过门静脉注射到裸鼠肝脏体内. 2 wk后取裸鼠肝脏并制作冰冻切片、固定、DAPI染色, 荧光显微镜下观察NK细胞在肝脏的分布及存活情况.
1.2.7 裸鼠肝脏肿瘤生长及转移的检测: 4周龄Balb/c裸鼠后腿皮下注射移植2×106 MHCC97-H细胞建立皮下瘤模型. 14 d后取下皮下瘤并切割成1 mm3大小的肿瘤组织块, 并接种于裸鼠的肝脏左叶, 建立裸鼠肝脏人肝癌细胞原位移植瘤模型. 随后在关闭腹腔前, 实验组门静脉注射经活化的2×106 NK细胞. 对照组采用生理盐水代替NK细胞. 两组均在裸鼠肝脏人肝癌组织原位移植瘤模型建立后的第5天和第30天在裸鼠腹腔注射IL-2(1 pg/mg体质量). 根据MHCC97-H细胞特性, 在原位移植后8 wk裸鼠均能出现肺转移. 通过MRI检测肝脏肿瘤, 根据MRI数据估算肿瘤体积. 监测肿瘤的生长并在手术后第56天对裸鼠实行安乐死. 取出肝、肺等组织称质量, 取材, 制作石蜡切片(5 μm), HE染色, 显微镜下观察计数肿瘤细胞. 根据Yang等[10]所描述的方法肺转移结节分为4级. Ⅰ级: ≤20个癌细胞/癌结节; Ⅱ级: 20-50个癌细胞/癌结节; Ⅲ级: 50-100个癌细胞/癌结节; Ⅳ级: >100个癌细胞/癌结节.
统计学处理 采用SPSS13.0统计软件处理, 定量资料采用mean±SD表示, 2组计量资料比较采用t检验, 2组或者多组计数资料比较采用秩和检验. 以P<0.05为差异具有统计学意义.
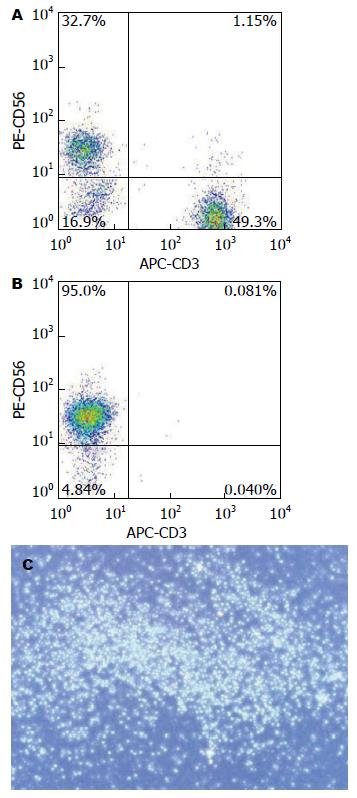
文献[5]表明, 外周血NK细胞表达高水平的CD56而不表达CD3. 因此, 从外周血单个核细胞分离得到的CD56+ CD3细胞认为是NK细胞. 实验结果提示外周血NK细胞占单个核细胞的比例为10%-30%(图1A), 且经分离后的NK细胞纯度>95%(图1B). 分离得到的NK细胞具有高度活性, 在培养基中以悬浮群集方式生长繁殖(图1C).
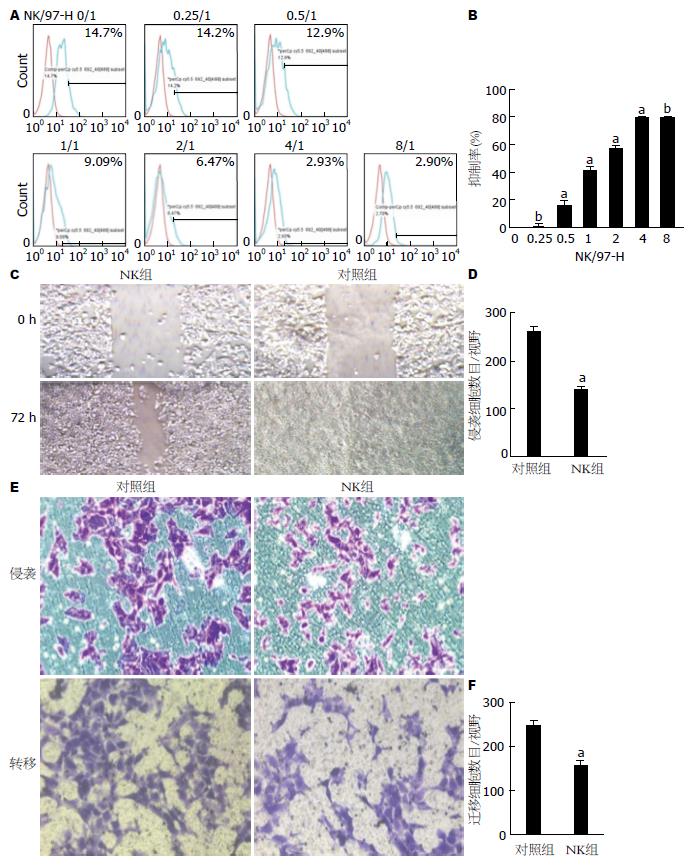
为研究NK细胞在体外对肝癌细胞增殖的抑制作用, 我们比较MHCC97-H在有无NK细胞存在的生长情况. MHCC97-H经BrdU染色后上流式细胞仪检测细胞个数. 数据显示, NK细胞/MHCC97-H在合适的比例情况下NK细胞可抑制MHCC97-H细胞增殖. 当NK/MHCC97 H>0.25/1, NK细胞就可以抑制MHCC97-H细胞增殖. 当NK/MHCC97 H达到4/1, NK细胞抑制作用达到高峰(图2A, B). 细胞划痕实验数据表明MHCC97-H在NK细胞存在的情况其移动能力明显下降(图2C). 同样, Transwell实验数据表明在NK细胞存在的情况下MHCC97-H的迁移和侵袭能力明显下降(图2D-F).
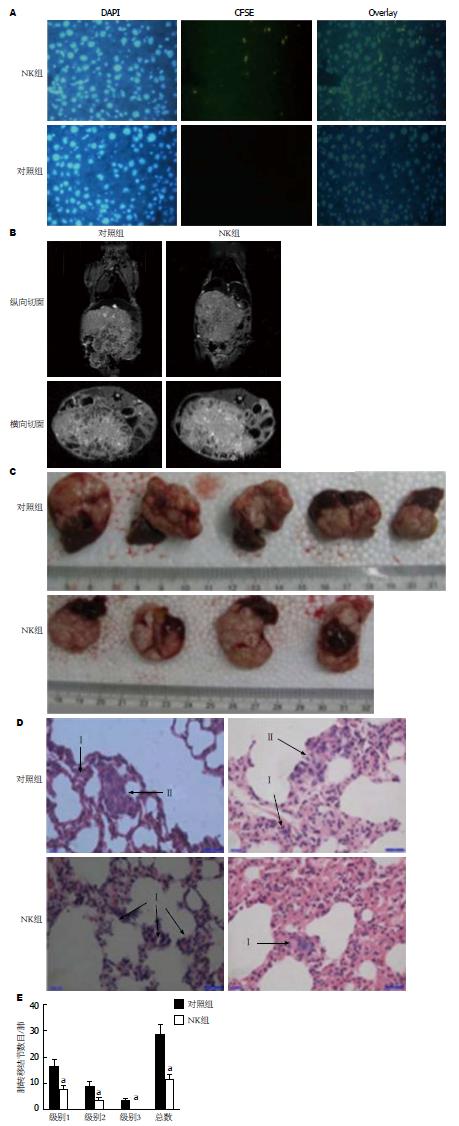
体内细胞存活实验表明, 经CFDA-SE染色的NK细胞定居并存活于裸鼠的肝脏组织(图3A). 为研究NK细胞在体内功能, 采用NK细胞干预人肝癌组织裸鼠肝脏原位移植模型. 实验结果显示NK细胞组和对照组裸鼠均存活6 wk以上. 两组裸鼠的食欲和活性均无显著差异. 裸鼠肝癌大小和质量无明显差异(数据未显示); 由于肺转移病灶太小无法采用MRI检测到(图3B, C). 实验组的肺转移灶大小及数量均显著低于对照组(图3D, E).
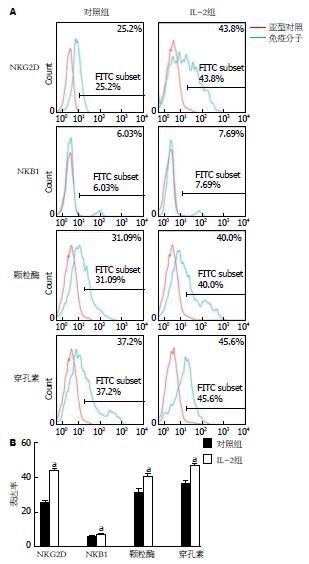
既往研究[11]表明, IL2为NK细胞生长、增殖和活化所必需. 在本研究中, 比较NK细胞在有无IL2存在的情况下培养48 h[8]. 我们检测NKG2D、KIR3DL1(即NKB1, NK细胞的抑制性受体)、穿孔素和颗粒酶(NK细胞内的功能性分子)的表达情况. 实验数据表明, NK细胞表达中等量NKG2D、穿孔素和颗粒酶且NKG2D、穿孔素和颗粒酶表达在经IL-2刺激后显著升高. NK细胞低表达KIR3DL1, 且KIR3DL1表达在经IL-2刺激后轻度升高(图4).
NK细胞是先天免疫系统的重要成员之一. NK细胞对肿瘤的浸润情况可作为预测肝癌的预后[12]. 研究[13]表明, 肝脏肿瘤微环境中NK细胞的免疫学功能受到抑制. 因此, 激活NK细胞并使其发挥免疫功能是治疗肝癌的一种有效方法.
在本研究中, 我们对NK细胞的抗肿瘤活性进行了评估. 目前, 学者把外周血CD56+ CD3-的单个核细胞定义为NK细胞. 本研究发现, 外周血NK细胞占外周血单个核细胞总数的10%-30%. 经分离得到NK细胞纯度达到95%. 在IL-2存在的情况下, NK细胞增殖快速并保留良好的细胞活力. NK细胞能在裸鼠肝脏定居并长期生存. 这一发现与前人的研究[8,10]结果相一致. 肝癌患者NK细胞功能障碍与多个因素相关[14,15], 其中包括肿瘤微环境免疫, 各种免疫细胞因子表达的失衡[16,17]. 比如: IL-2对于肿瘤微环境中NK细胞的活化有重要作用[18]. 如前所述, IL-2是NK细胞生长、活化、增殖所必需. 此外, 受抑制后的NK细胞经IL-2刺激后可重新恢复其免疫杀伤功能[19]. 这些细胞因子影响NK细胞的免疫功能.
目前, 已有多项研究表明NK细胞能抑制肿瘤生长. Maat等[20]表明, NK细胞参与预防葡萄膜黑色素瘤的转移过程. 然而, 在NK细胞抑制肝细胞癌转移的研究尚少. Barkholt等[8]报道, NK细胞联合IL-2可以安全地用于肝癌患者的治疗. 我们的研究数据表明, 在体外IL-2可激活NK细胞, 抑制MHCC97-H细胞增殖、迁移和侵袭. 此外, 在体内实验数据表明, NK细胞抑制肝细胞癌肺转移. 然而, 实验组和对照组肝脏肿瘤大小差异不显著. 这也许跟动物模型后期肝脏表达大量的肿瘤坏死因子和裸鼠营养不良等有关.
NK细胞抑制肿瘤转移和侵袭的潜在机制尚不明确. 如前所述, NK细胞分泌的细胞因子在激活抗肿瘤免疫中发挥重要的作用. 例如, 干扰素-γ主要来自NK, 他在IL-2抗肿瘤的过程中扮演重要角色[21]. 此外, NK细胞介导的抗肿瘤反应也可能是通过与肿瘤细胞或其他免疫细胞的直接接触. NK细胞与肿瘤细胞之间的接触可能通过细胞表面分子的相互作用促使肿瘤细胞发生免疫编辑促使肿瘤细胞更易于被识别与杀伤[22,23]. 既往研究[24,25]表明, NK细胞受体和其相应的配体在肝脏疾病发生发展中发挥重要的作用. NKG2D是一种重要的NK细胞表面激活受体. NKG2D的表达, 与肝癌预后直接相关[26]. UL16结合蛋白是一种NKG2D配体并且在肿瘤细胞表面表达. UL16结合蛋白表达缺失已被确定为肝癌复发的独立因素[27]. NK细胞的细胞毒作用是通过NKG2D与肿瘤细胞的主要组织相容性复合体(major histocompatibility complex, MHC)Ⅰ类相关链的A/B的相互作用[28]. 在本研究中, NK细胞经IL-2刺激后其NKG2D表达显著增加. NK细胞抑制性受体NKB1表达轻度增加. 而作为NK细胞活化的主要标记物颗粒酶、穿孔素表达显著增加. 总体而言, NK细胞经活化后对肝癌细胞增殖、迁移和侵袭有抑制作用. 杀伤细胞免疫球蛋白受体(killer cell Ig-like receptor, KIR)是与肝癌发生相关的NK细胞受体. 通过识别与结合特定的人类白细胞抗原(human leukocyte antigen, HLA)Ⅰ类抗原, KIR参与调节NK细胞的活化. 因此, 肿瘤细胞表达的HLA类型可以调节NK细胞的抗肿瘤功能[29]. NKB1(KIR3DL1)是KIR家族的成员. NKB1与靶细胞特定的HLA-B抗原相互作用后抑制NK细胞介导的细胞毒作用. NKB1可能作为一个负面信号, 抑制NK细胞的活化. 因此, MHCⅠ类抗原和KIR的相互作用可调节NK免疫功能[30].
关于NK细胞抗肿瘤迁移和侵袭的潜在机制还不清楚. 有研究表明NK细胞能够清除循环中的微转移细胞和攻击器官内的转移细胞. 因此, 关于进一步提高NK细胞的抗肿瘤作用方法得到相当的关注. 关于NK细胞发育过程中细胞通路和基因表达的功能既往已经有所研究. Notch信号通路的活化使得NK细胞分泌抑制性细胞因子, 从而使得NK细胞反应低下、受体表达下降、功能不良[31]. 此外, 已确定microRNA-30c-1通过调节管家基因转录因子homeobox-1的表达来增强NK细胞杀伤肝癌细胞的功能[32]. 这些研究表明, NK细胞抗肿瘤活性可能与调节自身信号转导通路或基因表达相关.
总之, 本研究发现NK细胞在体外对MHCC97-H细胞的增殖、迁移和侵袭有明显的抑制作用. NK细胞在裸鼠肝脏可长期存活并能在体内抑制肝细胞癌肺转移. 研究数据表明, IL-2通过诱导免疫相关分子的表达而增强NK细胞介导的抑制肿瘤转移的功能. 然而, 需要更进一步的研究来确定使NK细胞抑制肝癌肺转移的机制.
多种肿瘤患者抗肿瘤免疫力低下是肿瘤发生、发展和转移的主要因素, 包括肝癌. 肝脏肿瘤微环境中自然杀伤(natural killer, NK)细胞的免疫学功能受到抑制. 目前, 已有多项研究表明NK细胞能抑制肿瘤生长. 因此, 激活NK细胞并使其发挥免疫功能是治疗肝癌的一种有效方法. 然而, 在NK细胞抑制肝细胞癌转移的研究尚少.
关于NK细胞抗肿瘤迁移和侵袭的潜在机制还不清楚. 有研究表明NK细胞能够清除循环中的微转移细胞和攻击器官内的转移细胞. 因此, 关于进一步提高NK细胞的抗肿瘤作用方法得到相当的关注. 研究显示, NK细胞抗肿瘤活性可能与调节自身信号转导通路或基因表达相关. 然而, 我们需要更进一步的研究来明确NK细胞抑制肝癌肺转移的机制.
目前, 已有多项研究表明NK细胞能抑制肿瘤生长. Maat等表明, NK细胞参与预防葡萄膜黑色素瘤的转移过程. Barkholt等报道, NK细胞联合IL-2可以安全地用于肝癌患者的治疗.
(1)用裸鼠肝脏人肝癌组织原位移植裸鼠肺转移模型来研究肝癌的侵袭及转移, 这样更符合临床, 既往研究少, 有一定创新; (2)在完成裸鼠肝脏人肝癌组织原位移植后通过门静脉输注NK细胞, 与既往研究采用尾静脉输注外源细胞比较,前者NK细胞能更直接在肝脏发挥生物学功能. 既往未见类似的报道; (3)既往关于NK细胞与肝癌的研究, 大都集中于相关性及NK细胞抑制肝癌生长等方面, 关于NK细胞抑制肝癌侵袭转移的研究尚少见, 具有一定的创新性.
我们可通过评估肝癌中NK细胞的浸润情况作为预测肝癌的预后; 通过IL-2激活NK细胞, 使其发挥免疫功能是治疗肝癌的一种有效方法.
任宁, 博士, 主任医师, 复旦大学附属中山医院外科
本文研究了NK细胞对肝细胞癌增殖、转移的影响, 从体外和动物模型两方面验证了NK细胞在肝癌发展过程中可能发挥的抗肿瘤作用. 立题依据充分, 研究方法可行, 实验内容详实, 论文书写流畅, 层次分明.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 福建省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:李瑞芳
| 1. | But DY, Lai CL, Yuen MF. Natural history of hepatitis-related hepatocellular carcinoma. World J Gastroenterol. 2008;14:1652-1656. [PubMed] [DOI] |
| 2. | Hao K, Luk JM, Lee NP, Mao M, Zhang C, Ferguson MD, Lamb J, Dai H, Ng IO, Sham PC. Predicting prognosis in hepatocellular carcinoma after curative surgery with common clinicopathologic parameters. BMC Cancer. 2009;9:389. [PubMed] [DOI] |
| 3. | Sangiovanni A, Colombo M. Treatment of hepatocellular carcinoma: beyond international guidelines. Liver Int. 2016;36 Suppl 1:124-129. [PubMed] [DOI] |
| 4. | Invernizzi F, Viganò M, Grossi G, Lampertico P. The prognosis and management of inactive HBV carriers. Liver Int. 2016;36 Suppl 1:100-104. [PubMed] [DOI] |
| 5. | Seki S, Nakashima H, Nakashima M, Kinoshita M. Antitumor immunity produced by the liver Kupffer cells, NK cells, NKT cells, and CD8 CD122 T cells. Clin Dev Immunol. 2011;2011:868345. [PubMed] [DOI] |
| 6. | Geissler M, Mohr L, Blum HE. Immunotherapy of hepatocellular carcinoma. Dtsch Med Wochenschr. 2001;126:1464-1466. [PubMed] [DOI] |
| 7. | Gersuk GM, Westermark B, Mohabeer AJ, Challita PM, Pattamakom S, Pattengale PK. Inhibition of human natural killer cell activity by platelet-derived growth factor (PDGF). III. Membrane binding studies and differential biological effect of recombinant PDGF isoforms. Scand J Immunol. 1991;33:521-532. [PubMed] [DOI] |
| 8. | Barkholt L, Alici E, Conrad R, Sutlu T, Gilljam M, Stellan B, Christensson B, Guven H, Björkström NK, Söderdahl G. Safety analysis of ex vivo-expanded NK and NK-like T cells administered to cancer patients: a phase I clinical study. Immunotherapy. 2009;1:753-764. [PubMed] [DOI] |
| 9. | Doskali M, Tanaka Y, Ohira M, Ishiyama K, Tashiro H, Chayama K, Ohdan H. Possibility of adoptive immunotherapy with peripheral blood-derived CD3-CD56+ and CD3+CD56+ cells for inducing antihepatocellular carcinoma and antihepatitis C virus activity. J Immunother. 2011;34:129-138. [PubMed] [DOI] |
| 10. | Yang X, Liang L, Zhang XF, Jia HL, Qin Y, Zhu XC, Gao XM, Qiao P, Zheng Y, Sheng YY. MicroRNA-26a suppresses tumor growth and metastasis of human hepatocellular carcinoma by targeting interleukin-6-Stat3 pathway. Hepatology. 2013;58:158-170. [PubMed] [DOI] |
| 11. | Ciaglia E, Pisanti S, Picardi P, Laezza C, Sosa S, Tubaro A, Vitale M, Gazzerro P, Malfitano AM, Bifulco M. N6-isopentenyladenosine affects cytotoxic activity and cytokines production by IL-2 activated NK cells and exerts topical anti-inflammatory activity in mice. Pharmacol Res. 2014;89:1-10. [PubMed] [DOI] |
| 12. | Zhu LY, Zhou J, Liu YZ, Pan WD. Prognostic significance of natural killer cell infiltration in hepatocellular carcinoma. Ai Zheng. 2009;28:1198-1202. [PubMed] [DOI] |
| 13. | Matsuoka S, Maeda N, Izumiya C, Yamashita C, Nishimori Y, Fukaya T. Expression of inhibitory-motif killer immunoglobulin-like receptor, KIR2DL1, is increased in natural killer cells from women with pelvic endometriosis. Am J Reprod Immunol. 2005;53:249-254. [PubMed] [DOI] |
| 14. | Li T, Yang Y, Hua X, Wang G, Liu W, Jia C, Tai Y, Zhang Q, Chen G. Hepatocellular carcinoma-associated fibroblasts trigger NK cell dysfunction via PGE2 and IDO. Cancer Lett. 2012;318:154-161. [PubMed] [DOI] |
| 15. | Ju Y, Hou N, Meng J, Wang X, Zhang X, Zhao D, Liu Y, Zhu F, Zhang L, Sun W. T cell immunoglobulin- and mucin-domain-containing molecule-3 (Tim-3) mediates natural killer cell suppression in chronic hepatitis B. J Hepatol. 2010;52:322-329. [PubMed] [DOI] |
| 16. | Ohira M, Nishida S, Tryphonopoulos P, Tekin A, Selvaggi G, Moon J, Levi D, Ricordi C, Ishiyama K, Tanaka Y. Clinical-scale isolation of interleukin-2-stimulated liver natural killer cells for treatment of liver transplantation with hepatocellular carcinoma. Cell Transplant. 2012;21:1397-1406. [PubMed] [DOI] |
| 17. | Tsunematsu H, Tatsumi T, Kohga K, Yamamoto M, Aketa H, Miyagi T, Hosui A, Hiramatsu N, Kanto T, Hayashi N. Fibroblast growth factor-2 enhances NK sensitivity of hepatocellular carcinoma cells. Int J Cancer. 2012;130:356-364. [PubMed] [DOI] |
| 18. | Mikuriya Y, Tashiro H, Kuroda S, Nambu J, Kobayashi T, Amano H, Tanaka Y, Ohdan H. Fatty liver creates a pro-metastatic microenvironment for hepatocellular carcinoma through activation of hepatic stellate cells. Int J Cancer. 2015;136:E3-E13. [PubMed] [DOI] |
| 19. | Faridi RM, Das V, Tripthi G, Talwar S, Parveen F, Agrawal S. Influence of activating and inhibitory killer immunoglobulin-like receptors on predisposition to recurrent miscarriages. Hum Reprod. 2009;24:1758-1764. [PubMed] [DOI] |
| 20. | Maat W, van der Slik AR, Verhoeven DH, Alizadeh BZ, Ly LV, Verduijn W, Luyten GP, Mulder A, van Hall T, Koning F. Evidence for natural killer cell-mediated protection from metastasis formation in uveal melanoma patients. Invest Ophthalmol Vis Sci. 2009;50:2888-2895. [PubMed] [DOI] |
| 21. | Uemura A, Takehara T, Miyagi T, Suzuki T, Tatsumi T, Ohkawa K, Kanto T, Hiramatsu N, Hayashi N. Natural killer cell is a major producer of interferon gamma that is critical for the IL-12-induced anti-tumor effect in mice. Cancer Immunol Immunother. 2010;59:453-463. [PubMed] [DOI] |
| 22. | Wu Y, Kuang DM, Pan WD, Wan YL, Lao XM, Wang D, Li XF, Zheng L. Monocyte/macrophage-elicited natural killer cell dysfunction in hepatocellular carcinoma is mediated by CD48/2B4 interactions. Hepatology. 2013;57:1107-1116. [PubMed] [DOI] |
| 23. | Yoon JC, Lim JB, Park JH, Lee JM. Cell-to-cell contact with hepatitis C virus-infected cells reduces functional capacity of natural killer cells. J Virol. 2011;85:12557-12569. [PubMed] [DOI] |
| 24. | Yamagiwa S, Kamimura H, Ichida T. Natural killer cell receptors and their ligands in liver diseases. Med Mol Morphol. 2009;42:1-8. [PubMed] [DOI] |
| 25. | Hoechst B, Voigtlaender T, Ormandy L, Gamrekelashvili J, Zhao F, Wedemeyer H, Lehner F, Manns MP, Greten TF, Korangy F. Myeloid derived suppressor cells inhibit natural killer cells in patients with hepatocellular carcinoma via the NKp30 receptor. Hepatology. 2009;50:799-807. [PubMed] [DOI] |
| 26. | Konjević G, Mirjacić Martinović K, Vuletić A, Jović V, Jurisić V, Babović N, Spuzić I. Low expression of CD161 and NKG2D activating NK receptor is associated with impaired NK cell cytotoxicity in metastatic melanoma patients. Clin Exp Metastasis. 2007;24:1-11. [PubMed] [DOI] |
| 27. | Kamimura H, Yamagiwa S, Tsuchiya A, Takamura M, Matsuda Y, Ohkoshi S, Inoue M, Wakai T, Shirai Y, Nomoto M. Reduced NKG2D ligand expression in hepatocellular carcinoma correlates with early recurrence. J Hepatol. 2012;56:381-388. [PubMed] [DOI] |
| 28. | Morisaki T, Onishi H, Koya N, Kiyota A, Tanaka H, Umebayashi M, Ogino T, Nagamatsu I, Katano M. Combinatorial cytotoxicity of gemcitabine and cytokine-activated killer cells in hepatocellular carcinoma via the NKG2D-MICA/B system. Anticancer Res. 2011;31:2505-2510. [PubMed] |
| 29. | Pan N, Jiang W, Sun H, Miao F, Qiu J, Jin H, Xu J, Shi Q, Xie W, Zhang J. KIR and HLA loci are associated with hepatocellular carcinoma development in patients with hepatitis B virus infection: a case-control study. PLoS One. 2011;6:e25682. [PubMed] [DOI] |
| 30. | Townsley E, O'Connor G, Cosgrove C, Woda M, Co M, Thomas SJ, Kalayanarooj S, Yoon IK, Nisalak A, Srikiatkhachorn A. Interaction of a dengue virus NS1-derived peptide with the inhibitory receptor KIR3DL1 on natural killer cells. Clin Exp Immunol. 2016;183:419-430. [PubMed] [DOI] |
| 31. | Bachanova V, McCullar V, Lenvik T, Wangen R, Peterson KA, Ankarlo DE, Panoskaltsis-Mortari A, Wagner JE, Miller JS. Activated notch supports development of cytokine producing NK cells which are hyporesponsive and fail to acquire NK cell effector functions. Biol Blood Marrow Transplant. 2009;15:183-194. [PubMed] [DOI] |
| 32. | Gong J, Liu R, Zhuang R, Zhang Y, Fang L, Xu Z, Jin L, Wang T, Song C, Yang K. miR-30c-1* promotes natural killer cell cytotoxicity against human hepatoma cells by targeting the transcription factor HMBOX1. Cancer Sci. 2012;103:645-652. [PubMed] [DOI] |