修回日期: 2017-05-15
接受日期: 2017-05-22
在线出版日期: 2017-07-18
定量分析中晚期食管癌患者切除修复交叉互补基因1(excision repair cross comple-menting 1, ERCC1)C-19007T基因多态性与铂类药物化疗敏感性的关系.
计算机检索PubMed、EMBASE、Cochrane Library, 中文科技期刊数据库、中国生物医学文献数据库、中国期刊全文数据库和万方数据库, 收集有关中晚期食管癌患者ERCC1-C19007T基因多态性与基于铂类药物方案化疗敏感性的相关研究, 以临床化疗有效率(完全缓解+部分缓解)作为化疗敏感评价指标, 采用Reviewm5.2及Stata12.1软件进行统计学分析, 计算合并比值比(odd ratio, OR)及95%可信区间(confidence interval, CI).
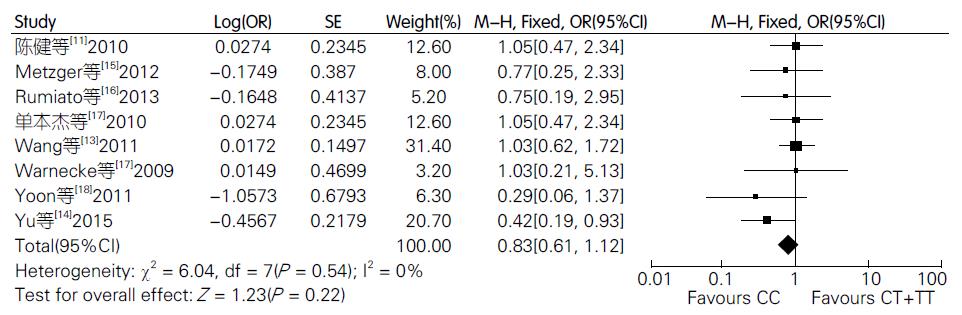
本研究共纳入8篇文献. Meta分析结果显示, 各基因型之间(CT vs CC: OR = 3.31, 95%CI: 1.94-5.64); (CT vs TT: OR = 5.48, 95%CI: 3.21-9.35); (CT vs CC+TT: OR = 4.06, 95%CI: 2.66-6.18); 差异有统计学意义, 表明ERCC1-C19007T基因多态性与中晚期食管癌对铂类化疗药物敏感性的差异有统计学意义.
ERCC1-C19007T基因多态性可能与食管癌铂类药物化疗耐药相关.
核心提要: 目前, 有较多研究表明, ERCC1-C19007T基因单核苷酸多态性与基于铂类方案的化疗敏感性相关. 本研究拟采用Meta分析的方法, 对以往国内外发表的关于ERCC1-C19007T基因多态性与铂类药物化疗敏感性关系的研究结果进行了定量分析, 以期为中晚期食管癌的临床个体化治疗提供证据.
引文著录: 柏启州, 于珺, 苟云久, 贺生亮, 李永顺, 黄长荣, 汪诚风. ERCC1-C19007T基因多态性与中晚期食管癌铂类药物化疗敏感性的Meta分析. 世界华人消化杂志 2017; 25(20): 1854-1860
Revised: May 15, 2017
Accepted: May 22, 2017
Published online: July 18, 2017
To evaluate the association between C-19007T polymorphism of the excision repair cross complementing 1 (ERCC1) gene and sensitivity to platinum based chemotherapy in advanced esophageal cancer.
Relevant published studies were retrieved from PubMed, EMBASE, Cochrane Library, Chinese Science and Technology Periodicals Data, Chinese Biomedical Literature Data, and China National Knowledge Infrastructure. Clinical response [complete response (CR) + partial response (PR)] was employed to estimate chemosensitivity. Odds ratio (OR) and its 95% confidence interval (CI) were calculated. Statistical analyses were conducted using Reviewm5.2 and Stata12.1 software.
A total of 8 trials were included in this analysis. The result of meta-analysis showed that statistical significance was found between ERCC1-C-19007T polymorphism and clinical response in genotypes CT vs CC (OR = 3.31, 95%CI: 1.94-5.64); CT vs TT (OR = 5.48, 95%CI: 3.21-9.35); and CT vs CC + TT (OR = 4.06, 95%CI: 2.66-6.18).
Polymorphism of ERCC1-C-19007T may be associated with non-response to platinum-based chemotherapy in advanced esophageal cancer.
- Citation: Bai QZ, Yu J, Gou YJ, He SL, Li YS, Huang CR, Wang CF. Association between C-19007T polymorphism of ERCC1 gene and sensitivity to platinum based chemotherapy in advanced esophageal cancer: A meta-analysis. Shijie Huaren Xiaohua Zazhi 2017; 25(20): 1854-1860
- URL: https://www.wjgnet.com/1009-3079/full/v25/i20/1854.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i20.1854
食管癌是世界范围内较常见的恶性肿瘤之一, 其发病率居全球恶性肿瘤的第8位, 死亡率居第6位. 我国是食管癌发病率较高的国家之一, 而且大部分患者就诊时已属中晚期, 虽然具有手术联合放化疗等多种治疗手段, 但治疗效果依然较差[1,2]. 基于铂类的化疗方案是食管癌常用的方案之一, 其作用机制是铂类药物可与DNA形成链间或链内交联而导致DNA损伤, 最终引起肿瘤细胞的凋亡, 但铂类药物产生的耐药性是引起化疗失败的主要原因[3-5]. 于铂类的化疗方案的近期客观有效率仅为30%-50%, 因此, 约有50%-70%的患者应用该方案是无效的, 而且还需承担较贵的经济费用和相应的不良反应[6]. 核苷酸切除修复(nucleotide excision repair, NER)是细胞内修复铂类化疗造成的DNA损伤的重要途径, 除修复交叉互补基因1(excision repair cross complementing 1, ERCC1)是NER途径中的限速酶, 其主要参与DNA交联损伤的修复途径[5,7]. 目前, 有较多研究[8-10]表明, ERCC1-C19007T基因单核苷酸多态性(single nucleotidepolymorphisms, SNP)与基于铂类方案的化疗敏感性相关. 本研究拟采用Meta分析的方法, 对以往国内外发表的关于ERCC1-C19007T基因多态性与铂类药物化疗敏感性关系的研究结果进行了定量分析, 以期为中晚期食管癌的临床个体化治疗提供证据.
计算机检索PubMed、EMBASE、Web of Science、CNKI、VIP、CBM和万方数据库等. 检索词包括: 食管癌、铂类、化疗、切除修复交叉互补基因、基因多态性、Esophageal Cancer、ERCC1、Chemotherapy、platinum、gene polymorphism等, 检索时限至2016-03.
1.2.1 文献纳入标准: (1)研究设计及研究对象: 国内外公开发表的ERCC1-C19007T基因多态性与中晚期食管癌铂类药物联合化疗的相关性研究, 食管癌均为病理或细胞学研究证实; (2)文献中纳入研究对象的群体的基因型的分布符合Hardy-Weinberg平衡; (3)化疗疗效的依据是根据世界卫生组织标准或实体瘤疗效的评价标准, 有效为完全缓解(complete response, CR)和部分缓解(partial response, PR)之和.
1.2.2 文献筛选: 由2名研究者(苟云久、柏启州)根据入选标准决定文献是否被纳入, 若有分歧经讨论或寻求第三者(于珺)解决.
1.2.3 资料提取: 从纳入的文献中提取的信息包括: 作者、发表年限、人群来源、化疗方案、总例数和各基因型携带病例数、治疗有效率等.
统计学处理 应用Reviewm5.2和Stata12.1软件进行Meta分析, 采用Q检验分纳入研究间的异质性, 若无统计学差异(P>0.1, I2≤50%), 则采用固定效应模型进行Meta分析, 否则采用随机效应模型. 并在Stata12.1中采用Egger法和Begg法对发表偏倚进行定量分析. 并通过逐一排除的方法进行敏感性分析, 若OR值无明显变化, 则说明稳定性较好.
初检相关文献105篇, 通过阅读标题和摘要剔除92篇, 按照纳入和排除标准阅读全文后剔除5篇(2篇为没有基因分型, 3篇为会议摘要), 最终纳入8篇文献[11-18], 共包含869例患者.
各纳入研究的基本特征如表1, 其中4篇文献的研究对象为中国人群[11-14], 4篇研究为欧美人群[15-18], 8篇研究均符合Hardy-Weinberg平衡[11-18], 5篇研究报道各等位基因频数[14-18], 3篇研究报道[11-13]的基因型为CC/CT+TT(表1).
| 纳入研究 | 国家 | 基因检测方法 | 病理类型 | 化疗方案 | n | 化疗有效性(n/N) | HWE | ||
| CC | CT | TT | |||||||
| 陈健等[11]2010 | 中国 | PCR-RFLP | AEC | FLP | 98 | 23/53 | 19/451 | - | Yes |
| Metzger等[15]2012 | 德国 | PCR-RFLP | AEC | FLP | 153 | 5/16 | 37/63 | 14/74 | Yes |
| Rumiato等[16]2013 | 意大利 | PCR-RFLP | AEC | FLP | 63 | 4/10 | 16/28 | 9/25 | Yes |
| 单本杰等[12]2010 | 中国 | PCR-RFLP | AEC | FLP | 99 | 23/53 | 19/451 | - | Yes |
| Wang等[13]2010 | 中国 | PCR-RFLP | AEC | FLP | 241 | 56/130 | 47/1111 | - | Yes |
| Warnecke等[17]2009 | 德国 | PCR-RFLP | AEC | FLP | 52 | 3/7 | 14/20 | 5/25 | Yes |
| Yoon[18]2011 | 美国 | PCR-RFLP | AEC | DDP+Taxane/FLP | 60 | 3/38 | 5/22 | 0 | Yes |
| Yu等[14]2015 | 中国 | PCR-RFLP | AEC | DDP+5-Fu/Taxane | 104 | 19/52 | 28/41 | 2/11 | Yes |
对ERCC1-C19007T基因多态性与食管癌铂类药物化疗敏感性进行Meta分析, 异质性检结果显示, 各模型之间同质性良好, 采用固定效应模型进行合并效应值计算. Meta分析结果显示(表2), 杂合子CT模型的中晚期食管癌患者对基于铂类方案的化疗具有较好的敏感性: (CT vs CC: OR = 3.31, 95%CI: 1.94-5.64); (CT vs TT: OR = 5.48, 95%CI: 3.21-9.35); (CT vs CC+TT: OR = 4.06, 95%CI: 2.66-6.18), 差异有统计学意义, 表明杂合子CT模型较重合子CC、TT模型对化疗有较好的敏感性; 重合子模型CC vs TT: OR = 1.98, 95CI%: 0.95-4.13, CC vs CT+TT: OR = 0.83, 95%CI: 0.61-1.12(图1); 按人种进行亚组分析, 结果显示: 亚洲人群CC vs CT+TT: OR = 0.87, 95%CI: 0.62-1.23; 欧美人群CC vs CT+TT: OR = 0.67, 95%CI: 0.34-1.31, 差异均无统计学意义(表2).
| 基因模型 | 纳入研究数量 | 异质性分析 | 合并模型 | OR(95%CI) | P值 | |
| P值 | I2(%) | |||||
| CT vs CC | 5 | 0.75 | 0 | Fixed | 3.31[1.94,5.64] | 0.0001 |
| CC vs TT | 4 | 0.86 | 0 | Fixed | 1.98[0.95,4.13] | 0.07 |
| CT vs TT | 4 | 0.35 | 9 | Fixed | 5.48[3.21,9.35] | <0.0001 |
| CC vs CT+TT | 8 | 0.54 | 0 | Fixed | 0.83[0.61,1.12] | 0.22 |
| CT vs CC+TT | 5 | 0.45 | 0 | Fixed | 4.06[2.66,6.18] | <0.0001 |
| 亚组分析 | ||||||
| 亚洲CC vs CT+TT | 4 | 0.25 | 26 | Fixed | 0.87[0.62,1.23] | 0.44 |
| 欧洲CC vs CT+TT | 4 | 0.69 | 0 | Fixed | 0.67[0.34,1.31] | 0.24 |
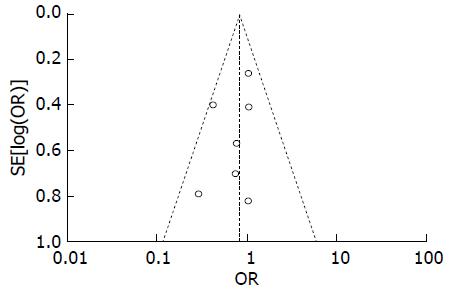
利用Reviewm5.2软件绘制漏斗图(图2), 并在Stata12.1软件中采用Begg法对发表偏倚进行定量分析, 其中, Begg秩相关检验所得P = 0.322; Egger线性回归所得P = 0.270, 均提示无明显发表偏倚; 漏斗图对称, 表明发表偏倚较小, 结果较可靠.
对纳入的文献采取逐一排除的方法进行敏感性分析, 结果显示被纳入的任意一篇文献被排除后, 其OR值与总OR值相近, 说明本研究结果稳定性好.
铂类化疗药物的种类包括顺铂、卡铂以及奈达铂和奥沙利铂, 基于铂类方案的化疗对多种肿瘤的治疗有效, 如肺癌、胃癌、食管癌等. 铂类化疗药的抗肿瘤的机制主要是铂原子进入细胞内后, 与DNA的嘌呤碱基相结合, 形成链内交联的Pt-DNA加成物, 这些加成物通过改变DNA的结构, 从而使的DNA的复制和转录受到抑制, 导致细胞周期紊乱, 并继发细胞的衰老和凋亡, 达到肿瘤治疗的目的[19,20].
但是, 机体内NER的存在可将形成的Pt-DNA加成物予以切除, 并修复DNA的结构, 破坏了我们希望看到的细胞周期紊乱的结果, 影响治疗效果, 同样也是造成铂类化疗药物耐药的主要机制[20,21]. ERCC1是NER途径中的限速酶, 该途径属于核苷酸切除修复途径, 也是DNA损伤最主要的修复途径[22-24]. ERCC1定位于19q13.2-13.3, 结构上高度保守, 含有14个外显子, 分布于基因15 Kb处. 编码1.2 Kb个碱基对, 常与着色性干皮病基因F(xeroderma pigmentosum group F, XPF), 形成ERCC1-XPF复合体, 该复合体是5'-3'的限制性核酸内切酶, 可以在损伤位点15-24个核苷酸处切开DNA单链, 进而参与DNA链的切割和损伤识别[25,26]. 有研究[27]显示在众多NER的修复相关因子中ERCC1-XPF是影响DNA修复能力最为重要的因素, 其中ERCC1蛋白又是NER途径中具有特异性的重要组成部分, 他的存在对生命至关重要.
目前有关ERCC1基因多态性与铂类药物化疗敏感性的研究已较多, 本Meta分析共纳入8篇文献[11-18], 4篇来源于中国[11-14], 2篇来自德国[15,17], 1篇来自意大利[16], 1篇来自美国[18]. 其中3篇文献(国内1篇[14], 国外2篇[15,16])研究认为, ERCC1-C19007T杂合子基因型(CT)的食管癌患者对化疗的敏感性高于重合子基因型(CC、TT或CC+TT)的患者, 这与本Meta分析结果研究一致(表2); 但本研究结果与现有的关于ERCC1基因多态性对铂类药物治疗胃癌[28]和肺癌[25]的荟萃分析结果差异较大, 上述两种肿瘤的荟萃分析结果均显示野生基因型(CC)胃癌和肺癌患者对化疗的敏感性均高于突变型的(CT+TT)(肺癌CC vs TT+CT: OR = 2.17, 95%CI: 1.43-3.33; 胃癌TT+CT vs CC:OR = 0.52, 95%CI: 0.39-0.70), 认为突变型基因(CT/TT)胃癌和肺癌患者与野生型(CC)患者相比, 对铂类药物化疗的敏感性降低. 但在本研究纳入的文献中, 有国内3篇文献报道[11-13]的数据将CT+TT值是合并在一起, 并分析了野生基因模型(CC)与突变基因型(CT+TT)的化疗的敏感性结果, 但结果均无统计学差异, 本研究也将纳入的所有文献将数据合并后对比分析了CC vs CT+TT, 其结果(OR = 0.83, 95%CI: 0.61-1.12), 与国内报道的文献结果一致, 对亚洲人群和欧美人群进行亚组分析, 结果分别为(OR = 0.87, 95%CI: 0.62-1.23)、(OR = 0.67, 95%CI: 0.34-1.31), 也无统计学差异, 说明ERCC1-C19007T基因多态性与中晚期食管癌化疗敏感性之间不存在种族差异. 本研究结果与理论推断的结果相反, 这可能与肿瘤本身的特性有关, 肿瘤的发生发展是多基因、多因素参与的过程, 而不只是单单的SNP, 并且DNA损伤修复过程也涉及多种基因[29], 有学者[24,30]研究显示ERCC1的基因多态性并没有改变其细胞内蛋白的表达, 这也就意味着有其他基因参与ERCC1蛋白表达, 并对肿瘤的治疗产生了一定的效果; 因此, 在今后的研究过程中, 应对ERCC1基因多态性与铂类药物化疗之间的多基因的相互作用进行研究.
本研究存在以下局限性: (1)纳入的研究的样本量小, 主要涉及的是亚洲和欧美人群, 不能代表总体人群; (2)不同的化疗方案和检测方法可能对结果产生影响; (3)与随机对照试验不同, 目前尚无合适的前瞻性队列研究的质量评价体系, 未对纳入的研究进行质量评价, 可能存在相应的统计学差异; (4)食管癌病理类型的不一致对研究结果造成一定的影响.
总之, ERCC1-C19007T基因多态性可能与中晚期食管癌铂类方案的化疗的耐药性有关, 基于肿瘤的发生发展属于多因素过程, 因此尚需更多、大样本的临床研究来进一步证实.
基于铂类的化疗方案是食管癌常用的方案之一, 但基于铂类的化疗方案的近期客观有效率仅为30%-50%, 因此, 约有50%-70%的患者应用该方案是无效的, 而且还需承担较贵的经济费用和相应的不良反应. 因此, 寻找引起铂耐药的原因具有重要意义.
食管癌对铂类化疗药物的敏感性是由一系列相关基因共同调控的复杂过程. 切除修复交叉互补基因1(excision repair cross com-plementing 1, ERCC1)是人体重要的DNA修复基因家族成员, 有研究显示: ERCC1的表达与铂类化疗药物的疗效呈负相关, 但具体机制目前尚未可知.
有研究报道了关于ERCC1基因多态性对铂类药物治疗胃癌和肺癌的荟萃分析的研究结果, 但对食管癌的基于铂类化疗的荟萃分析较少.
关于ERCC1基因多态性对铂类药物治疗胃癌和肺癌的荟萃分析结果差异较大, 肺癌和胃癌两种肿瘤的荟萃分析结果显示野生基因型(CC)胃癌和肺癌患者对化疗的敏感性均高于突变型的(CT+TT), 而本研究结果与理论推断的结果相反, 这可能与肿瘤本身的特性有关, 肿瘤的发生发展是多基因、多因素参与的过程, 而不只是单单的SNP, 并且DNA损伤修复过程也涉及多种基因.
基于铂类的化疗方案是食管癌化疗的主要方案之一, 但铂类化疗的客观有效性较低, ERCC1的表达与铂类化疗药物的疗效呈负相关, 本研究表明ERCC1-C19007T基因多态性可能与食管癌铂类药物化疗耐药相关.
单核苷酸基因多态性(SNP): 主要是指在基因组水平上由单个核苷酸的变异所引起的DNA序列多态性.
许建新, 副主任医师, 福建医科大学教学医院莆田市第一医院胸外科
本文从循证医学角度分析了ERCC1-C19007T基因多态性与中晚期食管癌铂类药物化疗的敏感性, 对指导临床和相关研究具有一定的实用价值和指导意义.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 甘肃省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:李瑞芳
| 1. | Shahbaz Sarwar CM, Luketich JD, Landreneau RJ, Abbas G. Esophageal cancer: an update. Int J Surg. 2010;8:417-422. [PubMed] [DOI] |
| 2. | Tanaka K, Otake K, Mohri Y, Ohi M, Yokoe T, Toiyama Y, Miki C, Tonouchi H, Kusunoki M. Clinical significance of the gene expression profile in residual tumor cells after neoadjuvant chemo-radiotherapy for esophageal cancer. Oncol Rep. 2009;21:1489-1494. [PubMed] [DOI] |
| 3. | Bradbury PA, Kulke MH, Heist RS, Zhou W, Ma C, Xu W, Marshall AL, Zhai R, Hooshmand SM, Asomaning K. Cisplatin pharmacogenetics, DNA repair polymorphisms, and esophageal cancer outcomes. Pharmacogenet Genomics. 2009;19:613-625. [PubMed] [DOI] |
| 5. | Tse D, Zhai R, Zhou W, Heist RS, Asomaning K, Su L, Lynch TJ, Wain JC, Christiani DC, Liu G. Polymorphisms of the NER pathway genes, ERCC1 and XPD are associated with esophageal adenocarcinoma risk. Cancer Causes Control. 2008;19:1077-1083. [PubMed] [DOI] |
| 6. | Liu G, Zhou W, Yeap BY, Su L, Wain JC, Poneros JM, Nishioka NS, Lynch TJ, Christiani DC. XRCC1 and XPD polymorphisms and esophageal adenocarcinoma risk. Carcinogenesis. 2007;28:1254-1258. [PubMed] [DOI] |
| 7. | Dewalt RI, Kesler KA, Hammoud ZT, Baldridge L, Hattab EM, Jalal SI. Gastroesophageal junction adenocarcinoma displays abnormalities in homologous recombination and nucleotide excision repair. Lung Cancer (Auckl). 2014;5:11-20. [PubMed] [DOI] |
| 8. | Ojima T, Nakamori M, Nakamura M, Katsuda M, Hayata K, Nakamura Y, Yamaue H. Expression of BRCA1, a factor closely associated with relapse-free survival, in patients who underwent neoadjuvant chemotherapy with docetaxel, cisplatin, and fluorouracil for squamous cell carcinoma of the esophagus. Surg Today. 2017;47:65-73. [PubMed] [DOI] |
| 9. | Kim MK, Cho KJ, Kwon GY, Park SI, Kim YH, Kim JH, Song HY, Shin JH, Jung HY, Lee GH. ERCC1 predicting chemoradiation resistance and poor outcome in oesophageal cancer. Eur J Cancer. 2008;44:54-60. [PubMed] [DOI] |
| 10. | Ge H, Lu Y, Chen Y, Zheng X, Wang W, Yu J. ERCC1 expression and tumor regression predict survival in esophageal squamous cell carcinoma patients receiving combined trimodality therapy. Pathol Res Pract. 2014;210:656-661. [PubMed] [DOI] |
| 12. | 单 本杰, 何 义富, 陈 健, 李 笑秋, 季 楚舒, 胡 长路, 胡 冰. 晚期食管癌患者外周血ERCC1基因多态性与顺铂化疗疗效相关性研究. 中华肿瘤防治杂志. 2010;17:1447-1450. |
| 13. | Wang Y, Chen J, Li X, He Y, Hu B, Ji C, Xu J. Genetic polymorphisms of ERCC1 and their effects on the efficacy of cisplatin-based chemotherapy in advanced esophageal carcinoma. Oncol Rep. 2011;25:1047-1052. [PubMed] [DOI] |
| 14. | Yu X, Xiao H, Zhao B, Zhang X, Wang G. DNA repair gene ERCC1 C118T polymorphism predicts sensitivity of recurrent esophageal cancer to radiochemotherapy in a Chinese population. Thorac Cancer. 2015;6:741-748. [PubMed] [DOI] |
| 15. | Metzger R, Warnecke-Eberz U, Alakus H, Kütting F, Brabender J, Vallböhmer D, Grimminger PP, Mönig SP, Drebber U, Hölscher AH. Neoadjuvant radiochemotherapy in adenocarcinoma of the esophagus: ERCC1 gene polymorphisms for prediction of response and prognosis. J Gastrointest Surg. 2012;16:26-34; discussion 34. [PubMed] [DOI] |
| 16. | Rumiato E, Cavallin F, Boldrin E, Cagol M, Alfieri R, Basso D, Castoro C, Ancona E, Amadori A, Ruol A. ERCC1 C8092A (rs3212986) polymorphism as a predictive marker in esophageal cancer patients treated with cisplatin/5-FU-based neoadjuvant therapy. Pharmacogenet Genomics. 2013;23:597-604. [PubMed] [DOI] |
| 17. | Warnecke-Eberz U, Vallböhmer D, Alakus H, Kütting F, Lurje G, Bollschweiler E, Wienand-Dorweiler A, Drebber U, Hölscher AH, Metzger R. ERCC1 and XRCC1 gene polymorphisms predict response to neoadjuvant radiochemotherapy in esophageal cancer. J Gastrointest Surg. 2009;13:1411-1421. [PubMed] [DOI] |
| 18. | Yoon HH, Catalano PJ, Murphy KM, Skaar TC, Philips S, Powell M, Montgomery EA, Hafez MJ, Offer SM, Liu G. Genetic variation in DNA-repair pathways and response to radiochemotherapy in esophageal adenocarcinoma: a retrospective cohort study of the Eastern Cooperative Oncology Group. BMC Cancer. 2011;11:176. [PubMed] [DOI] |
| 19. | Bahamon BN, Gao F, Danaee H. Development and Validation of an ERCC1 Immunohistochemistry Assay for Solid Tumors. Arch Pathol Lab Med. 2016;140:1397-1403. [PubMed] [DOI] |
| 20. | Huang J, Zhou Y, Zhang H, Qu T, Mao Y, Zhu H, Quan L, Xing P, Wang J, He J. A phase II study of biweekly paclitaxel and cisplatin chemotherapy for recurrent or metastatic esophageal squamous cell carcinoma: ERCC1 expression predicts response to chemotherapy. Med Oncol. 2013;30:343. [PubMed] [DOI] |
| 21. | Zhou F, Zhu M, Wang M, Qiu L, Cheng L, Jia M, Xiang J, Wei Q. Genetic variants of DNA repair genes predict the survival of patients with esophageal squamous cell cancer receiving platinum-based adjuvant chemotherapy. J Transl Med. 2016;14:154. [PubMed] [DOI] |
| 22. | Li Q, Yu JJ, Mu C, Yunmbam MK, Slavsky D, Cross CL, Bostick-Bruton F, Reed E. Association between the level of ERCC-1 expression and the repair of cisplatin-induced DNA damage in human ovarian cancer cells. Anticancer Res. 2000;20:645-652. [PubMed] |
| 23. | Huang X, Liu C, Cui Y, Zhang H, Liu Y, Zhou X, Luo J. Association between XRCC1 and ERCC1 single-nucleotide polymorphisms and the efficacy of concurrent radiochemotherapy in patients with esophageal squamous cell carcinoma. Oncol Lett. 2017;13:704-714. [PubMed] [DOI] |
| 24. | Gao R, Reece K, Sissung T, Reed E, Price DK, Figg WD. The ERCC1 N118N polymorphism does not change cellular ERCC1 protein expression or platinum sensitivity. Mutat Res. 2011;708:21-27. [PubMed] [DOI] |
| 25. | Wei SZ, Zhan P, Shi MQ, Shi Y, Qian Q, Yu LK, Song Y. Predictive value of ERCC1 and XPD polymorphism in patients with advanced non-small cell lung cancer receiving platinum-based chemotherapy: a systematic review and meta-analysis. Med Oncol. 2011;28:315-321. [PubMed] [DOI] |
| 26. | Qixing M, Gaochao D, Wenjie X, Rong Y, Feng J, Lin X, Mantang Q, Qiang C. Predictive Value of Ercc1 and Xpd Polymorphisms for Clinical Outcomes of Patients Receiving Neoadjuvant Therapy: A Prisma-Compliant Meta-Analysis. Medicine (Baltimore). 2015;94:e1593. [PubMed] [DOI] |
| 27. | Vogel U, Dybdahl M, Frentz G, Nexo BA. DNA repair capacity: inconsistency between effect of over-expression of five NER genes and the correlation to mRNA levels in primary lymphocytes. Mutat Res. 2000;461:197-210. [PubMed] [DOI] |
| 28. | 王 玉凤, 姜 雷, 关 泉林, 魏 孔孔, 代 强, 邓 成辉. ERCC1Asn118Asn(C/T)基因多态性与进展期胃癌铂类药物化疗敏感性的Meta分析. 肿瘤. 2014;34:557-563. |
| 29. | Miura JT, Xiu J, Thomas J, George B, Carron BR, Tsai S, Johnston FM, Turaga KK, Gamblin TC. Tumor profiling of gastric and esophageal carcinoma reveal different treatment options. Cancer Biol Ther. 2015;16:764-769. [PubMed] [DOI] |
| 30. | Sobajima J, Haga N, Kumamoto K, Ishibashi K, Ishida H. ERCC1 and TS expression in chemoradiotherapy treated esophageal squamous cell carcinoma. Gan To Kagaku Ryoho. 2010;37:2394-2396. [PubMed] |