修回日期: 2016-11-07
接受日期: 2016-11-14
在线出版日期: 2017-01-18
炎症反应是腹部手术创伤的重要病理生理变化, 适度炎症反应对创伤愈合起到积极作用, 但过度炎症反应对机体有害, 是术后各种并发症的主要原因, 是发展至多器官障碍综合征的共同通路. 因此, 对围手术期过度炎症反应积极进行干预, 可以减少术后并发症发病率和死亡率. 但目前对围手术期过度炎症反应的病理生理过程的认识尚处初级阶段. 本文对腹部外科围手术期过度炎症反应的诱发因素、发生机制、病理生理变化及对机体的危害和影响进行系统介绍.
核心提要: 近年来关于腹部外科围手术期过度炎症反应的研究方兴未艾, 研究的领域涉及多个方面, 本文主要综述了腹部外科围手术期过度炎症反应的诱发因素、发生机制、病理生理变化及对机体的危害和影响. 以期对其特殊节点进行检测干预, 为诊断治疗提供新思路.
引文著录: 孙宝房, 陈强谱. 腹部外科围手术期过度炎症反应机制及对机体的影响. 世界华人消化杂志 2017; 25(2): 178-184
Revised: November 7, 2016
Accepted: November 14, 2016
Published online: January 18, 2017
Inflammation is an important pathophysiological change in the perioperative period of abdominal surgery. Moderate inflammatory plays a positive role in wound healing, but excessive inflammation is harmful to the body and is a major cause of postoperative complications and the common pathway of multiple organ dysfunction syndrome. Therefore, intervention of excessive inflammation response in the perioperative period can reduce the morbidity and mortality of patients. However, the current understanding of the pathophysiological process of excessive inflammatory response during the perioperative period is still in the primary stage. This article systematically reviews the induced factors, mechanism and pathophysiological changes of excessive inflammatory response during the perioperative period of abdominal surgery as well as its harm to and influence on the body.
- Citation: Sun BF, Chen QP. Mechanism and effect of excessive inflammatory response in perioperative period of abdominal surgery. Shijie Huaren Xiaohua Zazhi 2017; 25(2): 178-184
- URL: https://www.wjgnet.com/1009-3079/full/v25/i2/178.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i2.178
炎症是具有血管系统的活体组织对损伤因子所发生的防御反应. 炎症对机体的损伤的局部组织所呈现的反应称为炎症反应. 在局部炎症过程中, 一方面损伤因子直接或间接造成组织和细胞的破坏, 另一方面通过炎症充血和渗出反应, 以稀释、杀伤和包围损伤因子. 同时通过实质和间质细胞的再生使受损的组织得以修复和愈合[1]. 如果炎症失控、炎症介质泛滥, 炎症介质溢到血浆并在远隔部位引起全身性炎症. 尽管手术技术和围手术期护理改善, 术后并发症减少, 但炎症发病率仍较高, 特别是经历复杂腹部手术的患者[2]. 因此, 了解腹部外科围手术期炎症发生机制及对机体的影响, 在炎症特殊阶段检测标志物并给予治疗, 可改善预后. 因此, 本文对腹部外科围手术期过度炎症反应机制及对机体的影响最新进展作一综述.
术前焦虑、营养不良、饥饿等, 术中手术创伤、麻醉、输血、低体温等, 术后疼痛、缺血、感染、胃肠功能障碍等因素[3-5]可通过不同途径激活中性粒细胞和单核细胞, 释放肿瘤坏死因子(tumor necrosis factor, TNF)-α、白介素(interleukin, IL)-1等促炎介质, 引起局部炎症反应, 参与机体防御反应[6]. 如果大量炎症细胞活化, 活化的炎症细胞突破了炎症细胞产生炎症介质的自限性作用, 通过自我持续放大的级联反应, 使炎症反应不断扩大, 当超出机体代偿能力时, 机体出现过度炎症反应[5]. 最近Kehlet等[7]荟萃分析证实, 焦虑、疼痛、组织损伤、肠梗阻、低体温、睡眠障碍及术前并存病增加手术应激反应强度, 促使炎症因子级联反应, 出现过度炎症反应.
大手术创伤为引起过度炎症反应的主要诱发因素[8]. 组织创伤和失血引起局部炎症反应, 损伤血管内皮, 造成微循环障碍, 从而引起相关的术后并发症, 加重全身炎症反应. 目前认为影响手术创伤程度的因素主要为: 手术类型、持续时间、麻醉、病人的年龄、性别、既往健康状况、药物作用、液体治疗、术后疼痛等[9,10]. 其中, 年龄是一个特别的因素, 老年人大多数存在并存病, 应对手术应激反应的储备能力下降[11]. Cecconi等[12]荟萃分析证实, 老年手术病人更易受到手术应激影响, 故更易出现过度炎症反应.
2.1.1 炎症细胞活化: 炎症启动的特征是炎症细胞激活. 在损伤部位, 固有和非固有免疫细胞为刺激信号的"第一反应者". 固有免疫细胞, 如巨噬细胞、肥大细胞、树突状细胞、成纤维细胞、淋巴细胞, 和非固有免疫细胞, 如中性粒细胞、淋巴细胞. 它们活化后产生多种细胞因子、趋化因子、蛋白酶、白三烯、NO等[9,13]. 炎症细胞除了免疫细胞外, 还包括参与炎症反应的内皮细胞、血小板等. 内皮细胞活化后促使凝血系统激活、化学介质释放、血管渗透、白细胞黏附和募集. 活化的血小板产生生长因子, 例如: 转化生长因子-β、血小板衍生生长因子等, 并作为白细胞趋化因子[14].
2.1.2 免疫系统的激活: 在大手术创伤的前30 min, 主要有由失血和组织创伤引起局部炎症反应. 组织损伤启动损伤相关分子模式或警报素[15]. 它们由激活的免疫细胞分泌或坏死组织释放. 损伤相关分子模式直接激活一些免疫细胞, 包括中性粒细胞和单核细胞, 作用于细胞表面损伤相关分子受体. 损伤相关分子模式还是补体的有效激活剂, 导致C3a、C5a等的快速产生. 补体和炎症细胞导致炎症因子的产生和释放[6,16].
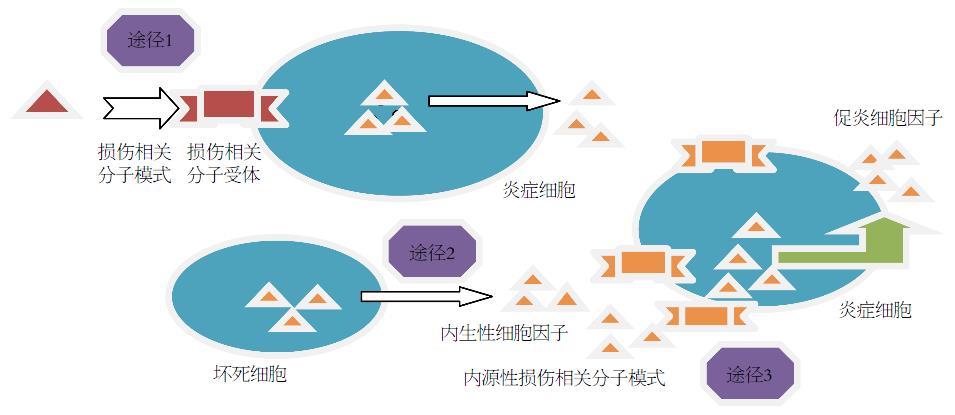
目前认为[14], 组织损伤等无菌性刺激诱导的损伤相关分子模式和细胞因子激活机体免疫系统, 诱导炎症反应至少包含3个相互不排斥的途径: (1)损伤相关分子模式激活相关分子受体, 例如Toll样受体、核苷酸聚化结构域样受体3. 这些受体激活导致细胞因子和趋化因子的上调, 例如IL-1β等. 这些细胞因子的释放来激活额外的炎症细胞; (2)损伤或坏死的细胞释放内生性细胞因子(如IL-1α、IL-33), 来激活信号途径下游的损伤相关分子受体[17]; (3)内源性损伤相关分子模式直接通过机体受体途径(图1).
一些最新观点[18,19]认为, 在重要脏器存在"炎症警报细胞". "炎症警报细胞"为器官和脉管系统内通过炎症受体和细胞内信号系统产生炎性介质的一类细胞. 例如重要脏器的一些上皮细胞、血管内皮细胞等. 它们可识别受损组织中的配体, 如损伤相关分子模式或警报素, 产生趋化因子和炎症因子, 进而可引起全身炎症反应, 易导致多器官功能障碍综合征[18,20]. 另外, 通过内源性报警信号相关的免疫训练, 可以维持损伤相关分子模式诱导的免疫反应[21].
2.1.3 炎症介质播散: 器官损伤和感染导致相关分子模式进一步释放, 进而形成循环, 导致持续炎症反应和免疫激活[6]. 炎症细胞激活后能产生多种促炎细胞因子, 它们又可导致炎症细胞活化, 两者互为因果, 形成炎症瀑布. 如果炎症失控, 炎症介质泛滥到血浆并在远隔部位引起全身性炎症.
2.2.1 促炎介质的泛滥: 腹部外科手术创伤引起炎症细胞如巨噬细胞、单核细胞、成纤维细胞和内皮细胞活化, 释放炎症介质, 包括细胞因子、补体裂解产物及氧自由基等. 炎症是一种对手术的适应性反应, 当炎症反应不受管制时导致过度反应[22]. 过度炎症反应时, 活化的炎症细胞突破了炎症细胞产生炎症介质的自限性作用, 产生自我持续放大的级联反应[23]. 促使大量促炎介质释放, 如TNF-α、IL-1、IL-2、IL-6、IL-8、干扰素(Interferon, IFN)、白三烯、血小板活化因子、活性氧、溶酶体酶、组织因子、血栓素A2、血浆源介质等[9]. 进而溢到血浆, 引起全身性炎症反应.
2.2.2 促炎、抗炎介质失衡: 近年来, 提出了持续性炎症、免疫抑制、分解代谢综合征, 为一种促炎-抗炎反应失衡的状态, 特别是在腹部外科[24]. 炎症细胞既能产生促炎介质, 也能产生抗炎介质. 主要的抗炎介质有: IL-4、IL-10、IL-13、前列腺素E2、前列环素、脂氧素、NO、膜联蛋白-1、可溶性TNF-α受体、内源性IL-1受体拮抗剂等. 机体内的抗炎介质与促炎介质在不同的环节上相互作用、相互拮抗, 形成复杂的炎症调控网络[25]. 生理状态下, 促炎反应与抗炎反应处于平衡状态. 应激状态下促炎细胞因子被激活, 促炎细胞因子进而可激活中性粒细胞、巨噬细胞等, 引起促炎因子二次释放, 促炎反应占主导地位, 引起全身炎症反应综合征, 最终导致多器官功能衰竭[10]. 在手术后早期阶段, IL-6在抗炎作用中起主要作用. 减弱TNF-α、IL-1作用, 促进IL-Rα和可溶性TNF受体产生; 通过结合于促炎细胞因子TNF-α、IL-1β, 起到减弱炎症反应作用; 诱导巨噬细胞释放前列腺素E2, 前列腺素E2阻止T细胞分裂、IL-2产生及IL-2受体表达; 通过细胞内环磷激活酸腺苷, 前列腺素E2抑制巨噬细胞TNF-α、IL-1β合成, 来减弱炎症反应. 前列腺素E2也可刺激潜在抗炎细胞因子IL-10释放. 这些抗炎反应导致细胞因子失衡, 这就是抗炎反应综合征. 这一综合征的特点是: 促炎细胞因子TNF-α、IL-1β、IL-12和TNF-γ水平降低, 抗炎细胞因子IL-6、IL-10、IL-1Rα水平升高[8]. 抗炎介质占优势时, 导致免疫抑制, 增加对感染的易感性[26]. 当抗炎介质与促炎介质同时并存又相互加强, 则会导致炎症反应和免疫功能更为严重的紊乱[27,28].
腹部外科围手术期炎症反应损伤血管内皮细胞, 产生炎症因子和凝血因子, 导致微循环障碍. 同时, 促炎因子释放增加血管渗漏、氮氧化合物产生及黏附分子相互作用, 导致多核白细胞相互黏附, 从而加重微循环障碍, 改变微循环环境, 引起组织器官功能障碍[9,34]. 这一病理过程如果得不到有效调控, 最终可能导致多器官功能障碍综合征的发生[35].
脓毒血症及脓毒血症性休克是腹部外科大手术后严重的并发症. 手术创伤及术后感染等致IL-1、IL-6、IFN-γ等大量炎症因子、前列腺素、血小板活化因子等炎症调节介质释放, 同时引起单核细胞、中性粒细胞、自然杀伤细胞等功能抑制, 进一步发展导致脓毒血症及脓毒血症性休克[36,37]. 常表现为: 寒战、高热、白细胞增加, 重者可有神志改变、心肌炎、弥散性血管内凝血、呼吸窘迫综合征等[38]. 如果不能得到有效调控, 将进一步发展为多器官功能障碍综合征[39].
目前认为, 促炎细胞因子引起肝Kupffer细胞和中性粒细胞活化. Kupffer细胞活化后分泌IL-8、组织因子等, 引起中性粒细胞黏附和微血栓形成, 导致微循环障碍. 同时分泌TNF-α, 产生氮氧化合物, 释放氧自由基等, 直接损伤紧邻的肝细胞. 中性粒细胞活化后释放活性氧, 诱导中性粒细胞到达肝血管床, 导致肝细胞损伤. 促炎细胞因子还可作为趋化信号促使白细胞外渗, 并攻击肝细胞. 白细胞黏附分子诱导白细胞脱颗粒, 致蛋白酶和活性氧形成, 这些进入肝组织, 引起肝细胞内氧化应激反应和线粒体功能障碍, 最终导致肝细胞坏死[40]. 另外, 坏死的细胞可释放介质, 如: HMGB-1, 从而进一步引起中性粒细胞活化和组织损伤, 最终可引起肝功能障碍[34]. Rahbari等[41]研究证明, 肝切除术可直接造成肝脏的损伤, 术后肝脏组织减少, 过度炎症反应可促使肝功能障碍的发生.
细胞因子、黏附分子、趋化因子可促使肺小血管内中性粒细胞聚集、黏附, 内皮细胞受损, 肺毛细血管内可有微血栓形成. 同时, TNF-α、IL-1β激活微血管内皮细胞, 导致内皮细胞E选择素、P选择素、ICAM-1表达和白细胞聚集, 致呼吸膜损伤. 激活的白细胞可释放活性氧、蛋白水解酶和细胞因子, 进一步损伤内皮细胞, 使毛细血管通透性增加, 进一步损伤肺泡上皮, 肺泡上皮的屏障功能降低, 肺顺应性降低, 引起肺泡水肿, 诱导呼吸功能障碍[34]. 最近研究[42]发现, TNF-α通过激活TNF受体P55介导的细胞凋亡蛋白酶-8死亡信号引起肺水肿, 进而引起肺功能障碍.
手术创伤可引起肾血流量减少及肾小管功能障碍, 过度炎症反应进一步加重了肾脏损害. Golden等[43]认为, 炎症反应释放的炎症因子和氧自由基直接造成血管内皮损伤, 造成微循环障碍, 导致围手术期肾损伤, 致急性肾功能障碍. 其中, TNF-α降低肾小球滤过率, 导致肾小球上皮损伤[44]. IL-1β诱导中性粒细胞聚集, 致肾小球微血栓形成, 致微循环障碍, 加重肾损伤[45].
Paniagua Iglesias等[46]发现, 手术应激和组织损伤引起机体过度炎症和高凝状态, 可致冠脉血栓形成, 引起急性冠脉综合征. 在炎症过程中, 细胞因子的过度释放可致心血管功能障碍, 如动脉粥样硬化、动脉瘤和高血压的发生[34]. 氮氧化合物和超氧离子相互作用, 形成氧自由基, 进而促进心肌细胞损伤、维持炎症状态、诱导特殊的凋亡途径, 最终削弱心肌功能.
Briasoulis等[47]认为, 慢性的炎症过程可致心肌细胞的逆行重构、心肌外基质病理性肥大、心肌壁变薄等, 最终可导致心力衰竭. 其中, 促炎细胞因子TNF-α、IL-8与抗炎细胞因子IL-10失衡, 可促使左心室重构, 致左心衰竭的发生[48].
Hu等[49]认为, 炎症反应可通过多种分子机制激活小胶质细胞, 小胶质细胞可以分泌大量可溶性炎症分子, 包括细胞因子、类花生四希酸、补体、兴奋性氨基酸、氧自由基及氮氧化合物等. 这些可溶性炎症因子可通过影响神经物质的产生和作用、神经可塑性及神经毒性引起认知能力下降. 而Krenk等[50]认为, 手术引起促炎因子表达, 导致机体急性期反应, 这些反应包括行为、生理、心理方面的改变, 从而增加疲劳、减少睡眠、减少饮食摄入、减少社会接触和活动、发热、痛觉过敏. 这些间接引起认知功能障碍.
最近研究[51]发现, 在手术应激状态下, 小胶质细胞和其他大脑免疫细胞它们的形态学和功能状态发生改变, 分泌大量促炎细胞因子和前列腺素. 这些炎症调节介质破坏了神经生理与免疫反应之间的平衡, 对记忆、神经塑变性和神经发生产生毒性作用. 同时减少神经营养因子和塑变相关因子的产生, 导致认知功能障碍和其他神经精神疾病的发生.
腹部外科围手术期过度炎症反应是由围手术期各种诱发因素引起的, 以炎细胞活化、细胞因子及炎性介质异常表达、促炎-抗炎网络体系失衡为基础, 导致各器官功能障碍的一系列病理生理学过程. 虽然对其发病机制及对机体的影响做了大量的研究, 但其确切机制及特殊阶段的干预仍需进一步探讨. 因此, 对腹部外科围手术期过度炎症反应及导致各器官功能障碍过程的特殊节点进行检测干预, 为诊断治疗提供新思路, 是下一步研究的重点.
尽管手术技术和围手术期护理改善, 术后并发症减少, 但经历复杂腹部手术的患者, 术后炎症并发症发病率仍较高. 因此, 本文对腹部外科围手术期过度炎症反应机制及对机体的影响最新进展作一综述, 希望对改善预后提供帮助.
在腹部外科围手术期中, 适度炎症反应对创伤愈合起到积极作用, 但过度炎症反应对机体有害. 对围手术期过度炎症反应的确切机制及对"度"特殊节点检测标志物并给予干预, 尚需进一步的研究.
近年来, 人们曾试图人工合成一些炎症介质的拮抗药来治疗围手术期过度炎症反应. 然而, 机体内的抗炎介质与促炎介质在不同的环节上相互作用、相互拮抗, 形成复杂的炎症调控网络. 当抗炎介质与促炎介质同时并存又相互加强, 则会导致炎症反应和免疫功能更为严重的紊乱.
本文对腹部外科围手术期过度炎症反应的诱发因素、发生机制、病理生理变化及对机体的危害和影响进行了系统介绍. 而且对无菌性刺激诱导过度炎症反应机制进行了详细图文阐述, 希望对读者有所启发.
目前, 对围手术期过度炎症反应的病理生理过程的认识尚处于初级阶段. 本文对腹部外科围手术期度炎症反应的诱发因素、发生机制、对机体的影响最新进展进行了综述, 为临床诊断治疗提供了新思路, 对防止术后并发症, 提高患者生存率有一定的意义.
炎症警报细胞: 为器官和脉管系统内通过炎症受体和细胞内信号系统产生炎性介质的一类细胞. 例如重要脏器的一些上皮细胞、血管内皮细胞等. 他们可识别受损组织中的配体, 如损伤相关分子模式或警报素, 产生趋化因子和炎症因子, 进而可引起全身炎症反应.
钦丹萍, 教授, 浙江中医药大学附属第一医院消化内科; 王小众, 教授, 福建医科大学附属协和医院消化内科; 禹正杨, 副教授, 南华大学附属第一医院; 张雅丽, 主任医师, 黑龙江省中医药科学院
本文对腹部外科围手术期过度炎症反应的诱发因素、发生机制、病理生理变化及对机体的危害和影响进行系统介绍, 综述的文献较新, 综述的内容结构合理, 表达清晰, 对临床与科研开展相关工作具有一定的参考价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 山东省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): D
E级 (差): 0
编辑: 马亚娟 电编:胡珊
| 1. | Cervantes-Villagrana RD, Cervantes-Villagrana AR, Presno-Bernal JM. Signaling mechanisms involved in resolution of inflammation. Gac Med Mex. 2014;150:440-449. [PubMed] |
| 2. | Lahiri R, Derwa Y, Bashir Z, Giles E, Torrance HD, Owen HC, O'Dwyer MJ, O'Brien A, Stagg AJ, Bhattacharya S. Systemic Inflammatory Response Syndrome After Major Abdominal Surgery Predicted by Early Upregulation of TLR4 and TLR5. Ann Surg. 2016;263:1028-1037. [PubMed] [DOI] |
| 3. | Carli F. Physiologic considerations of Enhanced Recovery After Surgery (ERAS) programs: implications of the stress response. Can J Anaesth. 2015;62:110-119. [PubMed] [DOI] |
| 4. | Drapalova J, Kopecky P, Bartlova M, Lacinova Z, Novak D, Maruna P, Lips M, Mraz M, Lindner J, Haluzik M. The influence of deep hypothermia on inflammatory status, tissue hypoxia and endocrine function of adipose tissue during cardiac surgery. Cryobiology. 2014;68:269-275. [PubMed] [DOI] |
| 6. | Lord JM, Midwinter MJ, Chen YF, Belli A, Brohi K, Kovacs EJ, Koenderman L, Kubes P, Lilford RJ. The systemic immune response to trauma: an overview of pathophysiology and treatment. Lancet. 2014;384:1455-1465. [PubMed] [DOI] |
| 7. | Kehlet H, Wilmore DW. Evidence-based surgical care and the evolution of fast-track surgery. Ann Surg. 2008;248:189-198. [PubMed] [DOI] |
| 8. | Ni Choileain N, Redmond HP. Cell response to surgery. Arch Surg. 2006;141:1132-1140. [PubMed] [DOI] |
| 9. | Dobson GP. Addressing the Global Burden of Trauma in Major Surgery. Front Surg. 2015;2:43. [PubMed] [DOI] |
| 10. | Alazawi W, Pirmadjid N, Lahiri R, Bhattacharya S. Inflammatory and Immune Responses to Surgery and Their Clinical Impact. Ann Surg. 2016;264:73-80. [PubMed] [DOI] |
| 11. | Al-Refaie WB, Parsons HM, Habermann EB, Kwaan M, Spencer MP, Henderson WG, Rothenberger DA. Operative outcomes beyond 30-day mortality: colorectal cancer surgery in oldest old. Ann Surg. 2011;253:947-952. [PubMed] [DOI] |
| 12. | Cecconi M, Corredor C, Arulkumaran N, Abuella G, Ball J, Grounds RM, Hamilton M, Rhodes A. Clinical review: Goal-directed therapy-what is the evidence in surgical patients? The effect on different risk groups. Crit Care. 2013;17:209. [PubMed] [DOI] |
| 13. | O'Dwyer MJ, Owen HC, Torrance HD. The perioperative immune response. Curr Opin Crit Care. 2015;21:336-342. [PubMed] [DOI] |
| 14. | Chen GY, Nuñez G. Sterile inflammation: sensing and reacting to damage. Nat Rev Immunol. 2010;10:826-837. [PubMed] [DOI] |
| 15. | Pálmai-Pallag T, Bachrati CZ. Inflammation-induced DNA damage and damage-induced inflammation: a vicious cycle. Microbes Infect. 2014;16:822-832. [PubMed] [DOI] |
| 16. | Pugin J. How tissue injury alarms the immune system and causes a systemic inflammatory response syndrome. Ann Intensive Care. 2012;2:27. [PubMed] [DOI] |
| 17. | Hirsiger S, Simmen HP, Werner CM, Wanner GA, Rittirsch D. Danger signals activating the immune response after trauma. Mediators Inflamm. 2012;2012:189-194. [PubMed] [DOI] |
| 18. | Hatakeyama N, Matsuda N. Alert cell strategy: mechanisms of inflammatory response and organ protection. Curr Pharm Des. 2014;20:5766-5778. [PubMed] [DOI] |
| 19. | Matsuda N. Alert cell strategy in SIRS-induced vasculitis: sepsis and endothelial cells. J Intensive Care. 2016;4:21. [PubMed] [DOI] |
| 20. | Manson J, Thiemermann C, Brohi K. Trauma alarmins as activators of damage-induced inflammation. Br J Surg. 2012;99 Suppl 1:12-20. [PubMed] [DOI] |
| 21. | Crișan TO, Netea MG, Joosten LA. Innate immune memory: Implications for host responses to damage-associated molecular patterns. Eur J Immunol. 2016;46:817-828. [PubMed] [DOI] |
| 22. | Koo EG, Lai LM, Choi GY, Chan MT. Systemic inflammation in the elderly. Best Pract Res Clin Anaesthesiol. 2011;25:413-425. [PubMed] [DOI] |
| 23. | Mokart D, Giaoui E, Barbier L, Lambert J, Sannini A, Chow-Chine L, Brun JP, Faucher M, Guiramand J, Ewald J. Postoperative sepsis in cancer patients undergoing major elective digestive surgery is associated with increased long-term mortality. J Crit Care. 2016;31:48-53. [PubMed] [DOI] |
| 24. | Gentile LF, Cuenca AG, Efron PA, Ang D, Bihorac A, McKinley BA, Moldawer LL, Moore FA. Persistent inflammation and immunosuppression: a common syndrome and new horizon for surgical intensive care. J Trauma Acute Care Surg. 2012;72:1491-1501. [PubMed] [DOI] |
| 25. | Binkowska AM, Michalak G, Słotwiński R. Current views on the mechanisms of immune responses to trauma and infection. Cent Eur J Immunol. 2015;40:206-216. [PubMed] [DOI] |
| 26. | Islam MN, Bradley BA, Ceredig R. Sterile post-traumatic immunosuppression. Clin Transl Immunology. 2016;5:e77. [PubMed] [DOI] |
| 27. | Ding R, Ma X. Persistent inflammation immunosuppression catabolism syndrome: a special type of chronic critical illness. Zhonghua Weichang Waike Zazhi. 2016;19:734-736. [PubMed] |
| 28. | Kimura F, Shimizu H, Yoshidome H, Ohtsuka M, Miyazaki M. Immunosuppression following surgical and traumatic injury. Surg Today. 2010;40:793-808. [PubMed] [DOI] |
| 29. | Braga M. Perioperative immunonutrition and gut function. Curr Opin Clin Nutr Metab Care. 2012;15:485-488. [PubMed] [DOI] |
| 30. | Braga M, Wischmeyer PE, Drover J, Heyland DK. Clinical evidence for pharmaconutrition in major elective surgery. JPEN J Parenter Enteral Nutr. 2013;37:66S-72S. [PubMed] [DOI] |
| 31. | Becher RD, Hoth JJ, Miller PR, Mowery NT, Chang MC, Meredith JW. A critical assessment of outcomes in emergency versus nonemergency general surgery using the American College of Surgeons National Surgical Quality Improvement Program database. Am Surg. 2011;77:951-959. [PubMed] |
| 32. | Becher RD, Hoth JJ, Miller PR, Meredith JW, Chang MC. Systemic inflammation worsens outcomes in emergency surgical patients. J Trauma Acute Care Surg. 2012;72:1140-1149. [PubMed] [DOI] |
| 33. | Lawson EH, Wang X, Cohen ME, Hall BL, Tanzman H, Ko CY. Morbidity and mortality after colorectal procedures: comparison of data from the American College of Surgeons case log system and the ACS NSQIP. J Am Coll Surg. 2011;212:1077-1085. [PubMed] [DOI] |
| 34. | Hsing CH, Wang JJ. Clinical implication of perioperative inflammatory cytokine alteration. Acta Anaesthesiol Taiwan. 2015;53:23-28. [PubMed] [DOI] |
| 35. | Fry DE. Sepsis, systemic inflammatory response, and multiple organ dysfunction: the mystery continues. Am Surg. 2012;78:1-8. [PubMed] |
| 36. | Fried E, Weissman C, Sprung C. Postoperative sepsis. Curr Opin Crit Care. 2011;17:396-401. [PubMed] [DOI] |
| 37. | Emami-Razavi SH, Mohammadi A, Alibakhshi A, Jalali M, Ghajarzadeh M. Incidence of Post-Operative Sepsis and Role of Charlson Co-Morbidity Score for Predicting Postoperative Sepsis. Acta Med Iran. 2016;54:318-322. [PubMed] |
| 39. | Rossaint J, Zarbock A. Pathogenesis of Multiple Organ Failure in Sepsis. Crit Rev Immunol. 2015;35:277-291. [PubMed] [DOI] |
| 40. | Jaeschke H. Mechanisms of Liver Injury. II. Mechanisms of neutrophil-induced liver cell injury during hepatic ischemia-reperfusion and other acute inflammatory conditions. Am J Physiol Gastrointest Liver Physiol. 2006;290:G1083-G1088. [PubMed] [DOI] |
| 41. | Rahbari NN, Garden OJ, Padbury R, Brooke-Smith M, Crawford M, Adam R, Koch M, Makuuchi M, Dematteo RP, Christophi C. Posthepatectomy liver failure: a definition and grading by the International Study Group of Liver Surgery (ISGLS). Surgery. 2011;149:713-724. [PubMed] [DOI] |
| 42. | Patel BV, Wilson MR, O'Dea KP, Takata M. TNF-induced death signaling triggers alveolar epithelial dysfunction in acute lung injury. J Immunol. 2013;190:4274-4282. [PubMed] [DOI] |
| 43. | Golden D, Corbett J, Forni LG. Peri-operative renal dysfunction: prevention and management. Anaesthesia. 2016;71 Suppl 1:51-57. [PubMed] [DOI] |
| 44. | Xu C, Chang A, Hack BK, Eadon MT, Alper SL, Cunningham PN. TNF-mediated damage to glomerular endothelium is an important determinant of acute kidney injury in sepsis. Kidney Int. 2014;85:72-81. [PubMed] [DOI] |
| 45. | Berry M, Clatworthy MR. Immunotherapy for acute kidney injury. Immunotherapy. 2012;4:323-334. [PubMed] [DOI] |
| 46. | Paniagua Iglesias P, Díaz Ruano S, Álvarez-García J. Myocardial injury after noncardiac surgery. Rev Esp Cardiol (Engl Ed). 2014;67:794-796. [PubMed] [DOI] |
| 47. | Briasoulis A, Androulakis E, Christophides T, Tousoulis D. The role of inflammation and cell death in the pathogenesis, progression and treatment of heart failure. Heart Fail Rev. 2016;21:169-176. [PubMed] [DOI] |
| 48. | Zarrouk-Mahjoub S, Zaghdoudi M, Amira Z, Chebi H, Khabouchi N, Finsterer J, Mechmeche R, Ghazouani E. Pro- and anti-inflammatory cytokines in post-infarction left ventricular remodeling. Int J Cardiol. 2016;221:632-636. [PubMed] [DOI] |
| 49. | Hu Z, Ou Y, Duan K, Jiang X. Inflammation: a bridge between postoperative cognitive dysfunction and Alzheimer's disease. Med Hypotheses. 2010;74:722-724. [PubMed] [DOI] |
| 50. | Krenk L, Rasmussen LS, Kehlet H. New insights into the pathophysiology of postoperative cognitive dysfunction. Acta Anaesthesiol Scand. 2010;54:951-956. [PubMed] [DOI] |
| 51. | Yirmiya R, Goshen I. Immune modulation of learning, memory, neural plasticity and neurogenesis. Brain Behav Immun. 2011;25:181-213. [PubMed] [DOI] |