修回日期: 2016-11-04
接受日期: 2016-11-30
在线出版日期: 2017-01-18
系统评价趋化因子受体7(chemokine factor receptor 7, CXCR7)在胃癌组织中的表达及其临床意义.
检索PubMed、EMBASE、Web of Science、CNKI、CBM、维普和万方数据库关于CXCR7在胃癌中表达的病例对照研究. 结果用RevMan5.3对比值比(odds ratio, OR)及95%置信区间(confidence interval, CI)进行统计分析.
共纳入4个病例对照研究, 共425个病例, 胃癌组320例, 正常对照组105例. Meta分析结果显示: CXCR7在胃癌组织中呈高表达(OR = 46.35, 95%CI: 19.99-107.43). 并且CXCR7的表达与胃癌组织的浸润深度(OR = 0.17, 95%CI: 0.05-0.58)、淋巴结转移(OR = 0.23, 95%CI: 0.12-0.44)、临床分期(OR = 0.29, 95%CI: 0.16-0.54)有关. 至于CXCR7是否影响胃癌组织的分化, 目前尚不能确定, 需要更多的研究来明确、证实.
胃癌组织中CXCR7的表达高于正常组织. CXCR7在胃癌组织中的表达与胃癌的浸润深度、淋巴结转移和临床分期有关, 说明CXCR7在胃癌的发展、转移中发挥作用.
核心提要: 胃癌组织中趋化因子受体7(chemokine factor receptor 7, CXCR7)的表达高于正常组织. CXCR7在胃癌组织中的表达与胃癌的浸润深度、淋巴结转移和临床分期有关, 说明CXCR7在胃癌的发展、转移中发挥作用.
引文著录: 杨婧, 黄显斌, 郝相勇, 魏丽, 景武堂, 郭天康. 趋化因子受体7在胃癌组织中的表达及其临床意义的Meta分析. 世界华人消化杂志 2017; 25(2): 139-146
Revised: November 4, 2016
Accepted: November 30, 2016
Published online: January 18, 2017
To investigate the expression of chemokine factor receptor 7 (CXCR7) in gastric cancer and evaluate its clinical significance.
PubMed, EMBASE, Web of Science, CNKI, CBM, VIP, and Wanfang were searched for case-control studies on the significance of expression of CXCR7 in gastric cancer. Meta-analysis was conducted using RevManv.5.3 software to yield odds ratio (OR) and 95% confidence interval (95%CI).
A total of four case-control studies involving 320 gastric cancer tissues and 105 normal gastric tissues were included. The results of meta-analyses showed that the positive rate of CXCR7 expression was higher in gastric cancer tissues than in normal gastric tissues (OR = 46.35, 95%CI: 19.99-107.43), and CXCR7 expression in gastric cancer tissues was significantly associated with deep invasion (OR = 0.17, 95%CI: 0.05-0.58), lymph node metastasis (OR = 0.23, 95%CI: 0.12-0.44), and advanced clinical stage (OR = 0.29, 95%CI: 0.16-0.54). However, no significant correlation was found between CXCR7 expression and the degree of differentiation in gastric cancer.
The expression of CXCR7 in gastric cancer is higher than that in normal tissue. CXCR7 expression is associated with depth of invasion, lymph node metastasis and clinical stage, indicating that CXCR7 may play a role in gastric cancer metastasis.
- Citation: Yang J, Huang XB, Hao XY, Wei L, Jing WT, Guo TK. Clinical significance of expression of chemokine factor receptor 7 in gastric cancer: A meta-analysis. Shijie Huaren Xiaohua Zazhi 2017; 25(2): 139-146
- URL: https://www.wjgnet.com/1009-3079/full/v25/i2/139.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i2.139
胃癌是我国发病率和死亡率均居前列的恶性肿瘤, 胃癌患者的死亡原因其中之一就是肿瘤已经淋巴结转移或者侵犯周围脏器导致不能手术切除而使治疗失败. 因此, 更进一步研究胃癌的发生、浸润、淋巴结转移的分子生物学机制, 寻找靶向治疗药物, 从而在分子层面阻断胃癌的发生发展具有重要的意义. 近年来, CXC趋化因子家族的受体之一趋化因子受体7(chemokine factor receptor 7, CXCR7)在胃癌的发生、发展中的作用受到广泛的关注. 一些研究[1,2]表明CXCR7与胃癌的生长部位、肿瘤大小、肿瘤的组织学类型、临床分期无明显关系. 而另外一些研究[3]则认为CXCR7与胃癌的分化程度无关. 因此, 本研究全面收集国内外关于CXCR7在胃癌中的表达及意义的相关文献, 采用Meta分析的方法, 旨在对CXCR7在胃癌的发生发展中的关系进行分析, 以期对胃癌的治疗和干预提供依据.
计算机检索PubMed、EMBASE、Web of Science、CNKI、CBM、维普和万方数据库. 检索词包括: 中文(胃、胃癌、胃恶性肿瘤、趋化因子受体7、CXC类趋化因子受体7)、英文(Stomach Neoplasms、Gastric Cancer、Stomach Cancer、Gastric carcinoma、Stomach carcinoma、Chemokine factor receptor 7、CXCR7、CXC chemokine receptor 7). 检索方式采用主题词与自由词相结合, 检索时间为各数据库建库至2015-12, 检索语言无限制. 并采用参考文献追溯和手工检索补充, 以免遗漏部分文献.
1.2.1 纳入和排除标准: (1)评价CXCR7的表达与胃癌及其临床特征的相关性的病例对照研究; (2)所有病例均有完整的临床病理资料, 纳入的病例术前均未行放化疗及生物治疗, 术后病理证实为胃癌; (3)胃癌组取材部位为胃癌组织, 对照组取材部位为正常胃组织或未受癌细胞侵犯的癌旁组织; (4)CXCR7的检测为免疫组织化学法, 结果统计采用细胞得数或阳性强度划分法. 有以下情况者给予排除: (1)未设置对照组, 或者对照组的取材不符合纳入标准; (2)CXCR7的检测手段为非免疫组织化学方法, 或者结果判定标准不一致; (3)重复发表的文献.
1.2.2 文献筛选与资料提取: 文献筛选由2个研究者(杨婧、黄显斌)独立进行, 当出现争议时共同商量或由第三人裁定. 通过阅读摘要及全文是否符合纳入标准决定是否采用. 资料提取包括文题、作者、发表年份、纳入病例的一般情况、肿瘤直径、组织学类型、肿瘤分化程度、浸润深度、淋巴结转移情况和临床分期等.
1.2.3 文献质量评价: 文献质量评价参照Newcastle-Ottawa Scale文献质量评价量表[4]中关于病例对照研究的质量评价. (1)病例的定义是否充分; (2)病例的代表性; (3)对照的选择; (4)对照的定义; (5)基于设计或分析所得的病例与对照的可比性; (6)暴露的确定; (7)病例和对照的暴露是否采用相同的确定方法; (8)2组的无应答率. 以上8项每项1分, 评分≥6分为高质量文献.
统计学处理 本研究采用RevMan5.3[5]进行Meta分析. 各研究间的异质性通过I2统计量来检验[6]. I2<50%说明同质性好, 各研究之间的异质性小, 采用固定效应模型; I2≥50%说明各研究间的异质性大, 对异质性的来源进行分析说明并采用亚组分析, 若仍不能找到异质性来源, 则采用随机效应模型或者不进行合并, 仅对数据进行描述性说明. 采用比值比(odds ratio, OR)及95%置信区间(confidence interval, CI)来评价CXCR7与胃癌相关性的各项结果合并量的统计指标.
纳入的4个研究[1-3,7]共425个病例, 胃癌组320例, 正常对照组105例. 其中4个研究[1-3,7]均报告了胃癌组织中CXCR7的表达情况; 3个研究[1,3,7]报告了肿瘤的分化程度、浸润深度、淋巴结转移情况、临床分期等与CXCR7表达之间的关系的情况; 2个研究[1,3]报告了肿瘤大小、组织学类型等与CXCR7表达之间的关系的情况; 1个研究[1]报告了胃癌远处转移时CXCR7的表达情况. 各研究的基本特征及治疗评价结果如表1.
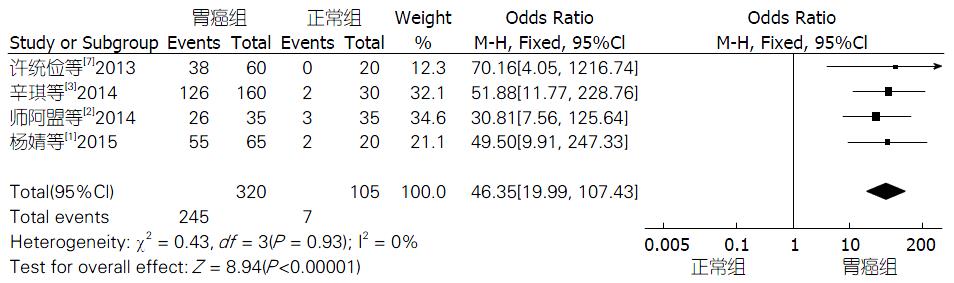
2.3.1 胃癌与正常组织中CXCR7的表达情况: 纳入的4个研究[1-3,7]均报道了胃癌与正常组织CXCR7的表达情况. 各研究之间没有显著的异质性(I2 = 0, P = 0.93). 采用固定效应模型. 从结果可以看出, 胃癌组织比正常组织中CXCR7的表达显著升高(OR = 46.35, 95%CI: 19.99-107.43, P<0.00001, 图2).
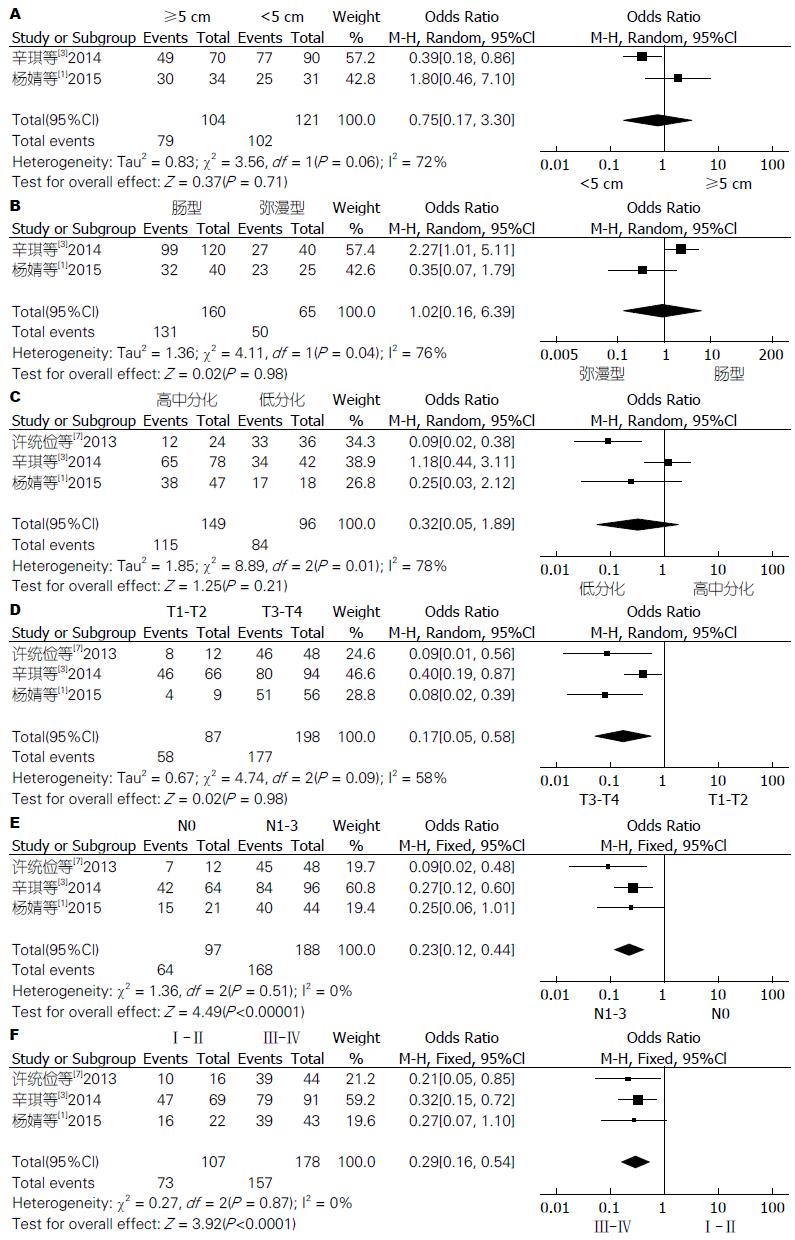
2.3.2 CXCR7在不同大小的肿瘤组织中的表达情况: 纳入的2个研究[1,3]报道了不同大小的肿瘤组织中CXCR7的表达情况. 各研究间存在异质性(I2 = 72%, P = 0.06), 采用随机效应模型进行统计量合并. 结果为(OR = 0.75, 95%CI: 0.17-3.30, P = 0.71), 在不同大小的肿瘤组织中CXCR7的表达无明显差异(图3A). 因纳入的研究较少, 无法进行敏感性分析. 因此, 此结果的可信度较低.
2.3.3 CXCR7在不同组织学类型的胃癌组织中的表达情况: 纳入的2个研究[1,3]报道了不同组织学类型的胃癌组织中CXCR7的表达情况. 各研究间存在异质性(I2 = 76%, P = 0.04), 采用随机效应模型进行统计量合并. 结果为(OR = 1.02, 95%CI: 0.16-6.39, P = 0.98), 在不同组织学类型的胃癌组织中CXCR7的表达无明显差异(图3B). 因纳入的研究较少, 无法进行敏感性分析. 因此, 此结果的可信度较低.
2.3.4 CXCR7在不同分化程度的胃癌组织中的表达情况: 纳入的3个研究[1,3,7]报道了不同分化程度的胃癌组织中CXCR7的表达情况. 各研究间存在异质性(I2 = 78%, P = 0.01), 采用随机效应模型进行统计量合并. 结果为(OR = 0.32, 95%CI: 0.05-1.89, P = 0.21), 在不同分化程度的胃癌组织中CXCR7的表达无明显差异. 敏感性分析显示, 剔除掉辛琪等[3]的研究后, 各研究之间不存在异质性(I2 = 0, P = 0.44), 采用固定效应模型, 结果为(OR = 0.13, 95%CI: 0.04-0.45, P = 0.001<0.05), 提示在不同分化程度的胃癌组织中CXCR7的表达存在显著性差异(图3C). 因此, 此Meta分析结果不稳定, 可信度低.
2.3.5 CXCR7在不同浸润深度的胃癌组织中的表达情况: 纳入的3个研究[1,3,7]报道了不同浸润深度的胃癌组织中CXCR7的表达情况. 各研究间存在轻度异质性(I2 = 58%, P = 0.09), 采用随机效应模型进行统计量合并. 结果为(OR = 0.17, 95%CI: 0.05-0.58, P = 0.005<0.05), 在不同浸润深度的胃癌组织中CXCR7的表达差异有统计学意义. 未侵犯浆膜层的胃癌组织中CXCR7的表达低于侵犯浆膜层的胃癌组织(图3D).
2.3.6 CXCR7在是否有淋巴结转移的胃癌组织中的表达情况: 纳入的3个研究[1,3,7]报道了在是否有淋巴结转移的胃癌组织中CXCR7的表达情况. 各研究间不存在异质性(I2 = 0, P = 0.51), 采用固定效应模型进行统计量合并. 结果为(OR = 0.23, 95%CI: 0.12-0.44, P<0.00001), 在是否有淋巴结转移的胃癌组织中CXCR7的表达差异有统计学意义. 有淋巴结转移的胃癌组织CXCR7的表达显著高于无淋巴结转移者(图3E).
2.3.7 CXCR7在不同临床分期的胃癌中的表达情况: 纳入的3个研究[1,3,7]报道了在不同临床分期的胃癌组织中CXCR7的表达情况. 各研究间不存在异质性(I2 = 0, P = 0.87), 采用固定效应模型进行统计量合并. 结果为(OR = 0.29, 95%CI: 0.16-0.54, P<0.0001), 在不同临床分期的胃癌组织中CXCR7的表达差异有统计学意义. Ⅲ-Ⅳ期胃癌组织中CXCR7的表达显著高于Ⅰ-Ⅱ期者(图3F).
本研究采用Meta分析的方法收集国内外所有关于CXCR7与胃癌及临床病理特征之间的关系的病理对照研究. 共纳入4个研究进行定量分析, 行效应量合并, 共425个病例. Meta分析结果显示, 胃癌组织中CXCR7的表达显著高于正常组织. CXCR7的表达还与胃癌组织的浸润深度、淋巴结转移、临床分期有关. 但CXCR7的表达与胃癌组织的分化程度之间的关系尚不确定.
CXCR7是趋化因子基质细胞衍生因子(又称CXCL12)的另一特异性受体[8-15]. Burns等[16]发现CXCR7可提高细胞存活并促进血管内皮细胞生长. 另外, CXCR7具有促进血管生成和细胞间黏附的作用, 特别是在肿瘤血管形成、肿瘤的侵袭和转移上均发挥重要作用[16-23].
目前证实CXCR7与多种恶性肿瘤关系密切, 且其表达水平与肿瘤转移及预后均有关[24-30]. 本研究显示, CXCR7在胃癌组织中呈高表达(OR = 46.35, 95%CI: 19.99-107.43). 并且CXCR7的表达与胃癌组织的浸润深度(OR = 0.17, 95%CI: 0.05-0.58)、淋巴结转移(OR = 0.23, 95%CI: 0.12-0.44)、临床分期(OR = 0.29, 95%CI: 0.16-0.54)有关. 至于CXCR7是否影响胃癌组织的分化, 目前尚不能确定, 需要更多的研究来明确、证实.
此外, 本研究也存在一定的局限性. (1)本研究仅纳入了4个研究, 且样本量较少, 因此对结果的准确性有一定的影响; (2)本研究纳入的4个研究均在中国实施, 纳入研究的病例结构单一, 不具有代表性, 影响本研究结果的适用范围; (3)本研究纳入的4个研究的质量中等, 一篇文献[2]未就基于设计或分析所得的病例与对照的可比性进行说明. 4篇文献[1-3,7]均为对病例的代表性及2组的无应答率进行分析说明, 有可能造成选择性偏倚及失访偏倚; 另外对各研究自身实验过程中的偏倚情况未进行分析讨论, 可能使本研究产生未可知的偏倚, 从而影响结果的可靠性.
总之, 通过对当前有限的关于CXCR7与胃癌的关系的研究表明, 胃癌组织中CXCR7的表达高于正常组织. CXCR7在胃癌组织中的表达与胃癌的浸润深度、淋巴结转移和临床分期有关, 说明CXCR7在胃癌的发展、转移中发挥作用. 另外, CXCR7是否影响胃癌组织的分化仍需要更进一步的研究证实.
胃癌是我国发病率和死亡率均居前列的恶性肿瘤, 胃癌患者的死亡原因其中之一就是肿瘤已经淋巴结转移或者侵犯周围脏器导致不能手术切除而使治疗失败, 因此新的治疗方法的研究显得更加迫切.
胃癌的发生、浸润、淋巴结转移的分子生物学机制, 寻找靶向治疗药物, 从而在分子层面阻断胃癌的发生发展具有重要的意义.
杨婧、辛琪、师阿盟、许统俭等用免疫组织化学的方法检验并评估趋化因子受体7(chemokine factor receptor 7, CXCR7)与胃癌的发生发展的关系.
通过循证医学的方法总结评估目前现有的CXCR7与胃癌的相关性的研究, 更直观的了解CXCR7与胃癌发生发展中的临床病理之间的相关性.
CXCR7与胃癌发生发展存在相关性, 给胃癌发生发展的分子生物学机制研究及治疗提供了一个思路.
异质性: 由于纳入同一个Meta分析的所有研究都存在差异, 因此大家将Meta分析中不同研究间的各种变异, 称之为异质性. 这些变异主要是研究对象、研究设计、干预措施、结果测量上的变异.
许庆文, 主任医师, 广东医学院附属医院普通外科; 杨秋蒙, 副主任医师, 上海交通大学医学院附属瑞金医院
本文的科学性、创新性及可读性能较好地反映我国或国际胃肠病学临床和基础研究的先进水平.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 甘肃省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:胡珊
| 1. | 杨 婧, 黄 显斌, 郝 相勇, 魏 丽, 景 武堂, 郭 天康. 趋化因子受体4和趋化因子受体7在胃癌组织中的表达及其临床意义. 中国普外基础与临床杂志. 2015;22:1062-1067. |
| 4. | Wells GA, Shea B, O'Connell D, Robertson J, Peterson J, Welch V, Losos M, Tugwell P. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses. Available from: http: //www.ohri.ca/programs/clinical_epidemiology/nosgen.pdf. |
| 5. | Review Manager (RevMan) [Computer program]. Version 5.3. Copenhagen: The Nordic Cochrane Centre, The Cochrane Collaboration 2014; http: //tech.cochrane.org/revman/revman53beta. |
| 6. | Cochran WG. The Combination of estimates from different experiments. Biometrics. 1954;10:101-129. [DOI] |
| 8. | Balabanian K, Lagane B, Infantino S, Chow KY, Harriague J, Moepps B, Arenzana-Seisdedos F, Thelen M, Bachelerie F. The chemokine SDF-1/CXCL12 binds to and signals through the orphan receptor RDC1 in T lymphocytes. J Biol Chem. 2005;280:35760-35766. [PubMed] [DOI] |
| 9. | Hartmann TN, Grabovsky V, Pasvolsky R, Shulman Z, Buss EC, Spiegel A, Nagler A, Lapidot T, Thelen M, Alon R. A crosstalk between intracellular CXCR7 and CXCR4 involved in rapid CXCL12-triggered integrin activation but not in chemokine-triggered motility of human T lymphocytes and CD34+ cells. J Leukoc Biol. 2008;84:1130-1140. [PubMed] [DOI] |
| 10. | Zabel BA, Wang Y, Lewén S, Berahovich RD, Penfold ME, Zhang P, Powers J, Summers BC, Miao Z, Zhao B. Elucidation of CXCR7-mediated signaling events and inhibition of CXCR4-mediated tumor cell transendothelial migration by CXCR7 ligands. J Immunol. 2009;183:3204-3211. [PubMed] [DOI] |
| 11. | Infantino S, Moepps B, Thelen M. Expression and regulation of the orphan receptor RDC1 and its putative ligand in human dendritic and B cells. J Immunol. 2006;176:2197-2207. [PubMed] [DOI] |
| 12. | Schönemeier B, Kolodziej A, Schulz S, Jacobs S, Hoellt V, Stumm R. Regional and cellular localization of the CXCl12/SDF-1 chemokine receptor CXCR7 in the developing and adult rat brain. J Comp Neurol. 2008;510:207-220. [PubMed] [DOI] |
| 13. | Thelen M, Thelen S. CXCR7, CXCR4 and CXCL12: an eccentric trio? J Neuroimmunol. 2008;198:9-13. [PubMed] [DOI] |
| 14. | Wang J, Shiozawa Y, Wang J, Wang Y, Jung Y, Pienta KJ, Mehra R, Loberg R, Taichman RS. The role of CXCR7/RDC1 as a chemokine receptor for CXCL12/SDF-1 in prostate cancer. J Biol Chem. 2008;283:4283-4294. [PubMed] [DOI] |
| 15. | Levoye A, Balabanian K, Baleux F, Bachelerie F, Lagane B. CXCR7 heterodimerizes with CXCR4 and regulates CXCL12-mediated G protein signaling. Blood. 2009;113:6085-6093. [PubMed] [DOI] |
| 16. | Burns JM, Summers BC, Wang Y, Melikian A, Berahovich R, Miao Z, Penfold ME, Sunshine MJ, Littman DR, Kuo CJ. A novel chemokine receptor for SDF-1 and I-TAC involved in cell survival, cell adhesion, and tumor development. J Exp Med. 2006;203:2201-2213. [PubMed] [DOI] |
| 17. | Luker KE, Gupta M, Steele JM, Foerster BR, Luker GD. Imaging ligand-dependent activation of CXCR7. Neoplasia. 2009;11:1022-1035. [PubMed] [DOI] |
| 18. | Tarnowski M, Liu R, Wysoczynski M, Ratajczak J, Kucia M, Ratajczak MZ. CXCR7: a new SDF-1-binding receptor in contrast to normal CD34(+) progenitors is functional and is expressed at higher level in human malignant hematopoietic cells. Eur J Haematol. 2010;85:472-483. [PubMed] [DOI] |
| 19. | Meijer J, Ogink J, Roos E. Effect of the chemokine receptor CXCR7 on proliferation of carcinoma cells in vitro and in vivo. Br J Cancer. 2008;99:1493-1501. [PubMed] [DOI] |
| 20. | Grymula K, Tarnowski M, Wysoczynski M, Drukala J, Barr FG, Ratajczak J, Kucia M, Ratajczak MZ. Overlapping and distinct role of CXCR7-SDF-1/ITAC and CXCR4-SDF-1 axes in regulating metastatic behavior of human rhabdomyosarcomas. Int J Cancer. 2010;127:2554-2568. [PubMed] [DOI] |
| 21. | Dambly-Chaudière C, Cubedo N, Ghysen A. Control of cell migration in the development of the posterior lateral line: antagonistic interactions between the chemokine receptors CXCR4 and CXCR7/RDC1. BMC Dev Biol. 2007;7:23. [PubMed] [DOI] |
| 22. | Dai X, Tan Y, Cai S, Xiong X, Wang L, Ye Q, Yan X, Ma K, Cai L. The role of CXCR7 on the adhesion, proliferation and angiogenesis of endothelial progenitor cells. J Cell Mol Med. 2011;15:1299-1309. [PubMed] [DOI] |
| 23. | Hou KL, Hao MG, Bo JJ, Wang JH. CXCR7 in tumorigenesis and progression. Chin J Cancer. 2010;29:456-459. [PubMed] [DOI] |
| 24. | Guillemot E, Karimdjee-Soilihi B, Pradelli E, Benchetrit M, Goguet-Surmenian E, Millet MA, Larbret F, Michiels JF, Birnbaum D, Alemanno P. CXCR7 receptors facilitate the progression of colon carcinoma within lung not within liver. Br J Cancer. 2012;107:1944-1949. [PubMed] [DOI] |
| 25. | Iwakiri S, Mino N, Takahashi T, Sonobe M, Nagai S, Okubo K, Wada H, Date H, Miyahara R. Higher expression of chemokine receptor CXCR7 is linked to early and metastatic recurrence in pathological stage I nonsmall cell lung cancer. Cancer. 2009;115:2580-2593. [PubMed] [DOI] |
| 26. | Hao M, Zheng J, Hou K, Wang J, Chen X, Lu X, Bo J, Xu C, Shen K, Wang J. Role of chemokine receptor CXCR7 in bladder cancer progression. Biochem Pharmacol. 2012;84:204-214. [PubMed] [DOI] |
| 27. | Yates TJ, Knapp J, Gosalbez M, Lokeshwar SD, Gomez CS, Benitez A, Ekwenna OO, Young EE, Manoharan M, Lokeshwar VB. C-X-C chemokine receptor 7: a functionally associated molecular marker for bladder cancer. Cancer. 2013;119:61-71. [PubMed] [DOI] |
| 28. | D'Alterio C, Consales C, Polimeno M, Franco R, Cindolo L, Portella L, Cioffi M, Calemma R, Marra L, Claudio L. Concomitant CXCR4 and CXCR7 expression predicts poor prognosis in renal cancer. Curr Cancer Drug Targets. 2010;10:772-781. [PubMed] [DOI] |
| 29. | Zheng K, Li HY, Su XL, Wang XY, Tian T, Li F, Ren GS. Chemokine receptor CXCR7 regulates the invasion, angiogenesis and tumor growth of human hepatocellular carcinoma cells. J Exp Clin Cancer Res. 2010;29:31. [PubMed] [DOI] |
| 30. | Hattermann K, Held-Feindt J, Lucius R, Müerköster SS, Penfold ME, Schall TJ, Mentlein R. The chemokine receptor CXCR7 is highly expressed in human glioma cells and mediates antiapoptotic effects. Cancer Res. 2010;70:3299-3308. [PubMed] [DOI] |