修回日期: 2017-05-03
接受日期: 2017-05-11
在线出版日期: 2017-06-28
非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)是非酒精性脂肪肝病的进展形式, 可能会进展为肝硬化或肝细胞性肝癌. 单纯的节食及生活方式改变难以坚持, 且无法减缓疾病进展. 传统治疗方法对脂肪变性和炎症有效, 但其对纤维化无效, 而纤维化恰巧是判断患者预后的一种重要标准. 随着对NASH发病机制和进展了解的不断深入, 目前正在进行的研究评估了一些前景良好的、靶向治疗, 同时可逆转纤维化的新型治疗方法, 这些均使得未来NASH治疗前景更加乐观.
核心提要: 目前尚无美国食品药物管理局批准的非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)治疗药物, 迫切需要有效的治疗方法. 随着对NASH发病机制不断深入了解, 希望通过各类新药的研发, 改变现有饮食和运动调节治疗效果欠佳的局面.
引文著录: 冷雪君, 颜学兵. 非酒精性脂肪性肝炎的药物治疗进展. 世界华人消化杂志 2017; 25(18): 1645-1654
Revised: May 3, 2017
Accepted: May 11, 2017
Published online: June 28, 2017
Non-alcoholic steatohepatitis (NASH), the more aggressive form of non-alcoholic fatty liver disease, may progress to cirrhosis and hepatocellular carcinoma. Only changes in diet and lifestyle are hard to maintain and have little effect in delaying the progression of NASH. Traditional methods are effective in reducing steatosis and inflammation, but they have no effect on fibrosis, which is the main determinant of patient outcome. With the understanding of the pathogenesis and progression of NASH, several promising novel therapies to target and possibly reverse fibrosis are being evaluated, making the future of NASH therapy more optimistic.
- Citation: Leng XJ, Yan XB. Pharmacotherapies for non-alcoholic steatohepatitis. Shijie Huaren Xiaohua Zazhi 2017; 25(18): 1645-1654
- URL: https://www.wjgnet.com/1009-3079/full/v25/i18/1645.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i18.1645
非酒精性脂肪肝病(non-alcoholic fatty liver diseases, NAFLD)是西方国家慢性肝病最常见的病因, 同时也是世界范围内肝脏相关疾病发病与死亡的首要病因[1]. 在美国, NAFLD患病率约30%, 而我国成人NAFLD患病率也呈迅速增长态势, 部分地区患病率高达30%, 且越来越多的病毒性肝炎合并NAFLD[2]. 近5年, 国内外更新了多部关于NAFLD的临床指南[3-9], 足以说明当前人们对此类疾病的重视. NAFLD代表着一类临床病理疾病, 初步认为, 此类疾病是由于肝细胞内脂肪过度积累引起(脂肪变性). 通常认为, NAFLD为代谢综合征(metabolic syndrome, MS)的肝脏表现, MS同时还包括肥胖、胰岛素抵抗(insulin resistance, IR)、高血压和高血脂. NAFLD广义分为两类, 分别是仅有脂肪变性的非酒精性脂肪肝和进展性亚型--非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH), 可伴有细胞损伤、炎性细胞浸润及肝细胞气球样变, 进一步进展形成肝纤维化、肝硬化(liver cirrhosis, LC), 甚至肝细胞性肝癌(hepatocellular carcinoma, HCC). 预计在未来5-15年, NASH将取代丙型肝炎病毒(hepatitis C virus, HCV)成为终末期肝病进行肝移植的首要病因[10].
不仅对成年人, NAFLD也逐渐成为青少年和年轻人(adolescents and young adults, AYAs)的重要健康负担. 这与肥胖和MS在AYAs中发病率的上升, 及不健康的生活方式是密切相关的[11]. 目前美国食品药物管理局(the United States Food and Drug Administration, FDA)尚未批准治疗NASH的药物. 因此, 对能控制NASH复杂病理生理进展的有效治疗手段的需求不容忽视. 目前, 在研发管线上, 有许多针对疾病进展过程中不同阶段和分子事件的新型药物, 同时一些既往"超说明书"应用治疗的药物目前仍在使用. 因此, 本文旨在介绍NASH病理生理机制的基础上, 回顾性总结当前NASH治疗的可及手段和最新药物研制进展.
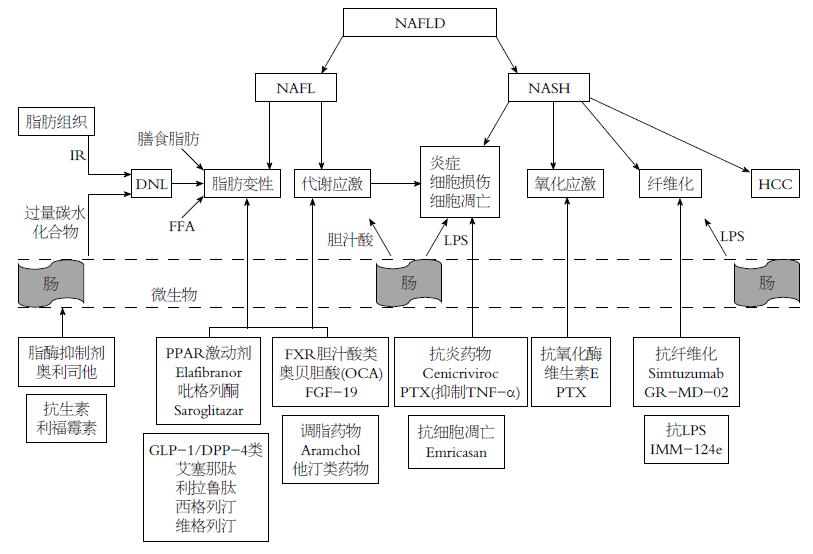
关于NASH的发病机制目前仍处于争论阶段. 在传统的"二次打击"假说中, 肝脂肪变性是第一次"打击", 他增强了肝脏对随后的第二次打击的敏感性, 而第二次打击则可引起肝损伤、炎症和纤维化. 但根据最新的研究发现, "多次平行打击"假说更受青睐. 该理论认为, 引起肝脏损伤的不同致病事件是平行发生的, 而非相继连续发生. 简单的脂肪变性和NASH是两种具有不同自然疾病进程的不同疾病. 所有引起NASH的均可能为潜在的药物作用靶点, 包括IR、脂质毒性、氧化应激、内质网应激、线粒体功能障碍、脂肪组织功能紊乱和自身免疫、细胞因子分泌及肠道肝脏轴的调节改变[12](图1).
NASH多种分子干扰的病理生理机制是复杂且多因素的. 但由于代谢失衡引起肝脏内脂肪过度堆积, 主要有以下3种原因: (1)增加了膳食纤维的吸收或从肠道向肝脏的传递, 或肠道生理功能或微生物调节异常; (2)增加了来自非酯化蓄积池(主要来自白脂肪组织)的游离脂肪酸的流入; (3)增加了过量碳水化合物重新合成肝脏脂肪(和/或脂肪组织IR引起的高胰岛素血症)[13]. 当这些过程无法被肝脏代偿分泌的极低密度脂蛋白所抵消, 或由其他代谢途径利用, 就会在肝脏细胞内出现甘油三酯和游离脂肪酸的净沉积.
通常认为肝细胞脂质毒性主要由游离脂肪酸及其代谢物引起, 而甘油三酯聚集的影响性较小. 肝内的这种改变对线粒体和内质网造成额外的代谢压力, 同时产生了许多压力诱导反应, 包括活性氧的释放, 及免疫细胞和其他细胞损伤介质的补充. 这一系列反应引起了更多的细胞损伤, 包括更多炎症、程序性细胞死亡(凋亡)和由活化肝星状细胞引起的胶原沉积而造成的纤维化重塑[14].
研究[15]表明, 肠道微生物群的改变在NAFLD的发生和发展进程中可能发挥重要作用. 肠道微生物群的改变可引起细菌易位, 尤其是称为脂多糖(lipopolysaccharide, LPS)的高免疫反应性革兰氏阴性细胞壁成分, 进入体循环, 进一步加重了由活化巨噬细胞和枯否细胞引起的炎症进展.
NASH管理的一线方案包含生活方式改变, 主要是持续性减重(通过限制摄入热量)及增加运动锻炼. 3%的轻微减重可能减轻肝脏脂肪变性, 而对NASH患者, 需减重10%以上才能减轻炎症并逆转纤维化[16]. 即使在管理良好的环境中, 仅有少数患者成功并持续约10%的减重. 鉴于生活方式改变实行较困难, 预计在未来, 生活方式改变同药物治疗的联合将成为NASH管理的规范.
过氧化物酶体增殖物激活受体(peroxisome proliferator-activator receptors, PPARs)是一组分子受体, 在肝内、脂肪组织、心脏、骨骼肌和肾脏内表达, 通过转录调节多种代谢过程, 包括β-氧化、脂质运输及糖生成. 共有3种PPAR(α、β/δ、γ), 虽其组织分布不同, 但均作用于相同的DNA片段.
PPAR α激动剂, 如贝特类降脂药, 广泛应用于高甘油三酯血症的治疗, 但可能由于受体在肝外组织广泛分布, 尚未显示对NAFLD的特异性. 存在于巨噬细胞中的PPAR δ, 对降低巨噬细胞和枯否细胞活化及增加脂肪酸氧化有效. 尽管PPAR β/δ激动剂(GW501516)在初期试验中认为是具有前景的, 但该药物可能因为安全问题而被中止研究[17].
3.1.1 Elafibranor: 作为一种PPAR α/δ双效激动剂, Elafibranor能有效改善腹部肥胖患者的肝内和外周胰岛素敏感性, 同时调节糖稳态和脂质代谢, 并能够减少炎症发生. 一项多中心、国际性、随机、双盲、安慰剂对照的临床Ⅱb期试验研究[18], 将无LC的NASH患者随机分为3组: 分别接受Elafibranor 80 mg/d(n = 93), Elafibranor 120 mg/d(n = 91)及安慰剂组(n = 92), 共治疗52 wk. 初期研究结果显示, 与安慰剂组相比, 应用Elafibranor 120 mg/d组NASH改善率更高, 肝酶、血脂、葡萄糖及全身炎症指标水平显著降低. Elafibranor耐受性良好, 并未导致体质量增加或心脏事件等不良事件, 但却可引起轻微、可逆的血清肌酐水平升高.
3.1.2 噻唑烷二酮类: PPAR γ激动剂, 目前以噻唑烷二酮类(thiazolidinediones, TZDs)药物形式, 作为胰岛素增敏剂广泛应用于糖尿病的治疗中. 也有研究显示TZDs对NASH治疗有效. 一项PIVENS试验研究, 将吡格列酮、VitE和安慰剂比较, 虽吡格列酮组具有改善NASH组织学的趋势, 但并未能达到研究目标. 与对照组相比, 试验组能观察到血清丙氨酸氨基转移酶(alanine aminotransferase, ALT)和天冬氨酸氨基转移酶水平显著下降, 以及肝脏脂肪变性和小叶性炎症的改善, 但纤维化程度未见明显改善[19]. 同时, 已知的增重不良反应(同样在PIVENS研究中也出现)和可能引起药物相关性充血性心力衰竭风险, 都限制了其在NASH治疗中的应用. 近期由Musso等[20]进行的一项评估TZDs用于NASH治疗的随机对照临床试验, 研究显示, TZDs能够逆转进展性纤维化并改善整体纤维化阶段. 在所有的TDZs治疗方案中, 吡格列酮对NASH的效用最全面, 同时在非糖尿病患者中也可观察到这些治疗效果.
3.1.3 Saroglitazar: Saroglitazar于2013年在印度获批上市, 是全球首个新型的PPAR α/γ双效激动剂, 用于治疗糖尿病性血脂异常, 尤其适用于他汀类药物无法控制的由2型糖尿病引起的血脂异常和高甘油三脂血症. 在临床前期研究模型中, Saroglitazar能够有效降低血脂水平并提高胰岛素敏感性[21]. 且有研究[22]显示该药物能够显著降低NAFLD和肝活检证实的NASH患者的ALT水平. 仍需要更多的临床研究以证明该药物的临床有效性.
法尼酯X受体(farnesoid X receptor, FXR)是一种在人体组织内高度表达的核激素受体, 参与包括肝脏、肠道和肾脏的胆红素代谢. 胆汁酸为FXRs的天然配体. FXRs能够调节编码胆固醇7-羟化酶(cholesterol 7 alpha-hydroxylase, CYP7A1)的基因表达, 而CYP7A1正是胆汁酸合成的限速酶. 此外, FXRs在碳水化合物和脂质代谢及调控胰岛素敏感性中发挥重要作用. 出现肝脏损伤时, FXRs也可调节肝细胞的生长和再生. 此外, 在NAFLD和NASH的动物模型中, FXR激活可预防脂肪性肝损伤, 并能改善高脂血症、葡萄糖耐受不良和胰岛素敏感性[23].
3.2.1 奥贝胆酸: 奥贝胆酸(obeticholic acid, OCA)是一种胆汁酸合成衍生物和FXR激动剂, 为高度亲脂性, 无内源性胆汁淤积活性. 在胆汁淤积、肝纤维化的小鼠模型中, OCA具有抗胆汁淤积活性 (阻止胆汁流出障碍), 能够逆转肝纤维化和肝硬化, 同时可降低门脉高压[24]. 目前正在进行无LC、经肝活检证实的NASH患者的FLINT研究(一项多中心、随机、双盲、安慰剂对照研究)[25]. 在此项研究中, 283名患者随机接受OCA 25 mg/d(n = 141)或安慰剂(n = 142)治疗72 wk. 结果显示, OCA组具有显著的组织学及纤维化评分改善. OCA治疗患者中, 约23%观察到瘙痒等不良反应, 导致一些受试者中止服药. 同时OCA治疗组还可能出现血脂异常的加重, 虽这种不良反应是可逆的, 但仍需要对可能出现的心血管意外进行密切监测. 但到目前为止, 仍认为OCA在治疗NASH方面极具前景. 接下来进行的临床Ⅲ期试验研究(NCT02548351)有望证实该药物的治疗有效性.
3.2.2 NGM-282: 成纤维细胞生长因子19(fibroblast growth factor 19, FGF19)是一种通过FXR活化转录调节的激素, 能应对回肠末端餐后胆汁酸的大量涌入. FGF19与FGF受体(FGF receptor, FGFR)4/β-klotho(一种单次跨膜蛋白)受体复合物结合. 在肝细胞膜上, 促进糖原合成的同时抑制糖异生[26]. NGM-282是人工合成的FGF19激素. 有研究显示, FGF19的过度表达可促进转基因小鼠的肝脏肿瘤发展, 且FGFR4的活化对肝细胞有促癌作用. 因此, 设计合成NGM282旨在消除FGF19与致癌特性相关信号元素的同时, 保留FGFR1c亚型和FGFR4诱导的天然激素信号活动, 从而直接调节代谢和胆汁酸合成. NGM282提供了一个独特的机会, 在无潜在致瘤风险的同时, 平衡FGF19双重作用机制, 能够开展多元化研发计划以有效评估其药物机制和价值, 并最大化临床和商业潜力[27]. 目前一项临床Ⅱ期试验研究(NCT02443116)评估了NGM-282的12 wk治疗周期对NASH患者的影响.
硬脂酰辅酶A脱氢酶(stearoyl-coA desaturase, SCD)位于内质网, 能催化单一不饱和脂肪酸合成的限速阶段. 动物试验研究显示, SCD-1异构体的缺点(或抑制)与肝脏脂肪变性减轻和胰岛素敏感度增高相关. 患NASH的肥胖个体较正常肝脏个体相比, SCD-1活性更高(P<0.002), 可能与基因表达水平相应.
3.3.1 Aramchol: Aramchol是一种新型合成脂质分子, 通过牢固的酰胺键结合2种天然成分--胆酸(胆汁酸)和花生酸(饱和脂肪酸). 在高脂饮食动物模型中, Aramchol能显著降低肝脂肪含量. 体外试验显示, Aramchol能够抑制70%-83%的SCD1活性. 抑制SCD1能增加脂肪酸合成并减少β氧化, 减少甘油三酯和脂肪酸酯的肝脏储存[28,29]. 目前一项纳入60例肝活检证实的NAFLD患者(仅有6例NASH患者)的双盲、安慰剂对照试验研究正在对该药物进行评估[30]. 该60例患者随机分配接受Aramchol 100 mg/d, 300 mg/d以及安慰剂(每组n = 20)治疗3 mo. 与安慰剂组相比, 应用300 mg/d Aramchol能够减少肝脏脂肪含量. 研究表明, 经过3 mo的随访管理, Aramchol是安全、可耐受, 并能显著降低NAFLD患者的肝脏脂肪含量. 肝脏脂肪含量的减少以剂量依赖方式表现, 并与代谢改善趋势相关, 这些结果均表明Aramchol治疗NAFLD的适用性.
3.3.2 他汀类药物: 他汀类药物是一种羟甲基戊二酰辅酶A还原酶抑制剂. 因其有降低血脂的作用, 目前广泛应用于心血管疾病(cardiovascular diseases, CVD)的一、二级预防. 血脂异常是MS与NAFLD的共有特征, 能够增加个体患CVD的风险. 此外, NAFLD是心血管疾病的独立危险因素. 近期进行了一项评估NAFLD与10年CVD风险关联的研究[31], 结果显示, 根据美国心脏病学会/美国心脏协会评估方法及弗雷明汉初级保健评估方法, NAFLD患者的10年CVD风险高于无NAFLD个体. 大部分NAFLD患者完成他汀类药物治疗标准的建议, 这表明他汀类药物治疗可以减少NAFLD患者10年CVD风险. 事实上, 针对他汀类治疗NASH的研究较少. 在一项纳入1201名因可疑NASH而进行肝穿刺活检的欧洲居民的队列研究[32]中, 结果显示, 他汀类药物能改善脂肪变性、脂肪性肝炎及F2-F4阶段的纤维化.
胰高血糖素样肽-1(glucagon-like peptide 1, GLP-1)是一类激素, 属于肠促胰岛素类蛋白质, 由回肠末端和结肠近端的L细胞分泌[33]. 除了刺激胰腺引起β细胞增殖和增强胰岛素合成, GLP-1还能与消化道其他部分及肺内、肾脏和中枢神经系统的受体相互作用. GLP-1有许多代谢作用, 包括延迟胃排空、抑制食欲、增加肝脏糖分吸收和外周胰岛素敏感性, 及葡萄糖依赖的胰岛素分泌, 同时抑制α细胞释放胰高血糖素. GLP-1呈葡萄糖依赖性降血糖, 有效避免了严重低血糖的发生, 是T2DM具有广泛应用前景的药物. GLP-1能被二肽基肽酶-4(dipeptidyl peptidase-4, DPP-4)快速分解, 而DPP-4抑制剂则通过抑制降解GLP-1关键酶DPP-4的活性, 间接提高血清中GLP-1浓度发挥控制血糖的效应[34].
3.4.1 GLP-1受体激动剂: 尽管如艾塞那肽(exenatide)和利拉鲁肽(liraglutide)这种GLP-1受体激动剂已获批用于Ⅱ型糖尿病的治疗, 一些研究[35]的Meta分析结果显示了该药物对NASH患者具有显著的积极作用, 包括能降低血清ALT水平, 改善肝脏脂肪含量及纤维化. 由于此类药物具有减重效果, 故其极有望用于NASH和MS的治疗.
一项纳入52名受试者以评估利拉鲁肽治疗NASH的安全性和有效性的LEAN研究[36], 受试者随机接受利拉鲁肽1.8 mg/d或安慰剂治疗48 wk(每组n = 26). 该研究结果显示, 利拉鲁肽组约39%的患者达到了初期终点目标(NASH改善而无加重纤维化), 而安慰剂组仅有9%(P = 0.019). 利拉鲁肽组仅有9%出现进展纤维化, 而安慰剂组发生率高达36%(n = 0.019). 这使得利拉鲁肽极有望成为一种可行的NASH治疗方法.
3.4.2 DPP-4抑制剂: DPP-4抑制剂, 如西格列汀(sitagliptin)和维格列汀(vildapliptin), 可作用于DPP-4酶, 该酶能够快速分解GLP-1. 该类药物作用机制在于延长GLP-1的有效时间. 目前, 进行了比较西格列汀与安慰剂治疗NASH患者的组织学参数改变的研究, 试验结果均显示, 与安慰剂相比, 西格列汀并不能更有效的改善NASH患者的肝脏脂肪含量和肝纤维化程度[37,38]. 因此尚无证据说明此类药物治疗NASH的有效性. 故需更多试验研究来全面证实其临床有效性.
3.5.1 维生素E: 维生素E作为一种抗氧化剂, 能够降低CVD风险、保护神经、调节免疫和抗过敏反应, 同时可应用于非酒精性脂肪肝的治疗[39]. 目前认为, 具有抗氧化作用的维生素E是NASH管理中的一线治疗, 尤其是当节食和生活方式改变无效时. 一项PIVENS试验[19], 纳入无糖尿病、经肝活检证实的NASH患者, 分别接受维生素E 800 IU/d(800 mg/d, n = 84), 吡格列酮(30 mg/d, n = 80)以及安慰剂(n = 83). 研究结果显示, 与安慰剂组相比, 维生素E能更好地降低ALT水平, 改善肝脂肪变性和炎症, 与能够显著改善NASH(43% vs 19%, P = 0.001).
尽管上文涉及的研究报道了维生素E有明显不良反应, 延长该药物使用时间, 尤其大剂量应用时, 可能会引起有害的不良反应. 目前有一些研究表明长期应用维生素E可能会增加前列腺癌和出血性卒中的风险. 因此, 在决定治疗时, 除了疾病活动进展和患者健康水平, 还需考虑药物潜在风险. 在某些情况下, 推荐应用维生素E的剂量为 400 IU/d[40].
3.5.2 Emricasan: 肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)位于NASH中介导的肝细胞损伤和半胱天冬酶调节的细胞凋亡两种途径的交叉点. Emricasan是一种泛蛋白酶抑制剂, 初期研究[41]结果显示, 该药物能降低ALT水平, 尤其对于HCV和NASH患者. 目前一项在NASH小鼠模型上评估Emricasan用于治疗节食相关性MS所引起的肝损伤及肝纤维化有效性的研究[42], 结果显示, 该药物能够通过抑制肝脏细胞凋亡而减轻肝脏损伤及肝纤维化, 从而表明Emricasan可能成为NASH的一种有前景的抗纤维化治疗方法.
3.5.3 已酮可可碱: 已酮可可碱(pentoxifylline, PTX)是一种甲基黄嘌呤衍生物, 对磷酸二酯酶和TNF-α均有抑制性作用, 因此可能具有调节其他炎症细胞因子的功能. PTX既往用于酒精性肝炎(alcoholic hepatitis, AH)的治疗, 但在肝活检证实的NASH患者中, 应用PTX能显著改善NASH组织学表现. 在NASH的发病机制和进展过程中, 脂质氧化具有重要作用, 而PTX能够通过降低氧自由基介导的氧化应激作用从而抑制脂质氧化. 一项评估PTX用于NASH患者不同脂质氧化物质的有效性[43], 结果显示, 与安慰剂相比, 应用PTX能显著减少氧化脂肪酸. 另外一项研究显示, PTX能显著抑制肝脏癌前病变的发生进展, 同时减少肝脏甘油三酯含量. 体外研究显示, PTX治疗还可减少一些脂肪生成相关基因和细胞株趋化因子的表达. 这些结果均表明, PTX能通过减轻慢性肝脏炎症和降低肝内脂肪生成相关基因表达以阻止NASH相关肝脏肿瘤的发生[44].
3.5.4 Cenicriviroc: 在肝脏损伤过程中, 肝细胞和其他类型肝脏细胞释放炎症趋化因子, 如CC趋化因子配体2[chemokine(CC-motif)ligand 2, CCL2]的单核细胞趋化蛋白1和CCL5的正常T细胞表达和分泌因子, 将巨噬细胞和其他炎症细胞聚集至炎症处. CCL2和CCL5通过各自受体--CCL2受体(CCL2 receptor, CCR2)和CCR5发挥作用, 该受体多位于炎症细胞上以引起细胞迁移. 有趣的是, 在NASH患者中, CCL2和CCL5属17种正调节基因的其中2种. Cenicriviroc(CVC)是一种CCR2/CCR5拮抗剂, 在动物模型中已显示了具有潜在的抗炎和抗纤维化活性. 目前正在进行该药物针对NASH患者的临床Ⅱb期试验研究(CENTAUR). CENTAUR是一项前瞻性研究[45], 研究对象仅纳入NASH和肝纤维化, 或有进展HCC风险的患者, 旨在评估口服制剂CVC有效性, 同时比较短期和长期CVC治疗, 并评估降低炎症反应和纤维化两者间的相关性.
3.5.5 其他: 其他能够影响细胞炎症、损伤或凋亡, 及免疫相关因子的药物目前正处于临床试验阶段. 例如, Selonsertib(GS-4997), 是凋亡信号调节激酶1(apoptosis signal-regulating kinase 1, ASK-1)抑制剂, ASK-1是在氧化应激环境中能促进炎症、细胞凋亡和纤维化的一种蛋白质[46]; 丝裂原活化蛋白3激酶在肝脂肪变性和纤维化中起效.
干扰肝-肠屏障的完整性是NAFLD和NASH发病机制的重要基础, 因细菌及其产物(尤其是LPS)能逃避并进入体循环而引起肝脏大量炎症反应. 因此, 任何一种能够阻止细菌或LPS向体循环或肝脏易位的治疗方法均为可行的.
3.6.1 IMM-124e: Immuron制药公司的独特口服免疫制剂--IMM-124e, 一种免疫球蛋白G增强的牛初乳提取物, 将内脏与全身免疫系统相关联. 肠道是人体内最大的淋巴器官, 能够在复杂的背景(有益和有害抗原)下识别抗原信号. IMM-124e主要通过抑制炎症反应而发挥作用, 通过微生物穿透细胞壁继续传递信号[47]. 在初期临床研究取得了可喜的结果, 如能改善血糖控制、胰岛素抵抗和血脂代谢. 目前仍在进行后续研究.
3.6.2 奥利司他: 奥利司他(Orlistat)是FDA批准的脂酶抑制剂, 通过作用于肠道而减少膳食脂肪吸收以治疗肥胖. 一项旨在评估奥利司他治疗患有NASH的肥胖患者有效性研究, 结果显示, 奥利司他能降低转氨酶、总胆固醇、甘油三酯和低密度脂蛋白水平. 应用奥利司他治疗, IR指数和丙二醛水平明显改善, 而糖化血红蛋白(HbA1c)水平无明显改变. 对患NASH的肥胖患者而言, 应用奥利司他治疗可肝纤维化和炎症得到改善[48].
3.6.3 索利霉素: 其他作用于微生物的药物包括一种大环内酯类抗生素, 索利霉素(solithromycin). 目前该药物正处于临床Ⅱ期试验研究(NCT02510599).
目前的研究显示, 肝纤维化阶段是NAFLD患者死亡率的最有力预测因素. 因此, 目前有意研发针对肝纤维化过程不同因素的合适治疗药物.
3.7.1 Simtuzumab: Simtuzumab(既往称GS-6624)是一种单克隆抗体, 靶向阻断赖氨酰氧化酶样蛋白-2(lysyl oxidase-like 2 protein, LOXL2). LOXL2是胶原形成的关键基质酶, 并且在肝内高度表达[49], 可通过促进胶原纤维的交联修饰胞外基质, 被认为在肿瘤恶化和纤维化中发挥重要作用, 具有遏制肿瘤进展及逆转纤维化的潜能. 目前该药物正在进行临床Ⅱ期试验, 该研究同时纳入了有肝硬化和无肝硬化的NASH患者.
3.7.2 GR-MD-02: 半乳糖凝集素3(Galectin-3)是一种主要表达于免疫细胞的蛋白质, 能够识别并结合半乳糖残基. Galectin-3是肝脏纤维化发生的关键蛋白, 而GR-MD-02是一种良好的半乳糖凝集素抑制剂. 一项评估GR-MD-02治疗伴桥接性肝纤维化NASH患者的安全性和药物动力学的研究[50]结果显示, GR-MD-02的实际有效剂量高于临床前期研究得到的剂量范围, 且依据药效动力学相关数据, 这种较高水平的有效剂量是安全的同时耐受性良好. 目前正在进行两项评估该药物用于治疗肝纤维化或LC的临床Ⅱ期试验(NCT02462967). 动物临床数据表明, GR-MD-02有逆转肝纤维化和肝硬化的治疗效果[51].
由于NAFLD疾病的发病隐匿性及社会重视度欠缺, 造成了高发病率、低检出率、低治疗率的社会环境, 导致NAFLD的诊断和治疗较困难. 而NASH作为NAFLD的一种进展性亚型, 有进展LC甚至HCC可能, 需进行早期干预以改善、减缓甚至逆转疾病进展. 鉴于目前尚无FDA批准的用于NAFLD/NASH的药物, 目前主要的治疗方法仍为个体化节食和生活方式改变. 可接受的改善NASH和纤维化逆转的减重阈值(减重大于体质量的10%)难以实现, 且生活方式改变获得临床改善的时间较长, 有效率较低, 因此迫切需要药物性治疗方案.
NAFLD是MS的肝脏表现, 常伴有高血脂、高血糖等, 因此许多治疗高脂血症(如他汀类)、糖尿病(如GLP-1激动剂、DPP-4抑制剂)的药物对NAFLD也有一定改善作用, 换言之, 应在治疗NAFLD同时综合兼顾调节血脂、血糖, 以改善整体预后.
目前维生素E和吡格列酮仍是许多指南推荐的一线治疗药物. 但由于其可能存在的不良反应, 临床实践应用时仍需谨慎. 新型治疗的研发管线中增加了多种药物, 这些药物作用机制各异, 侧面反应了NASH病理生理机制的复杂多样性, 但同时也为研究新型药物提供了多种作用靶点. 由于各种新药尚处于临床试验阶段, 需要更多的试验研究以证明其治疗有效性. 可预测, 未来几年内, 将有更多的制药公司加入研发NASH治疗新药的队列中, 使得未来治疗NASH的成功率增加.
近年针对非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)治疗的指南更新迅速, 随着治疗NASH药物研制进展, 各类新药有望陆续上市, 如何根据不同的患者制定切实可行而且经济的治疗方案变得更为复杂.
由于NASH新药多处于临床试验阶段, 仍有许多问题尚未解决, 如果对各类药物作用机制及其相应特点不熟悉, 盲目用药可能会给患者以后的治疗带来众多问题, 同时也不利于未来治疗的发展.
鉴于非酒精性脂肪肝病(non-alcoholic fatty liver diseases, NAFLD)持续增加的发病率, 近5年国内外更新了多部关于NAFLD的临床指南. 目前饮食与运动仍为一线治疗方法, 但多种NASH新药的产生为患者提供了新的治疗方案.
治疗NASH新药种类繁多, 建议对于新的指南在还没有十分明确的情况下, 加上大部分药物目前仍处于临床试验阶段, 详细了解各类药物的作用机制, 掌握未来治疗前沿技术.
本文对已上市和在研的NASH药物的种类、作用机制及未来市场前景进行简要述评及总结, 同时为NASH研究者或从事卫生保健工作的专家提供最新的治疗进展.
法尼酯X受体(FXR): 核激素受体超家族中的一员, 作为一种胆汁酸受体和胆汁酸生物合成的生物感受器, 参与机体多种生理活动.
唐映梅, 副主任医师, 昆明医科大学第二附属医院消化内科
文章对近5年内非酒精性脂肪性肝炎药物治疗的相关进展进行了论述, 观点明确、条理清楚、论述得当.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 江苏省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:李瑞芳
| 1. | Loomba R, Sanyal AJ. The global NAFLD epidemic. Nat Rev Gastroenterol Hepatol. 2013;10:686-690. [PubMed] [DOI] |
| 3. | Chalasani N, Younossi Z, Lavine JE, Diehl AM, Brunt EM, Cusi K, Charlton M, Sanyal AJ. The diagnosis and management of non-alcoholic fatty liver disease: practice Guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association. Hepatology. 2012;55:2005-2023. [PubMed] [DOI] |
| 5. | Korean Association for the Study of the Liver (KASL). KASL clinical practice guidelines: management of nonalcoholic fatty liver disease. Clin Mol Hepatol. 2013;19:325-348. [PubMed] [DOI] |
| 6. | Review Team, LaBrecque DR, Abbas Z, Anania F, Ferenci P, Khan AG, Goh KL, Hamid SS, Isakov V, Lizarzabal M, Peñaranda MM, Ramos JF, Sarin S, Stimac D, Thomson AB, Umar M, Krabshuis J, LeMair A. World Gastroenterology Organisation global guidelines: Nonalcoholic fatty liver disease and nonalcoholic steatohepatitis. J Clin Gastroenterol. 2014;48:467-473. [PubMed] [DOI] |
| 7. | Watanabe S, Hashimoto E, Ikejima K, Uto H, Ono M, Sumida Y, Seike M, Takei Y, Takehara T, Tokushige K. Evidence-based clinical practice guidelines for nonalcoholic fatty liver disease/nonalcoholic steatohepatitis. J Gastroenterol. 2015;50:364-377. [PubMed] [DOI] |
| 8. | European Association for the Study of the Liver (EASL), European Association for the Study of Diabetes (EASD), European Association for the Study of Obesity (EASO). EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol. 2016;64:1388-1402. [PubMed] [DOI] |
| 9. | NICE guidelines [NG49]: Non-alcoholic fatty liver disease (NAFLD): assessment and management (EB/OL). Available from: https: //www.nice.org.uk/guidance/ng49. |
| 10. | Charlton MR, Burns JM, Pedersen RA, Watt KD, Heimbach JK, Dierkhising RA. Frequency and outcomes of liver transplantation for nonalcoholic steatohepatitis in the United States. Gastroenterology. 2011;141:1249-1253. [PubMed] [DOI] |
| 11. | Doycheva I, Watt KD, Alkhouri N. Nonalcoholic fatty liver disease in adolescents and young adults: The next frontier in the epidemic. Hepatology. 2017;65:2100-2109. [PubMed] [DOI] |
| 12. | Rotman Y, Sanyal AJ. Current and upcoming pharmacotherapy for non-alcoholic fatty liver disease. Gut. 2017;66:180-190. [PubMed] [DOI] |
| 13. | Oseini AM, Sanyal AJ. Therapies in non-alcoholic steatohepatitis (NASH). Liver Int. 2017;37 Suppl 1:97-103. [PubMed] [DOI] |
| 14. | Neuschwander-Tetri BA. Hepatic lipotoxicity and the pathogenesis of nonalcoholic steatohepatitis: the central role of nontriglyceride fatty acid metabolites. Hepatology. 2010;52:774-788. [PubMed] [DOI] |
| 15. | Tilg H, Cani PD, Mayer EA. Gut microbiome and liver diseases. Gut. 2016;65:2035-2044. [PubMed] [DOI] |
| 16. | Vilar-Gomez E, Martinez-Perez Y, Calzadilla-Bertot L, Torres-Gonzalez A, Gra-Oramas B, Gonzalez-Fabian L, Friedman SL, Diago M, Romero-Gomez M. Weight Loss Through Lifestyle Modification Significantly Reduces Features of Nonalcoholic Steatohepatitis. Gastroenterology. 2015;149:367-378.e5; quiz e14-e15. [PubMed] [DOI] |
| 17. | Sanchis-Gomar F, Lippi G, Perez-Quilis C. PPARδ modulation by GW501516: An unsuccessful exercise mimetic. Clin Pharmacol Ther. 2017; Jan 25. [Epub ahead of print]. [PubMed] [DOI] |
| 18. | Ratziu V, Harrison SA, Francque S, Bedossa P, Lehert P, Serfaty L, Romero-Gomez M, Boursier J, Abdelmalek M, Caldwell S. Elafibranor, an Agonist of the Peroxisome Proliferator-Activated Receptor-α and -δ, Induces Resolution of Nonalcoholic Steatohepatitis Without Fibrosis Worsening. Gastroenterology. 2016;150:1147-1159.e5. [PubMed] [DOI] |
| 19. | Sanyal AJ, Chalasani N, Kowdley KV, McCullough A, Diehl AM, Bass NM, Neuschwander-Tetri BA, Lavine JE, Tonascia J, Unalp A. Pioglitazone, vitamin E, or placebo for nonalcoholic steatohepatitis. N Engl J Med. 2010;362:1675-1685. [PubMed] [DOI] |
| 20. | Musso G, Cassader M, Paschetta E, Gambino R. Thiazolidinediones and Advanced Liver Fibrosis in Nonalcoholic Steatohepatitis: A Meta-analysis. JAMA Intern Med. 2017;177:633-640. [PubMed] [DOI] |
| 21. | Jain MR, Giri SR, Trivedi C, Bhoi B, Rath A, Vanage G, Vyas P, Ranvir R, Patel PR. Saroglitazar, a novel PPARα/γ agonist with predominant PPARα activity, shows lipid-lowering and insulin-sensitizing effects in preclinical models. Pharmacol Res Perspect. 2015;3:e00136. [PubMed] [DOI] |
| 22. | Jani RH, Pai V, Jha P, Jariwala G, Mukhopadhyay S, Bhansali A, Joshi S. A multicenter, prospective, randomized, double-blind study to evaluate the safety and efficacy of Saroglitazar 2 and 4 mg compared with placebo in type 2 diabetes mellitus patients having hypertriglyceridemia not controlled with atorvastatin therapy (PRESS VI). Diabetes Technol Ther. 2014;16:63-71. [PubMed] [DOI] |
| 23. | Ali AH, Carey EJ, Lindor KD. Recent advances in the development of farnesoid X receptor agonists. Ann Transl Med. 2015;3:5. [PubMed] [DOI] |
| 24. | Markham A, Keam SJ. Obeticholic Acid: First Global Approval. Drugs. 2016;76:1221-1226. [PubMed] [DOI] |
| 25. | Neuschwander-Tetri BA, Loomba R, Sanyal AJ, Lavine JE, Van Natta ML, Abdelmalek MF, Chalasani N, Dasarathy S, Diehl AM, Hameed B. Farnesoid X nuclear receptor ligand obeticholic acid for non-cirrhotic, non-alcoholic steatohepatitis (FLINT): a multicentre, randomised, placebo-controlled trial. Lancet. 2015;385:956-965. [PubMed] [DOI] |
| 26. | Kir S, Beddow SA, Samuel VT, Miller P, Previs SF, Suino-Powell K, Xu HE, Shulman GI, Kliewer SA, Mangelsdorf DJ. FGF19 as a postprandial, insulin-independent activator of hepatic protein and glycogen synthesis. Science. 2011;331:1621-1624. [PubMed] [DOI] |
| 27. | Nash Biotechs. NGM282 (EB/OL). Available from: http: //www. nashbiotechs.com/drugs_en/NGM282.php. |
| 28. | Dobrzyn A, Ntambi JM. Stearoyl-CoA desaturase as a new drug target for obesity treatment. Obes Rev. 2005;6:169-174. [PubMed] [DOI] |
| 29. | Dobrzyn P, Dobrzyn A, Miyazaki M, Cohen P, Asilmaz E, Hardie DG, Friedman JM, Ntambi JM. Stearoyl-CoA desaturase 1 deficiency increases fatty acid oxidation by activating AMP-activated protein kinase in liver. Proc Natl Acad Sci USA. 2004;101:6409-6414. [PubMed] [DOI] |
| 30. | Safadi R, Konikoff FM, Mahamid M, Zelber-Sagi S, Halpern M, Gilat T, Oren R. The fatty acid-bile acid conjugate Aramchol reduces liver fat content in patients with nonalcoholic fatty liver disease. Clin Gastroenterol Hepatol. 2014;12:2085-2091.e1. [PubMed] [DOI] |
| 31. | Motamed N, Rabiee B, Poustchi H, Dehestani B, Hemasi GR, Khonsari MR, Maadi M, Saeedian FS, Zamani F. Non-alcoholic fatty liver disease (NAFLD) and 10-year risk of cardiovascular diseases. Clin Res Hepatol Gastroenterol. 2017;41:31-38. [PubMed] [DOI] |
| 32. | Dongiovanni P, Petta S, Mannisto V, Mancina RM, Pipitone R, Karja V, Maggioni M, Kakela P, Wiklund O, Mozzi E. Statin use and non-alcoholic steatohepatitis in at risk individuals. J Hepatol. 2015;63:705-712. [PubMed] [DOI] |
| 33. | Drucker DJ, Nauck MA. The incretin system: glucagon-like peptide-1 receptor agonists and dipeptidyl peptidase-4 inhibitors in type 2 diabetes. Lancet. 2006;368:1696-1705. [PubMed] [DOI] |
| 35. | Carbone LJ, Angus PW, Yeomans ND. Incretin-based therapies for the treatment of non-alcoholic fatty liver disease: A systematic review and meta-analysis. J Gastroenterol Hepatol. 2016;31:23-31. [PubMed] [DOI] |
| 36. | Armstrong MJ, Gaunt P, Aithal GP, Barton D, Hull D, Parker R, Hazlehurst JM, Guo K; LEAN trial team, Abouda G, Aldersley MA, Stocken D, Gough SC, Tomlinson JW, Brown RM, Hübscher SG, Newsome PN. Liraglutide safety and efficacy in patients with non-alcoholic steatohepatitis (LEAN): a multicentre, double-blind, randomised, placebo-controlled phase 2 study. Lancet. 2016;387:679-690. [PubMed] [DOI] |
| 37. | Cui J, Philo L, Nguyen P, Hofflich H, Hernandez C, Bettencourt R, Richards L, Salotti J, Bhatt A, Hooker J. Sitagliptin vs. placebo for non-alcoholic fatty liver disease: A randomized controlled trial. J Hepatol. 2016;65:369-376. [PubMed] [DOI] |
| 38. | Joy TR, McKenzie CA, Tirona RG, Summers K, Seney S, Chakrabarti S, Malhotra N, Beaton MD. Sitagliptin in patients with non-alcoholic steatohepatitis: A randomized, placebo-controlled trial. World J Gastroenterol. 2017;23:141-150. [PubMed] [DOI] |
| 39. | Galli F, Azzi A, Birringer M, Cook-Mills JM, Eggersdorfer M, Frank J, Cruciani G, Lorkowski S, Özer NK. Vitamin E: Emerging aspects and new directions. Free Radic Biol Med. 2017;102:16-36. [PubMed] [DOI] |
| 40. | Rinella ME, Sanyal AJ. Management of NAFLD: a stage-based approach. Nat Rev Gastroenterol Hepatol. 2016;13:196-205. [PubMed] [DOI] |
| 41. | Pockros PJ, Schiff ER, Shiffman ML, McHutchison JG, Gish RG, Afdhal NH, Makhviladze M, Huyghe M, Hecht D, Oltersdorf T. Oral IDN-6556, an antiapoptotic caspase inhibitor, may lower aminotransferase activity in patients with chronic hepatitis C. Hepatology. 2007;46:324-329. [PubMed] [DOI] |
| 42. | Barreyro FJ, Holod S, Finocchietto PV, Camino AM, Aquino JB, Avagnina A, Carreras MC, Poderoso JJ, Gores GJ. The pan-caspase inhibitor Emricasan (IDN-6556) decreases liver injury and fibrosis in a murine model of non-alcoholic steatohepatitis. Liver Int. 2015;35:953-966. [PubMed] [DOI] |
| 43. | Zein CO, Lopez R, Fu X, Kirwan JP, Yerian LM, McCullough AJ, Hazen SL, Feldstein AE. Pentoxifylline decreases oxidized lipid products in nonalcoholic steatohepatitis: new evidence on the potential therapeutic mechanism. Hepatology. 2012;56:1291-1299. [PubMed] [DOI] |
| 44. | Shirakami Y, Shimizu M, Kubota M, Ohno T, Kochi T, Nakamura N, Sumi T, Tanaka T, Moriwaki H, Seishima M. Pentoxifylline prevents nonalcoholic steatohepatitis-related liver pre-neoplasms by inhibiting hepatic inflammation and lipogenesis. Eur J Cancer Prev. 2016;25:206-215. [PubMed] [DOI] |
| 45. | Friedman S, Sanyal A, Goodman Z, Lefebvre E, Gottwald M, Fischer L, Ratziu V. Efficacy and safety study of cenicriviroc for the treatment of non-alcoholic steatohepatitis in adult subjects with liver fibrosis: CENTAUR Phase 2b study design. Contemp Clin Trials. 2016;47:356-365. [PubMed] [DOI] |
| 46. | Nash Biotechs. Selonsertib (EB/OL). Available from: http: //www. nashbiotechs.com/drugs_en/IMM124E.php. |
| 47. | Nash Biotechs. Imm124E (EB/OL). Available from: http: //www. nashbiotechs.com/drugs_en/IMM124E.php. |
| 48. | Hussein O, Grosovski M, Schlesinger S, Szvalb S, Assy N. Orlistat reverse fatty infiltration and improves hepatic fibrosis in obese patients with nonalcoholic steatohepatitis (NASH). Dig Dis Sci. 2007;52:2512-2519. [PubMed] [DOI] |
| 49. | Barry-Hamilton V, Spangler R, Marshall D, McCauley S, Rodriguez HM, Oyasu M, Mikels A, Vaysberg M, Ghermazien H, Wai C. Allosteric inhibition of lysyl oxidase-like-2 impedes the development of a pathologic microenvironment. Nat Med. 2010;16:1009-1017. [PubMed] [DOI] |
| 50. | Harrison SA, Marri SR, Chalasani N, Kohli R, Aronstein W, Thompson GA, Irish W, Miles MV, Xanthakos SA, Lawitz E. Randomised clinical study: GR-MD-02, a galectin-3 inhibitor, vs. placebo in patients having non-alcoholic steatohepatitis with advanced fibrosis. Aliment Pharmacol Ther. 2016;44:1183-1198. [PubMed] [DOI] |
| 51. | Nash Biotechs. Gr_md_02 (EB/OL). Available from: http: //www. nashbiotechs.com/drugs_en/GR_MD_02.php. |