修回日期: 2017-04-12
接受日期: 2017-04-17
在线出版日期: 2017-06-28
锌参与300种以上的细胞生理过程, 包括DNA及蛋白合成、酶的活化以及细胞内信号转导过程. 同时锌也是许多酶类, 如碳酸酐酶、基质金属蛋白酶的关键组分, 而这些酶类与缺氧、血管生成、细胞增殖及肿瘤转移密切相关, 因此, 锌的获取对于恶性肿瘤的生长和进展非常重要. 细胞内锌离子的浓度变化受到ZnT1、ZIP4、金属硫蛋白及金属转录因子1等的调控, 细胞内锌稳态是多种调控机制参与下锌内流、锌外流和保留之间动态平衡的结果. 已有大量研究证实锌稳态调控失衡与胰腺癌的发生和转移有关, 因此, 锌及锌稳态的调控异常在胰腺癌的发生发展中具有重要作用.
核心提要: 大量研究证实锌稳态调控失衡与胰腺癌的发生和转移有关. 进一步深入研究胰腺细胞中锌稳态调控的具体机制, 可以为胰腺癌的靶向治疗提供理论支持, 从而为胰腺癌的基因治疗提供一种新的选择, 改善胰腺癌预后.
引文著录: 杨晓军. 细胞内锌稳态调控及其在胰腺癌发生发展过程中的作用. 世界华人消化杂志 2017; 25(18): 1615-1623
Revised: April 12, 2017
Accepted: April 17, 2017
Published online: June 28, 2017
Zinc (Zn) is an essential micronutrient that is required in over 300 different cellular processes, including DNA and protein synthesis, enzyme activity, and intracellular signaling. Zn availability is also important for tumor growth and progression because it is an essential component for many enzymes such as carbonic anhydrase and matrix metalloproteinases, which are involved in hypoxia, angiogenesis, cell proliferation, and metastasis. Intracellular Zn homeostasis is tightly regulated through the integration of Zn transporting mechanisms, including zinc influx, efflux and intracellular retention. A large number of studies have confirmed that the deregulation of Zn homeostasis is related to the occurrence and metastasis of pancreatic carcinoma. Therefore, the abnormal regulation of intracellular zinc homeostasis plays an important role in the occurrence and development of pancreatic carcinoma.
- Citation: Yang XJ. Regulation of intracellular zinc homeostasis: Role in occurrence and development of pancreatic carcinoma. Shijie Huaren Xiaohua Zazhi 2017; 25(18): 1615-1623
- URL: https://www.wjgnet.com/1009-3079/full/v25/i18/1615.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i18.1615
胰腺癌是一种高度恶性的肿瘤, 预后极差. 未接受治疗的胰腺癌患者生存期约为4 mo, 接受旁路手术治疗的患者生存期约7 mo, 切除手术后患者一般能生存16 mo[1,2]. 在北美, 胰腺癌在所有的肿瘤相关死亡中位居第4. 尽管数十年来手术治疗、化疗以及放疗都取得了一些进展, 但是就胰腺癌而言, 发生率仍然等于死亡率[3-5]. 因为缺乏可靠的检验手段能用于早期诊断, 也缺乏有效的治疗手段可以用来控制转移, 所以胰腺癌的生存率统计数据非常差. 唯一可能治愈胰腺癌的方法就是外科手术切除, 然而, 对于已经出现临床症状的胰腺癌患者来说, 80%已经丧失了手术机会[5,6]. 显然, 我们需要更深入的研究来揭示胰腺癌的发病机制, 并探索更加有效的治疗方法. 因此, 把某些或者在胰腺癌中特异性表达, 或者参与细胞代谢、营养摄取等关键通路的基因作为靶点进行研究, 将有利于提高胰腺癌的诊断和治疗水平.
锌离子是人体含量居第2位的微量元素, 参与300种以上的细胞生理过程, 包括DNA及蛋白合成、酶的活化以及细胞内信号转导过程. 锌也是许多包含锌指结构的金属酶和转录因子的催化/结构组分[7,8]. 实验动物的锌缺乏会导致生长迟滞、摄食减少、DNA合成障碍、免疫功能异常以及严重的皮炎[9]. 锌的获取对于恶性肿瘤的生长和进展非常重要, 因为锌是许多酶类, 如碳酸酐酶、基质金属蛋白酶的关键组分, 而这些酶类与缺氧、血管生成、细胞增殖及肿瘤转移密切相关[10,11]. 高锌浓度对于细胞是有毒性作用的, 因此, 细胞进化形成一套复杂的调控体系以维持锌摄取、细胞内储存及外流之间的动态平衡[12,13]. 研究证实有两个溶质相关载体(SLC)基因家族具有锌转运功能: SLC30基因, 编码锌转运子蛋白(Zinc transporter, ZnT); SLC39基因, 编码Zrt-Irt样蛋白(ZIP)[13-15], 他们在细胞内锌稳态的维持过程中作用相反. ZnT转运子通过促进细胞内的锌外流或者进入囊泡内而降低细胞内锌浓度; 反之, ZIP转运子通过促进细胞外锌的摄取和囊泡内锌进入胞质而提高细胞内锌浓度. ZnT和ZIP锌转运子家族均为组织特异性表达, 对饮食中锌缺乏/过量反应不同, 通过激素和细胞因子对生理刺激也呈现不同反应[16].
在多种肿瘤动物模型中都已经发现锌对于肿瘤生长的重要性. 例如, 在乳腺癌[17]、Lewis肺癌[18]、白血病[19]、Walker256癌[20,21]以及其他数种实质性肿瘤[19]中都发现锌缺失可抑制移植肿瘤生长, 提高Lewis肺癌和Walker256癌移植瘤动物的存活率[20,21], 而锌的饱和供给则明显促进这些恶性肿瘤动物模型的肿瘤形成. 已有大量研究[13,22-24]证实锌转运子ZIP4与胰腺癌、前列腺癌的发生和转移有关. 在胰腺癌细胞中, ZIP4已被证明能够促进细胞周期, 细胞增殖和侵袭. 在体内研究中, ZIP4的沉默显著增加了胰腺癌原位及异位移植瘤裸鼠的存活率.
锌离子是人体必需的微量元素, 广泛参与细胞增殖和分化、核酸与蛋白质的合成以及其他许多重要的生理活动. 在人体中已鉴定出300多种含锌酶和至少1000多种含锌转录因子, 这些酶和转录因子必须有锌离子的参与才能发挥其正常功能和作用. 人体中, 锌的含量约为 2-3 g, 其中90%位于肌肉和骨骼中. 细胞内锌离子含量因细胞种类和所处部位不同而有所差异. 前列腺细胞中锌离子含量是其他组织的3-10倍[25]; 正常情况下细胞质内锌离子浓度约是10-9-10-8 mol数量级, 而在某些囊泡和锌体中, 锌离子含量可达10-3 mol以上[26]. 但从细胞整体水平上看, 锌离子含量始终是处于动态平衡之中. 这种动态平衡, 对于维持细胞正常生理活动和功能有着极其重要的作用[27], 平衡一旦被打破, 就会引起细胞内生理活动的紊乱, 引发多种病症.
人体内锌离子缺乏会导致免疫力下降、男性生殖功能减退等问题. 而锌离子过剩, 也会引发缺铁性贫血、提高心血管疾病发病率等. 锌在细胞生长和增殖过程中发挥重要作用, 锌缺乏与各种疾病密切相关, 包括免疫功能受损、生长迟滞、伤口愈合延迟、骨骼发育迟滞以及骨质疏松症[9,28]. 之前的一些研究提示锌对成骨样细胞的增殖和分化都有直接作用. 已经证实锌通过数个不同机制调控细胞的增殖, 对于影响细胞分裂和增殖的酶系统而言锌是至关重要的. 祛除细胞外环境中的锌会导致脱氧胸苷激酶活性减弱并降低腺苷(5')四磷酸(5')腺苷的水平. 因此, 锌有可能通过对这些酶的影响而直接调节DNA的合成. 锌还影响细胞分裂过程中的相关激素调控. 例如, 垂体生长激素-胰岛素样生长因子-1(insulin-like growth factor-1, IGF-1)轴亦对锌的水平变化发生反应, 显然在细胞增殖过程中, 锌对于诱导产生IGF-1是必需的[9,29]. Chesters等[30]完成了一项对体外培养细胞DNA合成过程中锌的需求时间点的实验, 据此他们推测锌对于介导细胞进入S期的蛋白的汇集及维持是必不可缺的. 这些研究结果提示锌有可能是通过影响DNA合成和细胞周期而在细胞增殖和生长过程中发挥重要作用. 然而, 高浓度的锌对细胞是有毒性的, 并可导致凋亡[31]. 因此, 细胞必须通过调节锌转运子活性等一整套稳态机制来维持细胞内的锌水平在一个狭小的生理范围内. 研究细胞内锌离子动态平衡的相关生理机制有助于了解这些疾病的发病机制, 对于疾病的预防和治疗有着重要的指导意义.
细胞内锌离子稳态的维持, 需要各种锌转运机制的精细协同, 调控细胞内锌离子在各种细胞器之间的合理分布. 在真核细胞中, 锌离子动态平衡的调控主要包括锌离子在细胞水平的吸收, 锌离子在细胞膜或细胞器膜上的运输, 锌离子在囊泡或锌体内的储存, 以及锌离子进入细胞核后启动相关基因的表达等生理活动[26]. 这一系列生理活动的调控, 主要由ZIP/SLC39A家族蛋白(solutelinked carrier 39A, SLC39A)、ZnT/SLC30A家族蛋白(solutelinked carrier 30A, SLC30A)、金属硫蛋白(metallothionein, MT)以及金属转录因子1(metal response element binding transcription factor1, MTF1)这4大类锌指蛋白共同参与完成[25]. 目前已经有24个锌转运蛋白被鉴定出来, 对于他们在锌稳态维持过程中的功能研究正在进行之中[32,33]. SLC30A基因家族成员(包括ZnT1-10)的作用是将锌离子转运出细胞质, 但ZnT5是个例外[34], 只是结构类似, 都具有6个跨膜结构域和1个在锌离子结合过程中发挥关键作用的组氨酸富集区域[33]. 与之相反, SLC39A(ZIP1-14)基因家族成员能够将锌离子转运至细胞质内[32,35].
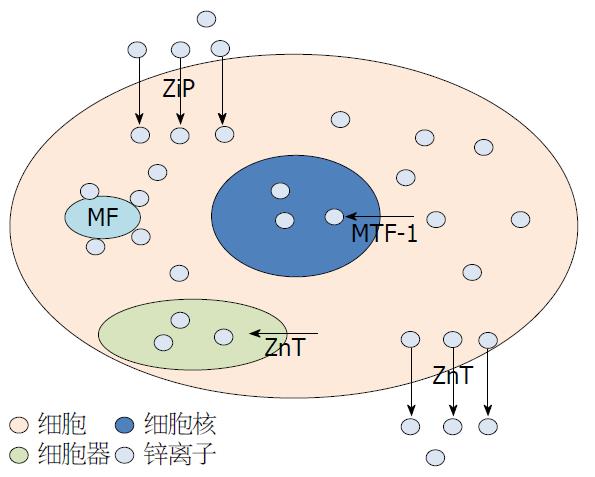
正常生理条件下, 一定时间内细胞内与细胞外、细胞质与细胞器间锌离子流量保持动态平衡. 即ZIP摄入胞内的锌离子量基本等于ZnT排除出胞外的锌离子量; 从细胞质进入细胞器或锌离子结合蛋白的锌离子量基本等于细胞器或锌离子结合蛋白上释放出来的锌离子量, 如图1所示. 当细胞受到高浓度锌离子刺激时, 细胞会首先启动锌离子缓冲反应体系, 以此来削弱因锌离子的流入而造成胞内锌离子含量的升高. 细胞内锌离子缓冲方式包括: (1)金属硫蛋白结合游离态的锌离子(MT-Zinc); (2)通过ZnT家族转运蛋白, 把游离态锌离子转运到亚细胞器内, 或是把锌离子排出细胞外, 从而使胞内锌离子浓度恢复到初始平衡值[26]. 但当高浓度的锌离子量超过其缓冲体系的缓冲能力时, 锌离子就会启动核内相关基因的转录系统. 此时, MTF1结合游离态锌离子, 结合有锌离子的MTF1接着转移至细胞核内, 在相关蛋白的辅助下, 与相关基因的MRE启动位点结合, 启动相关基因的表达, 比如MT、ZnT1蛋白的表达, 从而继续缓冲胞内的锌离子, 直至细胞内锌离子浓度恢复到正常水平. 当细胞受到锌离子饥饿刺激时, 胞内的含锌蛋白或细胞器, 例如, 囊泡或锌体中存储的锌离子便能为细胞提供锌离子, 锌离子从锌体等存储部位上释放出来. 同时ZIP蛋白可从细胞外摄入锌离子, 维持细胞内锌离子动态平衡.
锌离子稳态的失衡与多种肿瘤的发生有关, 缺锌成为促发肿瘤的重要因素. 缺锌可增加DNA链的突变概率, 使DNA修复蛋白p53基因发生突变, 增加DNA的氧化压力, 造成DNA氧化性损害, 破坏DNA的完整性, 干扰异常增生组织细胞的凋亡, 进而促发肿瘤[36,37]. 在肿瘤细胞中, 缺锌可使肿瘤组织的细胞核抗原、cyclinD1、cyclinD1依赖性激酶4、p53、抗细胞凋亡蛋白Bcl2、细胞角蛋白14和表皮生长因子受体等过度表达, 破坏细胞的凋亡抗肿瘤机制[38,39]. 人食管鳞状细胞癌中, 缺锌使细胞角蛋白14和cyclinD1过度表达, 造成细胞周期G1期控制紊乱, 促发肿瘤的发生[40]. 现已发现在消化系肿瘤、腮腺肿瘤、鼻咽肿瘤、肺癌、前列腺癌、头颈部癌等中锌离子的含量显著偏离正常组织. 胃、大肠、膀胱和女性生殖器官肿瘤组织中, 锌含量均有一定程度下降, 肾癌组织中锌离子的浓度比正常组织显著下降. 但在乳腺癌组织和脑瘤组织中, 其锌含量则是明显升高的[41]. 可见, 肿瘤的发生与锌离子动态平衡失衡有一定相关性.
锌离子作为辅助因子参与机体多种酶促反应, 同时, 也是维持许多信号转导分子和转录因子正常表达与结构完整不可或缺的部分, 而这些活性分子大都与肿瘤的生长及转移相关[8,10,42]. 细胞内锌离子水平的相对稳定是由2个功能截然相反的锌转运子家族维持. 其中ZnT转运子通过向细胞外排出而降低细胞内的锌离子水平, 反之, ZIP家族通过促进细胞外的摄取而提高细胞内锌离子水平. 锌转运子表达水平的异常会导致细胞内锌离子水平发生变化, 而涉及多种肿瘤的病理过程. 例如, 化学诱导的乳腺癌就以ZnT1表达水平降低及细胞内锌离子水平12倍的升高为特征[13]. ZIP6的过表达可以提高锌离子水平且与雌激素受体阳性的乳腺癌及淋巴结转移相关[23], 而ZIP10的表达对于乳腺癌细胞的侵袭特性是不可或缺的[43]. 最近的研究[44-46]阐明锌转入子ZIP4在胰腺癌发生发展过程中发挥重要生物功能. ZIP4是胰腺癌中表达升高的主要锌转入子, 可以促进肿瘤生长, 并且可以促进肿瘤的增殖和转移[44]. 过表达的ZIP4可以导致IL-6/STAT3/信号通路激活, 并且提高VEGF和基质金属蛋白酶(matrix metalloproteinases, MMPs)的表达水平[46]. 尽管在多种恶性肿瘤中, 细胞内锌离子和锌转运子的生物学效应已经被基本阐明, 但其潜在的分子机制仍不清楚.
胰腺是一个兼具内外分泌功能的器官, 锌离子参与了胰腺生理功能的多个环节, 包括胰高血糖素分泌、消化酶活性以及胰岛素的包装、分泌和信号转导. 由于锌离子具有如此广泛的生理效应, 所以胰腺内锌离子的代谢失衡会影响多个关键生理过程, 包括血糖的调控[47-51], 并与胰腺癌[46,47,52]和慢性胰腺炎[53-56]的发生相关.
锌离子调节胰腺功能的多个方面, 包括胰高血糖素的分泌[57-59]. ZIP1、ZIP10和ZIP14表达在胰腺α细胞, 并且定位于细胞膜, 提示这些转运子全部或者至少有一个的功能是将锌离子转运至细胞内[60]. 除了参与胰腺细胞活力调控之外[61], 锌还属于细胞内的信号转导分子, 在糖饥饿条件下对于胰腺α细胞分泌释放胰高血糖素发挥"关闭"作用[59]. 这种情况下, 胰腺β细胞在血糖刺激下会释放包含锌离子的胰岛素四聚体进入胰岛内的外周循环中. 锌离子从胰岛素上解离下来, 通过结合于胰腺α细胞表面而发挥作用, 从而开放ATP依赖性钾离子通道, 使细胞超极化, 抑制电压依赖性钙通道. 因此, 胰腺α细胞储存的胰高血糖分泌释放过程受到抑制[58], 提示锌离子是调节胰高血糖素分泌的关键分子. 此外, 其他几个葡萄糖异生相关酶, 包括磷酸烯醇式丙酮酸羧激酶和葡萄糖-6-磷酸酶都是锌离子依赖性的[57], 进一步说明锌离子是糖代谢调控的关键分子.
除了调控胰高血糖素的分泌, 锌离子还参与全身的血糖调控[62-65]. ZIP4定位于胰腺β细胞的细胞膜, 提示ZIP4参与锌离子进入β细胞的调控过程[66]. 胰岛素的生物合成过程是在胰腺β细胞内进行的, 胰岛素原先被转运至高尔基复合体内, 接着进入富含锌离子的分泌囊泡[67], 2个锌离子先和2个胰岛素2聚体结合, 然后再与另外一个胰岛素2聚体结合, 从而形成一个含有锌离子的6聚体单元[68]. 因此, 锌离子是胰岛素生物合成必不可少的结构成分之一, 对于胰腺β细胞的结构及功能完整也是不可或缺. 释放至外周血液循环中的锌离子在维持血糖水平恒定方面的具体作用有待进一步深入研究. 而且, 锌离子还能调节胰岛素对其靶组织的效应. 例如, 锌离子可以通过PI3/Akt信号通路启动靶组织对胰岛素的反应[65], 证实了锌离子在外周组织胰岛素信号通路中的关键作用. 此外, 胰岛素反应性氨基肽酶(insulin reactive aminopeptidase, IRAP)也属于锌离子依赖性酶, 他的具体功能目前尚不清楚. IRAP和葡萄糖转运子4[62,63]共同定位, 并且在胰岛素作用下共同转位至细胞膜表面[69]. 和葡萄糖转运子4类似, 在2型糖尿病患者, 转位至肌细胞及脂肪细胞表面的IRAP数量减少[62]. 这一现象又在锌离子代谢和胰岛素信号之间建立了另一种关联. 但是, 仍需进一步深入研究以深刻理解胰岛素信号转导的锌离子依赖程度.
在正常饮食条件下, 每天有1-2 mg的锌离子从胰腺腺泡细胞以酶原颗粒的形式分泌进入消化道[70]. 这些酶原颗粒中含有消化功能所必需的消化酶, 这些酶活性都是锌离子依赖性的[71]. ZIP5定位于腺泡细胞的基底膜, 显然是在锌离子的转入细胞过程中发挥作用[66]. 最近, 研究[72]发现ZnT2涉及锌离子转运至酶原颗粒而参与消化酶的代谢. 锌的缺乏会引起ZnT2表达降低并且使酶原颗粒中的锌浓度下降. 因此, 锌离子稳态的破坏可能会影响消化酶的活性, 并进而影响营养吸收. 这一点在人体对锌离子需求增大的某些特殊阶段可能尤为重要, 像妊娠、哺乳和发育阶段. 进一步的深入研究有助于我们深刻了解锌离子缺乏对人体消化酶活性及营养吸收功能的影响.
胰腺癌是一种高度恶性, 预后极差的恶性肿瘤, 确诊后的整体5年生存率仅仅5%[73]. 该肿瘤目前约占全部恶性肿瘤2%-3%, 且发病率逐年上升. 手术切除目前仍是延长生存期的最有效手段. 但大部分患者就医时肿瘤已为局部进展期或存在远处转移而无法行根治性切除. 即使可切除, 术后复发率也很高. 越来越多的研究结果显示锌离子稳态失衡与胰腺癌的发病机制密切相关[44-46,52], 锌离子治疗和锌转运子可作为潜在治疗靶点进行深入研究[44-46,74-76].
Jayaraman等[52]所完成的一项研究证实: 将胰腺癌细胞暴露在锌离子下, 可以增加细胞的泛素化并加速细胞死亡, 提示锌离子可以做为胰腺癌的潜在治疗药物. 此外, 高表达锌转运子ZIP4可以通过促进细胞内锌离子蓄积而与胰腺癌的病理过程密切相关[44-46]. Li等[44]的研究发现, 与癌旁正常组织相比较, 锌转运子ZIP4在17份胰腺腺癌的临床样本中有16份(94%)显著高表达. ZIP4 mRNA的表达水平在胰腺癌细胞中明显高于人胰腺导管上皮细胞. 他们进一步研究了过表达ZIP4在体外实验中对胰腺癌细胞增殖能力的影响, 以及在体内实验中对胰腺癌进展的影响. 实验结果表明[44]人为过表达ZIP4在体外实验中可以提高细胞内的锌离子水平, 使细胞增殖能力有2倍的增高; 在裸鼠皮下移植瘤实验中肿瘤体积相比对照组有13倍的增加; 在裸鼠原位移植瘤实验中, 不仅使肿瘤重量有7.2倍的增加, 而且增加腹膜扩散转移和腹水的发生率. 此外, 在肿瘤组织中也观察到了细胞增殖的加快和锌含量的提高. 这些数据证实ZIP4的异常过表达能够促进胰腺癌的发生和发展, 也提示一个针对胰腺癌的新治疗策略, 即靶向沉默ZIP4可以控制胰腺癌的生长. 接下来的研究[45]证实了这一设想: 在ZIP4敲除的裸鼠皮下移植瘤体内实验中, 胰腺癌进展的几个方面都受到了抑制, 包括细胞增殖、转移和侵袭; 另外, 在胰腺癌原位移植瘤模型中, 沉默ZIP4表达使肿瘤的大小、重量受抑, 裸鼠生存率增加.
Zhang等[46]发现ZIP4过表达可以通过cAMP反应组分结合蛋白(cAMP responsive element-binding protein, CREB)增加IL-6的转录, 然后, IL-6激活STAT3, 进一步增加细胞周期素D1的表达, 促进细胞增殖和肿瘤进展. 他们进一步深入研究发现, ZIP4介导的细胞内锌离子浓度升高, 可以转录诱导胰腺癌中mir373的表达并促进肿瘤生长[74]. 报告子表达分析以及染色体免疫共沉淀实验均证实: ZIP4可以激活锌离子依赖转录因子CREB, 并且需要CREB通过调控启动子来促进mir373的表达. 在ZIP4介导的细胞增殖、侵袭及肿瘤生长过程中, mir373的激活是不可或缺的一环. 进一步对mir373的体内致癌功能进行研究发现, mir373的表达受到TP53INP1、CD44以及LATS2的负性调控. 这些结果揭示了一个新的细胞信号转导轴: ZIP4-CREB-mir373, 可以促进胰腺癌的生长, 并且可以部分解释锌转运子在癌细胞中的作用机制. 这些研究结果阐明了ZIP4介导胰腺癌生长的一条新的信号通路, 并且对胰腺癌靶向治疗提出了一些新的靶点, 包括ZIP4、IL-6、mir373以及STAT3. 还有几个由ZIP4所调控介导的信号通路被证实也与胰腺癌的进展相关. ZIP4过表达可以显著增加神经纤毛蛋白-1、VEGF、MMPs的表达, 反之ZIP4敲除可以逆转这些效应[75]. 最新的研究[76]结果表明: ZIP4不仅在胰腺癌的增殖、转移和侵袭过程中发挥重要作用, 而且还与胰腺癌细胞在锌缺乏状态下的凋亡抵抗能力密切相关. ZIP4稳定过表达的MIA PaCa-2(MIA-ZIP4)细胞对锌耗竭诱导的凋亡的抵抗性更强. 相反, ZIP4稳定降低的AsPC-1(AsPC-shZIP4)细胞对锌缺乏诱导的凋亡比对照更敏感. ZIP4所介导的细胞凋亡抵抗是通过胱天蛋白酶途径实现.
锌离子通过调控多个细胞信号通路, 在胰腺癌的病理过程中发挥非常复杂的作用, 他和ZIP4都可以作为治疗靶点深入研究.
胰腺癌是恶性程度极高的疾病之一, 在所有恶性肿瘤中胰腺癌的死亡率位居第1, 总体5年生存率不足5%[3,5,77]. 胰腺癌的特点就是浸润型生长早期发生转移, 而且对放疗及化疗不敏感[78]. 对于胰腺癌, 缺乏可靠的早期诊断标志物, 而对于大多数在进展期确诊的病例也缺乏有效的治疗措施. 尽管目前对于胰腺发生发展的生物学研究取得了一些进展, 但是对于胰腺癌增殖和信号转导的具体机制仍然知之甚少. 显然, 我们迫切需要对胰腺癌发生发展的细胞及分子机制做深入研究, 以求发现针对这一致死性疾病的更有效的治疗方法.
锌是一种微量元素, 人体含有2-3 g的锌. 由于体内没有锌的储存系统, 所以锌需要每日口服摄入, 并需要准确地调节其稳态平衡. 锌的化学特性使其成为生命过程中重要的金属离子之一, 有数百种锌依赖酶和信号事件依赖于锌. 因为锌具有重要的生理功能, 锌缺乏与多个器官功能障碍有关. 最近的研究显示锌的水平和恶性肿瘤尤其是胰腺癌风险之间存在某种关联, 然而, 锌和锌转运子在胰腺癌进展过程中的具体作用尚不清除. 生命系统严格控制着锌浓度的稳态平衡, 并且这种平衡是通过细胞本身调节锌离子流入和流出而实现的. 目前普遍的共识是ZIP家族蛋白、ZnT家族蛋白、金属硫蛋白以及金属转录因子1这4大类锌指蛋白共同参与完成锌稳态的调控. 胰腺对锌离子有特殊需求, 用以完成一些关键的细胞生理过程, 因此, 胰腺细胞中的锌稳态失衡与细胞功能受损、锌离子分泌障碍及某些疾病密切相关也就不足为奇了. 目前对胰腺细胞中锌离子稳态的具体调控机制研究的还不是十分清楚. 但是, 就现有的研究成果来看, 基于锌离子的干预治疗策略对于提高相关疾病尤其是胰腺癌的诊断及治疗能力都是非常有价值的. 下一步研究工作的关键是探讨锌离子调控蛋白的基因变异和突变对于胰腺功能以及胰腺癌发生发展的影响.
进一步深入研究胰腺细胞中锌稳态调控的具体机制, 可以为胰腺癌的靶向治疗提供理论支持, 从而为胰腺癌的基因治疗提供一种新的选择, 改善胰腺癌预后, 有较高的科学意义和应用前景.
在多种肿瘤动物模型中都已经发现锌对于肿瘤生长的重要性. 而锌的饱和供给则明显促进这些恶性肿瘤动物模型的肿瘤形成. 已有大量研究证实锌转运子ZIP4与胰腺癌、前列腺癌的发生和转移有关.
在胰腺癌细胞中, ZIP4已被证明能够促进细胞周期, 细胞增殖和侵袭. 在体内研究中, ZIP4的沉默显著增加了胰腺癌原位及异位移植瘤裸鼠的存活率.
ZIP4的异常过表达能够促进胰腺癌的发生和发展, 提示一个针对胰腺癌的新治疗策略, 即靶向沉默ZIP4可以控制胰腺癌的生长. 在ZIP4敲除的裸鼠皮下移植瘤体内实验中, 胰腺癌进展的几个方面都受到了抑制, 包括细胞增殖、转移和侵袭; 另外, 在胰腺癌原位移植瘤模型中, 沉默ZIP4表达使肿瘤的大小、重量受抑, 裸鼠生存率增加.
细胞内锌稳态是多种调控机制参与下锌内流、锌外流和保留之间动态平衡的结果. 大量研究证实锌稳态调控失衡与胰腺癌的发生和转移有关, 因此, 锌及锌稳态的调控异常在胰腺癌的发生发展中具有重要作用.
越来越多的研究结果显示锌离子稳态失衡与胰腺癌的发病机制密切相关, 锌离子治疗和锌转运子可作为潜在治疗靶点进行深入研究.
锌稳态(zinc homeostasis): 从细胞整体水平上看, 锌离子含量始终是处于动态平衡之中. 这种动态平衡, 对于维持细胞正常生理活动和功能有着极其重要的作用.
陈光, 教授, 吉林大学第一医院消化器官外科
近几年研究证实, 锌与胰腺癌具有一定相关性, 特别是ZIP4蛋白与胰腺癌的相关性. 国内尚无锌与胰腺癌相关综述. 本文内容主要分为细胞内锌稳态调控、锌稳态在胰腺癌发生发展过程中的作用两部分, 语言简练, 结构安排合理.
手稿来源: 邀请约稿
学科分类: 胃肠病学和肝病学
手稿来源地: 甘肃省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 马亚娟 电编:李瑞芳
| 1. | German RR, Fink AK, Heron M, Stewart SL, Johnson CJ, Finch JL, Yin D. The accuracy of cancer mortality statistics based on death certificates in the United States. Cancer Epidemiol. 2011;35:126-131. [PubMed] [DOI] |
| 2. | Kindler HL. Front-line therapy of advanced pancreatic cancer. Semin Oncol. 2005;32:S33-S36. [PubMed] [DOI] |
| 3. | Landis SH, Murray T, Bolden S, Wingo PA. Cancer statistics, 1998. CA Cancer J Clin. 1998;48:6-29. [PubMed] [DOI] |
| 4. | Torrisani J, Buscail L. Molecular pathways of pancreatic carcinogenesis. Ann Pathol. 2002;22:349-355. [PubMed] |
| 5. | Warshaw AL, Fernández-del Castillo C. Pancreatic carcinoma. N Engl J Med. 1992;326:455-465. [PubMed] [DOI] |
| 6. | Fisher WE, Berger DH. Angiogenesis and antiangiogenic strategies in pancreatic cancer. Int J Gastrointest Cancer. 2003;33:79-88. [PubMed] [DOI] |
| 7. | Mao X, Kim BE, Wang F, Eide DJ, Petris MJ. A histidine-rich cluster mediates the ubiquitination and degradation of the human zinc transporter, hZIP4, and protects against zinc cytotoxicity. J Biol Chem. 2007;282:6992-7000. [PubMed] [DOI] |
| 8. | Wang K, Zhou B, Kuo YM, Zemansky J, Gitschier J. A novel member of a zinc transporter family is defective in acrodermatitis enteropathica. Am J Hum Genet. 2002;71:66-73. [PubMed] [DOI] |
| 9. | Ross AC, Caballero B, Cousins RJ, Tucker KL, Ziegler TR. Modern Nutrition in Health and Disease. 11 ed. Baltimore: Lippincott Williams & Wilkins 2005; 271-285. |
| 10. | Juhász M, Chen J, Lendeckel U, Kellner U, Kasper HU, Tulassay Z, Pastorekova S, Malfertheiner P, Ebert MP. Expression of carbonic anhydrase IX in human pancreatic cancer. Aliment Pharmacol Ther. 2003;18:837-846. [PubMed] [DOI] |
| 11. | Garcea G, Doucas H, Steward WP, Dennison AR, Berry DP. Hypoxia and angiogenesis in pancreatic cancer. ANZ J Surg. 2006;76:830-842. [PubMed] [DOI] |
| 12. | Kim BE, Wang F, Dufner-Beattie J, Andrews GK, Eide DJ, Petris MJ. Zn2+-stimulated endocytosis of the mZIP4 zinc transporter regulates its location at the plasma membrane. J Biol Chem. 2004;279:4523-4530. [PubMed] [DOI] |
| 13. | Liuzzi JP, Cousins RJ. Mammalian zinc transporters. Annu Rev Nutr. 2004;24:151-172. [PubMed] [DOI] |
| 14. | Guerinot ML. The ZIP family of metal transporters. Biochim Biophys Acta. 2000;1465:190-198. [PubMed] [DOI] |
| 15. | Eide DJ. The SLC39 family of metal ion transporters. Pflugers Arch. 2004;447:796-800. [PubMed] [DOI] |
| 16. | Cousins RJ, Liuzzi JP, Lichten LA. Mammalian zinc transport, trafficking, and signals. J Biol Chem. 2006;281:24085-24089. [PubMed] [DOI] |
| 17. | Mills BJ, Broghamer WL, Higgins PJ, Lindeman RD. Inhibition of tumor growth by zinc depletion of rats. J Nutr. 1984;114:746-752. [PubMed] |
| 18. | DeWys W, Pories W. Inhibition of a spectrum of animal tumors by dietary zinc deficiency. J Natl Cancer Inst. 1972;48:375-381. [PubMed] |
| 19. | Takeda A, Goto K, Okada S. Zinc depletion suppresses tumor growth in mice. Biol Trace Elem Res. 1997;59:23-29. [PubMed] [DOI] |
| 20. | McQuitty JT, DeWys WD, Monaco L, Strain WH, Rob CG, Apgar J, Pories WJ. Inhibition of tumor growth by dietary zinc deficiency. Cancer Res. 1970;30:1387-1390. [PubMed] |
| 21. | DeWys W, Pories WJ, Richter MC, Strain WH. Inhibition of Walker 256 carcinosarcoma growth of dietary zinc deficiency. Proc Soc Exp Biol Med. 1970;135:17-22. [PubMed] [DOI] |
| 22. | Murgia C, Vespignani I, Rami R, Perozzi G. The Znt4 mutation inlethal milk mice affects intestinal zinc homeostasis through the expression of other Zn transporters. Genes Nutr. 2006;1:61-70. [PubMed] [DOI] |
| 23. | Taylor KM, Morgan HE, Johnson A, Hadley LJ, Nicholson RI. Structure-function analysis of LIV-1, the breast cancer-associated protein that belongs to a new subfamily of zinc transporters. Biochem J. 2003;375:51-59. [PubMed] [DOI] |
| 24. | Taylor KM, Hiscox S, Nicholson RI. Zinc transporter LIV-1: a link between cellular development and cancer progression. Trends Endocrinol Metab. 2004;15:461-463. [PubMed] [DOI] |
| 25. | Plum LM, Rink L, Haase H. The essential toxin: impact of zinc on human health. Int J Environ Res Public Health. 2010;7:1342-1365. [PubMed] [DOI] |
| 26. | Colvin RA, Holmes WR, Fontaine CP, Maret W. Cytosolic zinc buffering and muffling: their role in intracellular zinc homeostasis. Metallomics. 2010;2:306-317. [PubMed] [DOI] |
| 27. | Lichten LA, Cousins RJ. Mammalian zinc transporters: nutritional and physiologic regulation. Annu Rev Nutr. 2009;29:153-176. [PubMed] [DOI] |
| 28. | Tang Z, Sahu SN, Khadeer MA, Bai G, Franklin RB, Gupta A. Overexpression of the ZIP1 zinc transporter induces an osteogenic phenotype in mesenchymal stem cells. Bone. 2006;38:181-198. [PubMed] [DOI] |
| 29. | Lee R, Woo W, Wu B, Kummer A, Duminy H, Xu Z. Zinc accumulation in N-methyl-N-nitrosourea-induced rat mammary tumors is accompanied by an altered expression of ZnT-1 and metallothionein. Exp Biol Med (Maywood). 2003;228:689-696. [PubMed] |
| 30. | Chesters JK, Boyne R. Nature of the Zn2+ requirement for DNA synthesis by 3T3 cells. Exp Cell Res. 1991;192:631-634. [PubMed] [DOI] |
| 31. | Kim AH, Sheline CT, Tian M, Higashi T, McMahon RJ, Cousins RJ, Choi DW. L-type Ca(2+) channel-mediated Zn(2+) toxicity and modulation by ZnT-1 in PC12 cells. Brain Res. 2000;886:99-107. [PubMed] [DOI] |
| 32. | Eide DJ. Zinc transporters and the cellular trafficking of zinc. Biochim Biophys Acta. 2006;1763:711-722. [PubMed] [DOI] |
| 33. | Palmiter RD, Huang L. Efflux and compartmentalization of zinc by members of the SLC30 family of solute carriers. The ABC of solute carriers. New York: Springer-Verlag 2003; . |
| 34. | Kambe T, Narita H, Yamaguchi-Iwai Y, Hirose J, Amano T, Sugiura N, Sasaki R, Mori K, Iwanaga T, Nagao M. Cloning and characterization of a novel mammalian zinc transporter, zinc transporter 5, abundantly expressed in pancreatic beta cells. J Biol Chem. 2002;277:19049-19055. [PubMed] [DOI] |
| 35. | Dufner-Beattie J, Langmade SJ, Wang F, Eide D, Andrews GK. Structure, function, and regulation of a subfamily of mouse zinc transporter genes. J Biol Chem. 2003;278:50142-50150. [PubMed] [DOI] |
| 36. | Ho E. Zinc deficiency, DNA damage and cancer risk. J Nutr Biochem. 2004;15:572-578. [PubMed] [DOI] |
| 37. | Navarro Silvera SA, Rohan TE. Trace elements and cancer risk: a review of the epidemiologic evidence. Cancer Causes Control. 2007;18:7-27. [PubMed] [DOI] |
| 38. | Fong LY, Mancini R, Nakagawa H, Rustgi AK, Huebner K. Combined cyclin D1 overexpression and zinc deficiency disrupts cell cycle and accelerates mouse forestomach carcinogenesis. Cancer Res. 2003;63:4244-4252. [PubMed] |
| 39. | Fong LY, Feith DJ, Pegg AE. Antizyme overexpression in transgenic mice reduces cell proliferation, increases apoptosis, and reduces N-nitrosomethylbenzylamine-induced forestomach carcinogenesis. Cancer Res. 2003;63:3945-3954. [PubMed] |
| 40. | Cintorino M, Tripod SA, Santopietro R, Antonio P, Lutfi A, Chang F, Syrjänen S, Shen Q, Tosi P, Syrjänen K. Cytokeratin expression patterns as an indicator of tumour progression in oesophageal squamous cell carcinoma. Anticancer Res. 2001;21:4195-4201. [PubMed] |
| 41. | Prasad AS, Beck FW, Snell DC, Kucuk O. Zinc in cancer prevention. Nutr Cancer. 2009;61:879-887. [PubMed] [DOI] |
| 42. | Dufner-Beattie J, Wang F, Kuo YM, Gitschier J, Eide D, Andrews GK. The acrodermatitis enteropathica gene ZIP4 encodes a tissue-specific, zinc-regulated zinc transporter in mice. J Biol Chem. 2003;278:33474-33481. [PubMed] [DOI] |
| 43. | Kagara N, Tanaka N, Noguchi S, Hirano T. Zinc and its transporter ZIP10 are involved in invasive behavior of breast cancer cells. Cancer Sci. 2007;98:692-697. [PubMed] [DOI] |
| 44. | Li M, Zhang Y, Liu Z, Bharadwaj U, Wang H, Wang X, Zhang S, Liuzzi JP, Chang SM, Cousins RJ. Aberrant expression of zinc transporter ZIP4 (SLC39A4) significantly contributes to human pancreatic cancer pathogenesis and progression. Proc Natl Acad Sci USA. 2007;104:18636-18641. [PubMed] [DOI] |
| 45. | Li M, Zhang Y, Bharadwaj U, Zhai QJ, Ahern CH, Fisher WE, Brunicardi FC, Logsdon CD, Chen C, Yao Q. Down-regulation of ZIP4 by RNA interference inhibits pancreatic cancer growth and increases the survival of nude mice with pancreatic cancer xenografts. Clin Cancer Res. 2009;15:5993-6001. [PubMed] [DOI] |
| 46. | Zhang Y, Bharadwaj U, Logsdon CD, Chen C, Yao Q, Li M. ZIP4 regulates pancreatic cancer cell growth by activating IL-6/STAT3 pathway through zinc finger transcription factor CREB. Clin Cancer Res. 2010;16:1423-1430. [PubMed] [DOI] |
| 47. | Huber AM, Gershoff SN. Effect of zinc deficiency in rats on insulin release from the pancreas. J Nutr. 1973;103:1739-1744. [PubMed] |
| 48. | Jou MY, Philipps AF, Lönnerdal B. Maternal zinc deficiency in rats affects growth and glucose metabolism in the offspring by inducing insulin resistance postnatally. J Nutr. 2010;140:1621-1627. [PubMed] [DOI] |
| 49. | Hall AG, Kelleher SL, Lönnerdal B, Philipps AF. A graded model of dietary zinc deficiency: effects on growth, insulin-like growth factor-I, and the glucose/insulin axis in weanling rats. J Pediatr Gastroenterol Nutr. 2005;41:72-80. [PubMed] [DOI] |
| 50. | Kinlaw WB, Levine AS, Morley JE, Silvis SE, McClain CJ. Abnormal zinc metabolism in type II diabetes mellitus. Am J Med. 1983;75:273-277. [PubMed] [DOI] |
| 51. | Canfield WK, Hambidge KM, Johnson LK. Zinc nutriture in type I diabetes mellitus: relationship to growth measures and metabolic control. J Pediatr Gastroenterol Nutr. 1984;3:577-584. [PubMed] [DOI] |
| 52. | Jayaraman AK, Jayaraman S. Increased level of exogenous zinc induces cytotoxicity and up-regulates the expression of the ZnT-1 zinc transporter gene in pancreatic cancer cells. J Nutr Biochem. 2011;22:79-88. [PubMed] [DOI] |
| 53. | Girish BN, Rajesh G, Vaidyanathan K, Balakrishnan V. Zinc status in chronic pancreatitis and its relationship with exocrine and endocrine insufficiency. JOP. 2009;10:651-656. [PubMed] |
| 54. | Milnerowicz H, Jabłonowska M, Bizoń A. Change of zinc, copper, and metallothionein concentrations and the copper-zinc superoxide dismutase activity in patients with pancreatitis. Pancreas. 2009;38:681-688. [PubMed] [DOI] |
| 55. | Yavuz N, Unal E, Dogan M, Kiziler AR, Aydemir B, Titiz I. Serum free prostate-specific antigen and zinc levels in experimental acute pancreatitis. Biol Trace Elem Res. 2005;106:205-209. [PubMed] [DOI] |
| 56. | Bojarski K, Dabrowski A, Wallner G, Maciejewski R. Shift of zinc in serum and tissues in course of experimental acute pancreatitis. Ann Univ Mariae Curie Sklodowska Med. 2002;57:74-78. [PubMed] |
| 57. | Cameron AR, Anil S, Sutherland E, Harthill J, Rena G. Zinc-dependent effects of small molecules on the insulin-sensitive transcription factor FOXO1a and gluconeogenic genes. Metallomics. 2010;2:195-203. [PubMed] [DOI] |
| 58. | Ramracheya R, Ward C, Shigeto M, Walker JN, Amisten S, Zhang Q, Johnson PR, Rorsman P, Braun M. Membrane potential-dependent inactivation of voltage-gated ion channels in alpha-cells inhibits glucagon secretion from human islets. Diabetes. 2010;59:2198-2208. [PubMed] [DOI] |
| 59. | Slucca M, Harmon JS, Oseid EA, Bryan J, Robertson RP. ATP-sensitive K+ channel mediates the zinc switch-off signal for glucagon response during glucose deprivation. Diabetes. 2010;59:128-134. [PubMed] [DOI] |
| 60. | Gyulkhandanyan AV, Lu H, Lee SC, Bhattacharjee A, Wijesekara N, Fox JE, MacDonald PE, Chimienti F, Dai FF, Wheeler MB. Investigation of transport mechanisms and regulation of intracellular Zn2+ in pancreatic alpha-cells. J Biol Chem. 2008;283:10184-10197. [PubMed] [DOI] |
| 61. | Kim BJ, Kim YH, Kim S, Kim JW, Koh JY, Oh SH, Lee MK, Kim KW, Lee MS. Zinc as a paracrine effector in pancreatic islet cell death. Diabetes. 2000;49:367-372. [PubMed] [DOI] |
| 62. | Garvey WT, Maianu L, Zhu JH, Brechtel-Hook G, Wallace P, Baron AD. Evidence for defects in the trafficking and translocation of GLUT4 glucose transporters in skeletal muscle as a cause of human insulin resistance. J Clin Invest. 1998;101:2377-2386. [PubMed] [DOI] |
| 63. | Keller SR. Role of the insulin-regulated aminopeptidase IRAP in insulin action and diabetes. Biol Pharm Bull. 2004;27:761-764. [PubMed] [DOI] |
| 64. | Keller SR, Scott HM, Mastick CC, Aebersold R, Lienhard GE. Cloning and characterization of a novel insulin-regulated membrane aminopeptidase from Glut4 vesicles. J Biol Chem. 1995;270:23612-23618. [PubMed] |
| 65. | Tang X, Shay NF. Zinc has an insulin-like effect on glucose transport mediated by phosphoinositol-3-kinase and Akt in 3T3-L1 fibroblasts and adipocytes. J Nutr. 2001;131:1414-1420. [PubMed] [DOI] |
| 66. | Dufner-Beattie J, Kuo YM, Gitschier J, Andrews GK. The adaptive response to dietary zinc in mice involves the differential cellular localization and zinc regulation of the zinc transporters ZIP4 and ZIP5. J Biol Chem. 2004;279:49082-49090. [PubMed] [DOI] |
| 67. | Chimienti F, Devergnas S, Favier A, Seve M. Identification and cloning of a beta-cell-specific zinc transporter, ZnT-8, localized into insulin secretory granules. Diabetes. 2004;53:2330-2337. [PubMed] [DOI] |
| 68. | Coffman FD, Dunn MF. Insulin-metal ion interactions: the binding of divalent cations to insulin hexamers and tetramers and the assembly of insulin hexamers. Biochemistry. 1988;27:6179-6187. [PubMed] [DOI] |
| 69. | Albiston AL, Yeatman HR, Pham V, Fuller SJ, Diwakarla S, Fernando RN, Chai SY. Distinct distribution of GLUT4 and insulin regulated aminopeptidase in the mouse kidney. Regul Pept. 2011;166:83-89. [PubMed] [DOI] |
| 70. | Hambidge KM, Miller LV, Westcott JE, Sheng X, Krebs NF. Zinc bioavailability and homeostasis. Am J Clin Nutr. 2010;91:1478S-1483S. [PubMed] [DOI] |
| 71. | Vehik K, Dabelea D. The changing epidemiology of type 1 diabetes: why is it going through the roof? Diabetes Metab Res Rev. 2011;27:3-13. [PubMed] [DOI] |
| 72. | Guo L, Lichten LA, Ryu MS, Liuzzi JP, Wang F, Cousins RJ. STAT5-glucocorticoid receptor interaction and MTF-1 regulate the expression of ZnT2 (Slc30a2) in pancreatic acinar cells. Proc Natl Acad Sci USA. 2010;107:2818-2823. [PubMed] [DOI] |
| 73. | Ellison LF. Measuring the effect of including multiple cancers in survival analyses using data from the Canadian Cancer Registry. Cancer Epidemiol. 2010;34:550-555. [PubMed] [DOI] |
| 74. | Zhang Y, Yang J, Cui X, Chen Y, Zhu VF, Hagan JP, Wang H, Yu X, Hodges SE, Fang J. A novel epigenetic CREB-miR-373 axis mediates ZIP4-induced pancreatic cancer growth. EMBO Mol Med. 2013;5:1322-1334. [PubMed] [DOI] |
| 75. | Zhang Y, Chen C, Yao Q, Li M. ZIP4 upregulates the expression of neuropilin-1, vascular endothelial growth factor, and matrix metalloproteases in pancreatic cancer cell lines and xenografts. Cancer Biol Ther. 2010;9:236-242. [PubMed] [DOI] |
| 76. | Cui X, Zhang Y, Yang J, Sun X, Hagan JP, Guha S, Li M. ZIP4 confers resistance to zinc deficiency-induced apoptosis in pancreatic cancer. Cell Cycle. 2014;13:1180-1186. [PubMed] [DOI] |
| 77. | Li D, Xie K, Wolff R, Abbruzzese JL. Pancreatic cancer. Lancet. 2004;363:1049-1057. [PubMed] [DOI] |
| 78. | Yu X, Zhang Y, Chen C, Yao Q, Li M. Targeted drug delivery in pancreatic cancer. Biochim Biophys Acta. 2010;1805:97-104. [PubMed] [DOI] |