修回日期: 2017-04-05
接受日期: 2017-04-17
在线出版日期: 2017-06-08
转运体是药物吸收、分布、代谢和排泄的重要决定因素, 在肝脏表达尤为广泛. 肝脏转运体可以摄取大多数内源性物质、营养物质和外源性物质进入肝脏, 在肝脏内经过一系列的代谢转化, 最终将其外排入胆汁, 并由胆汁排到肝外. 越来越多的证据表明, 肝脏疾病状态下转运体的表达和功能会发生改变, 影响药物在体内的处置过程, 进而增加药物相互作用的可能性, 同时加大了疾病药物治疗的难度. 本文从肝脏摄取型和外排型转运体两方面出发, 针对肝脏转运体表达和功能的变化对肝疾病的影响作一综述.
核心提要: 本文着重介绍了肝脏转运体表达和功能的变化对肝疾病的影响, 包括肝脏转运体的定义与分类、肝脏疾病状态下转运体的变化、肝脏转运体的变化对肝疾病的影响, 并阐述了其潜在的临床治疗前景.
引文著录: 王鹤鹏, 孙鹏远, 刘克辛. 肝脏转运体表达和功能的变化对肝疾病的影响. 世界华人消化杂志 2017; 25(16): 1427-1437
Revised: April 5, 2017
Accepted: April 17, 2017
Published online: June 8, 2017
Hepatic transporters are extensively expressed in the human body, especially in the liver. They are important determinants for drug absorption, distribution, metabolism and excretion. Most of endogenous substances, nutrients and exogenous substances can be transported into hepatocytes by hepatic uptake transporters. After metabolism, their metabolic products are excreted into bile. All the clinical relevance of hepatic transporters in drug disposition depends on their localization on the membrane of hepatocytes. There has been growing evidence regarding the importance of liver disease status on alterations in hepatic transporter proteins, which can increase the difficulty of drug therapy by influencing the process of drug disposition. This review focuses on uptake and efflux transporter proteins in the liver and summarizes the effect of alterations of hepatic transporter expression and function on liver disease.
- Citation: Wang HP, Sun PY, Liu KX. Effect of altered expression and function of hepatic transporters on liver disease. Shijie Huaren Xiaohua Zazhi 2017; 25(16): 1427-1437
- URL: https://www.wjgnet.com/1009-3079/full/v25/i16/1427.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i16.1427
肝脏是参与药物代谢和排泄的主要器官, 在其表面存在着许多转运体, 主要分为可溶性载体(solute carrier, SLC)和ATP-结合盒(ATP binding cassette, ABC)转运体家族[1]. SLC转运体家族主要是摄取型转运体, 通过协同运输和/或离子交换进行转运; ABC转运体家族主要是外排型转运体, 通过利用ATP水解释放出的能量逆浓度梯度进行转运[2]. 已有研究[3]表明, 转运体的活性会受到药物间相互作用和基因多态性的影响, 进而影响药物治疗的安全性和有效性. 除此之外, 一些其他因素也会影响转运体的活性, 如机体的病理状态、激素和环境等[3]. 因此, 近年来科研工作者非常重视转运体与疾病的相关性研究, 然而关于疾病状态对转运体的影响还没有被广泛地认知. 人类疾病均可以引起转运体表达和功能的显著变化, 这些变化会导致药物在体内药代动力学的改变, 甚至会导致在临床上联合用药过程中产生不良的药物相互作用, 后果不堪设想[4]. 因此, 研究肝脏疾病状态下转运体的变化, 阐明相关的作用机制, 有助于了解肝脏疾病的发病机制, 有利于为肝病治疗找到新的突破口, 从而为避免药物相互作用的发生, 选择更合理的药物进行治疗, 提高用药安全性和有效性提供必要的保障[5]. 本文就肝脏两大转运体家族的类型、肝脏疾病状态下转运体的变化和疾病进展的关系进行了文献综述, 旨在探索药物治疗的新靶点.
肝脏是人体内药物代谢的主要部位, 这些代谢药物的肝药酶主要包含Ⅰ相酶和Ⅱ相酶, 而在肝脏的表面则广泛存在着高表达的摄取型和外排型转运体[6]. 肝细胞血管侧膜上的转运体(摄取型转运体)可以将药物转运至肝细胞内, 再经肝药酶代谢, 最后经胆管侧的转运体(外排型转运体)从肝细胞内部清除药物及其代谢产物. 此过程维持了一个良好的浓度梯度以便新的药物再进入细胞. 如果没有转运体的参与, 药物代谢则会变得很低效. 由此可见, 转运体是药物吸收、分布、代谢和排泄的关键因素, 具有十分重要的药理学意义[3]. 根据有关体内、在体和体外实验研究以及临床资料[7]显示, 药物可能通过相互竞争来结合转运体, 从而导致在血浆和组织中药物浓度水平明显的变化, 甚至可能会产生不良反应.
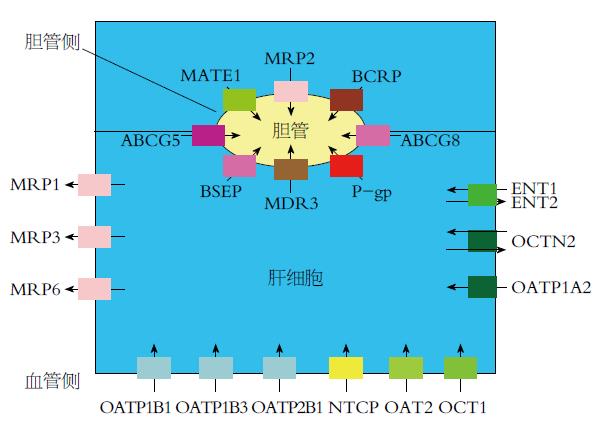
在肝脏中, 许多内源性和外源性物质的摄取都是由血管侧摄取型转运体介导的, 主要包括有机阴离子转运多肽(organic anion-transporting polypeptide, OATP)、钠离子-牛磺胆酸共转运蛋白(Na+-taurocholate cotransporting polypeptide, NTCP)、有机阴离子转运体(organic anion transporter, OAT)和有机阳离子转运体(organic cation transporter, OCT), 这些都属于SLC转运体家族(图1).
1.1.1 OATP: OATP是膜转运蛋白超家族中一类重要的转运体, 能够介导多种内源性化合物、多种药物和其他外源性物质摄取进入肝脏, 包括胆汁酸、类固醇结合物、甲状腺激素、阴离子肽、羟甲基戊二酰辅酶A还原酶抑制剂(普伐他汀、阿托伐他汀)和强心苷类药物(地高辛)[8]. 目前发现, 人类OATP家族由OATP1A2、1B1、1B3、1C1、2A1、2B1、3A1、4A1、4C1、5A1和6A1这11个成员组成, 其中, OATP1B1、OATP1A2、OATP1B3和OATP2B1在药物处置过程中主要发挥作用[9]. OATP1A2主要位于十二指肠膜和血脑屏障表面, 其功能促进底物吸收, 从而进入血液循环和中枢神经系统, 而OATP1B1、OATP1B3和OATP2B1的功能是将其底物由血液摄取进入肝细胞, 这一步骤是药物代谢和消除的重要过程[10].
1.1.2 NTCP: NTCP位于肝细胞的血管侧膜, 主要介导胆汁酸和胆盐进入肝细胞[11], NTCP从肝细胞转运出两个钠离子, 同时吸收一个胆盐分子进入肝细胞[12]. 在大鼠肝脏中, NTCP的胆汁盐转运功能占主导地位[13]. 此外, NTCP还可以转运雌酮-3-硫酸盐、磺溴酞钠、硫酸脱氢表雄酮和甲状腺激素T3和T4等[14].
1.1.3 OAT: OAT2主要在肝脏表达, 而OAT1和OAT3主要表达于肾脏[3]. 人的OAT2(SLC22A7)主要介导对氨基马尿酸、水杨酸、乙酰水杨酸、前列腺素E、α-酮戊二酸盐和甲氨蝶呤的转运[15].
1.1.4 OCT: 人体OCT1主要在肝脏表达, 而OCT2和OCT3都主要表达在肾脏. OCT1位于肝细胞的血管侧膜, 在肝细胞对有机阳离子的摄取起重要作用, 包括四甲基铵、维生素B1、胆碱、多巴胺、5-羟色胺、组胺和肾上腺素等[16].
ABC转运体主要介导了药物及其代谢产物在肝细胞中的外排转运, ABC转运体主要包括多药耐药相关蛋白(multidrug resistance-associated proteins, MRPs)、胆盐输出泵(bile salt export pump, BSEP)、乳腺癌耐药蛋白(breast cancer resistance protein, BCRP)和P-糖蛋白(P-glycoprotein, P-gp)(图1).
1.2.1 MRPs: MRPs在很多组织和器官中有所表达, 如血脑屏障、胎盘、肝脏、肾脏和肠道. MRP家族已经确认有9种亚型, 其中在肝脏表达的有MRP1、MRP2、MRP3和MRP6[3]. 然而在转运药物及其代谢物至胆管的过程中, 只有MRP2起主要作用. MRP1和MRP3在MRP2底物运输被抑制的情况下才会起作用, 作为一个备用系统[17]. MRP2为毛细血管多专属性有机阴离子转运体(canalicular multispetific organic anion transporter, cMOAT), 他对于许多阴离子化合物和共轭代谢物经胆汁排泄起着重要作用. MRP2能转运葡萄糖醛酸结合物、硫酸结合物、谷胱甘肽结合物和非共轭结合的有机阴离子, 如普伐他汀、甲氨蝶呤、伊立替康、HIV蛋白酶抑制剂以及喹诺酮类化合物等. 公认的MRP2的抑制剂为丙磺舒和MK571[18].
1.2.2 BSEP: BSEP也是一个胆管侧膜转运体, 主要表达在肝腺泡[12]. BSEP与P-gp具有同源性(接近49%-50%的氨基酸序列相同), 同时可导致大量细胞株产生多药耐药性. BSEP的功能主要是从肝细胞转运胆盐至胆汁, 但此种转运功能容易受到抑制, 从而会诱导肝内胆汁淤积, 进而影响其他转运体发挥作用[19].
1.2.3 BCRP: BCRP最初在人体乳腺癌细胞系中发现, 其参与了癌细胞对米托蒽醌, 阿霉素和柔红霉素产生耐药性的过程, 主要表达在肝脏、肾脏、肠、血脑屏障、肺和胎盘[20]. BCRP位于肝细胞胆管侧和肾小管上皮细胞, 能识别多种抗癌药物如甲氨喋呤、多柔比星等. 其底物专属性与P-gp、MRP2有部分重叠, 抑制剂有新生霉素和GF120918等[18].
1.2.4 P-gp: P-gp利用ATP分解产生的能量将各种抗癌药物从细胞内排出去, 是癌细胞对抗癌药物产生多药耐药性的主要原因之一. P-gp的底物范围很广泛, 主要为脂溶性较高的阳离子或中性药物, 包括抗癌药(多柔比星)、抗生素(利福平)、免疫抑制剂(环孢素A)、HIV-蛋白酶抑制剂(茚地那韦)、β-肾上腺素受体拮抗剂、钙通道阻滞剂(维拉帕米)、类固醇激素(地塞米松)、抗真菌药(酮康唑)、心血管药物(地高辛、奎尼丁)和罗丹明123等. 经典的抑制剂有维拉帕米、环孢素、奎尼丁等. 公认的诱导剂有利福平、地塞米松等[18,21].
关于肝脏疾病状态下摄取型和外排型转运体的变化, 至今还没有一个全面的研究来阐明其中的联系. 然而在一些特定条件下, 科研工作者已经考察了人类和啮齿类动物体内某些肝脏疾病状态下转运体的表达和功能的变化, 包括胆汁淤积、原发性胆汁性肝硬化(primary biliary cirrhosis, PBC)、非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)、病毒性肝炎(乙型肝炎和丙型肝炎)、肝细胞癌(hepatocellular carcinoma, HCC)和肝移植. 一些研究[4]表明, 药物转运会由于肝脏疾病的影响而被中断, 进而导致药物不良反应. 胆汁排泄减少是改变药物配置和药代动力学的一个主要机制. 据报道[22], 在大鼠的NASH模型中, 甲氨蝶呤引起肝脏和其他器官的不良反应继发于胆管和基底膜侧外排型转运体表达的减少. 然而, 在小鼠NASH模型中, Mrp3和Mrp4的上调与对乙酰氨基酚葡糖苷酸的尿清除增加有关[23]. 这些结果与一组在患有NAFLD的儿童体内发现的结果一致[24]. 在大鼠肝外胆汁淤积模型中, Mrp3和尿苷5'-二磷酸葡萄糖醛酸转移酶2家族可诱导多肽蛋白b1的表达, 从而增加吗啡-3-葡糖苷酸的外排进入体循环[25]. 在炔雌醇造成的大鼠胆汁淤积模型中, 二甲双胍的肝脏摄取减少继发于OCT1蛋白表达的减少[26]. 以上这些研究资料[27]表明, 在患有肝脏疾病的患者体内, 转运体表达和功能的改变对药物处置及毒性产生会有很大的影响. 表1总结了肝脏疾病状态下, 人和啮齿类动物体内肝脏摄取型和外排型转运体的变化.
| 转运体 | 基因型 | 研究种属 | 肝脏疾病状态下的改变 | 参考文献 |
| OATP1B1/OATP2/OATP-C | SLCO1B1 | 人 | 胆汁淤积状态下, mRNA表达减少; | [29] |
| HCV纤维化加重期, mRNA表达明显减少; | [40] | |||
| HCV的癌旁组织中, mRNA表达明显减少; | [41] | |||
| OATP1B3 | SLCO1B3 | 人 | HCV的癌旁组织中, mRNA表达明显减少; | [41] |
| HCC促瘤增长现象下, mRNA和蛋白表达增加; | [48] | |||
| OATP2B1/OATPB/Oatp2b1 | SLCO2B1/Slco2b1 | 人, 大鼠 | HCV纤维化加重期, mRNA表达明显减少; | [40] |
| Oatp1a1/Oatp1 | Slco1a1 | 大鼠, 小鼠 | 胆汁淤积状态下, mRNA表达减少; | [30] |
| Oatp1a4/Oatp2 | Slco1a4 | 大鼠, 小鼠 | 胆汁淤积状态下, mRNA表达减少; | [30] |
| Oatp1b2/Oatp4 | Slco1b2 | 大鼠, 小鼠 | 胆汁淤积状态下, mRNA表达减少; | [30] |
| OAT2/Oat2 | SLC22A7/Slc22a7 | 人, 大鼠 | 胆汁淤积状态下, mRNA表达不变; | [30] |
| NASH状态下, 大鼠体内mRNA表达减少; | [39] | |||
| HCV纤维化加重期, mRNA表达明显减少; | [40] | |||
| OAT3/Oat3 | SLC22A8/Slc22a8 | 大鼠 | 胆汁淤积状态下, mRNA表达减少; | [30] |
| NASH状态下, 大鼠体内mRNA表达减少; | [39] | |||
| NTCP/Ntcp | SLC10A1/Slc10a1 | 人, 大鼠 | 胆汁淤积状态下, mRNA表达减少; | [29] |
| NASH状态下, 大鼠体内mRNA表达减少; | [39] | |||
| HCV纤维化加重期, mRNA表达明显减少; | [40] | |||
| HCV肝纤维化第1阶段, mRNA表达明显增加; | [43] | |||
| 人体肝移植后, mRNA表达增加; | [53] | |||
| 大鼠体内缺血再灌注后, mRNA表达减少; | [55] | |||
| OCT1/Oct1 | SLC22A1/Slc22a1 | 人, 大鼠 | 胆汁淤积状态下, mRNA表达减少; | [30] |
| HCV纤维化加重期, mRNA表达明显减少; | [40] | |||
| HCV肝纤维化第1阶段, mRNA表达明显增加; | [41] | |||
| HCV癌旁组织中, mRNA表达明显减少; | [41] | |||
| HCC状态下, 蛋白表达减少; | [47] | |||
| OCT3 | SLC22A3 | 人 | HCC状态下, 蛋白表达减少; | [47] |
| MRP1/Mrp1 | ABCC1/ | 人, 大鼠, 小鼠 | NASH状态下, mRNA和蛋白表达增加; | [38] |
| Abcc1 | HCV状态下, mRNA表达则不一致; | [41,44] | ||
| HCC的肿瘤组织和肿瘤周围组织中, mRNA表达均明显增加; | [49] | |||
| HCC状态下, mRNA表达增加; | [50] | |||
| MRP2/Mrp2 | ABCC2/ | 人, 大鼠, 小鼠 | PBC III期, 蛋白表达增加; | [31] |
| Abcc2 | HCV状态下, mRNA表达明显减少; | [42] | ||
| HCV纤维化加重期, mRNA表达明显减少; | [40] | |||
| HCV的癌旁组织中, mRNA表达明显减少; | [41] | |||
| HCC的肿瘤组织和肿瘤周围组织中, mRNA表达均明显增加; | [49] | |||
| HCC状态下, 蛋白表达不变; | [47] | |||
| HCC状态下, mRNA表达增加; | [50] | |||
| 大鼠体内缺血再灌注后, mRNA和蛋白表达减少; | [56] | |||
| MRP3/Mrp3 | ABCC3/ | 人, 大鼠, 小鼠 | NASH状态下, mRNA和蛋白表达增加; | [38] |
| Abcc3 | HCV状态下, mRNA表达不一致; | [41,44] | ||
| HCC的肿瘤组织和肿瘤周围组织中, mRNA表达均明显增加; | [49] | |||
| HCC状态下, mRNA表达增加; | [50] | |||
| MRP4/Mrp4 | ABCC4/ | 人, 大鼠, 小鼠 | NASH状态下, mRNA和蛋白表达增加; | [38] |
| Abcc4 | HCV状态下, mRNA表达明显增加; | [41] | ||
| HCV癌旁组织中, mRNA表达明显增加; | [41] | |||
| HCC的肿瘤组织和肿瘤周围组织中, mRNA表达均明显增加; | [49] | |||
| HCC状态下, mRNA表达增加; | [50] | |||
| MRP5 | ABCC5 | 人 | NASH状态下, mRNA和蛋白表达增加; | [38] |
| HCC状态下, mRNA表达增加; | [50] | |||
| MRP6 | ABCC6 | 人 | NASH状态下, mRNA表达减少, 蛋白表达增加; | [38] |
| MRP7 | MRP7 | 人 | HCC状态下, mRNA表达增加; | [50] |
| MRP8 | MRP8 | 人 | HCC状态下, mRNA表达增加; | [50] |
| MRP9 | MRP9 | 人 | HCC状态下, mRNA表达增加; | [50] |
| MDR1/P-gp Mdr1a/1b | MDR1/P-gp | 人, 小鼠 | PBC III期和IV期, 蛋白表达增加; | [31] |
| Mdr1a/1b | PBC III期, mRNA表达略有增加; | [31] | ||
| NASH状态下, mRNA和蛋白表达增加; | [38] | |||
| HCV状态下, mRNA表达不一致; | [41,44] | |||
| HCC的肿瘤组织和肿瘤周围组织中, mRNA表达均明显增加; | [49] | |||
| HCC状态下, 蛋白表达减少; | [47] | |||
| HCC状态下, mRNA表达增加; | [50] | |||
| MDR6 | MDR6 | 人 | HCC状态下, mRNA表达增加; | [5] |
| BCRP/Bcrp | ABCG2/ | NASH状态下, mRNA和蛋白表达增加; | [38] | |
| Abcg2 | HCV状态下, mRNA表达明显减少; | [42] | ||
| HCV纤维化发展阶段, mRNA表达不变; | [40] | |||
| HCV的癌旁组织中, mRNA表达明显减少; | [41] | |||
| HCC状态下, 蛋白表达增加; | [47] | |||
| BSEP/Bsep | ABCB11/ | 人, 大鼠 | 胆汁淤积状态下, mRNA表达减少; | [29] |
| Abcb11 | PBC Ⅲ期, mRNA和蛋白表达增加; | [31] | ||
| HCV纤维化加重期, mRNA表达明显减少; | [40] | |||
| 人体肝移植后, mRNA表达增加; | [53] | |||
| 大鼠体内缺血再灌注后, mRNA表达减少; | [55] | |||
| BSEP/Bsep | ABCB11/ | 人, 大鼠 | 胆汁淤积状态下, mRNA表达减少; | [29] |
| Abcb11 | PBC Ⅲ期, mRNA和蛋白表达增加; | [31] | ||
| HCV纤维化加重期, mRNA表达明显减少; | [40] | |||
| 人体肝移植后, mRNA表达增加; | [53] | |||
| 大鼠体内缺血再灌注后, mRNA表达减少; | [55] | |||
| ENT1 | SLC29A1 | 人 | 人体肝移植后, mRNA表达减少; | [54] |
| ENT2 | SLC29A2 | 人 | 人体肝移植后, mRNA和蛋白表达减少; | [54] |
| RLI1 | ABCE1 | 人 | HCC状态下, mRNA表达增加; | [50] |
| MATE1 | SLC47A1 | 人 | HCV的癌旁组织中, mRNA表达明显减少; | [41] |
胆汁淤积的原因一般可分为两种: 一种是发生在肝内的如急性肝炎、酒精性肝病和原发性胆汁性肝硬化等; 而另一种是发生在肝外的如胆管结石、胆管缩小、胆管癌或胰腺癌等. 胆汁淤积使胆汁流量减少, 导致胆汁酸在肝内蓄积而产生毒性[28]. Zollner等[29]在经皮人肝活检标本中研究了肝胆转运体的表达. 与空白组相比, 胆汁淤积炎症患者体内SLC10A1(NTCP)、SLCO1B1和ABCB11的mRNA水平明显降低. 在啮齿类动物的胆汁淤积模型中, 科研工作者对摄取型转运体(Oatps、Oats和Octs)也进行了考察. 结果表明[30], Slco1a1、Slco1a4、Slco1b2、Slc22a1和Slc22a8的mRNA表达降低, 而Slc22a7的mRNA表达不变. Zollner等[31]对PBC Ⅲ期和Ⅳ期患者的肝胆转运体表达进行了研究. 在PBC Ⅲ期, BSEP和MRP2的蛋白表达和ABCB11的mRNA表达都明显增加. MDR1和MDR3的蛋白表达在PBC Ⅲ期和Ⅳ期都增加. 在PBC Ⅲ期, ABCB1的mRNA表达略有增加, 而ABCB4增加明显, 但是在PBC Ⅳ期, ABCB4的mRNA表达仅有轻度增加. 由此可见, 在胆汁淤积的疾病状态下, 摄取型转运体表达降低而外排型转运体表达增强. 这些资料有助于研究者了解胆汁淤积引起的肝脏转运体的变化, 通过利用胆汁淤积性肝病导致的转运体表达的变化有助于改善胆汁淤积性肝损伤. 因此, 进一步增强胆管侧外排型转运体对胆汁盐的排泄可以改善胆汁酸在肝脏内的蓄积, 使肝损伤状态得到缓解.
NASH是NAFLD中最严重的一种形式, 在美国所影响的人群数量占全美总人口的三分之一[32]. NASH的特点是肝细胞损伤、肝脏慢性炎症和纤维化[33,34]. 据报道[35], 在患有NASH的人体内, 肝脏基因的整体表达都会发生改变. Clarke等[36]与Hardwick等[37]对NASH引起药物转运体的改变进行了一系列深入的研究. 研究人员[35]发现, 在NASH患者体内共有162个摄取型转运体的基因发生了改变. 另一项研究[38]采用成人肝活检组织样本考察NAFLD的病情发展对外排型转运体表达的影响, 研究人员发现, 在病情不断恶化的NASH患者体内, 外排型转运体(ABCC1、ABCC4、ABCC5、ABCC3、ABCB1和ABCG2)的基因和蛋白表达都明显上调. 相比之下, ABCC6的mRNA表达减少, 而蛋白表达与正常组样本相比有所增加. 有资料[39]显示, 与空白组相比, 在高脂饮食和蛋氨酸胆碱缺乏饮食的大鼠肝脏中Oat2/Slc22a7、Oat3/Slc22a8和Ntcp/Slc10a1的mRNA表达明显减少. 整体来看, 以上这些资料可以证明在人体和啮齿类动物处于NASH的疾病状态下, 肝脏摄取型转运体的表达和功能降低, 而外排型转运体的表达和功能增强. 通过研究转运体的变化, 有助于进一步分析NASH的发病机制, 进而改善其损伤状态.
丙型肝炎病毒(hepatitis C virus, HCV)感染可以导致肝纤维化、严重的肝硬化以及肝脏的癌变[40]. 据报道[41], 在HCV患者体内肝脏转运体的表达发生了明显的改变. 在HCV样本中, 与空白肝脏样本相比, ABCB1、ABCC3和ABCC4的基因表达有明显的增加. 相比之下, ABCG2和ABCC2的基因表达则明显减少[42]. 另一项研究报告[40]显示, 在伴有肝纤维化第1阶段与第3阶段的HCV患者体内, ABCB11、ABCB4、ABCC2、SLC10A1、SLC22A7和SLCO1B1的基因表达明显降低. 除此之外, 与肝纤维化第1阶段患者的样本相比, 在肝纤维化第2阶段和第3阶段的状态下, SLCO2B1和SLC22A1的表达有明显的减少. 而ABCG2、ABCB1和ABCC3的表达在肝纤维化各期状态下均无明显的改变. Nakai等[43]发现, 与未患有HCV的样本相比, 在肝纤维化第1阶段SLC10A1和SLC22A1的mRNA表达明显增加. 而在严重的肝纤维化阶段, SLC10A1、SLCO1B1和SLC22A1的mRNA表达则有所降低. Ogasawara等[41]在癌旁肝组织中考察了17种药物转运体的mRNA表达, 与正常组织相比患有HCV的组织中3种转运体均显著上调: ABCB1、ABCC1和ABCC4; 6个转运体显著下调: SLC22A1、SLCO1B1、SLCO1B3、SLC47A1、ABCC2和ABCG2. Hinoshita等[44]在肝肿瘤患者的癌旁组织样本中考察了P-gp/ABCB1、MDR3/ABCB4、MRP1/ABCC1、MRP2/ABCC2和MRP3/ABCC3的基因表达. 在HCV感染与未感染的样本中, 这些基因的表达普遍较低. Ros等[45]报道与健康的志愿者相比, 在HCV感染患者的肝脏中, ABCB1和ABCC3的mRNA表达均有增加. 这些发现证实了在病毒性肝炎和HCV引起的肝硬化患者体内的肝脏中, 转运体的表达会发生改变, 但是改变的结果并不一致, 这与其所处的病情发展阶段密切相关, 需要通过更多的研究来进一步说明.
肝细胞癌的药物治疗受限于药物的耐药性和不良反应, 导致其治疗效果很不理想, 而这其中一部分原因就是转运体介导的药物转运所造成的. HCC中肿瘤细胞的耐药机制是药物摄取减少, 而外排增加[46]. 据报道[47], 在日本患者人群中(n = 24)发现, 与非肿瘤样本相比, HCC样本中BCRP的蛋白表达明显增加, 而OCT1、OCT3和MDR1的蛋白表达均减少, 且MRP2并没有明显的变化. Ueno等[48]在来自HCC患者的冰冻组织中发现, HCC样本中SLCO1B3/OATP1B3表达上调, 并认为这种现象与促瘤增长密切相关. 除此之外, OATP1B3的表达增加还可能与Wnt/β-catenin信号通路密不可分, 这个通路可以调节干细胞的多能性以及在生命活动过程中调节细胞的存活率[48]. 在HCC患者和正常患者的肝脏中, 通过考察转运体的基因表达来评估潜在的化疗敏感性[49]. 与正常肝组织相比, HCC的肿瘤性和非肿瘤性组织中的ABCC1、ABCC2和ABCB1的mRNA表达均显著增加, 而ABCC3和ABCB4的表达并没有明显改变. Borel等[50]对来自HCC患者的冰冻样本中15个ABC转运体的表达进行了考察. 研究者发现, 与健康肝组织相比, 在HCC患者中有12种转运体的表达均上调(ABCA2、ABCB1、ABCB6、ABCC1、ABCC2、ABCC3、ABCC4、ABCC5、ABCC10、ABCC11、ABCC12和ABCE1). 整体看来, 在HCC疾病状态下, 外排型转运体的表达普遍增加, 而这恰恰就是导致肿瘤细胞产生耐药现象的主要原因, 通过利用HCC导致的转运体表达的变化可以进一步来改善其耐药现象. 尽管只有一些研究表明在HCC的肝结节和肿瘤中, ABCC3/Abcc3的mRNA表达增加[50-52], 但最近关于ABCC3在癌症的产生、促进和发展过程中的作用已经被提出[51]. 总之, 在HCC组织与健康肝脏组织中转运体表达的差异已经被证实. MRP3/ABCC3可能是一种潜在的治疗HCC的标志物.
目前, 关于转运体蛋白表达和功能在肝移植过程中会如何改变的研究资料有限. 由Geuken等[53]进行的一项研究证实, 在人体进行肝脏移植后, 可以增加胆盐的分泌和胆汁转运蛋白(NTCP/SLC10A1和BSEP/ABCB11)在肝脏的表达. Zimmerman等[54]在原位肝移植过程中考察了人体活检标本中的平衡型核苷转运蛋白的表达情况. ENT1/SLC29A1和ENT2/SLC29A2的转录水平均有所减少, 同时肝脏的ENT2蛋白表达水平也随之减少. 有一项研究对大鼠肝动脉缺血模型进行了考察, 据资料[55]显示, 与假手术对照组相比, Slc10a1和Abcb11的mRNA表达减少, 而囊性纤维化跨膜传导调节转运体的表达有所增加. 另外一项研究[56]在大鼠的肝脏和肾脏中发现, 肝缺血再灌注能减少Mrp2/Abcc2蛋白和mRNA的表达, 并且Mrp2蛋白表达下调比mRNA更明显, 提示存在一个转录后的调节作用. 这些发现可以证实肝移植会引起肝脏转运体表达的改变, 但其改变结果不一致, 其中以Mrp2/Abcc2的变化最为显著. 而Mrp2/Abcc2作为一个重要的外排型转运体, 在其他动物模型中也证明了其蛋白和基因表达均有所减少, 如肝毒性模型和胆汁淤积模型等, 由此会导致经Mrp2转运的治疗药物在药物处置过程中可能会发生很大的变化, 甚至需要通过调整给药剂量来维持原有的水平. 因此, 在人体肝移植过程中要综合评估转运蛋白的表达水平和功能, 需要提供一个关于对药物的处置和反应是如何改变的, 以及这些改变可能对治疗反应和结果有何影响的理论依据.
摄取型和外排型转运体功能下降会引发许多肝脏疾病, 如Dubin-Johnson综合征、肝内胆汁淤积和肝癌等. 研究[57]表明, 肝内胆汁淤积主要是摄取型和/或外排型转运体表达减少, 导致肝细胞胆酸摄取和/或排泄胆汁过程障碍, 使胆盐和胆红素等在血液中潴留, 血清中胆盐和胆红素含量过高所致. MRP2转运体表达先天缺陷会引发Dubin-Johnson综合征[58]. BSEP功能缺陷可导致进行性家族性肝内胆汁淤积(progressive familial intrahepatic cholestasis, PFIC)2. 此外, BSEP功能缺陷可显著提高肝脏恶性肿瘤的发病率, 有研究[59]表明, 15%的BSEP功能缺陷患者可发展为肝癌或胆管上皮癌. MDR3基因缺陷可引发PFIC3, 肝组织表现出肝纤维化转向肝硬化, 常见于婴幼儿和妊娠妇女[60]. P-gp和MRP2主要负责外排胆酸盐和胆红素等成分至胆汁, 能够避免因胆汁淤积而引发的肝毒性, 具有保护作用. BSEP负责胆酸盐的转运, BCRP负责胆固醇的转运, 这些转运体的功能下降或缺失将导致炎性肝损伤甚至肝癌[59]. 种种迹象表明, 不仅肝脏疾病会引起转运体表达和功能发生变化, 转运体基因发生突变引起的功能下降或缺失与肝脏多种疾病的发生也休戚相关. 二者的关系相辅相成, 通过研究这种密切的关系, 有助于了解肝脏疾病的发病机制, 开拓治疗思路, 从而更广泛地应用于临床治疗.
随着对肝脏转运体进一步的认识, 转运体与肝脏疾病的关系逐渐被阐明, 而如何充分利用转运体为靶点, 有效地治疗肝脏疾病是一个凾待解决的问题. 目前已经证实, 药物转运体的表达可受多种因素的影响, 包括疾病病理学、基因多态性和药物相互作用. 本文着重强调了在某些重要的治疗领域, 转运蛋白对药物的反应是至关重要的. 除此之外, 本文也总结了在肝脏疾病状态下转运体的表达和功能的变化以及肝脏转运体的变化对肝脏疾病的影响. 文章涉及了很多介导细胞摄取和外排的转运体并且在各种肝脏疾病状态下都有一定程度的特征改变. 此外, 肝脏转运体基因突变引起其功能下降或缺失也与肝脏疾病的发生密不可分. 由此可以看出, 研究肝脏转运体可以增强对多种肝脏疾病发病机制的理解和认知, 有助于发现肝疾病治疗的新靶点, 进而利用转运体的功能选择性改善药物向靶器官的分布, 从而提高药物治疗的安全性和有效性. 因此转运体的表达状态可以作为疾病预后以及药物治疗效果的一个评价指标. 同时, 转运体的改变或者功能受到抑制会影响药物在体内的药代动力学, 降低药物的治疗作用或者增加药物的不良反应. 由此可见, 更好地了解肝脏疾病与药物转运体之间的关系是非常重要的, 可以有效地优化治疗方案并且避免不必要的药物相互作用. 随着定量蛋白组学、体内体外外推法和药代动力学模型的开发与实施, 将有助于增进了解药物转运体如何通过其表达和功能的改变来影响药物的药代动力学和治疗反应. 目前来看, 虽然应用于临床治疗有一定的难度, 但这至少为肝脏疾病的治疗带来了新的希望. 随着肝脏转运体与肝脏疾病关系研究的深入, 必将引领肝病治疗的新趋势, 具有划时代的意义. 相信在不久的将来, 随着肝脏转运体与肝病发病机制的不断阐明, 转运体与生理指标、病理状态数据库建设的进一步充实, 对人体各个器官中转运体的研究必将掀起新一轮的研究热潮, 进而发挥其对临床疾病诊断、治疗的指导意义, 造福更多的患者.
人类疾病能引起转运体表达和功能的显著变化, 导致药物在体内药代动力学的改变, 甚至产生不良的药物相互作用. 因此, 近年来科研工作者非常重视转运体与疾病的相关性研究, 然而关于疾病状态对转运体的影响还没有被广泛地认知.
通过利用转运体为靶点对肝脏疾病进行有效的治疗是目前转运体研究的热点, 如何以转运体的表达状态作为疾病预后以及药物治疗效果的评价指标将成为肝病治疗的新趋势.
Cherrington等发现, 在非酒精性脂肪性肝炎患者体内共有162个摄取型转运体的基因发生了改变. 此后陆续在其他肝脏疾病状态下也发现了转运体的改变, 这些资料有助于了解肝脏疾病引起的肝脏转运体的变化, 采取更有效的方法来改善肝损伤的状况.
本文简要概述了肝脏转运体的定义与分类, 在此基础上详细阐述了转运体表达和功能的改变与肝脏疾病之间的联系, 同时结合临床现状, 提出以转运体的表达状态作为肝脏疾病预后及药物治疗效果的评价指标, 对临床诊疗具有重要的指导意义.
利用转运体为靶点, 治疗肝脏疾病, 以转运体的表达状态作为肝脏疾病预后及药物治疗效果的评价指标, 为临床肝病治疗提供了新思路.
转运体: 是存在于细胞膜上的蛋白质, 其主要功能是承担物质转运, 维持细胞内环境.
李胜, 研究员, 山东省肿瘤防治研究院肝胆外科; 邱伟华, 主任医师, 上海交通大学医学院附属瑞金医院普外科; 徐迅迪, 教授, 中南大学湘雅二医院肝胆胰外科; 张丰深, 主任医师, 中国人民解放军第三二四医院肝胆外科
本文选题较好, 内容全面、有层次, 逻辑性与整体性把握较好, 并且为肝病的治疗提供新的思路, 具有较好的应用价值.
手稿来源: 邀请约稿
学科分类: 胃肠病学和肝病学
手稿来源地: 辽宁省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:李瑞芳
| 1. | Döring B, Petzinger E. Phase 0 and phase III transport in various organs: combined concept of phases in xenobiotic transport and metabolism. Drug Metab Rev. 2014;46:261-282. [PubMed] [DOI] |
| 2. | Lin L, Yee SW, Kim RB, Giacomini KM. SLC transporters as therapeutic targets: emerging opportunities. Nat Rev Drug Discov. 2015;14:543-560. [PubMed] [DOI] |
| 3. | Nigam SK. What do drug transporters really do? Nat Rev Drug Discov. 2015;14:29-44. [PubMed] [DOI] |
| 4. | Gandhi A, Moorthy B, Ghose R. Drug disposition in pathophysiological conditions. Curr Drug Metab. 2012;13:1327-1344. [PubMed] [DOI] |
| 6. | Riley RJ, Foley SA, Barton P, Soars MG, Williamson B. Hepatic drug transporters: the journey so far. Expert Opin Drug Metab Toxicol. 2016;12:201-216. [PubMed] [DOI] |
| 7. | Zamek-Gliszczynski MJ, Lee CA, Poirier A, Bentz J, Chu X, Ellens H, Ishikawa T, Jamei M, Kalvass JC, Nagar S. ITC recommendations for transporter kinetic parameter estimation and translational modeling of transport-mediated PK and DDIs in humans. Clin Pharmacol Ther. 2013;94:64-79. [PubMed] [DOI] |
| 8. | Giacomini KM, Huang SM, Tweedie DJ, Benet LZ, Brouwer KL, Chu X, Dahlin A, Evers R, Fischer V, Hillgren KM. Membrane transporters in drug development. Nat Rev Drug Discov. 2010;9:215-236. [PubMed] [DOI] |
| 9. | Kalliokoski A, Niemi M. Impact of OATP transporters on pharmacokinetics. Br J Pharmacol. 2009;158:693-705. [PubMed] [DOI] |
| 10. | Niemi M. Role of OATP transporters in the disposition of drugs. Pharmacogenomics. 2007;8:787-802. [PubMed] [DOI] |
| 11. | More VR, Wen X, Thomas PE, Aleksunes LM, Slitt AL. Severe diabetes and leptin resistance cause differential hepatic and renal transporter expression in mice. Comp Hepatol. 2012;11:1. [PubMed] [DOI] |
| 12. | Stieger B. The role of the sodium-taurocholate cotransporting polypeptide (NTCP) and of the bile salt export pump (BSEP) in physiology and pathophysiology of bile formation. Handb Exp Pharmacol. 2011;205-259. [PubMed] [DOI] |
| 13. | Fattah S, Augustijns P, Annaert P. Age-dependent activity of the uptake transporters Ntcp and Oatp1b2 in male rat hepatocytes: from birth till adulthood. Drug Metab Dispos. 2015;43:1-8. [PubMed] [DOI] |
| 14. | Visser WE, Wong WS, van Mullem AA, Friesema EC, Geyer J, Visser TJ. Study of the transport of thyroid hormone by transporters of the SLC10 family. Mol Cell Endocrinol. 2010;315:138-145. [PubMed] [DOI] |
| 15. | Parvez MM, Kaisar N, Shin HJ, Jung JA, Shin JG. Inhibitory Interaction Potential of 22 Antituberculosis Drugs on Organic Anion and Cation Transporters of the SLC22A Family. Antimicrob Agents Chemother. 2016;60:6558-6567. [PubMed] [DOI] |
| 16. | Boxberger KH, Hagenbuch B, Lampe JN. Common drugs inhibit human organic cation transporter 1 (OCT1)-mediated neurotransmitter uptake. Drug Metab Dispos. 2014;42:990-995. [PubMed] [DOI] |
| 17. | Faber KN, Müller M, Jansen PL. Drug transport proteins in the liver. Adv Drug Deliv Rev. 2003;55:107-124. [PubMed] [DOI] |
| 18. | Marquez B, Van Bambeke F. ABC multidrug transporters: target for modulation of drug pharmacokinetics and drug-drug interactions. Curr Drug Targets. 2011;12:600-620. [PubMed] [DOI] |
| 19. | Kullak-Ublick GA, Stieger B, Hagenbuch B, Meier PJ. Hepatic transport of bile salts. Semin Liver Dis. 2000;20:273-292. [PubMed] [DOI] |
| 20. | Huang XC, Xiao X, Zhang YK, Talele TT, Salim AA, Chen ZS, Capon RJ. Lamellarin O, a pyrrole alkaloid from an Australian marine sponge, Ianthella sp., reverses BCRP mediated drug resistance in cancer cells. Mar Drugs. 2014;12:3818-3837. [PubMed] [DOI] |
| 21. | Yigitaslan S, Erol K, Cengelli C. The Effect of P-Glycoprotein Inhibition and Activation on the Absorption and Serum Levels of Cyclosporine and Tacrolimus in Rats. Adv Clin Exp Med. 2016;25:237-242. [PubMed] [DOI] |
| 22. | Hardwick RN, Clarke JD, Lake AD, Canet MJ, Anumol T, Street SM, Merrell MD, Goedken MJ, Snyder SA, Cherrington NJ. Increased susceptibility to methotrexate-induced toxicity in nonalcoholic steatohepatitis. Toxicol Sci. 2014;142:45-55. [PubMed] [DOI] |
| 23. | Lickteig AJ, Fisher CD, Augustine LM, Aleksunes LM, Besselsen DG, Slitt AL, Manautou JE, Cherrington NJ. Efflux transporter expression and acetaminophen metabolite excretion are altered in rodent models of nonalcoholic fatty liver disease. Drug Metab Dispos. 2007;35:1970-1978. [PubMed] [DOI] |
| 24. | Barshop NJ, Capparelli EV, Sirlin CB, Schwimmer JB, Lavine JE. Acetaminophen pharmacokinetics in children with nonalcoholic fatty liver disease. J Pediatr Gastroenterol Nutr. 2011;52:198-202. [PubMed] [DOI] |
| 25. | Hasegawa Y, Kishimoto S, Takahashi H, Inotsume N, Takeuchi Y, Fukushima S. Altered expression of MRP2, MRP3 and UGT2B1 in the liver affects the disposition of morphine and its glucuronide conjugate in a rat model of cholestasis. J Pharm Pharmacol. 2009;61:1205-1210. [PubMed] [DOI] |
| 26. | Jin HE, Hong SS, Choi MK, Maeng HJ, Kim DD, Chung SJ, Shim CK. Reduced antidiabetic effect of metformin and down-regulation of hepatic Oct1 in rats with ethynylestradiol-induced cholestasis. Pharm Res. 2009;26:549-559. [PubMed] [DOI] |
| 27. | Atilano-Roque A, Roda G, Fogueri U, Kiser JJ, Joy MS. Effect of Disease Pathologies on Transporter Expression and Function. J Clin Pharmacol. 2016;56 Suppl 7:S205-S221. [PubMed] [DOI] |
| 28. | Canet MJ, Cherrington NJ. Drug disposition alterations in liver disease: extrahepatic effects in cholestasis and nonalcoholic steatohepatitis. Expert Opin Drug Metab Toxicol. 2014;10:1209-1219. [PubMed] [DOI] |
| 29. | Zollner G, Fickert P, Zenz R, Fuchsbichler A, Stumptner C, Kenner L, Ferenci P, Stauber RE, Krejs GJ, Denk H. Hepatobiliary transporter expression in percutaneous liver biopsies of patients with cholestatic liver diseases. Hepatology. 2001;33:633-646. [PubMed] [DOI] |
| 30. | Cherrington NJ, Slitt AL, Li N, Klaassen CD. Lipopolysaccharide-mediated regulation of hepatic transporter mRNA levels in rats. Drug Metab Dispos. 2004;32:734-741. [PubMed] [DOI] |
| 31. | Zollner G, Fickert P, Silbert D, Fuchsbichler A, Marschall HU, Zatloukal K, Denk H, Trauner M. Adaptive changes in hepatobiliary transporter expression in primary biliary cirrhosis. J Hepatol. 2003;38:717-727. [PubMed] [DOI] |
| 32. | Ali R, Cusi K. New diagnostic and treatment approaches in non-alcoholic fatty liver disease (NAFLD). Ann Med. 2009;41:265-278. [PubMed] [DOI] |
| 33. | Feldstein AE. Novel insights into the pathophysiology of nonalcoholic fatty liver disease. Semin Liver Dis. 2010;30:391-401. [PubMed] [DOI] |
| 34. | Masuoka HC, Chalasani N. Nonalcoholic fatty liver disease: an emerging threat to obese and diabetic individuals. Ann N Y Acad Sci. 2013;1281:106-122. [PubMed] [DOI] |
| 35. | Lake AD, Novak P, Fisher CD, Jackson JP, Hardwick RN, Billheimer DD, Klimecki WT, Cherrington NJ. Analysis of global and absorption, distribution, metabolism, and elimination gene expression in the progressive stages of human nonalcoholic fatty liver disease. Drug Metab Dispos. 2011;39:1954-1960. [PubMed] [DOI] |
| 36. | Clarke JD, Hardwick RN, Lake AD, Canet MJ, Cherrington NJ. Experimental nonalcoholic steatohepatitis increases exposure to simvastatin hydroxy acid by decreasing hepatic organic anion transporting polypeptide expression. J Pharmacol Exp Ther. 2014;348:452-458. [PubMed] [DOI] |
| 37. | Hardwick RN, Ferreira DW, More VR, Lake AD, Lu Z, Manautou JE, Slitt AL, Cherrington NJ. Altered UDP-glucuronosyltransferase and sulfotransferase expression and function during progressive stages of human nonalcoholic fatty liver disease. Drug Metab Dispos. 2013;41:554-561. [PubMed] [DOI] |
| 38. | Hardwick RN, Fisher CD, Canet MJ, Scheffer GL, Cherrington NJ. Variations in ATP-binding cassette transporter regulation during the progression of human nonalcoholic fatty liver disease. Drug Metab Dispos. 2011;39:2395-2402. [PubMed] [DOI] |
| 39. | Fisher CD, Lickteig AJ, Augustine LM, Oude Elferink RP, Besselsen DG, Erickson RP, Cherrington NJ. Experimental non-alcoholic fatty liver disease results in decreased hepatic uptake transporter expression and function in rats. Eur J Pharmacol. 2009;613:119-127. [PubMed] [DOI] |
| 40. | Hanada K, Nakai K, Tanaka H, Suzuki F, Kumada H, Ohno Y, Ozawa S, Ogata H. Effect of nuclear receptor downregulation on hepatic expression of cytochrome P450 and transporters in chronic hepatitis C in association with fibrosis development. Drug Metab Pharmacokinet. 2012;27:301-306. [PubMed] |
| 41. | Ogasawara K, Terada T, Katsura T, Hatano E, Ikai I, Yamaoka Y, Inui K. Hepatitis C virus-related cirrhosis is a major determinant of the expression levels of hepatic drug transporters. Drug Metab Pharmacokinet. 2010;25:190-199. [PubMed] [DOI] |
| 42. | Kurzawski M, Dziedziejko V, Post M, Wójcicki M, Urasińska E, Miętkiewski J, Droździk M. Expression of genes involved in xenobiotic metabolism and transport in end-stage liver disease: up-regulation of ABCC4 and CYP1B1. Pharmacol Rep. 2012;64:927-939. [PubMed] [DOI] |
| 43. | Nakai K, Tanaka H, Hanada K, Ogata H, Suzuki F, Kumada H, Miyajima A, Ishida S, Sunouchi M, Habano W. Decreased expression of cytochromes P450 1A2, 2E1, and 3A4 and drug transporters Na+-taurocholate-cotransporting polypeptide, organic cation transporter 1, and organic anion-transporting peptide-C correlates with the progression of liver fibrosis in chronic hepatitis C patients. Drug Metab Dispos. 2008;36:1786-1793. [PubMed] [DOI] |
| 44. | Hinoshita E, Taguchi K, Inokuchi A, Uchiumi T, Kinukawa N, Shimada M, Tsuneyoshi M, Sugimachi K, Kuwano M. Decreased expression of an ATP-binding cassette transporter, MRP2, in human livers with hepatitis C virus infection. J Hepatol. 2001;35:765-773. [PubMed] [DOI] |
| 45. | Ros JE, Libbrecht L, Geuken M, Jansen PL, Roskams TA. High expression of MDR1, MRP1, and MRP3 in the hepatic progenitor cell compartment and hepatocytes in severe human liver disease. J Pathol. 2003;200:553-560. [PubMed] [DOI] |
| 46. | Gillet JP, Gottesman MM. Mechanisms of multidrug resistance in cancer. Methods Mol Biol. 2010;596:47-76. [PubMed] [DOI] |
| 47. | Namisaki T, Schaeffeler E, Fukui H, Yoshiji H, Nakajima Y, Fritz P, Schwab M, Nies AT. Differential expression of drug uptake and efflux transporters in Japanese patients with hepatocellular carcinoma. Drug Metab Dispos. 2014;42:2033-2040. [PubMed] [DOI] |
| 48. | Ueno A, Masugi Y, Yamazaki K, Komuta M, Effendi K, Tanami Y, Tsujikawa H, Tanimoto A, Okuda S, Itano O. OATP1B3 expression is strongly associated with Wnt/β-catenin signalling and represents the transporter of gadoxetic acid in hepatocellular carcinoma. J Hepatol. 2014;61:1080-1087. [PubMed] [DOI] |
| 49. | Bonin S, Pascolo L, Crocé LS, Stanta G, Tiribelli C. Gene expression of ABC proteins in hepatocellular carcinoma, perineoplastic tissue, and liver diseases. Mol Med. 2002;8:318-325. [PubMed] |
| 50. | Borel F, Han R, Visser A, Petry H, van Deventer SJ, Jansen PL, Konstantinova P. Adenosine triphosphate-binding cassette transporter genes up-regulation in untreated hepatocellular carcinoma is mediated by cellular microRNAs. Hepatology. 2012;55:821-832. [PubMed] [DOI] |
| 51. | Carrasco-Torres G, Fattel-Fazenda S, López-Alvarez GS, García-Román R, Villa-Treviño S, Vásquez-Garzón VR. The transmembrane transporter ABCC3 participates in liver cancer progression and is a potential biomarker. Tumour Biol. 2016;37:2007-2014. [PubMed] [DOI] |
| 52. | Zúñiga-García V, Chávez-López Mde G, Quintanar-Jurado V, Gabiño-López NB, Hernández-Gallegos E, Soriano-Rosas J, Pérez-Carreón JI, Camacho J. Differential Expression of Ion Channels and Transporters During Hepatocellular Carcinoma Development. Dig Dis Sci. 2015;60:2373-2383. [PubMed] [DOI] |
| 53. | Geuken E, Visser D, Kuipers F, Blokzijl H, Leuvenink HG, de Jong KP, Peeters PM, Jansen PL, Slooff MJ, Gouw AS. Rapid increase of bile salt secretion is associated with bile duct injury after human liver transplantation. J Hepatol. 2004;41:1017-1025. [PubMed] [DOI] |
| 54. | Zimmerman MA, Tak E, Ehrentraut SF, Kaplan M, Giebler A, Weng T, Choi DS, Blackburn MR, Kam I, Eltzschig HK. Equilibrative nucleoside transporter (ENT)-1-dependent elevation of extracellular adenosine protects the liver during ischemia and reperfusion. Hepatology. 2013;58:1766-1778. [PubMed] [DOI] |
| 55. | Fouassier L, Beaussier M, Schiffer E, Rey C, Barbu V, Mergey M, Wendum D, Callard P, Scoazec JY, Lasnier E. Hypoxia-induced changes in the expression of rat hepatobiliary transporter genes. Am J Physiol Gastrointest Liver Physiol. 2007;293:G25-G35. [PubMed] [DOI] |
| 56. | Tanaka Y, Chen C, Maher JM, Klaassen CD. Ischemia-reperfusion of rat livers decreases liver and increases kidney multidrug resistance associated protein 2 (Mrp2). Toxicol Sci. 2008;101:171-178. [PubMed] [DOI] |
| 57. | Davit-Spraul A, Gonzales E, Baussan C, Jacquemin E. Progressive familial intrahepatic cholestasis. Orphanet J Rare Dis. 2009;4:1. [PubMed] [DOI] |
| 58. | Sticova E, Elleder M, Hulkova H, Luksan O, Sauer M, Wunschova-Moudra I, Novotny J, Jirsa M. Dubin-Johnson syndrome coinciding with colon cancer and atherosclerosis. World J Gastroenterol. 2013;19:946-950. [PubMed] [DOI] |
| 59. | Pawlikowska L, Strautnieks S, Jankowska I, Czubkowski P, Emerick K, Antoniou A, Wanty C, Fischler B, Jacquemin E, Wali S. Differences in presentation and progression between severe FIC1 and BSEP deficiencies. J Hepatol. 2010;53:170-178. [PubMed] [DOI] |
| 60. | Khabou B, Siala-Sahnoun O, Gargouri L, Mkaouar-Rebai E, Keskes L, Hachicha M, Fakhfakh F. In silico investigation of the impact of synonymous variants in ABCB4 gene on mRNA stability/structure, splicing accuracy and codon usage: Potential contribution to PFIC3 disease. Comput Biol Chem. 2016;65:103-109. [PubMed] [DOI] |