修回日期: 2017-04-04
接受日期: 2017-04-11
在线出版日期: 2017-05-28
幽门螺杆菌(Helicobacter pylori, H. pylori)与胃癌(gastric cancer, GC)发生发展密切相关, 根除H. pylori可降低GC发生率. 经济学分析表明, 在高危人群中根除治疗H. pylori作为预防GC的策略是成本效益较好的. 即使在GC低风险人群中, H. pylori筛查和治疗也能使上消化道其他非恶性疾病获益. 然而, 广泛开展H. pylori根除治疗可能带来其他问题, 包括抗生素耐药增加和与H. pylori负相关疾病(如胃食管反流病、Barrett食管、哮喘和肥胖等)的患病率升高. 本文将结合近年最新研究, 就上述问题展开论述, 进一步提出H. pylori根除治疗预防GC所面临的挑战以及将来可能的进展方向.
核心提要: 为降低高危人群胃癌的发病率, 幽门螺杆菌筛查和根除治疗可能是一种可行的、有效的和成本效益好的方法, 但是大规模开展人群筛查和治疗需综合考虑多种因素影响.
引文著录: 周林, 赵阳鹏, 张伟. 幽门螺杆菌根除治疗在胃癌预防中的现状及前景. 世界华人消化杂志 2017; 25(15): 1327-1337
Revised: April 4, 2017
Accepted: April 11, 2017
Published online: May 28, 2017
Helicobacter pylori (H. pylori) is strongly linked with gastric cancer (GC) formation and development, and eradication of H. pylori reduces the incidence of GC. Economic analyses suggest that eradication of H. pylori as a means of preventing GC is cost-effective in high-risk populations. Even in populations at low risk of GC, there might be other benefits arising from screening and treatment, owing to the effects on non-malignant upper gastrointestinal diseases. However, there are concerns about widespread use of eradication therapy, because it may cause antimicrobial resistance and a rise in the prevalence of diseases that are negatively associated with H. pylori, such as gastroesophageal reflux disease, Barrett esophagus, asthma and obesity. In this article, we review the current status of H. pylori eradication in prevention of gastric cancer. Furthermore, the challenges and future directions of H. pylori eradication to prevent GC are also discussed.
- Citation: Zhou L, Zhao YP, Zhang W. Current status and prospects of Helicobacter pylori eradication in prevention of gastric cancer. Shijie Huaren Xiaohua Zazhi 2017; 25(15): 1327-1337
- URL: https://www.wjgnet.com/1009-3079/full/v25/i15/1327.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i15.1327
幽门螺杆菌(Helicobacter pylori, H. pylori)是最常见的人类病原体之一, 定殖于全世界约50%人口的胃中[1-3]. 尽管H. pylori在美国和西欧国家的发生率在下降, 但是全球很多地方的发生率目前仍然较高, 例如中国部分地区、部分东欧和南美洲国家, 甚至达到80%以上[1,4]. H. pylori感染率与教育水平和生活水平等社会经济因素有关, 欠发达地区H. pylori的感染率和复发率更可能高于发达地区[5].
胃癌(gastric cancer, GC)是全球第五大癌症, 每年死亡近750000人, 在全球癌症相关死亡中位列第3[6]. 1975年Correa等[7]提出肠型GC多阶段发生模式(正常胃黏膜-非萎缩性胃炎-萎缩性胃炎-肠化生-异型增生-肠型GC), 该模型指出GC是众多突变的最终结局, 这些突变因生活中的未知因素触发而开始, 未知因素如今已被证实为H. pylori感染. H. pylori感染在GC发生发展中的重要作用获得了众多流行病学和临床研究的证据支持[8-10]. 能否通过根除H. pylori感染来降低GC的发病率, 从而减轻疾病负担是近年来最受关注的热点之一.
本文将从H. pylori感染和GC之间的关联出发, 分析H. pylori感染根除治疗的可行性和时机, 从而评估H. pylori根除治疗作为GC预防策略的现有证据, 并将进一步讨论H. pylori根除治疗可能产生的其他益处和潜在的有害影响, 最终为临床开展大规模H. pylori感染根除治疗提供理论指导.
1994年, 国际癌症研究机构(International Agency for Research on Cancer, IARC)将H. pylori定为Ⅰ类致癌因子[11]. 首次将H. pylori和GC关联在一起的研究是一项地理相关流行病学调查, 观察H. pylori在不同疾病风险人群中的感染率[12,13]. 紧接着一项前瞻性研究[14]观察全世界17个人群, 结果H. pylori感染率每增加10%, GC发病率上升约25%, GC相关死亡率增加18%. 后来病例对照研究的Meta分析证实, 与未感染相比, H. pylori阳性人群发生GC的可能性高3至6倍[15]. 然而, 这种相关性并不是在所有地理区域都存在, 即GC的"非洲之谜"和"印度之谜"(当地的H. pylori感染率很高, 但GC发病率很低), 具体原因仍不清楚, 可能与GC的发生除H. pylori因素外, 还必须有其他因素参与有关[16].
目前认为H. pylori主要在儿童时期通过胃-口途径传播[17], 在呕吐物中可检测到较高数量的转录活性H. pylori[18]. 然而, 由于确切的传播方式仍然未知, 制定有效干预措施依然受限制. 因此, 减少细菌感染的主要方法集中在机会主义地检测有症状的高风险群体, 比如消化性溃疡和功能性消化不良等, 检测出来的感染者接受H. pylori根除治疗, 通常用一种抑酸药(proton pump inhibitors, PPI)和两种抗生素治疗2 wk. 作为一种公共卫生措施, 在GC高风险群体中寻找和消除无症状个体之间的H. pylori的政策理论上应该能大大降低GC的发生率. 然而, 在大规模筛查难度较大和根除治疗的长期效果未知的情况下, 医疗服务人员不太可能认真考虑这项措施.
2014年发布的IARC工作报告呼吁更多公共卫生资源用于控制GC, 并建议各国探讨引入H. pylori人群筛查和治疗方案的可能性. 然而, 关于是否采用这些提议的决定都需要筛查方法安全、有效、准确、可接受和可负担, 以及根除治疗有效.
2.1.1 H. pylori感染的筛查: 上消化道内镜检查下活检组织快速脲酶试验检测H. pylori具有安全、有效和准确等优点, 灵敏度达到90%, 特异性在95%-100%[19,20]. 如果对所获得活检标本进一步进行组织病理学检查, 将有助于准确诊断和分类恶性和恶变前病症(胃炎和肠化生评估), 为下一步治疗或随访提供依据[21]. 然而, 该方法属于侵入性检查, 且成本较高, 在许多国家的内镜检查系统正在努力满足需求时, 对患者和提供者带来诸多不便. 因此, 用于检测细菌感染的非侵入性手段优先考虑用于群体筛查.
血清学方法通过ELISA检测H. pylori感染后IgG已开展超过30年, 并且具有许多优点[22]. 某些临床情况下, 如PPI或抗生素使用、萎缩性胃炎等, 导致胃中的细菌数量较低, 将降低其他诊断方法的灵敏度, 而血清学方法却不受影响[23]. 此外, H. pylori的血清学检测可与血清胃蛋白酶原检测同时进行, 这使得能够非侵入性地判断胃的恶性前病变, 如萎缩和肠化生等[24,25]. 血清学检测已实现商品化, 有些灵敏度和特异性均在90%以上[26], 而其缺点是血清学仅确认先前暴露于H. pylori, 因此其不能用于评估当前的感染, 也不能用于判断根除治疗是否成功.
13C尿素呼气试验也是检测H. pylori感染的一种非侵入性方法, 因其简便易行且具有高灵敏度(96%)和特异性(93%)而被广泛使用[27]. 单克隆粪便抗原检测是另一种选择, Meta分析指出其同样具有高特异性(94%)和灵敏度(97%)[28]. 尿素呼吸试验和粪便抗原试验, 均比血清学检测成本低廉[29], 并且可以用于确认根除H. pylori是否成功, 但是患者需要停止PPI治疗至少2 wk以上才能检查[30,31]. 此外, 作为群体筛查方法, 由于需要自行处理粪便, 因此粪便抗原测试不如呼气试验应用广泛[32].
2.1.2 H. pylori感染的治疗: 在很长一段时间里, H. pylori治疗金标准是1 wk疗程的PPI三联疗法, 由以一种PPI与克拉霉素、阿莫西林或甲硝唑的两种组合而成, 疗效显著[33]. 然而, 在过去5-10年中, 由于抗生素耐药问题, 特别是克拉霉素, 1 wk PPI三联治疗的根除率下降到不可接受的水平, 治愈率低至70%[34-36]. 因此, 目前要提高H. pylori根除率必须先了解克拉霉素耐药率. 如果克拉霉素耐药率低于20%, 那么仍可使用PPI三联疗法, 但治疗周期应延长至2 wk. 而在一些克拉霉素耐药率超过20%的地区, 就应该选用四联疗法, 即铋剂与PPI和两种抗生素(通常是甲硝唑和四环素)组成[37]. 根除治疗的效果部分取决于有效的酸抑制, 并且随着一类新的抑酸药物钾离子竞争性酸抑制剂(potassium competitive acid blocker, PCAB)的出现, H. pylori根除率可能会再次提高. 2016年发表的一项随机对照试验(randomized controlled trial, RCT)研究[38]报道PCAB富马酸沃诺拉赞联合阿莫西林和克拉霉素的H. pylori根除率超过90%.
近年研究者还提出疫苗接种用于减少H. pylori感染和相关疾病. 2004年首次报道[39]了一种候选疫苗用于健康志愿者接种后接触细菌的效果良好. 随后, 开发了口服重组疫苗, 且已进行到了Ⅲ期临床试验. 中国一项大型随机、安慰剂对照研究中, H. pylori阳性儿童中接种后显示出良好的有效性、安全性和免疫原性, 其有效率为71.8%[40].
H. pylori治疗的另一个关键是考虑应该在什么阶段开展. 绝大多数H. pylori感染发生在儿童期[41], 大约在6-15岁之间[42,43]. 为了中断通过各种癌前病变向GC进展的级联反应, H. pylori感染的筛查和根除应该在早期阶段进行, 青春期或青年期均可. 年长者普遍使用抑酸药物, 并且癌前病变的可能性增加, 因此假阴性概率增加, 而在早期就开展筛查和治疗将有效地避免这类问题. 另一方面, 年轻个体中出现消化不良或消化性溃疡疾病的可能性较低[43,44], 因此从根除治疗中获得症状改善的可能性很低, 而在年长个体的筛查和治疗恰恰相反. 此外, 常规根除治疗在年轻人中增加抗生素耐药性发生, 并导致肠道微生物群的实质性改变, 而这种生态失调的长期后果是未知的[45]. 然而, 尽管多项Meta分析显示H. pylori根除后胃窦和胃体中的胃黏膜萎缩可以逆转[46-48], 但是肠化生无法逆转, 少数个体中根除治疗可能阻止肠化生进一步进展[49-51]. 当肠化生已经发生时, 由于该时间幽门螺杆菌定殖水平减少, 因此根除治疗对肠化生获益较少[52]. 这些结果表明在黏膜变化发生之前较早的干预(根除治疗)是优选方案.
啮齿动物研究为H. pylori根除治疗作为GC预防手段提供了科学依据, 其中一项研究[53]证明H. pylori阳性蒙古沙鼠由化学方法诱导致癌后, 其GC发生风险随根除治疗时间的延后而增加. 在这群沙鼠中, 在5 wk时根除治疗的GC发生率为6.7%, 而在55 wk时根除治疗的沙鼠为38.2%, 没有接受根除治疗为56.3%. 研究者指出H. pylori感染诱导慢性炎症的持续时间将影响GC的发生率. RCT结果显示内镜下黏膜切除术后的H. pylori感染的早期GC患者中, 根除治疗后异时性GC的发生率与未治疗者相比显著降低[54-56].
3.1.1 RCT研究的证据: 迄今为止一共有6项RCT研究[57-63]关于H. pylori筛查和治疗对健康无症状感染个体的GC预防的效果, 并报道了筛查后在多个时间点的数据(表1). 除了一项在哥伦比亚进行的RCT外[59], 其他所有试验在中国或日本开展, 其中H. pylori感染的检测方法和根除治疗方案各不相同. 中国的一项RCT中[62], 随访7年后, 来自根除治疗组的817名个体中有7名(0.9%)发展成GC, 而对照组中813名个体中有11名(1.4%)癌变(P = 0.33), 无显著统计学差异. 进一步进行回顾性分析发现, 对于没有胃黏膜萎缩、肠化生或异型增生的受试者, 根除治疗后没有一个发展成肿瘤, 而对照组中6名出现癌变(P = 0.02), 差异显著. 在随访时间最长的一项RCT中[58], 随访14.7年后根除治疗的GC发病率明显降低, 有统计学差异(OR = 0.61; 95%CI: 0.38-0.96, P = 0.03). 其他试验均未获得具有统计学意义的数据, 可能与样本量以及没有随访足够长时间有关.
| 研究 | 地区 | H. pylori检测方法 | 各组受试者(n) | H. pylori根除治疗方案 | 随访时间(年) | 胃癌发生(n) | ||
| 治疗组 | 对照组 | 治疗组 | 对照组 | |||||
| Correa等[59] | 哥伦比亚拿里诺 | 组织学检测 | 437 | 415 | 铋剂+阿莫西林+甲硝唑, 2 wk | 6 | 3 | 2 |
| Zhou等[51,60,61] | 中国山东 | 组织学和快速脲酶试验 | 276 | 276 | 奥美拉唑+阿莫西林+克拉霉素, 1 wk | 10 | 2 | 7 |
| Wong等[62] | 中国福建 | 组织学和快速脲酶试验 | 817 | 813 | 奥美拉唑+阿莫西林+甲硝唑, 2 wk | 7.5 | 7 | 11 |
| Saito等[57] | 日本 | 未见报道 | 379 | 313 | 兰索拉唑+阿莫西林+克拉霉素, 1 wk | 4 | 2 | 3 |
| Ma等[58] | 中国山东 | 血清学检测 | 1130 | 1128 | 奥美拉唑+阿莫西林, 2 wk | 14.7 | 34 | 52 |
| Wong等[63] | 中国山东 | 尿素呼气试验 | 255 | 258 | 奥美拉唑+阿莫西林+克拉霉素 | 5 | 3 | 1 |
2014年发表的一项Meta分析[64]将所有6个RCT研究包括6497名健康H. pylori阳性个体的数据综合起来发现, 在根除治疗组3294例患者中有51例(1.6%)发展为GC, 而安慰剂组或无治疗组的3203例中76例(2.4%)GC. 与安慰剂或无治疗组相比, 治疗组发展为GC的相对危险度(RR)为0.66(95%CI: 0.46-0.95), 需治数(NNT)为124. 然而, H. pylori根除治疗对整体死亡率或GC相关死亡率均没有影响. 对不同国家的不同人群来计算NNT, 发现了不同人群治疗效果的显著差异性, 中国男性NNT低至15, 而美国女性高达245.
3.1.2 真实世界的证据: 台湾马祖岛地区进行的观察性研究[50]给我们提供了关于H. pylori筛查和治疗效果的现实证据. 1995年之前, 岛上的GC死亡率是台湾其他地区的3倍, 因此, 2004年开始了H. pylori筛查和根除计划. 该项目对4121名30岁以上成年人通过尿素呼气试验检测H. pylori感染情况, 其中2598(63.0%)名受试者为阳性, 进行上消化道内镜检查, 并且给予1 wk的PPI三联疗法用药, 包括埃索美拉唑、阿莫西林和克拉霉素. 2008年采用尿素呼气试验和内镜重新复查一直随访的受试者, 呼气试验结果提示人群中H. pylori的感染率下降到13.4%. 841名复查内镜的受试者中, 胃黏膜萎缩的发生率从2004年的59.9%下降到2008年的13.7%, 而肠化生从31.7%增加到38.9%, 再次证明肠化生"不可逆转"理论. 在筛查方案开始前的4年期间, 马祖岛上每100000人GC发生为40.3, 而2004年至2008年为30.4, 相当于发病率降低25%. 内镜检查还发现消化性溃疡的发生率降低, 从2004年的11.0%降至2008年的3.6%. 然而, GC的死亡率从1999年至2003年的每100000人20.1增加到2004年至2008年的每100000人26.3. 这一发现可能与研究期间不可逆的肠化生发生率增加相关, 研究者指出需要更长时间的随访来阐明H. pylori筛查和根除治疗是否可以降低GC的死亡率.
通过上消化道内镜检查发现早期GC的人群筛查方法在日本这类GC高风险国家是可行的[65]. 然而, 在GC风险较低的国家采用这种策略的成本是令人望而却步的, 因为需要数千名无症状的人接受上消化道内镜检查才检测出1例早期GC. 据估算, 即使通过内镜检查只筛查有症状(如消化不良等)的患者, 检测到一个恶性病变的成本也将高达83000美元[66].
H. pylori筛查和治疗来预防GC符合Wilson和Jungner于1968年为WHO制定的疾病筛查实施标准[67]. 然而, 再理想的情况下筛查计划也应具有成本效益. 第1个关于H. pylori筛查和治疗成本效益模型分析了50岁左右的感染者, 估算该筛查方法预防GC的花费达到25000美元/获得生命年[68]. Lansdorp-Vogelaar等[69]对此进行了Meta分析, 共纳入10项研究, 最终得出如下结论: 在普通人群中开展H. pylori筛查和治疗以预防GC的花费少于5万美元/获得生命年(低于发达国家常用的成本效益值). 在不同研究之间的成本/获得生命年变化较大, 造成这一差异的主要原因在于不同地区的GC风险、H. pylori感染率、筛查及根除治疗费用的差异. 尽管GC的发病率在西半球的许多地方正在下降, 但是, 通过筛查和根除H. pylori的策略可以带来其他益处. 目前的分析模型的评估是保守的, 并不考虑由该方法带来的其他潜在经济效益, 包括消化性溃疡患病率的减少和社区消化不良的发病率下降[50,70]. 另外, 血清学检测和粪便抗原检测比目前广泛推荐的尿素呼气试验的效益更高, 但血清学检测更方便, 接受度更高[71,72].
英国进行的两项H. pylori大规模筛查和治疗的研究[70,73]为我们提供了关于H. pylori根除治疗的其他益处的证据. 利兹HELP研究[70]是在英格兰利兹-布拉德福地区进行的双盲安慰剂对照试验, 随机选择8407名40-49岁的健康个体进行尿素呼吸试验筛查H. pylori, 一共2324人(27.6%)为H. pylori阳性, 随机分配到治疗组或安慰剂组, 治疗组是1 wk的PPI三联疗法, 包括奥美拉唑、克拉霉素和替硝唑. 随访2年, 880名治疗组受试者中247(28.1%)名出现消化不良, 而安慰剂组的871名受试者中有291名(33.4%)出现症状(RR = 0.84; 95%CI: 0.73-0.97, P = 0.015). 2年随访期内, 一共出现17例新发消化性溃疡, 其中13例发生在安慰剂组(P = 0.04). 消化不良的医疗成本在研究的2年期间, 根除治疗组中每人平均节省11.42英镑, 统计学上差异不显著[74]. 经过10年的随访, 接受根除治疗的消化不良相关的医疗成本显著降低, 平均每人节省费用65英镑(95%CI: 6-122, P = 0.03)[75]. 研究者指出, 10年节省出来的成本足以抵消初始阶段筛查和治疗H. pylori阳性的成本. 这些节省主要是由于消化不良相关用药减少(平均相差81英镑; 95%CI: 19-141, P = 0.01).
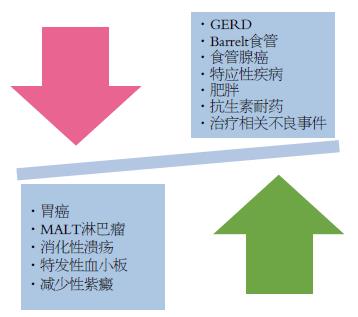
在英格兰西南部进行的布里斯托尔H. pylori项目[73]是一项类似的研究. 该研究随机招募10537名年龄在20-59岁之间的健康个体, 进行尿素呼吸检测. 检测为H. pylori阳性的1636(15.4%)名个体进行了2 wk根除治疗的双盲、安慰剂对照试验, 由雷尼替丁柠檬酸铋和克拉霉素组成. 经过2年的随访, 治疗组的消化不良症状(OR = 0.71; 95%CI: 0.56-0.90, P = 0.05)和消化不良相关咨询(OR = 0.65; 95%CI: 0.46-0.94, P = 0.02)的发生率显著降低. 两组参与者的生活质量无差异. 根除治疗组的成本比安慰剂组高, 平均相差85英镑(95%CI: 75-94), 这种成本的增加是由根除治疗费用导致的, 每人需要83英镑. 根除治疗导致消化不良相关咨询的大量减少在随访7年时仍然明显[76](图1).
H. pylori群体筛查和治疗的提出是存在争议的. 例如, 抗生素耐药性是全球医学面临的最大挑战之一, 医学界正在共同努力限制抗生素的使用[77], 而广泛地进行H. pylori根除治疗在群体和个体水平上对抗生素的使用均产生不利影响. 群体方面, H. pylori根除方案包含广谱抗生素(例如阿莫西林、克拉霉素和喹诺酮类等), 对控制抗菌药物使用产生消极影响. 这种影响对于某些抗生素用于治疗严重或危及生命的感染尤为重要. 例如, H. pylori耐药菌株治疗药物的使用增加[78], 如利福布汀, 可能影响多重耐药性结核病的治疗[79]. 个体方面, H. pylori治疗导致H. pylori对所用抗生素耐药性增加[80], 当克拉霉素耐药, 其敏感菌株低于20%时, 根除率将大大下降, 这被认为是一线根除治疗失败的最大原因[81]. 因此, 更广泛地使用诸如克拉霉素和甲硝唑等抗生素可能通过促进耐药菌株的发生而增加H. pylori相关疾病的负担.
H. pylori治疗相关的不良事件是非常常见的, 因方案不同而各不相同, 在实施大规模筛查和治疗计划时必须慎重考虑. 研究[82]表明不良反应与治疗失败和对治疗的依从性降低有关, 因此良好耐受和易于使用的治疗方案是根除治疗取得成功的关键. 虽然不良事件, 如腹泻、恶心、呕吐和味觉改变确实在治疗时发生, 但他们很少严重到必须停止治疗[83]. 对于标准一线PPI三联疗法来说, 多中心研究中不良事件的总体发生率为53.3%, 但这些事件通常是轻度的[84]. 二线或三线治疗的严重不良事件受到了更多的关注. 喹诺酮类已发现与跟腱炎和肝脏毒性有关[85,86], 服用利福布汀的患者中报道了骨髓抑制和眼部毒性[87,88]. 此外, H. pylori根除治疗改变肠道微生物群[89], 目前还没发现什么不良后果, 有待进一步观察. 在H. pylori人群筛查和治疗的RCT研究中将重点放在GC预防上, 不良事件发生率均未见报道[64]. 正在进行的一项研究[90]中, 入组超过88000名受试者, 1.5%发生不良事件发生而停止治疗, 其中最多的不良事件是恶心或呕吐(0.9%)和皮疹(0.4%). 没有严重或危及生命的不良事件.
广泛开展H. pylori根除治疗还能产生其他潜在有害影响. 在马祖岛进行的人群筛查项目[50]中侵蚀性食管炎的发生率在随访的4年中从13.7%增加到27.3%. 而在英国进行的RCT中都没有胃-食管反流症状增加的任何证据. Moayyedi等[70]发现, 根除治疗的2年中, 反流症状反而更少(22.6% vs 27.4%, P = 0.02). 在布里斯托尔H. pylori项目[91]中, 治疗对胃灼热或反流的发生没有影响, 并且没有导致在基线时有症状患者的患病率降低. 此外, 根除H. pylori和肥胖之间的关联也有所涉及. 在布里斯托研究中, 根除治疗组的19%体质量增长3 kg以上, 而安慰剂组仅有13%(OR = 1.58; 95%CI: 1.19-2.10), 并且两组之间的体质量指数平均差异为0.20 kg/m2(95%CI: 0.11-0.31 kg/m2)[92], 目前尚不清楚该发现是否与消化不良症状改善有关. 尽管Lionetti等[93]通过Meta分析的方法初步明确了在特应性疾病中的保护作用, 但是所入组研究皆为观察性研究, 到目前为止, 没有RCT数据报道根除治疗和特应性疾病发展之间的关系(图1).
尽管H. pylori被公认为GC的致癌物, 且癌前病变状态也可通过内镜监测, 但是H. pylori人群筛查和治疗却并没有获得卫生部门足够的关注和资金投入. 造成这种状况部分原因是GC在西方国家是一种发病率正在下降的疾病. 然而, 尽管许多发达国家的发病率在下降, 但在可预见的未来, 由于世界人口的平均年龄上升, GC的死亡总数可能继续增加[94], GC仍然是世界各地的一个主要公共卫生问题. 为降低高危人群GC的发病率, H. pylori筛查和根除治疗可能是一种可行的、有效的和成本效益好的方法[95,96]. 此外, 根除治疗可能带来其他公共卫生益处, 如减少消化性溃疡病的发病率和减轻社区消化不良的经济负担. 尽管如此, 仅仅日本在2013-02将H. pylori根除治疗纳入了国家医疗保险范围, 成为世界上首个实施全民H. pylori筛查和治疗的国家. 中国是H. pylori高感染和GC高发的国家, 部分地区的GC发病率非常高. 从临床角度看, H. pylori筛查和治疗将对社会卫生保健带来巨大的益处. 而中国幅员辽阔、人口众多、社会经济发展不平衡, H. pylori感染率和GC发病率的地区差异较大, 推行全民H. pylori筛查和治疗的策略任重道远, 在GC高发地区试行或许是今后的方向. 迄今为止最大的人口筛查和治疗试验[90]正在中国开展, 招募超过180000人, 要到2018年才能看出对GC发病率的影响, 结果值得期待.
H. pylori根除治疗对于GC发生具有显著的预防作用, 但是这种治疗应尽早进行, 最好早于癌前疾病的发生. H. pylori的血清学检测可能是开展筛查最具成本效益的方法, 且应根据当地细菌抗生素的耐药率来调整根除治疗方案. 在很多地区开展H. pylori筛查和治疗的成本效益和可行性都仍存在一些问题, 如基础设施、资源、GC发病率和PPI使用等. 鉴于现行治疗方案的根除率不断下降, 任何筛查方案都应适当考虑再次检测, 以确保成功根除. 然而, 广泛根除H. pylori除了控制相关恶性和非恶性疾病以外, 其他后果仍难以断定.
胃癌(gastric cancer, GC)是全球第五大癌症, 每年死亡近750000人. 幽门螺杆菌(Helicobacter pylori, H. pylori)感染是GC致癌的主要因素, 其根除治疗可能是预防GC的重要途径, 然而, 诸多因素制约了大规模人群筛查和治疗的开展.
广泛根除H. pylori除了控制GC和上消化道疾病以外, 其他后果仍难以断定. H. pylori筛查和根除治疗的影响仍有待更长时间的观察和评估.
近年研究发现广泛开展H. pylori根除治疗可能带来其他负面影响, 包括抗生素耐药增加与H. pylori负相关疾病(如胃食管反流病、Barrett食管、哮喘和肥胖等)的患病率升高.
本述评分析H. pylori感染根除治疗的可行性和时机, 从而评估H. pylori根除治疗作为GC预防策略的现有证据, 并进一步讨论H. pylori根除治疗可能产生的其他益处和潜在的有害影响, 最终为开展大规模H. pylori感染根除治疗提供理论指导.
H. pylori根除治疗对于GC发生具有显著的预防作用, 但是这种治疗应尽早进行, 最好早于癌前疾病的发生. H. pylori的血清学检测可能是开展筛查最具成本效益的方法, 且应根据当地细菌抗生素的耐药率来调整根除治疗方案.
芦永福, 副教授, 副主任医师, 青海大学附属医院消化科; 沙杰, 副主任医师, 江苏省靖江市人民医院消化科
本文对H. pylori根除治疗在GC预防中的现状及前景进行了总结和评价. 具有较好的科学性可读性, 对临床医生有一定的借鉴作用.
手稿来源: 邀请约稿
学科分类: 胃肠病学和肝病学
手稿来源地: 山东省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 马亚娟 电编:李瑞芳
| 1. | Leja M, Axon A, Brenner H. Epidemiology of Helicobacter pylori infection. Helicobacter. 2016;21 Suppl 1:3-7. [PubMed] [DOI] |
| 2. | Pounder RE, Ng D. The prevalence of Helicobacter pylori infection in different countries. Aliment Pharmacol Ther. 1995;9 Suppl 2:33-39. [PubMed] |
| 3. | Malfertheiner P, Link A, Selgrad M. Helicobacter pylori: perspectives and time trends. Nat Rev Gastroenterol Hepatol. 2014;11:628-638. [PubMed] [DOI] |
| 4. | Roberts SE, Morrison-Rees S, Samuel DG, Thorne K, Akbari A, Williams JG. Review article: the prevalence of Helicobacter pylori and the incidence of gastric cancer across Europe. Aliment Pharmacol Ther. 2016;43:334-345. [PubMed] [DOI] |
| 5. | Yan TL, Hu QD, Zhang Q, Li YM, Liang TB. National rates of Helicobacter pylori recurrence are significantly and inversely correlated with human development index. Aliment Pharmacol Ther. 2013;37:963-968. [PubMed] [DOI] |
| 6. | Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65:87-108. [PubMed] [DOI] |
| 7. | Correa P, Haenszel W, Cuello C, Tannenbaum S, Archer M. A model for gastric cancer epidemiology. Lancet. 1975;2:58-60. [PubMed] [DOI] |
| 8. | Amieva M, Peek RM. Pathobiology of Helicobacter pylori-Induced Gastric Cancer. Gastroenterology. 2016;150:64-78. [PubMed] [DOI] |
| 9. | Graham DY. Helicobacter pylori update: gastric cancer, reliable therapy, and possible benefits. Gastroenterology. 2015;148:719-731.e3. [PubMed] [DOI] |
| 10. | Khatoon J, Rai RP, Prasad KN. Role of Helicobacter pylori in gastric cancer: Updates. World J Gastrointest Oncol. 2016;8:147-158. [PubMed] [DOI] |
| 11. | Schistosomes, liver flukes and Helicobacter pylori. IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Lyon, 7-14 June 1994. IARC Monogr Eval Carcinog Risks Hum. 1994;61:1-241. [PubMed] |
| 12. | Forman D, Sitas F, Newell DG, Stacey AR, Boreham J, Peto R, Campbell TC, Li J, Chen J. Geographic association of Helicobacter pylori antibody prevalence and gastric cancer mortality in rural China. Int J Cancer. 1990;46:608-611. [PubMed] [DOI] |
| 13. | Correa P, Fox J, Fontham E, Ruiz B, Lin YP, Zavala D, Taylor N, Mackinley D, de Lima E, Portilla H. Helicobacter pylori and gastric carcinoma. Serum antibody prevalence in populations with contrasting cancer risks. Cancer. 1990;66:2569-2574. [PubMed] [DOI] |
| 14. | Epidemiology of, and risk factors for, Helicobacter pylori infection among 3194 asymptomatic subjects in 17 populations. The EUROGAST Study Group. Gut. 1993;34:1672-1676. [PubMed] [DOI] |
| 15. | Helicobacter and Cancer Collaborative Group. Gastric cancer and Helicobacter pylori: a combined analysis of 12 case control studies nested within prospective cohorts. Gut. 2001;49:347-353. [PubMed] [DOI] |
| 16. | Ghoshal UC, Chaturvedi R, Correa P. The enigma of Helicobacter pylori infection and gastric cancer. Indian J Gastroenterol. 2010;29:95-100. [PubMed] [DOI] |
| 17. | Parsonnet J, Shmuely H, Haggerty T. Fecal and oral shedding of Helicobacter pylori from healthy infected adults. JAMA. 1999;282:2240-2245. [PubMed] [DOI] |
| 18. | Janzon A, Bhuiyan T, Lundgren A, Qadri F, Svennerholm AM, Sjöling A. Presence of high numbers of transcriptionally active Helicobacter pylori in vomitus from Bangladeshi patients suffering from acute gastroenteritis. Helicobacter. 2009;14:237-247. [PubMed] [DOI] |
| 19. | McNulty CA, Dent JC, Uff JS, Gear MW, Wilkinson SP. Detection of Campylobacter pylori by the biopsy urease test: an assessment in 1445 patients. Gut. 1989;30:1058-1062. [PubMed] [DOI] |
| 20. | Vaira D, Holton J, Cairns S, Falzon M, Salmon P. Four hour rapid urease test (RUT) for detecting Campylobacter pylori: is it reliable enough to start treatment? J Clin Pathol. 1988;41:355-356. [PubMed] [DOI] |
| 21. | Rugge M, Fassan M, Pizzi M, Pennelli G, Nitti D, Farinati F. Operative Link for Gastritis Assessment gastritis staging incorporates intestinal metaplasia subtyping. Hum Pathol. 2011;42:1539-1544. [PubMed] [DOI] |
| 22. | Rathbone BJ, Wyatt JI, Worsley BW, Shires SE, Trejdosiewicz LK, Heatley RV, Losowsky MS. Systemic and local antibody responses to gastric Campylobacter pyloridis in non-ulcer dyspepsia. Gut. 1986;27:642-647. [PubMed] [DOI] |
| 23. | Logan RP, Walker MM, Misiewicz JJ, Gummett PA, Karim QN, Baron JH. Changes in the intragastric distribution of Helicobacter pylori during treatment with omeprazole. Gut. 1995;36:12-16. [PubMed] [DOI] |
| 24. | Sipponen P, Graham DY. Importance of atrophic gastritis in diagnostics and prevention of gastric cancer: application of plasma biomarkers. Scand J Gastroenterol. 2007;42:2-10. [PubMed] [DOI] |
| 25. | di Mario F, Cavallaro LG. Non-invasive tests in gastric diseases. Dig Liver Dis. 2008;40:523-530. [PubMed] [DOI] |
| 26. | Burucoa C, Delchier JC, Courillon-Mallet A, de Korwin JD, Mégraud F, Zerbib F, Raymond J, Fauchère JL. Comparative evaluation of 29 commercial Helicobacter pylori serological kits. Helicobacter. 2013;18:169-179. [PubMed] [DOI] |
| 27. | Ferwana M, Abdulmajeed I, Alhajiahmed A, Madani W, Firwana B, Hasan R, Altayar O, Limburg PJ, Murad MH, Knawy B. Accuracy of urea breath test in Helicobacter pylori infection: meta-analysis. World J Gastroenterol. 2015;21:1305-1314. [PubMed] [DOI] |
| 28. | Gisbert JP, de la Morena F, Abraira V. Accuracy of monoclonal stool antigen test for the diagnosis of H. pylori infection: a systematic review and meta-analysis. Am J Gastroenterol. 2006;101:1921-1930. [PubMed] [DOI] |
| 29. | Mégraud F, Burette A, Glupczynski Y, Fiocca R, Logan R, Quina M, Ericsson S, O'Morain C. Comparison of tests for assessment of Helicobacter pylori eradication: results of a multi-centre study using centralized facility testing. Eur J Gastroenterol Hepatol. 2000;12:629-633. [PubMed] [DOI] |
| 30. | Makristathis A, Pasching E, Schütze K, Wimmer M, Rotter ML, Hirschl AM. Detection of Helicobacter pylori in stool specimens by PCR and antigen enzyme immunoassay. J Clin Microbiol. 1998;36:2772-2774. [PubMed] |
| 31. | Lin YS, Chen MJ, Shih SC, Bair MJ, Fang CJ, Wang HY. Management of Helicobacter pylori infection after gastric surgery. World J Gastroenterol. 2014;20:5274-5282. [PubMed] [DOI] |
| 32. | Cullen KP, Broderick BM, Jayaram J, Flynn B, O'Connor HJ. Evaluation of the Helicobacter pylori stool antigen (HpSA) test in routine clinical practice--is it patient-friendly? Ir Med J. 2002;95:305-306. [PubMed] |
| 33. | Lopes D, Nunes C, Martins MC, Sarmento B, Reis S. Eradication of Helicobacter pylori: Past, present and future. J Control Release. 2014;189:169-186. [PubMed] [DOI] |
| 34. | Graham DY. Hp-normogram (normo-graham) for Assessing the Outcome of H. pylori Therapy: Effect of Resistance, Duration, and CYP2C19 Genotype. Helicobacter. 2016;21:85-90. [PubMed] [DOI] |
| 35. | Thung I, Aramin H, Vavinskaya V, Gupta S, Park JY, Crowe SE, Valasek MA. Review article: the global emergence of Helicobacter pylori antibiotic resistance. Aliment Pharmacol Ther. 2016;43:514-533. [PubMed] [DOI] |
| 36. | O'Connor A, Gisbert JP, O'Morain C, Ladas S. Treatment of Helicobacter pylori Infection 2015. Helicobacter. 2015;20 Suppl 1:54-61. [PubMed] [DOI] |
| 37. | Malfertheiner P, Megraud F, O'Morain CA, Atherton J, Axon AT, Bazzoli F, Gensini GF, Gisbert JP, Graham DY, Rokkas T. Management of Helicobacter pylori infection--the Maastricht IV/ Florence Consensus Report. Gut. 2012;61:646-664. [PubMed] [DOI] |
| 38. | Murakami K, Sakurai Y, Shiino M, Funao N, Nishimura A, Asaka M. Vonoprazan, a novel potassium-competitive acid blocker, as a component of first-line and second-line triple therapy for Helicobacter pylori eradication: a phase III, randomised, double-blind study. Gut. 2016;65:1439-1446. [PubMed] [DOI] |
| 39. | Graham DY, Opekun AR, Osato MS, El-Zimaity HM, Lee CK, Yamaoka Y, Qureshi WA, Cadoz M, Monath TP. Challenge model for Helicobacter pylori infection in human volunteers. Gut. 2004;53:1235-1243. [PubMed] [DOI] |
| 40. | Zeng M, Mao XH, Li JX, Tong WD, Wang B, Zhang YJ, Guo G, Zhao ZJ, Li L, Wu DL. Efficacy, safety, and immunogenicity of an oral recombinant Helicobacter pylori vaccine in children in China: a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2015;386:1457-1464. [PubMed] [DOI] |
| 41. | Kuipers EJ, Peña AS, van Kamp G, Uyterlinde AM, Pals G, Pels NF, Kurz-Pohlmann E, Meuwissen SG. Seroconversion for Helicobacter pylori. Lancet. 1993;342:328-331. [PubMed] [DOI] |
| 42. | Banatvala N, Mayo K, Megraud F, Jennings R, Deeks JJ, Feldman RA. The cohort effect and Helicobacter pylori. J Infect Dis. 1993;168:219-221. [PubMed] [DOI] |
| 43. | Nabwera HM, Nguyen-Van-Tam JS, Logan RF, Logan RP. Prevalence of Helicobacter pylori infection in Kenyan schoolchildren aged 3-15 years and risk factors for infection. Eur J Gastroenterol Hepatol. 2000;12:483-487. [PubMed] [DOI] |
| 44. | Ford AC, Forman D, Bailey AG, Cook MB, Axon AT, Moayyedi P. Who consults with dyspepsia? Results from a longitudinal 10-yr follow-up study. Am J Gastroenterol. 2007;102:957-965. [PubMed] [DOI] |
| 45. | Yallapragada SG, Nash CB, Robinson DT. Early-Life Exposure to Antibiotics, Alterations in the Intestinal Microbiome, and Risk of Metabolic Disease in Children and Adults. Pediatr Ann. 2015;44:e265-e269. [PubMed] [DOI] |
| 46. | Rokkas T, Pistiolas D, Sechopoulos P, Robotis I, Margantinis G. The long-term impact of Helicobacter pylori eradication on gastric histology: a systematic review and meta-analysis. Helicobacter. 2007;12 Suppl 2:32-38. [PubMed] [DOI] |
| 47. | Wang J, Xu L, Shi R, Huang X, Li SW, Huang Z, Zhang G. Gastric atrophy and intestinal metaplasia before and after Helicobacter pylori eradication: a meta-analysis. Digestion. 2011;83:253-260. [PubMed] [DOI] |
| 48. | Kong YJ, Yi HG, Dai JC, Wei MX. Histological changes of gastric mucosa after Helicobacter pylori eradication: a systematic review and meta-analysis. World J Gastroenterol. 2014;20:5903-5911. [PubMed] [DOI] |
| 49. | Satoh K, Kimura K, Takimoto T, Kihira K. A follow-up study of atrophic gastritis and intestinal metaplasia after eradication of Helicobacter pylori. Helicobacter. 1998;3:236-240. [PubMed] |
| 50. | Lee YC, Chen TH, Chiu HM, Shun CT, Chiang H, Liu TY, Wu MS, Lin JT. The benefit of mass eradication of Helicobacter pylori infection: a community-based study of gastric cancer prevention. Gut. 2013;62:676-682. [PubMed] [DOI] |
| 51. | Zhou L, Sung JJ, Lin S, Jin Z, Ding S, Huang X, Xia Z, Guo H, Liu J, Chao W. A five-year follow-up study on the pathological changes of gastric mucosa after H. pylori eradication. Chin Med J (Engl). 2003;116:11-14. [PubMed] |
| 52. | Malfertheiner P, Peitz U. The interplay between Helicobacter pylori, gastro-oesophageal reflux disease, and intestinal metaplasia. Gut. 2005;54 Suppl 1:i13-i20. [PubMed] [DOI] |
| 53. | Nozaki K, Shimizu N, Ikehara Y, Inoue M, Tsukamoto T, Inada K, Tanaka H, Kumagai T, Kaminishi M, Tatematsu M. Effect of early eradication on Helicobacter pylori-related gastric carcinogenesis in Mongolian gerbils. Cancer Sci. 2003;94:235-239. [PubMed] [DOI] |
| 54. | Fukase K, Kato M, Kikuchi S, Inoue K, Uemura N, Okamoto S, Terao S, Amagai K, Hayashi S, Asaka M. Effect of eradication of Helicobacter pylori on incidence of metachronous gastric carcinoma after endoscopic resection of early gastric cancer: an open-label, randomised controlled trial. Lancet. 2008;372:392-397. [PubMed] [DOI] |
| 55. | Choi J, Kim SG, Yoon H, Im JP, Kim JS, Kim WH, Jung HC. Eradication of Helicobacter pylori after endoscopic resection of gastric tumors does not reduce incidence of metachronous gastric carcinoma. Clin Gastroenterol Hepatol. 2014;12:793-800.e1. [PubMed] [DOI] |
| 56. | Yoon SB, Park JM, Lim CH, Cho YK, Choi MG. Effect of Helicobacter pylori eradication on metachronous gastric cancer after endoscopic resection of gastric tumors: a meta-analysis. Helicobacter. 2014;19:243-248. [PubMed] [DOI] |
| 57. | Saito D, Boku N, Fujioka T, Kakizoe T. Impact of H. pylori eradication on gastric cancer prevention: endoscopic results of the Japanese intervention trial (JITHP-Study): a randomized multi-center trial. Gastroenterology. 2005;128:A4. |
| 58. | Ma JL, Zhang L, Brown LM, Li JY, Shen L, Pan KF, Liu WD, Hu Y, Han ZX, Crystal-Mansour S. Fifteen-year effects of Helicobacter pylori, garlic, and vitamin treatments on gastric cancer incidence and mortality. J Natl Cancer Inst. 2012;104:488-492. [PubMed] [DOI] |
| 59. | Correa P, Fontham ET, Bravo JC, Bravo LE, Ruiz B, Zarama G, Realpe JL, Malcom GT, Li D, Johnson WD. Chemoprevention of gastric dysplasia: randomized trial of antioxidant supplements and anti-helicobacter pylori therapy. J Natl Cancer Inst. 2000;92:1881-1888. [PubMed] |
| 60. | Leung WK, Lin SR, Ching JY, To KF, Ng EK, Chan FK, Lau JY, Sung JJ. Factors predicting progression of gastric intestinal metaplasia: results of a randomised trial on Helicobacter pylori eradication. Gut. 2004;53:1244-1249. [PubMed] [DOI] |
| 61. | Sung JJ, Lin SR, Ching JY, Zhou LY, To KF, Wang RT, Leung WK, Ng EK, Lau JY, Lee YT. Atrophy and intestinal metaplasia one year after cure of H. pylori infection: a prospective, randomized study. Gastroenterology. 2000;119:7-14. [PubMed] [DOI] |
| 62. | Wong BC, Lam SK, Wong WM, Chen JS, Zheng TT, Feng RE, Lai KC, Hu WH, Yuen ST, Leung SY. Helicobacter pylori eradication to prevent gastric cancer in a high-risk region of China: a randomized controlled trial. JAMA. 2004;291:187-194. [PubMed] [DOI] |
| 63. | Wong BC, Zhang L, Ma JL, Pan KF, Li JY, Shen L, Liu WD, Feng GS, Zhang XD, Li J. Effects of selective COX-2 inhibitor and Helicobacter pylori eradication on precancerous gastric lesions. Gut. 2012;61:812-818. [PubMed] [DOI] |
| 64. | Ford AC, Forman D, Hunt RH, Yuan Y, Moayyedi P. Helicobacter pylori eradication therapy to prevent gastric cancer in healthy asymptomatic infected individuals: systematic review and meta-analysis of randomised controlled trials. BMJ. 2014;348:g3174. [PubMed] [DOI] |
| 65. | Leung WK, Wu MS, Kakugawa Y, Kim JJ, Yeoh KG, Goh KL, Wu KC, Wu DC, Sollano J, Kachintorn U. Screening for gastric cancer in Asia: current evidence and practice. Lancet Oncol. 2008;9:279-287. [PubMed] [DOI] |
| 66. | Vakil N, Talley N, van Zanten SV, Flook N, Persson T, Björck E, Lind T, Bolling-Sternevald E. Cost of detecting malignant lesions by endoscopy in 2741 primary care dyspeptic patients without alarm symptoms. Clin Gastroenterol Hepatol. 2009;7:756-761. [PubMed] [DOI] |
| 67. | Moayyedi P, Dixon MF. Significance of Helicobacter pylori infection and gastric cancer: implications for screening. Gastrointest Endosc Clin N Am. 1997;7:47-64. [PubMed] |
| 68. | Parsonnet J, Harris RA, Hack HM, Owens DK. Modelling cost-effectiveness of Helicobacter pylori screening to prevent gastric cancer: a mandate for clinical trials. Lancet. 1996;348:150-154. [PubMed] [DOI] |
| 69. | Lansdorp-Vogelaar I, Sharp L. Cost-effectiveness of screening and treating Helicobacter pylori for gastric cancer prevention. Best Pract Res Clin Gastroenterol. 2013;27:933-947. [PubMed] [DOI] |
| 70. | Moayyedi P, Feltbower R, Brown J, Mason S, Mason J, Nathan J, Richards ID, Dowell AC, Axon AT. Effect of population screening and treatment for Helicobacter pylori on dyspepsia and quality of life in the community: a randomised controlled trial. Leeds HELP Study Group. Lancet. 2000;355:1665-1669. [PubMed] [DOI] |
| 71. | Xie F, Luo N, Blackhouse G, Goeree R, Lee HP. Cost-effectiveness analysis of Helicobacter pylori screening in prevention of gastric cancer in Chinese. Int J Technol Assess Health Care. 2008;24:87-95. [PubMed] [DOI] |
| 72. | Xie F, O'Reilly D, Ferrusi IL, Blackhouse G, Bowen JM, Tarride JE, Goeree R. Illustrating economic evaluation of diagnostic technologies: comparing Helicobacter pylori screening strategies in prevention of gastric cancer in Canada. J Am Coll Radiol. 2009;6:317-323. [PubMed] [DOI] |
| 73. | Lane JA, Murray LJ, Noble S, Egger M, Harvey IM, Donovan JL, Nair P, Harvey RF. Impact of Helicobacter pylori eradication on dyspepsia, health resource use, and quality of life in the Bristol helicobacter project: randomised controlled trial. BMJ. 2006;332:199-204. [PubMed] [DOI] |
| 74. | Mason J, Axon AT, Forman D, Duffett S, Drummond M, Crocombe W, Feltbower R, Mason S, Brown J, Moayyedi P. The cost-effectiveness of population Helicobacter pylori screening and treatment: a Markov model using economic data from a randomized controlled trial. Aliment Pharmacol Ther. 2002;16:559-568. [PubMed] [DOI] |
| 75. | Ford AC, Forman D, Bailey AG, Axon AT, Moayyedi P. A community screening program for Helicobacter pylori saves money: 10-year follow-up of a randomized controlled trial. Gastroenterology. 2005;129:1910-1917. [PubMed] [DOI] |
| 76. | Harvey RF, Lane JA, Nair P, Egger M, Harvey I, Donovan J, Murray L. Clinical trial: prolonged beneficial effect of Helicobacter pylori eradication on dyspepsia consultations - the Bristol Helicobacter Project. Aliment Pharmacol Ther. 2010;32:394-400. [PubMed] [DOI] |
| 77. | Laxminarayan R, Sridhar D, Blaser M, Wang M, Woolhouse M. Achieving global targets for antimicrobial resistance. Science. 2016;353:874-875. [PubMed] [DOI] |
| 78. | Gisbert JP, Calvet X. Review article: rifabutin in the treatment of refractory Helicobacter pylori infection. Aliment Pharmacol Ther. 2012;35:209-221. [PubMed] [DOI] |
| 79. | Sirgel FA, Warren RM, Böttger EC, Klopper M, Victor TC, van Helden PD. The rationale for using rifabutin in the treatment of MDR and XDR tuberculosis outbreaks. PLoS One. 2013;8:e59414. [PubMed] [DOI] |
| 80. | Mégraud F. H pylori antibiotic resistance: prevalence, importance, and advances in testing. Gut. 2004;53:1374-1384. [PubMed] [DOI] |
| 81. | Megraud F, Coenen S, Versporten A, Kist M, Lopez-Brea M, Hirschl AM, Andersen LP, Goossens H, Glupczynski Y. Helicobacter pylori resistance to antibiotics in Europe and its relationship to antibiotic consumption. Gut. 2013;62:34-42. [PubMed] [DOI] |
| 82. | Henry A, Batey RG. Enhancing compliance not a prerequisite for effective eradication of Helicobacter pylori: the HelP Study. Am J Gastroenterol. 1999;94:811-815. [PubMed] [DOI] |
| 83. | Ford AC, Delaney BC, Forman D, Moayyedi P. Eradication therapy in Helicobacter pylori positive peptic ulcer disease: systematic review and economic analysis. Am J Gastroenterol. 2004;99:1833-1855. [PubMed] [DOI] |
| 84. | Misiewicz JJ, Harris AW, Bardhan KD, Levi S, O'Morain C, Cooper BT, Kerr GD, Dixon MF, Langworthy H, Piper D. One week triple therapy for Helicobacter pylori: a multicentre comparative study. Lansoprazole Helicobacter Study Group. Gut. 1997;41:735-739. [PubMed] [DOI] |
| 85. | van der Linden PD, Sturkenboom MC, Herings RM, Leufkens HG, Stricker BH. Fluoroquinolones and risk of Achilles tendon disorders: case-control study. BMJ. 2002;324:1306-1307. [PubMed] [DOI] |
| 86. | Spahr L, Rubbia-Brandt L, Marinescu O, Armenian B, Hadengue A. Acute fatal hepatitis related to levofloxacin. J Hepatol. 2001;35:308-309. [PubMed] [DOI] |
| 87. | Apseloff G. Severe neutropenia among healthy volunteers given rifabutin in clinical trials. Clin Pharmacol Ther. 2003;74:591-592; discussion 592-593. [PubMed] [DOI] |
| 88. | Bhagat N, Read RW, Rao NA, Smith RE, Chong LP. Rifabutin-associated hypopyon uveitis in human immunodeficiency virus-negative immunocompetent individuals. Ophthalmology. 2001;108:750-752. [PubMed] [DOI] |
| 89. | Yap TW, Gan HM, Lee YP, Leow AH, Azmi AN, Francois F, Perez-Perez GI, Loke MF, Goh KL, Vadivelu J. Helicobacter pylori Eradication Causes Perturbation of the Human Gut Microbiome in Young Adults. PLoS One. 2016;11:e0151893. [PubMed] [DOI] |
| 90. | Pan KF, Zhang L, Gerhard M, Ma JL, Liu WD, Ulm K, Wang JX, Zhang L, Zhang Y, Bajbouj M. A large randomised controlled intervention trial to prevent gastric cancer by eradication of Helicobacter pylori in Linqu County, China: baseline results and factors affecting the eradication. Gut. 2016;65:9-18. [PubMed] [DOI] |
| 91. | Harvey RF, Lane JA, Murray LJ, Harvey IM, Donovan JL, Nair P. Randomised controlled trial of effects of Helicobacter pylori infection and its eradication on heartburn and gastro-oesophageal reflux: Bristol helicobacter project. BMJ. 2004;328:1417. [PubMed] [DOI] |
| 92. | Lane JA, Murray LJ, Harvey IM, Donovan JL, Nair P, Harvey RF. Randomised clinical trial: Helicobacter pylori eradication is associated with a significantly increased body mass index in a placebo-controlled study. Aliment Pharmacol Ther. 2011;33:922-929. [PubMed] [DOI] |
| 93. | Lionetti E, Leonardi S, Lanzafame A, Garozzo MT, Filippelli M, Tomarchio S, Ferrara V, Salpietro C, Pulvirenti A, Francavilla R. Helicobacter pylori infection and atopic diseases: is there a relationship? A systematic review and meta-analysis. World J Gastroenterol. 2014;20:17635-17647. [PubMed] [DOI] |
| 94. | Yeh JM, Goldie SJ, Kuntz KM, Ezzati M. Effects of Helicobacter pylori infection and smoking on gastric cancer incidence in China: a population-level analysis of trends and projections. Cancer Causes Control. 2009;20:2021-2029. [PubMed] [DOI] |
| 95. | O'Connor A, O'Morain CA, Ford AC. Population screening and treatment of Helicobacter pylori infection. Nat Rev Gastroenterol Hepatol. 2017;14:230-240. [PubMed] [DOI] |
| 96. | Lee YC, Lin JT. Screening and Treating Helicobacter pylori Infection for Gastric Cancer Prevention on the Population Level. J Gastroenterol Hepatol. 2017; Jan 14. [Epub ahead of print]. [PubMed] [DOI] |