修回日期: 2017-03-19
接受日期: 2017-04-05
在线出版日期: 2017-05-18
粪菌移植(fecal microbiota transplantation, FMT)是近几年发展起来的一个治疗措施, 其标准适应证是难辨梭状芽孢杆菌感染, 随着对肠道菌群的研究, 发现肠道菌群对人体的影响很大, FMT的推荐适应证也不断增多, 其中重要的一个适应证就是溃疡性结肠炎(ulcerative colitis, UC). 新乡医学院第一附属医院消化内科二病区1例难治性UC患者, 在常规治疗效果不佳的情况下, 于2016-09采用了FMT治疗1次, 随访4 mo其症状完全缓解, 复查肠镜肠黏膜炎症缓解, 无明显不良反应.
核心提要: 溃疡性结肠炎(ulcerative colitis, UC)患者常伴有肠道菌群的改变, 粪菌移植(fecal microbiota transplantation, FMT)可优化其肠道菌群, 利于病情缓解. 本例难治性UC患者仅进行了一次FMT, 却取得了很好的疗效, 症状完全缓解, 肠镜下见到黏膜愈合, 仅遗留瘢痕和假息肉形成.
引文著录: 朱艳丽, 郭晓鹤, 张兰芳, 秦咏梅. 粪菌移植治疗溃疡性结肠炎1例. 世界华人消化杂志 2017; 25(14): 1321-1326
Revised: March 19, 2017
Accepted: April 5, 2017
Published online: May 18, 2017
Fecal microbiota transplantation (FMT) is a treatment developed in recent years, and its standard indication is Clostridium difficile infection. The in-depth research of gut bacteria and the finding that gut bacteria have a great effect on human heath have resulted in the expansion of the recommended indications for FMT. One of important recommended indications for FMT is ulcerative colitis. Here we report a case of fecal microbiota transplantation in a female patient with refractory ulcerative colitis who had a poor response to conventional treatment. During the 4 mo follow-up, all of her symptoms disappeared and intestinal mucosal inflammation was in remission as revealed by colonoscopy, without obvious adverse reaction.
- Citation: Zhu YL, Guo XH, Zhang LF, Qin YM. A case of fecal microbiota transplantation for treatment of ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2017; 25(14): 1321-1326
- URL: https://www.wjgnet.com/1009-3079/full/v25/i14/1321.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i14.1321
粪菌移植(fecal microbiota transplantation, FMT)治疗于2013年写入美国临床医学指南, 用于复发性难辨梭状芽孢杆菌感染(clostridium difficile infection, CDI)的治疗. 此后关于FMT及肠道菌群的研究突飞猛进. 有关FMT治疗炎症性肠病、肠易激综合征、便秘等的研究取得了一定的效果. 新乡医学院第一附属医院消化内科于2016-09在河南省率先开展了此项治疗, 取得了一定的疗效, 报道如下.
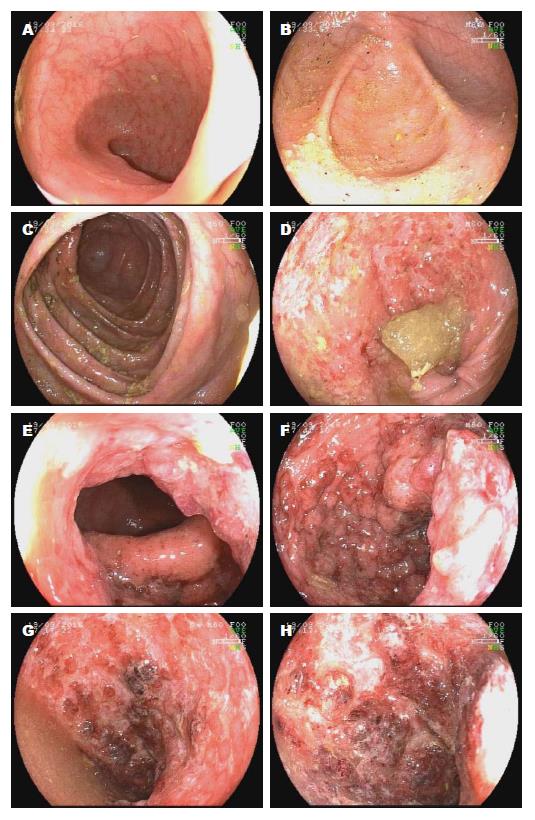
患者, 女, 53岁. 主诉: 间断腹痛伴黏液脓血便10年余, 加重1 mo余. 患者先后应用美沙拉嗪(进口), 糖皮质激素, 硫唑嘌呤, 沙利度胺等, 效差, 仍每日便血4-5次. 实验室检查: 血常规: 白细胞4.7×109/L, 红细胞3.74×1012/L, 血红蛋白100 g/L, 血小板237×109/L; 血沉48 mm/h; C-反应蛋白3.31 mg/L; 血白蛋白35.0 g/L; 术前4项阴性. 2016-09-19结肠镜示: 末端回肠、阑尾内口未见异常. 升结肠近肝曲见大片状黏膜糜烂、黏膜下出血, 血管纹理消失, 长约5 cm, 活检2块送病理, 周边肝曲黏膜见白色瘢痕形成; 脾曲结肠见白色瘢痕. 距肛缘约22 cm乙状结肠、直肠黏膜弥漫性糜烂, 溃疡, 粗糙, 部分红褐色血栓形成, 血管纹理不清, 于直肠活检4块送病理. 肛门口见痔, 余所见各大肠黏膜光滑, 未见明显异常. 肠镜诊断: (1) 溃疡性结肠炎(ulcerative colitis, UC)(慢性持续型、活动期、直肠乙状结肠并肝曲结肠、重度); (2)痔(图1).
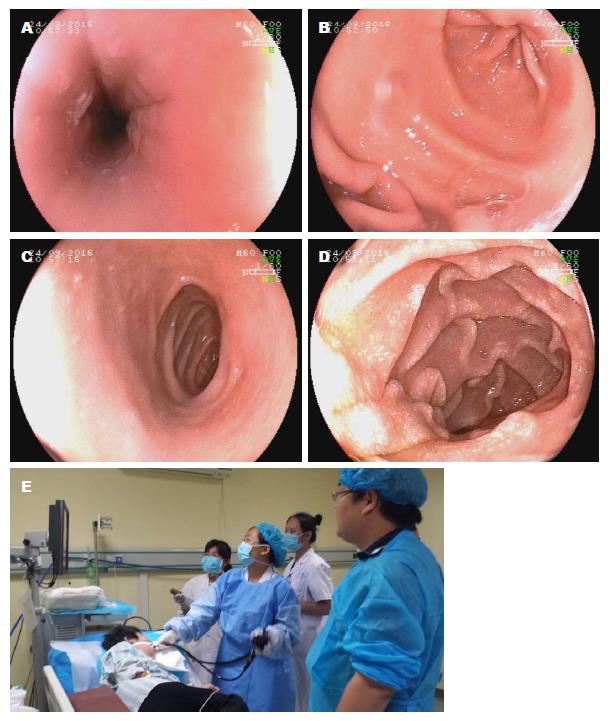
于2016-09-24实行经胃镜中消化道FMT: 患者头高脚低位, 术前应用奥美拉唑及胃复安, 进镜观察: 食管: 上段见散在白色块状分泌物附着, 余食管黏膜基本光滑, 血管纹理清晰. 贲门: 齿状线清晰, 黏膜光滑. 胃底: 黏膜光滑, 黏液湖清. 胃体、胃角未见异常, 胃窦黏膜充血水肿. 幽门及十二指肠球部未见明显异常, 降部黏膜绒毛浑浊发白. 经活检孔道注入新鲜粪菌悬液约100 mL后退镜, 球部及胃腔未见菌液反流. 胃镜诊断: (1)真菌性食管炎? (2)慢性浅表性胃炎; (3)内镜下FMT; (4)十二指肠绒毛浑浊(图2).
供体: 女, 23岁, 在校大学生, 与受体无任何关系, 近3 mo无任何疾病及抗生素应用史; 体检: 血常规, 大便常规, 大便培养, 血沉, C-反应蛋白, 肝功能, 肾功能, 输血前8项均正常.
粪菌制备方法: 为粗滤离心富集法, 取患者新鲜粪便约100 g于豆浆机中, 加生理盐水500 mL, 搅拌混匀数次, 混合液经无菌纱布及滤网过滤, 弃去杂质, 取过滤后的液体分装试管, 置离心机中以2000 r/min的速度离心3 min后, 弃去上清, 取沉淀加生理盐水, 混匀后再次离心, 同法共离心3次后加与沉淀等量的生理盐水, 混匀后用50 mL注射器抽吸, 封闭, 即为制备好的粪菌悬液.
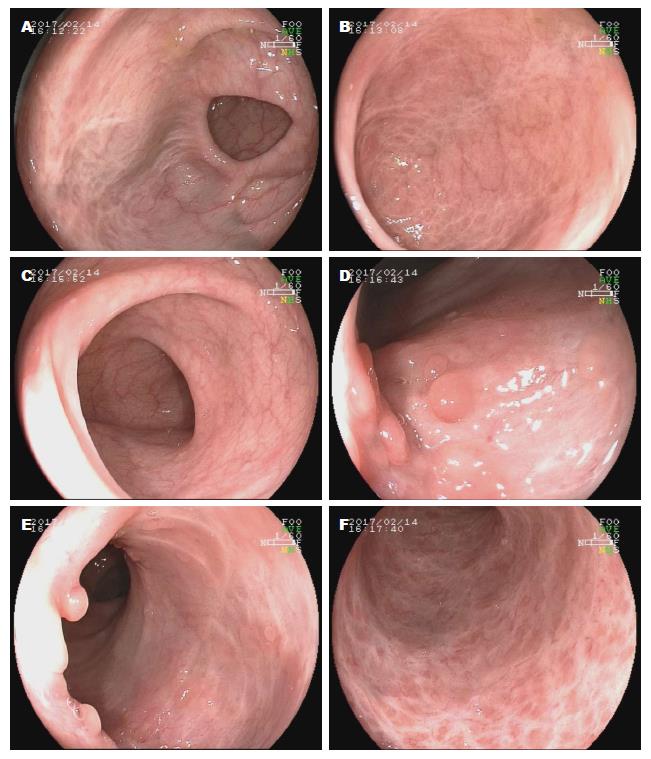
FMT术后情况: 术后无明显不良反应, 患者于术后4 d出院, 出院时脓血便有所减轻; 院外随访: 于术后12 d便血基本消失, 于术后18 d因大便干、排大便不顺, 自行服用泻药后出现剧烈腹痛和腹泻, 未再便血, 在当地对症治疗缓解. 术后1 mo随访未再出现便血. 术后3 mo随访患者在中医院服用中药治疗, 无明显不适. 术后4 mo余来新乡医学院第一附属医院复查, 无任何不适症状, 大便正常. 2017-02-14复查肠镜, 肠黏膜炎症缓解, 遗留瘢痕改变及假息肉形成. 肠镜报告: 肠道清洁可, 循腔进镜至回盲部及末端回肠, 退镜观察, 末端回肠、阑尾内口未见异常. 升结肠近肝曲及肝曲见大片状瘢痕改变, 血管纹理稍模糊. 距肛缘约15 cm以下直肠黏膜多发瘢痕形成及多发丘状、半球状息肉隆起, 血管纹理模糊, 余结肠黏膜光滑, 未见明显异常. 诊断: UC缓解期并假息肉形成(图3).
随着生物医学科学的发展, 肠道菌群的重要作用越来越多地被人们所认识, 目前我们已知人体肠道菌群的细菌个数约100万亿个, 是成年人体细胞总数的10倍, 重量1.0-1.5 kg, 其宏基因是人类基因的100倍, 种类约1000种[1], 人类现在只能鉴别其中约1/3的菌群种类, 能够培养出来的更是少之又少. 所以肠道菌群已被称为尚未被认识的人体第八大器官. 而与肠道菌群失调相关的疾病也是多种多样. 近4年来, 治疗肠道菌群失调的一种新疗法-FMT, 在国内外开展得越来越多, 如雨后春笋般, 将相关肠病的治疗推向一个新台阶. 所谓FMT, 他是指将健康人粪便中的功能菌群, 移植到患者肠道内, 重建新的肠道菌群, 实现肠道及肠道外疾病的治疗. 2012-10以来, 南京张发明团队[2]开展标准化FMT并建立了标准化粪菌库, 为将标准化FMT推向医学主流做出了巨大的贡献. FMT最主要的适应证依然是CDI, 其于2013年被列入美国临床医学指南[3], 推荐用于第3次复发CDI的治疗. 其后, 一系列应用FMT治疗的临床研究被注册和开展, 其研究对象除CDI外, 还包括炎症性肠病、便秘、肠易激综合征、代谢性疾病、肠道感染性疾病、肝性脑病、肝脏移植、HIV感染和血液系统疾病等.
2014年, Sha等[4]对来自12篇共111例炎症性肠病(inflammatory bowel disease, IBD)患者的结果进行系统分析, 结果表明FMT对IBD患者临床有效率达78.4%, 其中对成人UC的有效率接近90%; 同年, Colman等[5]对119例接受FMT治疗的IBD患者疗效进行分析, 表明FMT对IBD的临床缓解率为45%, 其中UC的临床缓解率为22%, 克罗恩病(Crohn's disease, CD)的临床缓解率为60.5%. 张发明团队发表的用FMT治疗30例难治性CD, 1 mo的有效率为86.7%, 缓解率为76.7%, 还报道FMT对CD相关的营养不良、腹痛、皮肤病、性功能减退有治疗作用[6].
FMT主要操作流程包括供体选择、粪菌制备、粪菌输入等环节. 供体筛选: 目前主要采用排除标准, 通过对供体病史、用药史、血液、粪便等指标进行筛查, 排除导致肠道菌群紊乱的因素和传染性疾病等的可能, 最大可能地排除不合格供体[7,8]. 粪菌制备方法分为"粗滤法"、"粗滤加离心富集法"和"微滤加离心富集法". 本例中我们制备的方法即粗滤加离心富集法. FMT的安全性是目前开展FMT最主要的考虑因素. 除了因粪菌的输入途径而可能导致患者出现恶心、呕吐、反流和吸入等并发症, 某些患者在FMT后可能会出现短暂的胃肠道症状[9]. 目前, 尽管在易发生感染的免疫状态受损的患者中, 也尚未有与FMT相关的严重不良事件发生, 但FMT的安全性还需要在临床研究中进一步验证.
我们本次FMT治疗难治性UC 1例, 粪菌制备的方法采用的是粗滤加离心富集法, 尽管粪菌的量偏少, 取得的效果却是非常好, 但对于大部分患者而言应该疗效与粪菌量有正比关系. 考虑以后尽量增加供体粪便量或多次治疗以提高疗效. 另患者FMT术后2 mo在服用中药, 其相信中药, 我们不便阻止, 但患者FMT之前也服用中药却无效, 所以我们考虑还是FMT的疗效, 其可能诱导缓解或改变了患者对治疗的敏感性. 本例的不足之处, 未对患者治疗前后的菌群谱的改变及供体的菌群谱进行科学的分析, 也是科研条件所限, 以后应该跟相关科研部门合作以了解肠道菌群谱的改变.
肠道菌群是机体离不开的一个特殊器官, 其在调节机体免疫、调控炎症、参与物质代谢等方面发挥重要作用[10,11]. FMT本质是重建肠道菌群, 通过对异常免疫、炎症反应、神经递质数量与活性、血管活性物质数量与活性、能量代谢等的调节而治疗疾病. 其在2013年被列入美国临床医学指南以后才成为正规疗法而受到广泛关注, 之前基本属于"偏方". 迄今, 除治疗CDI外, FMT治疗UC、CD、肠易激综合征、便秘、代谢综合征等疾病的结果已展示出了美好前景[12,13]. 其对肿瘤、化疗、对神经系统的影响也在不断研究中. 随着对关键菌群研究的深入, 可望实验室培养目标细菌, 再通过配方形成组合菌群(称之为"配方菌群治疗"), 用来代替"标准化FMT"[14].
人体内肠道菌群数量惊人, 超过人体细胞总数. 大量研究表明, 其不仅对于消化系统本身影响巨大, 对人体免疫、代谢、神经系统、情绪、心理及肿瘤的发生都有关系. 粪菌移植(fecal microbiota transplantation, FMT)可增加肠道细菌丰度, 优化肠道菌群谱, 从而多方面影响机体.
肠道菌群约1000余种, 人类认识的不足1/3, 其对免疫、神经系统、肿瘤等的影响已成为国内外研究热点, 在国际顶级杂志频频发表相关研究. 此例为河南省首例FMT, 必将推动河南省学者对肠道菌群的研究.
2016-12, Nature Reviews Cardiology杂志发表了题为"Role of gut microbiota in atherosclerosis"的文章, 研究动脉粥样硬化中肠道菌群的角色, 探讨了菌群影响动脉硬化的机制. 提出了菌群影响动脉硬化的3条途径.
2014年Rubin等对119例接受FMT治疗的炎症性肠病(inflammatory bowel disease, IBD)患者疗效进行分析, 表明FMT对IBD的临床缓解率为45%, 其中溃疡性结肠炎的临床缓解率为22%, 克罗恩病的临床缓解率为60.5%. 作者的研究首例效果良好, 以后还要继续观察.
本例良好的疗效为FMT在炎症性肠病患者中的应用提高了信心, 炎症性肠病属于常见病, 部分患者病情严重, 常规治疗疗效差, FMT不失为一种挽救治疗, 造福更多的患者. 同时其价格低廉, 无明显不良反应.
粪菌移植(FMT): 指将健康人粪便中的功能菌群, 移植到患者肠道内, 重建患者新的肠道菌群, 实现肠道及肠道外疾病的治疗;
难治性溃疡性结肠炎: 指足量常规药物, 包括美沙拉嗪, 糖皮质激素, 免疫抑制剂等治疗效果不好的溃疡性结肠炎.
江学良, 教授, 主任医师, 中国人民解放军济南军区总医院消化科; 梅武轩, 教授, 湖北科技学院临床医学院
本文报道了1例FMT治疗炎症性肠病, 取得一定效果, 有一定的价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 河南省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:李瑞芳
| 1. | Qin J, Li R, Raes J, Arumugam M, Burgdorf KS, Manichanh C, Nielsen T, Pons N, Levenez F, Yamada T. A human gut microbial gene catalogue established by metagenomic sequencing. Nature. 2010;464:59-65. [PubMed] [DOI] |
| 3. | Surawicz CM, Brandt LJ, Binion DG, Ananthakrishnan AN, Curry SR, Gilligan PH, McFarland LV, Mellow M, Zuckerbraun BS. Guidelines for diagnosis, treatment, and prevention of Clostridium difficile infections. Am J Gastroenterol. 2013;108:478-498; quiz 499. [PubMed] [DOI] |
| 4. | Sha S, Liang J, Chen M, Xu B, Liang C, Wei N, Wu K. Systematic review: faecal microbiota transplantation therapy for digestive and nondigestive disorders in adults and children. Aliment Pharmacol Ther. 2014;39:1003-1032. [PubMed] [DOI] |
| 5. | Colman RJ, Rubin DT. Fecal microbiota transplantation as therapy for inflammatory bowel disease: a systematic review and meta-analysis. J Crohns Colitis. 2014;8:1569-1581. [PubMed] [DOI] |
| 6. | Cui B, Feng Q, Wang H, Wang M, Peng Z, Li P, Huang G, Liu Z, Wu P, Fan Z. Fecal microbiota transplantation through mid-gut for refractory Crohn's disease: safety, feasibility, and efficacy trial results. J Gastroenterol Hepatol. 2015;30:51-58. [PubMed] [DOI] |
| 7. | Brandt LJ, Aroniadis OC. An overview of fecal microbiota transplantation: techniques, indications, and outcomes. Gastrointest Endosc. 2013;78:240-249. [PubMed] [DOI] |
| 8. | Kump PK, Krause R, Allerberger F, Högenauer C. Faecal microbiota transplantation--the Austrian approach. Clin Microbiol Infect. 2014;20:1106-1111. [PubMed] [DOI] |
| 9. | Khan MA, Sofi AA, Ahmad U, Alaradi O, Khan AR, Hammad T, Pratt J, Sodeman T, Sodeman W, Kamal S. Efficacy and safety of, and patient satisfaction with, colonoscopic-administered fecal microbiota transplantation in relapsing and refractory community- and hospital-acquired Clostridium difficile infection. Can J Gastroenterol Hepatol. 2014;28:434-438. [PubMed] |
| 10. | Borody TJ, Khoruts A. Fecal microbiota transplantation and emerging applications. Nat Rev Gastroenterol Hepatol. 2011;9:88-96. [PubMed] [DOI] |
| 11. | Round JL, Mazmanian SK. The gut microbiota shapes intestinal immune responses during health and disease. Nat Rev Immunol. 2009;9:313-323. [PubMed] [DOI] |
| 12. | Zhang FM, Wang HG, Wang M, Cui BT, Fan ZN, Ji GZ. Fecal microbiota transplantation for severe enterocolonic fistulizing Crohn's disease. World J Gastroenterol. 2013;19:7213-7216. [PubMed] [DOI] |
| 13. | Vrieze A, Van Nood E, Holleman F, Salojärvi J, Kootte RS, Bartelsman JF, Dallinga-Thie GM, Ackermans MT, Serlie MJ, Oozeer R. Transfer of intestinal microbiota from lean donors increases insulin sensitivity in individuals with metabolic syndrome. Gastroenterology. 2012;143:913-916.e7. [PubMed] [DOI] |
| 14. | de Vos WM. Fame and future of faecal transplantations--developing next-generation therapies with synthetic microbiomes. Microb Biotechnol. 2013;6:316-325. [PubMed] [DOI] |